
Синдром Карпентера: бессмертные линии трансмиссивного рака меняют своих смертных хозяев
04 ноября 2021
Синдром Карпентера: бессмертные линии трансмиссивного рака меняют своих смертных хозяев
- 4485
- 8
- 7
Синдром Карпентера. Для полного восприятия рекомендовано прослушать композицию Эннио Морриконе Humanity (Part II) — главную музыкальную тему к/ф «Нечто». Рисунок в полном размере.
рисунок Марины Католиковой
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Трансмиссивный рак (англоязычная аббревиатура — СТС) — инфекционное онкологическое заболевание, при котором инфекционным агентом служат сами раковые клетки. Животное, болеющее СТС, генетически является химерой, потому что у клеток рака и у собственных клеток животного разные генотипы. Генотип СТС родственен генотипу животного, у которого он появился впервые. То животное давно умерло, а его клонально делящиеся раковые клетки продолжают жить как паразиты. До последнего времени СТС считался редчайшим явлением. Поэтому гипотеза трансмиссивного рака редко учитывалась при интерпретации генетических или эпидемиологических данных. Недавнее открытие множественных линий СТС у двустворчатых моллюсков, в том числе способных передаваться между разными видами, заставляет пересмотреть взгляды о распространенности трансмиссивного рака и масштабе связанных с ним угроз. Для автора статьи это открытие стало потрясением, потому что, изучая генетику ракушек, он давно догадывался про химер, но не мог найти им разумного объяснения. Статья — рассказ про то, как он это пережил, и как поменялась его научная картина мира за пять лет с момента, когда он впервые услышал словосочетание Clonally Transmissible Cancer.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.
Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания Cytiva.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В моем позднесоветском детстве были такие видеомагнитофоны, с помощью которых можно было в домашних условиях смотреть видео, в том числе голливудские фильмы. Других возможностей с ними познакомиться тогда не было. Видеомагнитофоны дорого стоили, ни я, ни мои друзья их в глаза не видели. Зато видеомагнитофон был у нашего учителя, Дмитрия Шлемовича. Летними вечерами в юннатском лагере под Кандалакшей он нас иногда развлекал пересказами просмотренных фильмов. Больше всего нас потряс сюжет фильма Джона Карпентера The Thing, в русском переводе «Нечто». Настолько потряс, что даже карбас (тип парусно-гребной лодки), оснасткой которого мы тогда занимались, назвали «Нечто». По заснеженному пространству бежит собака. Собаку преследует вертолет. Из вертолета стреляют по собаке, пытаясь ее убить. Собака приближается к группе строений. Это американская антарктическая станция. Выбегающие на звук выстрелов люди попадают под пули. Завязывается перестрелка, в результате которой вертолет взрывается, а его пассажиры погибают. Собаку оставляют жить на станции. По мере развития событий выясняется, что полярники с соседней станции (те, что были в вертолете) выкопали из-подо льда Нечто — инопланетное зло. Нечто проникает в тело и душу человека и подчиняет их своей непостижимой, но зловещей миссии (извечный сюжет предания о дьяволе, изложенный на оригинальном материале). Технически Нечто исподволь замещает человека на клеточном уровне, и «достаточно всего одной пораженной клетки, чтобы уничтожить все человечество»! На беду тех американцев, Нечто умеет передаваться не только от человека к человеку (помните ту собаку?). Нечто коренится на станции, люди это понимают, но никто наверняка не знает, кто из его товарищей еще человек, а кто уже нет. Один из самых страшных моментов фильма — когда полярники догадываются, что Нечто боится огня, точнее высокой температуры, и договариваются брать друг у друга кровь и тестировать ее раскаленным гвоздем, чтобы понять, кто инфицирован. Когда тест, наконец, срабатывает, происходит такое…
Когда я разобрался в истории, которую хочу рассказать, первое, о чем я подумал, было Нечто. Мне почудилось, что оно существует, причем всю мою жизнь морского биолога, даже тогда, под Кандалакшей, оно было близко, ближе, чем на расстоянии вытянутой руки. Мой рассказ будет непоследовательным, однако, независимые пересекающиеся сюжетные линии доброму триллеру не помеха.
Между химерами и гибридами
Когда ты изучаешь природные популяции (может быть, когда ты просто что-нибудь изучаешь), то порой сталкиваешься с чем-то, что противоречит твоей картине мира. Объяснений этому феномену два: либо картина мира кривая (надо было лучше учиться и больше читать), либо руки кривые (надо было работать аккуратнее, чтобы не допускать артефактов). Поскольку мы обречены вести планомерные исследования, то есть имеющие заранее сформулированные гипотезы и четкий план, то, встретившись с необъяснимым, тебе остается потрясти головой и идти дальше выполнять свой план. Для меня таким проклятием были нестандартные генотипы, которые мы с коллегами изредка наблюдали у морских ракушек мидий, в том числе, из Белого моря (Кандалакша, напомню, город у Белого моря), и для себя называли «химерами». По аутосомным, диплоидным признакам у животного ожидаешь обнаружить два аллеля, один от мамы, другой от папы. По гаплоидным маркерам, например, митохондриальным, — один аллель, унаследованный от одного из родителей. Тут нужно оговориться, что, в отличие от большинства животных и растений, у которых митохондрии наследуются по материнской линии, у мидий и других двустворчатых моллюсков есть два разных, хорошо различающихся «полоспецифичных» митохондриальных генома, мужской и женский. Мужской наследуется от отцов сыновьями, а женский от матерей всеми потомками. В результате у самок есть только женские митохондрии, а у самцов и женские, и мужские. У самцов мужские и женские митохондрии находятся в разных клетках и в разных тканях и никогда, кроме самых ранних стадий эмбрионального развития, друг с другом не встречаются. Под химерами мы понимали случаи, когда на фоне одного индивидуального генотипа смутно проступал другой. В силу то ли методических причин, то ли каких еще, на фоне генотипа одного вида, мидии съедобной Mytilus edulis, мерещился генотип другого вида — мидии тихоокеанской M. trossulus. Два вида мидий могут скрещиваться, но гибриды имеют диплоидные генотипы по аутосомным признакам и гаплоидные — по полоспецифичным митохондриям. Поскольку при генотипировании используются биоматериалы, та же ДНК, то самое простое объяснение «химеризма» — контаминация, то есть загрязнение одного образца другим в ходе небрежно проведенного эксперимента. Но в независимых экспериментах наши химеры оставались химерами, оставляя тревожное чувство, что дело может быть не только в кривых руках. В 2016 году, когда я поехал в командировку в университет Монтпелье, где работает лидер моей науки о межвидовой гибридизации доктор Николас Биерне, я захватил с собой образцы ДНК «химер». Идея была подложить их в генетическое исследование, задуманное французами, тем более что они великодушно пообещали проанализировать наши образцы на своей базе «вслепую», то есть даже не спрашивая, что и зачем анализируется.
Вначале была собака
Конец 19 — начало 20 века было временем, когда люди верили в силу прогресса и безграничность возможностей науки и техники. Это воодушевление нашло отражение в молодой научно-фантастической литературе, где истории про инженера Гарина, профессора Доуэля, докторов Франкенштейна и Моро перекликались с реальными попытками скрестить человека с обезьяной и поддерживать жизнь в отрезанной собачьей голове. Чем-то подобным могли показаться и исследования 1870-х годов ветеринарного врача из Петербурга, Мстислава Новинского. Он изучал венерическую саркому собак (современное название — трансмиссивная венерическая опухоль собак, CTVT) — тяжелую болезнь, которая чаще всего проявляется как опухоли на половых органах. Новинский «перевивал» (пересаживал) кусочки опухолей от больных собак здоровым, и здоровые собаки заболевали саркомой.
Так Новинский доказал, что саркома является, в терминах того времени, не только «повальной» (массовой), но и «прилипчивой» (заразной) болезнью. Более того, он пришел к умозаключению, что раковые клетки сами по себе являются инфекционным агентом и передаются во время физических контактов между животными [1]. Плоть от плоти первой собаки, заболевшей саркомой, и, с большой долей вероятности, погибшей от нее, — беспрестанно размножающиеся линии раковых клеток меняют своих смертных хозяев, сами оставаясь бессмертными. Мы привыкли думать, что первопричиной онкологических заболеваний служат мутации в клетках больного организма, которые могут провоцироваться, например, химическими канцерогенами или онкогенными вирусами (вирусы во времена Новинского, кстати, еще не были открыты). А вот Новинский предложил альтернативную теорию канцерогенеза, сегодня известную как аллографтная (от allograph, по-русски чаще говорят «аллотрансплантат» — клетки, ткани или органы, пересаженные от одного организма другому того же вида). Его гипотезу объективно проверили ровно через сто лет методами генетики [2]. Оказалось, что у клеток саркомы и у собственных клеток больной собаки разные генотипы, причем у разных собак из одной и той же популяции раковые клетки имеют сходные генотипы. Такой результат возможен, если клетки саркомы метастазируют не только внутри особей, но и между особями. Венерическую саркому посчитали вопиющим исключением из правил, единственным в своем роде примером трансмиссивного рака. Но недаром говорят: помянешь черта — он и появится. Трансмиссивный рак, причем две разные, независимые болезни (DFT1, DFT2 — от devil facial tumor cancer, лицевая опухоль дьявола), нашли у тасманийского дьявола — сумчатого зверька, смахивающего на помесь медведя и крысы [3]. Дьяволы драчливы, кусают друг друга за мордочки, раковые клетки передаются с кровью через покусы.
Не игнорируйте нестандартные генотипы!
— И все-таки, что за мидий вы хотите генотипировать? — не удержался от вопроса д-р Биерне.
— Они имеют генотипы, которые я не могу интерпретировать, — уклончиво ответил я.
— Неужели химеры? — спросил он и, получив утвердительный ответ, протянул мне две распечатки. Одна, рукопись статьи самого Биерне, называлась «Не игнорируйте нестандартные генотипы: это может быть трансмиссивный рак» [4]. Она была про наших «химер» — про Мytilus edulis из европейских популяций, на фоне видового генотипа которых смутно проявляется генотип M. trossulus. Это не артефакт, это не контаминация. Это — генетический химеризм без кавычек — организм, состоящий из клеток, произошедших из разных зародышей. Клетки с генотипом M. edulis — клетки организма самой мидии. Клетки с генотипом M. trossulus — клетки трансмиссивного рака, родственного, то есть произошедшего от M. trossulus. Второй распечаткой была свежая статья в Nature коллектива авторов во главе с Майклом Метзгером [5]. Они доказывали, что двустворчатые моллюски болеют трансмиссивным раком, причем раковые линии могут передаваться не только между моллюсками одного вида, но и между моллюсками разных видов, если они встречаются в одних и тех же местообитаниях. Вот тут-то я и вспомнил страшную историю, рассказанную Дмитрием Шлемовичем, которая, выходит, была еще одним его уроком, который я не усвоил. Все что мне оставалось, это спросить: «Николас, вы смотрели фильм “Нечто”?»
— Это один из моих любимых фильмов, — с пониманием кивнул он.
Дурная кровь
Полярники диагностировали Нечто, тестируя кровь раскаленным гвоздем. Формально, у мидий, как животных с незамкнутой кровеносной системой, крови нет. У них жидкость, которую качает сердце, называется гемолимфой. Форменные элементы (клетки) гемолимфы зовутся гемоцитами. У гемоцитов много функций, главная из которых иммунная. Органы кроветворения у ракушек не найдены. Считается, что гемоциты воспроизводят сами себя. Действительно, на цитологических препаратах видно, что они делятся.
В один не прекрасный для мидии день в ее гемолимфе, среди нормальных гемоцитов, внешне напоминающих амеб, появляются новые клетки — округлой формы, с раздутыми, очевидно, полиплоидными ядрами. Это — симптом смертельной и «повальной» болезни, называемой диссеминированной неоплазией. Аналогом диссеминированной неоплазии у человека является лейкемия, или рак крови. Болезнь начинается с появления в гемолимфе таких раковых клеток. По мере развития болезни их становится все больше, они проникают во все ткани и органы, постепенно замещая их. Когда открываешь раковину мидии на поздней стадии рака, то видишь внутри железистую массу, в которой с трудом угадываются контуры органов. Это уже не мидия, а какой-то «рак во плоти». Если взять у не очень больной мидии гемолимфу и мышечную ткань и генотипировать раздельно, то в гемолимфе будет читаться один генотип, а в мышечных тканях другой. Если применить метод, позволяющий количественно оценить разнообразие аллелей (например, метод молекулярного клонирования), то окажется, что в обеих тканях присутствуют оба генотипа, но в разных пропорциях. В гемолимфе доминирует генотип рака, в мышцах — самой мидии.
Никто наверняка не знает, как происходит заражение. В отличие от собак и тасманийских дьяволов, у ракушек наружное оплодотворение и они неспособны к кровавым дракам. Экспериментально показано, что при стрессе гемоциты могут выходить из организма мидии во внешнюю среду и проникать в других особей [6]. Скорее всего, раковые клетки используют этот механизм для заражения.
У мидий обнаружены две разные, вероятно, независимо возникшие эволюционные линии рака, получившие названия BTN1 и BTN2 (от bivalve transmissible neoplasia, трансмиссивная неоплазия ракушек). Обе линии произошли от Mytilus trossulus. Судя по филогенетическим данным (см. ниже), BTN1 моложе BTN2. Надежных оценок абсолютного возраста линий нет. BTN1 имеет ограниченное распространение, ее находили только в популяциях M. trossulus тихоокеанского побережья Канады. Зато BTN2 где только не находили — и у чилийской мидии M. chilensis в Чили и в Аргентине, и у двух европейских видов — M. galloprovincialis и M. edulis. До самого последнего времени, BTN2 не находили только у одного вида мидий, а именно у M. trossulus, который ее, собственно, и породил.
Демонстрация трасмиссивной неоплазии у мидий
Давайте вслед за первооткрывателями BTN шаг за шагом пройдем путь доказательства трансмиссивного рака у мидий, используя для этого рисунок 1. Тем из читателей, которые не хотят вникать в детали, стоит пропустить этот параграф.
Для того чтобы доказать СТС, нужно, во-первых, найти больных раком животных. Во-вторых, провести для них тест на генетический химеризм. У животного, болеющего обычным раком, тест выявит единственный «среднестатистический» для данной популяции индивидуальный генотип, один и тот же в пораженных и здоровых тканях. У животного, болеющего трансмиссивным раком, тест выявит два разных генотипа. Наконец, для однозначного вывода нужно показать близкое родство раковых генотипов у разных животных.
Для диагностики диссеминированной неоплазии применяют разные гистологические и цитологические методы. Я для иллюстрации выбрал конфокальные фотографии клеток гемолимфы, окрашенных иммуноцитохимическим методом (рис. 1б, из [7]), потому что они красивые. Синим прокрасились ядра клеток, красным — их актиновый цитоскелет. Видны родовые признаки раковых клеток (отмечены звездочками), отличающие их от нормальных гемоцитов (отмечены стрелкой) — форма клетки, далекая от амебоидной, увеличенное ядро и аномальный цитоскелет, напоминающий иглы ощетинившегося ежа.
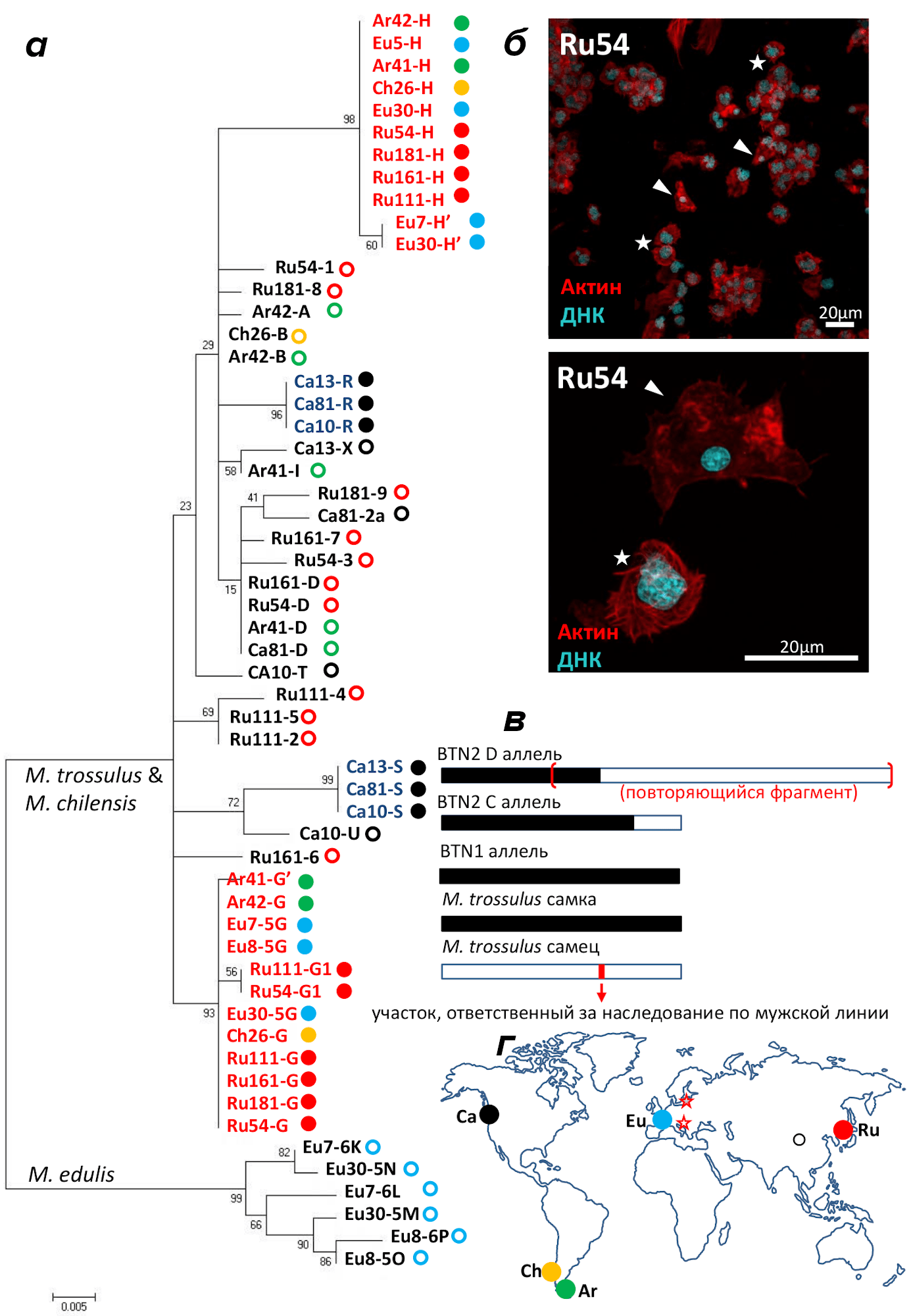
Рисунок 1. Филогенетический анализ ядерных и митохондриальных локусов у мидий с линиями BTN. a — Филогенетическое дерево EF1α маркеров мидий, построенное методом максимального правдоподобия. б — Конфокальные фотографии гемоцитов в больной мидии, окрашенных DAPI и фаллоидином, меченым флуоресцентным красителем TRITC. в — Схемы контрольных регионов BTN M. trossulus в сравнении с мужскими и женскими контрольными регионами. г — Карта мест находок мидий с BTN, — залитыми кружками отмечены места происхождения мидий, исследованных по аллелям EF1α.
Для демонстрации химеризма можно использовать любые полиморфные маркеры вкупе с методиками генотипирования, позволяющими различать индивидуальные аллели в смеси. Для мидий на сегодняшний день лучшим маркером является ядерный фактор элонгации 1-альфа (EF1α), потому что обе известные эволюционные линии BTN маркированы уникальными аллелями этого локуса. Это иллюстрирует филогения аллелей EF1α, выявленных методом молекулярного клонирования у мидий с трансмиссивной неоплазией (рис. 1а, по данным [7] и [8]). В названиях аллелей закодированы уникальные номера мидий и, через дефис, нуклеотидных последовательностей аллелей. Залитые кружки — аллели рака, выколотые — самих мидий. Цвет кружков обозначает географическое происхождение материала, как показано на карте (рис. 1г). На минимальном уровне сходства выявляются две клады, в одну попадают аллели M. edulis, в другую M. chilensis, M. trossulus и рака. Трансмиссивные неоплазии маркированы комбинациями уникальных аллелей: BTN1 — аллелями R и S (выделены темно-синим), BTN2 — аллелями групп H и G (выделены красным). В большинстве случаев у больных мидий выявляются две пары аллелей, соответствующие двум разным организмам. Например, среди мидий из популяции Ru, у Ru161 хозяйские аллели это 6 и D, а раковые — G и H, а у Ru181 — 9 и 8 и G и H соответственно. Однако не всегда результаты непротиворечивы. У двух других мидий из Ru и хозяйские, и раковые генотипы представлены тремя аллелями: у Ru111 — 2, 4, 5 и G, G1 и H, а у Ru54 (та же мидия, что на фотографиях рис. 1б) — 1, 3, D и G, G1 и H соответственно. За «лишними» аллелями могут стоять соматические мутации (такие мутации в первую очередь ожидаешь в анеуплоидном геноме клонально размножающего рака), а могут артефакты метода молекулярного клонирования.
Митохондриальное генотипирование может быть информативным для диагностики СТС. Например, контрольные регионы митохондрий BTN2 (в митохондриальном геноме различают кодирующую часть и контрольный регион) ни с чем не спутаешь. Это иллюстрируют схемы строения контрольных регионов BTN в сравнении с мужскими и женскими контрольными регионами M. trossulus (рис. 1в, из [8]). Однако интерпретация митохондриальных данных у СТС осложняется явлением горизонтального переноса митохондрий между хозяином и раком (подробнее см. ниже) и непониманием механизмов, приводящих к генотипам как у BTN2.
На сегодняшний день (07.10.2021) опубликованы надежные данные всего по 48 случаям BTN из семи географических популяций мидий. На карте (рис. 1г) отмечены места всех находок BTN. Места сбора раковых мидий, изученных по EF1α и использованных в филогенетическом анализе, отмечены залитыми кружками. Кроме этих районов, единичных мидий с BTN находили в Адриатическом и Балтийском морях (звездочки на карте), однако по EF1α их не изучали.
Дым парохода
Трансмиссивную неоплазию впервые выявили не у мидий, а у песчаной ракушки мии Mya arenaria [9], которую американцы еще называют steamer, то есть пароход. Название обыгрывает внешний вид животного, обладающего длинным, толстым, похожим на трубу сифоном. Сифоны прячущиеся глубоко в песке ракушки высовывают на поверхность, чтобы фильтровать воду. От того же слова — архаичное русское название парохода «стимбот». Первооткрыватели BTN знали, что «пароходки» болеют диссеминированной неоплазией, что болезнь можно вызывать переливанием гемолимфы от больной особи здоровой, и что в раковых гемоцитах повышена концентрация фермента обратной транскриптазы. Последнее может свидетельствовать о репликации ретроэлементов — ретровирусов или ретротранспозонов. Они искали онкогенный вирус, а нашли LTR-ретротранспозон. Эти мобильные элементы родственны ретровирусам. Они способны менять свое число (количество копий) и местоположение в геномах клеток, но, в отличие от вирусов, в норме не передаются между разными клетками и особями. Количество копий транспозона в раковых гемоцитах по сравнению со здоровыми было повышено на два порядка. По традиции, транспозонам дают образные названия, обыгрывающие их способность перемещаться по геномам, например, Odysseus и Legolas. Недолго думая, новый транспозон назвали Steamer, в честь моллюска и парохода.
Распределение Steamer в геномах раковых гемоцитов M. arenaria было иным, чем в здоровых, причем одинаковым во всех раковых клетках, в том числе разных особей. Ретротранспозоны потому и зовутся мобильными элементами, что умеют перемещаться по геномам, но они это делают в значительной степени хаотично. Никто никогда не отмечал такого единообразия в распределении, как у Steamer в раковых клетках мии. Осмысляя этот результат, Майкл Метзгер предположил, что Steamer может быть маркером клеточной линии. Если так, то все раковые гемоциты всех особей представляют одну и ту же линию, то есть это трансмиссивный рак. Дело оставалось за малым — провести тест на химеризм. Эрудированный, следящий за новостями науки Метзгер знал про трансмиссивный рак, тем более что громкое открытие лицевой опухоли дьявола пришлось на первые годы его работы с Mya. Он с самого начала учитывал гипотезу трансмиссивного рака как маловероятную, но теоретически возможную. Оборачиваясь назад, просто диву даешься, насколько близко ученые подбирались к открытию трансмиссивного рака за 50 лет исследований диссеминированной неоплазии у двустворчатых моллюсков. Вплоть до признания того, что все раковые гемоциты у вида имеют общий уникальный генотип [10] и допущения, что они никакие не гемоциты, а паразитические простейшие [11]. На мой прямой вопрос Метзгеру, почему никто не догадался, а он догадался, он пожал плечами: никакого инсайта, просто профессионализм.
Имеет ли Steamer отношение к этиологии неоплазии, так и осталось невыясненным. Может быть, он капитан этого парохода, а может — просто пассажир, заселивший успешную клеточную линию и путешествующий вместе с ней. Интересно, что Steamer-подобные элементы (то есть очень похожие на Steamer) нашли у всех моллюсков, болеющих трансмиссивным раком, а также у многих других водных животных, включая мадрепоровых кораллов, морских ежей и рыбок данио рерио [12]. Поскольку никто всерьез не верит, что трансмиссивный рак может передаваться между этими животными, остается заключить, что Steamer, пускай он формально и не вирус, все-таки способен к горизонтальному переносу и передается между разными организмами.
Картина мира
Явление трансмиссивного рака (англоязычное название clonally transmissible cancer, сокращенно СТС, можно перевести как «рак, передающийся как клон»), ставит теоретические, практические и философские вопросы, которые не раскрыть в одной статье. Поэтому я просто перечислю те из них, которые понимаю.
Шестой тип инфекции
Прошли времена, когда при ответе на экзаменационный вопрос «Сколько существует принципиальных типов инфекционных агентов?» на «четверку» достаточно было назвать четыре: вирусы (например, герпес или COVID-19), бактерии (чума или ангина), грибы (грибок ногтей или молочница) и паразиты (малярийный плазмодий или аскарида). На твердую «пятерку» — добавить к списку прионы (коровье бешенство или куру) — «взбесившиеся» белки с аномальной третичной структурой, провоцирующие превращение гомологичных нормальных белков в себе подобные как в своем, так и в чужом организме, в который они могут попасть с пищей (подробнее о прионах можно почитать на «Биомолекуле» «Прионы опасные и удивительные» [13]). Согласитесь, что трансмиссивный рак ни одним из вышеперечисленных инфекционных агентов не является. Значит, это — шестой тип инфекции [14].
Одноклеточная форма многоклеточной жизни
В 1991 году Ли Ван Вален и Вирджиния Майорана опубликовали статью «HeLa, новый вид микроба» [15], которую многие сочли провокационной. Они объявили HeLa («Хи́ла», произносится с ударением на первом слоге) — единственную существующую на тот момент иммортализованную (от immortalized, буквально «наделенную бессмертием», — фактически, долгоживущую) лабораторную линию раковых клеток человека, отдельным биологическим видом Helacyton gartleri. Вот их аргументы. Во-первых, HeLa имеет «таксономические» (уникальные, диагностические) генетические признаки. Помимо того, что у нее по определению уникальный генотип индивидуума — донора клеток, она, как и многие другие раковые линии, маркирована мутациями, в том числе уникальными хромосомными перестройками. Во-вторых, HeLa генетически (репродуктивно) изолирована от любых других видов, включая Homo sapiens. В-третьих, у HeLa есть собственная экологическая ниша (уникальное сочетание условий обитания) — лабораторная клеточная культура. Наконец, как любой вид и как любой рак, HeLa «эгоистична», борется за «место под солнцем» (лабораторной ультрафиолетовой лампой). В частности, HeLa не контролируется на 100% своим создателем, ученым-биологом. При несоблюдении правил культивирования она способна заражать, например, через плохо дезинфицированные инструменты другие клеточные культуры, со временем замещая их. Это был ужасный скандал в конце 1960-х, спровоцированный исследованиями Стенли Гартлера (отсюда видовое название): многие клеточные культуры человека и животных на поверку оказались не тем, что думали, а HeLa. Тут надо напомнить, что заглавный автор статьи — тот самый Ван Вален, который автор эволюционной гипотезы Красной королевы и экологической концепции вида. Это он определил вид как группу родственных организмов, адаптированных к уникальной экологической нише, а эволюцию как «гонку вооружений» между антагонистическими видами. Провокационной же статью сочли не столько из-за нестандартных идей, сколько из-за того, что объектом теоретического анализа была культура клеток женщины, умершей от рака (подробнее о HeLa и ее доноре можно почитать на «Биомолекуле» «Бессмертные клетки Генриетты Лакс» [16]). В контексте разговора о трансмиссивном раке трудно спорить с тем, что HeLa — это «демоверсия» СТС, к которому все вышеперечисленные аргументы приложимы безоговорочно. Линии трансмиссивного рака — это отдельные таксоны. CTVT — это паразитический вид одноклеточной собаки!
Размышляя над эволюционным потенциалом трансмиссивного рака, московские коллеги во главе с Александром Панчиным выдвинули остроумную гипотезу [17]. Если транмиссивный рак — это «возвращение» от многоклеточности к одноклеточности, то, может быть, возможно и обратное? Если да, то, например, некоторые «загадочные» (ни на что не похожие) группы паразитических беспозвоночных по происхождению могут быть древними линиями трансмиссивного рака, вторично вернувшимися к многоклеточности.
Генокрад и тать, сбежавший из-под иммунного надзора
Трудно представить, какие должны быть особенности у раковых клеток, чтобы они вырывались за пределы породившего их организма, становясь трансмиссивными паразитами. Однако ясно, что они неминуемо должны решать две проблемы. Первая проблема — избегать иммунного ответа своих жертв. Например, у позвоночных животных на поверхности клеток есть специальные генетически детерминированные структуры, известные как антигены гистосовместимости. По их состоянию иммунитет определяет, своя клетка или чужая, а если своя, то здоровая или больная. Аллотрансплантаты, а трансмиссивный рак суть аллотрансплантат, в норме отторгаются организмом, потому что у них неправильные антигены. (Эта «боязнь» аллографта — первородный страх, она есть не только у позвоночных, но у всех многоклеточных животных.) Вторая проблема — поддерживать в работоспособном состоянии свой раковый геном. Мы верим, что половое размножение, среди прочего, обеспечивает поддержание геномов в работоспособном состоянии. Теоретически, при долгом клонировании клеточные культуры животных, размножающихся половым путем, должны накапливать вредные мутации, в первую очередь митохондриальные, и оттого «портиться». Гипотеза получила метафорическое название «храповик Меллера» по имени своего автора, Германа Меллера, и по названию механизма, который не позволяет шестеренке прокручиваться обратно; такие еще ставят в турникетах, которые крутятся в одну сторону. CTVT поддерживает в работоспособном состоянии свой митохондриальный геном, приворовывая митохондрии у хозяев [18]. Собственная митохондрия заменяется собачьей. Из-за этого у CTVT в разных популяциях неродственные митохондрии, что создает иллюзию многократного происхождения болезни. Трансмиссивные раки позвоночных избегают иммунного надзора, подавляя свои антигены гистосовместимости [19]. У DFT их просто нет, у CTVT они проявляются на поздних стадиях болезни, что делает ее течение менее патологическим. Не знаю, как они воруют геномы и «отключают» антигены, но верю, что ответы на эти вопросы, когда будут получены, пригодятся трансплантологам, генным терапевтам и создателям ГМО.
Правило, а не исключение
На сегодняшний день трансмиссивный рак доказан у двух видов млекопитающих (собака, тасманийский дьявол) и у восьми видов двустворчатых моллюсков [5], [20], [21] (четыре вида мидий Mytilus, песчаная ракушка Mya arenaria, сердцевидка Cerastoderma edule, полититапес Polititapes aureus и венус Venus verrucosa; у P. aureus и V. verrucosa неоплазии имеют генотипы других видов — представителей того же семейства венериды, у которых рак пока не нашли). Обсуждать, почему трансмиссивным раком болеют именно эти виды, представители двух удаленных веточек раскидистого филогенетического древа животных, преждевременно. Его целенаправленно почти ни у кого не искали. Примеры трансмиссивных раков позвоночных поучительны тем, что у них определен эволюционный возраст [3], [18]. Возраст DFT1 и DFT2 не сильно старше времени своего открытия, 2006 и 2013 годы соответственно. Собачий рак — древнее, многотысячелетнее зло, возможно, старше самой собаки как биологического вида. Пример моллюсков поучителен тем, что у них трансмиссивные неоплазии могут передаваться между разными видами и, следовательно, выступать как ксенографты (то же, что аллографты, только между разными видами). Таким образом, трансмиссивный рак может быть как древним, так и появившимся только что. Он может появляться у одного и того же вида неоднократно, как у дьявола или M. trossulus. Как паразит, он может быть как специфическим, то есть паразитировать только в «родительском» виде, так и неспецифическим — менять хозяев «как перчатки».
На естественный вопрос, может ли трансмиссивный рак поразить человека, никто с уверенностью не ответит. Кажется, что пример HeLa слишком иллюстративен для того, чтобы сомневаться в возможности появления иммортализированных раковых линий у человека и в наличии путей их передачи между индивидуумами через медицинские процедуры, например, переливание крови. Подробнее, о риске для человека заразиться раковыми клетками см. предыдущий обзор о трансмиссивном раке на «Биомолекуле» «Заразный рак: правило или исключение?» [22].
Постскриптум
Давно прошли времена, когда нам полагалось верить, что всем открытиям мы обязаны отечественной науке, и что Россия — родина слонов, но авторство гипотезы трансмиссивного рака непреложно принадлежит нашему соотечественнику, Мстиславу Александровичу Новинскому. Чтобы как-то закончить рассказ о трансмиссивном раке, больше похожим на исповедь про то, как я нашел химер и ничего не понял, нужно вернуться в Россию, причем на ее тихоокеанское побережье. Там, в одной бухте под Находкой, на якоре плавает одинокая швартовая бочка. До берега далеко, как и до дна, и мидий ни там, ни там не находили. А на бочке мидии есть, обычные для тех мест Mytilus trossulus. На первый взгляд, бочка — худшее место для поиска трансмиссивного рака, который должен как-то передаваться клетками через воду, но он там есть (верно, он туда попал через мидий, живущих на днищах швартующихся лодок?). И это — мистическая линия BTN2, которая морочила голову исследователям по всему миру от Белого моря до Аргентины, и которую у кого только не находили, но только не у «родительского» вида M. trossulus. Пускай Россия — не родина слонов, но хотя бы родиной BTN2 она может быть? «Бочковые» мидии стали для нашего коллектива — цитологов Нэлии Одинцовой и Марии Майоровой, молекулярного биолога Марии Сказиной и меня — моделью для изучения трансмиссивного рака [7]. В первую очередь на примере BTN2 этих мидий («популяция Ru») проиллюстрировано явление рака на рис. 1. Там среди прочего приведены схемы двух известных вариантов строения митохондриальных геномов BTN2 в сравнении с мужскими и женскими геномами самих мидий (помните, у мидий два митохондриальных генома?). Эта схема сводит нас с ума. Мы не можем взять в толк две вещи. Первая. Как может быть, что в одних популяциях, например, в Аргентине, два варианта всегда детектируются вместе (у одних и тех же больных мидий), а в других, например, на бочке, — всегда порознь. Вторая. Этот трансмиссивный рак, он какого пола? Нечто — какого пола?
Для меня занятие наукой сродни переживанию сюжета добротной приключенческой истории. То особое волнение, когда не можешь оторваться от захватившей тебя книги, или фильма. Или, как в детстве, боишься пропустить хоть слово из страшной истории, которую рассказывают у костра ночью.
Моя работа поддержана РНФ.
Литература
- Novinski M.A. (1876). Zur Frage uber die Impfung der Krebsigen Geschwulste Zentralbl. Med. Wissensch. 14, 790-791;
- Claudio Murgia, Jonathan K. Pritchard, Su Yeon Kim, Ariberto Fassati, Robin A. Weiss. (2006). Clonal Origin and Evolution of a Transmissible Cancer. Cell. 126, 477-487;
- Maximilian R. Stammnitz, Tim H.H. Coorens, Kevin C. Gori, Dane Hayes, Beiyuan Fu, et. al.. (2018). The Origins and Vulnerabilities of Two Transmissible Cancers in Tasmanian Devils. Cancer Cell. 33, 607-619.e15;
- Florentine Riquet, Alexis Simon, Nicolas Bierne. (2017). Weird genotypes? Don't discard them, transmissible cancer could be an explanation. Evol Appl. 10, 140-145;
- Michael J. Metzger, Antonio Villalba, María J. Carballal, David Iglesias, James Sherry, et. al.. (2016). Widespread transmission of independent cancer lineages within multiple bivalve species. Nature. 534, 705-709;
- France Caza, Eve Bernet, Frédéric J. Veyrier, Stéphane Betoulle, Yves St-Pierre. (2020). Hemocytes released in seawater act as Trojan horses for spreading of bacterial infections in mussels. Sci Rep. 10;
- Maria Skazina, Nelly Odintsova, Maria Maiorova, Angelina Ivanova, Risto Väinölä, Petr Strelkov. (2021). First description of a widespread Mytilus trossulus-derived bivalve transmissible cancer lineage in M. trossulus itself. Sci Rep. 11;
- Yonemitsu M.A., Giersch R.M., Polo-Prieto M., Hammel M., Simon A., Cremonte F. et al. (2019). A single clonal lineage of transmissible cancer identified in two marine mussel species in South America and Europe. eLife. 8, e47788;
- Michael J. Metzger, Carol Reinisch, James Sherry, Stephen P. Goff. (2015). Horizontal Transmission of Clonal Cancer Cells Causes Leukemia in Soft-Shell Clams. Cell. 161, 255-263;
- Ekaterina I. Vassilenko, Annette F. Muttray, Patricia M. Schulte, Susan A. Baldwin. (2010). Variations in p53-like cDNA sequence are correlated with mussel haemic neoplasia: A potential molecular-level tool for biomonitoring. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 701, 145-152;
- Mackin J. G., Schlight F.G. (1976). A proteomyxan amoeba stage in the development of Labyrinthomyxa patuxent (Hogue) Mackin and Schlicht, with remarks on the relation of the Proteomyxids to the neoplastic diseases of oysters and clams. Mar. Fish. Rev. 38, 16-18;
- Michael J. Metzger, Ashley N. Paynter, Mark E. Siddall, Stephen P. Goff. (2018). Horizontal transfer of retrotransposons between bivalves and other aquatic species of multiple phyla. Proc Natl Acad Sci USA. 115, E4227-E4235;
- Прионы: опасные и удивительные;
- Michael J. Metzger, Stephen P. Goff. (2016). A Sixth Modality of Infectious Disease: Contagious Cancer from Devils to Clams and Beyond. PLoS Pathog. 12, e1005904;
- Van Valen L., Maiorana V.C. (1991). HeLa, a new microbial species. Evolutionary Theory. 10, 71-74;
- Бессмертные клетки Генриетты Лакс;
- A. Y. Panchin, V. V. Aleoshin, Y. V. Panchin. (2019). From tumors to species: a SCANDAL hypothesis. Biol Direct. 14;
- Andrea Strakova, Máire Ní Leathlobhair, Guo-Dong Wang, Ting-Ting Yin, Ilona Airikkala-Otter, et. al.. (2016). Mitochondrial genetic diversity, selection and recombination in a canine transmissible cancer. eLife. 5;
- H. V. Siddle, A. Kreiss, C. Tovar, C. K. Yuen, Y. Cheng, et. al.. (2013). Reversible epigenetic down-regulation of MHC molecules by devil facial tumour disease illustrates immune escape by a contagious cancer. Proceedings of the National Academy of Sciences. 110, 5103-5108;
- Maurine Hammel, Alexis Simon, Christine Arbiol, Antonio Villalba, Erika A. V. Burioli, et. al.. (2021). Prevalence and polymorphism of a mussel transmissible cancer in Europe. Mol Ecol;
- Daniel Garcia-Souto, Alicia L. Bruzos, Seila Diaz, Sara Rocha, Ana Pequeño, et. al. Mitochondrial genome sequencing of marine leukemias reveals cancer contagion between clam species in the Seas of Southern Europe — Cold Spring Harbor Laboratory;
- Заразный рак: правило или исключение?.







