
Штамм Pseudoalteromonas, выделенный из воды Белого моря, обладает природной множественной устойчивостью к антибиотикам
30 января 2025
Штамм Pseudoalteromonas, выделенный из воды Белого моря, обладает природной множественной устойчивостью к антибиотикам
- 277
- 0
- 2
Рисунок в полном размере.
рисунок авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В настоящее время проблема антибиотикорезистентности очень актуальна. Все больше бактерий становятся устойчивыми к известным группам антибиотиков. Кроме того, появляются супермикробы, резистентные сразу ко многим антимикробным веществам. В этой статье мы рассказали как раз про такую бактерию рода Pseudoalteromonas, выделенную из воды Белого моря.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
На границе Карелии и Мурманской области, прямо на Полярном круге, расположена самая северная биостанция МГУ — Беломорская биологическая станция им. Н. А. Перцова (ББС) (рис. 1). Здесь проходят практику студенты-биологи, круглый год продолжается научная работа. Здесь можно своими глазами увидеть северное сияние и полярный день, встретить китов и нерп, а еще в воде Белого моря живут удивительные микроорганизмы, одному из которых посвящено наше исследование.
Мы начали работу в рамках студенческого учебного проекта в 2023 году, но тема так нас увлекла, что в августе 2024 года мы снова приехали на ББС уже в качестве исследователей и продолжили погружаться в пучины Белого моря для изучения интересующих нас бактерий.
Почему наше исследование важно?
В настоящее время проблема устойчивости бактерий к антибиотикам очень актуальна [1]. Появляется все больше и больше резистентных форм к конкретным группам веществ. Из-за этого существующие антибиотики перестают эффективно работать, а поиск новых — это достаточно долгий и сложный процесс. Поэтому появление бактерий с множественной устойчивостью — по-настоящему страшно.
Широко известно, что к возникновению антибиотикорезистентных бактерий приводит тесное сожительство с человеком: мы принимаем антибиотики для лечения заболеваний. При этом иногда люди нарушают рекомендации врачей: не допивают курс до конца или же используют антибиотики в случаях, когда они не требуются для лечения. Такие действия приводят к возникновению устойчивых микробов. Но зачем искать антибиотикорезистентных бактерий в, казалось бы, «чистой» от влияния человека зоне, посреди Белого моря, на большой глубине? Дело в том, что среди микроорганизмов существуют продуценты антибиотиков; они выигрывают конкуренцию за место под солнцем, подавляя жизнедеятельность других микроорганизмов. Природная устойчивость к антибиотикам — это естественная защита бактерий от «нападения» на них других микробов.
В нашей статье мы рассказываем о множественной устойчивости к антибиотикам природного штамма рода Pseudoalteromonas, выделенного из Белого моря. Несмотря на то, что эти бактерии не являются патогенами человека, такая антибиотикорезистентность может быть опасна для людей. Каким же образом? Бактерии постоянно обмениваются генами друг с другом в результате горизонтального переноса генов [2]. Одним из вариантов этого явления является конъюгация [3]. В результате такого процесса штаммы, обладающие множественной антибиотикорезистентностью, способны передавать это свойство «по цепочке», где одним из участников может оказаться патогенная бактерия. В этом случае она обретет устойчивость сразу ко многим группам веществ, что сделает лечение вызываемой ею болезни очень трудным.
Работа морского микробиолога начинается не в лаборатории, а на корабле. Для того, чтобы отобрать пробы, мы выходили в открытое море и с помощью батометра (рис. 2) (гидрологический прибор для взятия проб воды с различных глубин водоема) брали пробы воды с разных глубин (5 м, 10 м, 20 м, 30 м, 40 м).

Рисунок 2. Батометр — прибор для отбора проб воды с разных глубин.

Рисунок 3. Внешний вид микроколоний на фильтре.
фотография авторов
Для выделения микроорганизмов из морской воды мы концентрировали полученные пробы на фильтрах с диаметром пор 0,22 нм, после чего клали фильтры на чашки Петри с питательной средой и культивировали до образования на них микроколоний.
Для культивирования мы использовали среду Мюллера-Хинтон (МХ) на морской воде. Это богатая питательная среда, которую обычно используют в работах, посвященных выявлению антибиотикорезистентных бактерий. Для поиска бактерий, устойчивых к антибиотикам, в среду добавляли антибиотики с разным механизмом действия по отдельности, а также использовали среду, содержащую смесь рифампицина, ампициллина, канамицина и тилозина для поиска мультирезистентных штаммов. Для того, чтобы предотвратить грибковое загрязнение, в среду добавляли нистатин.
Таким образом, мы получили накопительные культуры на фильтрах. Путем пересевов на чашку отдельных колоний, выросших на фильтрах, мы получили чистые культуры (рис. 4).
Накопительная культура — это культура, в которой преобладают представители одной физиологической группы (то есть микроорганизмы, обладающие сходными метаболическими характеристиками, такими как потребность в определенных веществах или устойчивость к антибиотикам) или даже одного вида микроорганизмов. Сущность метода накопительных культур заключается в создании элективных (избирательных) условий, обеспечивающих преимущественное развитие «нужных» организмов из смешанной популяции. Такие условия создаются чаще всего подбором соответствующих питательных сред, поскольку различные микроорганизмы предъявляют неодинаковые требования к источникам питания.
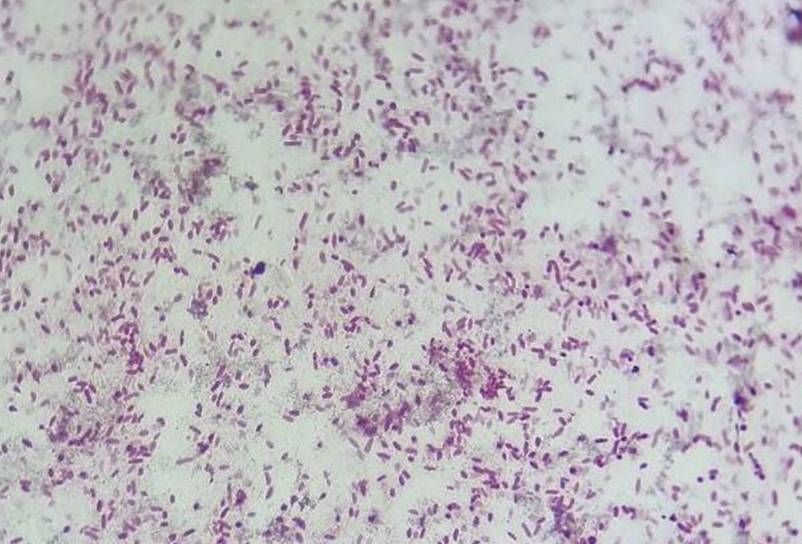
Рисунок 4. Чистая культура Pseudoalteromonas под микроскопом. Увеличение х100, окраска фуксином.
фотография авторов
В отличие от накопительной культуры, чистая культура содержит микроорганизмы одного вида, выросшие из одной колонии.
Кем же оказались наши микробы? Чтобы ответить на этот вопрос, мы выделили ДНК из чистых культур и с помощью секвенирования по 16S рРНК определили род нашего микроорганизма — Pseudoalteromonas. Бактерии этого рода — типичные обитатели северных морей. Pseudoalteromonas подразделяются на пигментированные и непигментированные (наш вариант) штаммы. Пигментированные Pseudoalteromonas продуцируют большое количество антимикробных веществ для защиты от патогенов и конкурентов в морской среде. Непигментированные обладают низкой антимикробной активностью, но при этом необычной ферментативной активностью (выделяют каррагиназы, хитиназы, альгиназы, холодоактивные ферменты) [4]. Кроме того, для Pseudoalteromonas показана устойчивость к антибиотикам: у некоторых видов (например, P. lipolytica [5]) устойчивость к антибиотикам связывают с мутациями в генах репарации MUT (репарация ошибочно спаренных нуклеотидов). В результате мутации повышалась устойчивость к ципрофлоксацину и рифампицину, главным образом за счет введения точечных мутаций в gyrAB, который кодирует ДНК-гиразу, или rpoB, который кодирует β-субъединицу РНК-полимеразы (то есть механизм — изменение мишени действия антибиотика) [6]. Другой пример — глубоководный Pseudoalteromonas из осадков — устойчив к тетрациклину, пенициллину, ампициллину и амоксициллину. У него есть четыре бета-лактамазы, 12 генов множественной устойчивости и эффлюксная помпа семейства AcrA/E, связанная с антибиотикорезистентностью [7]. Описаны механизмы устойчивости Pseudoalteromonas: эффлюксные помпы, кластеры устойчивости к гликопептидам, три вида бета-лактамаз, описана система секреции антимикробных соединений [8]. Однако большинство работ представляют собой биоинформатический анализ геномов [8], [9]. В нашей же работе мы решили подойти к проблеме антибиотикорезистентности Pseudoalteromonas с другой стороны и исследовать ее с помощью методов «мокрой биологии», о которых мы расскажем в этой статье. Кроме того, антибиотикорезистентные штаммы Pseudoalteromonas именно в Белом море еще не изучены. Именно поэтому дальнейшим этапом нашей работы стало лабораторное изучение особенностей этого микроорганизма.
Что мы получили, или что умеет наш штамм Pseudoalteromonas?
Антибиотики
Штамм Pseudoalteromonas вырос на всевозможных антибиотиках, используемых в нашей работе (рис. 5).
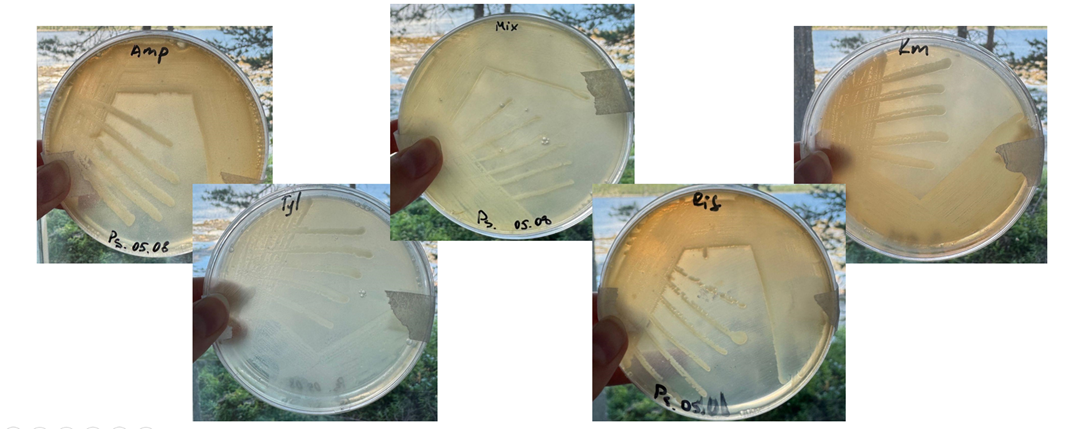
Рисунок 5. Рост штамма Pseudoalteromonas на антибиотиках слева направо: на ампициллине (50 мкг/мл), тилозине (30 мкг/мл), смеси из всех антибиотиков, рифампицине (15 мкг/мл), канамицине (100 мкг/мл). Все среды с антибиотиками также содержали нистатин (1600 ЕД/мл) для подавления роста грибов.
фотография авторов
После подтверждения роста на твердых питательных средах с антибиотиками мы решили проверить, какую концентрацию смогут выдержать эти бактерии. Для этого мы определяли минимальные ингибирующие концентрации (МИК) по схеме, представленной на рисунке 6.

Рисунок 6. Схема определения минимальных ингибирующих концентраций антибиотиков для Pseudoalteromonas. Делали последовательные разведения концентраций антибиотика в жидкой питательной среде от максимальной к минимальной с шагом уменьшения концентрации в два раза. Также ставили отрицательный и положительный контроль: пробирка со средой без бактерий и пробирка со средой с бактериями без антибиотиков, соответственно.
рисунок авторов
МИКи для всех тестируемых антибиотиков превысили все ожидания (таблица 1). Для сравнения приведем МИКи некоторых использованных антибиотиков для различных бактерий. Ингибирующая концентрация рифампицина для Staphylococcus aureus — 16 мкг/мл, что в 7,5 раз меньше, чем в нашем случае [10]. МИК ампициллина для Escherichia coli — 32 мкг/мл (меньше примерно в 30 раз) [11], МИК тилозина для Streptomyces sp. — 20 мкг/мл (меньше в 18 раз) [12], МИК канамицина для Pseudoalteromonas sp. — 25 мкг/мл (меньше в 1000 раз) [13].
| Антибиотик | Группа антибиотиков | Мишень | МИК, мкг/мл |
|---|---|---|---|
| Рифампицин | Ансамицины | РНК-полимераза | 120 |
| Ампициллин | Бета-лактамы | Транспептидаза | 1000 |
| Тилозин | Макролиды | 50S | 360 |
| Канамицин | Аминогликозиды | 30S | 25 600 |
| Стрептомицин | Аминогликозиды | 30S | 8000 |
| Ванкомицин | Гликопептиды | D-Ala-D-Ala | 2560 |
| Гентамицин | Аминогликозиды | 30S | 45 |
| Линкомицин | Линкозамиды | 50S | 5120 |
| Хлорамфеникол | Амфениколы | 50S | 400 |
Морская вода, даже профильтрованная и стерильная, содержит уникальный набор микроэлементов, витаминов и ростовых факторов. Сложность работы с морскими штаммами заключается в том, что иногда они «капризничают» и отказываются расти на искусственной морской воде. Интересно, что штамм Pseudoalteromonas рос в среде, в которой морская вода была заменена на раствор Рингера (аналог физиологического раствора) с 2% NaCl. Рост культуры сохранялся на протяжении нескольких пересевов, включая пересев на среду со смесью антибиотиков на морской воде (рис. 7), что говорит о том, что устойчивость при таких пересевах не теряется. Значит, поддерживать культуру можно и без морской воды. При этом на пресной воде Pseudoalteromonas не вырастал, это и понятно, ведь он — морской микроорганизм.

Рисунок 7. Рост Pseudoalteromonas на среде на растворе Рингера с 2% NaCl (0–3 пересевы). Стрелками показан пересев на среду на морской воде со смесью антибиотиков, на которой также наблюдается рост. Устойчивость к антибиотикам при таких пересевах не теряется.
рисунок авторов
Возможный механизм множественной резистентности у Pseudoalteromonas sp.
Антибиотикорезистентность у разных видов бактерий обеспечивается разными механизмами. В большинстве случаев антибиотики выкачиваются из клетки специализированными белками — помпами. У нас было несколько гипотез насчет механизма устойчивости нашей бактерии.
Первая гипотеза заключалась в том, что помпа у данной бактерии может работать только при ее росте на богатой среде. А при росте на бедной среде энергии для ее работы не хватает. Для проверки данной гипотезы мы культивировали Pseudoalteromonas sp. на средах со смесью антибиотиков: МХ на морской воде, олиготрофная МХ на морской воде (все компоненты среды уменьшены вдвое), морская вода с добавлением агара (бедная среда). В качестве контроля использовали такие же среды без антибиотиков (рис. 8). Рост наблюдался на всех вариантах сред.
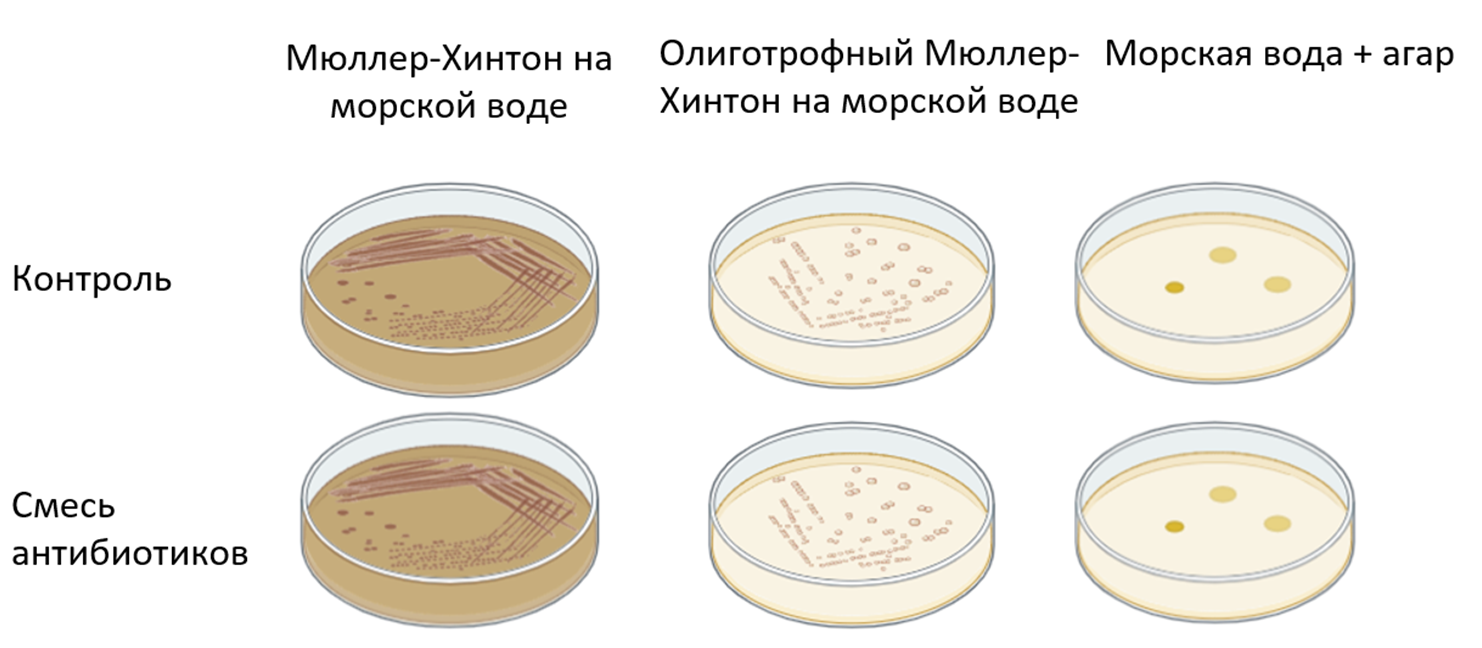
Рисунок 8. Культивирование Pseudoalteromonas sp. на средах разной степени «богатства»: МХ на морской воде с антибиотиками и без, олиготрофная среда МХ на морской воде с антибиотиками и без, морская вода с агаром с антибиотиками и без. Рост наблюдался на всех вариантах сред.
рисунок авторов
Таким образом, данная гипотеза оказалось ложной, так как Pseudoalteromonas sp. растет хорошо не только на богатой морской среде, но еще и на олиготрофной морской среде, и даже на морском агаре.
Вторая гипотеза — в переносе антибиотиков участвует насос, работающий по принципу антипорта. Для его работы нужна соль, которая есть в морской воде, но которой нет в растворе Рингера. Эта гипотеза подтверждается нашим экспериментом. Бактерии растут на следующих средах с антибиотиками: на морской воде, на искусственной морской воде, на искусственной морской воде с витаминами, а на среде с раствором Рингера — не растут (таблица 2).
| Среда | МХ на морской воде | МХ на ASW | МХ на ASW с витаминами | МХ на растворе Рингера c 2% NaCl |
|---|---|---|---|---|
| Контроль | + | + | + | + |
| Микс | + | + | + | – |
Нам захотелось получше изучить эту удивительную бактерию, поэтому мы решили выяснить, какими еще интересными свойствами она обладает. Так, мы проверили Pseudoalteromonas sp. на способность к гидролизу полисахаридов и на продукцию антимикробных веществ.
Полисахариды
Для проверки Pseudoalteromonas на способность к гидролизу полисахаридов было сделано следующее. Бактерии культивировали на твердых средах, содержащих агар, альгинат и каррагинан, а также на жидких средах с лигнином, целлюлозой, хитином и пектином. При первом пересеве использовали богатые среды с добавлением дрожжевого экстракта, при втором — бедные без дрожжевого экстракта (рис. 9).
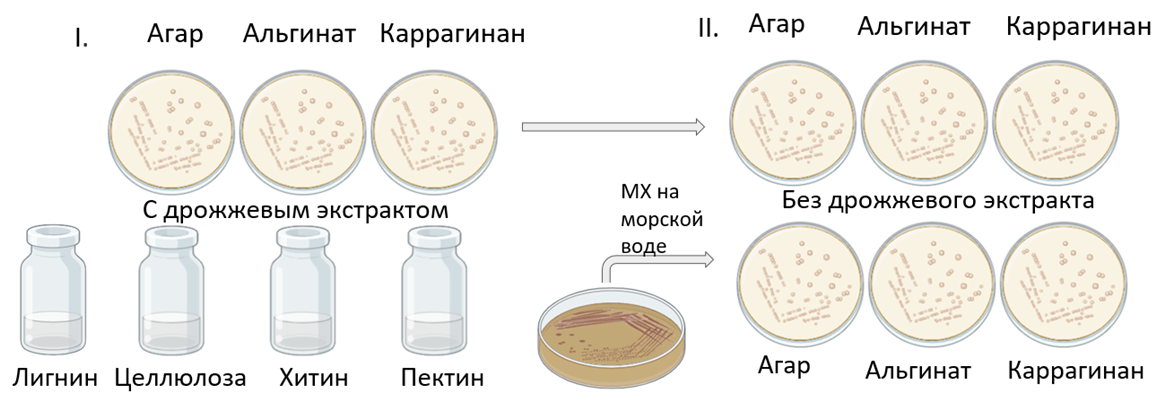
Рисунок 9. Схема эксперимента по гидролизу полисахаридов. Pseudoalteromonas sp. культивировали на твердых средах с агаром, альгинатом и каррагинаном, на жидких средах с лигнином, целлюлозой, хитином и пектином. Делали пересев с твердых сред с полисахаридами на такие же среды, а также со среды МХ на морской воде на твердые среды с полисахаридами.
рисунок авторов
Способность к гидролизу оценивали по наличию/отсутствию роста, при этом для оценки гидролиза полимеров в жидких средах проводили микроскопирование. Наш Pseudoalteromonas умеет гидролизовать все используемые нами виды полисахаридов, кроме хитина (табл. 3, рис. 10).
| Полисахарид | Рост |
|---|---|
| Агар | ++ |
| Альгинат | +++ |
| Каррагинан | +++ |
| Пектин | + |
| Целлюлоза | + |
| Хитин | – |
| Лигнин | + |
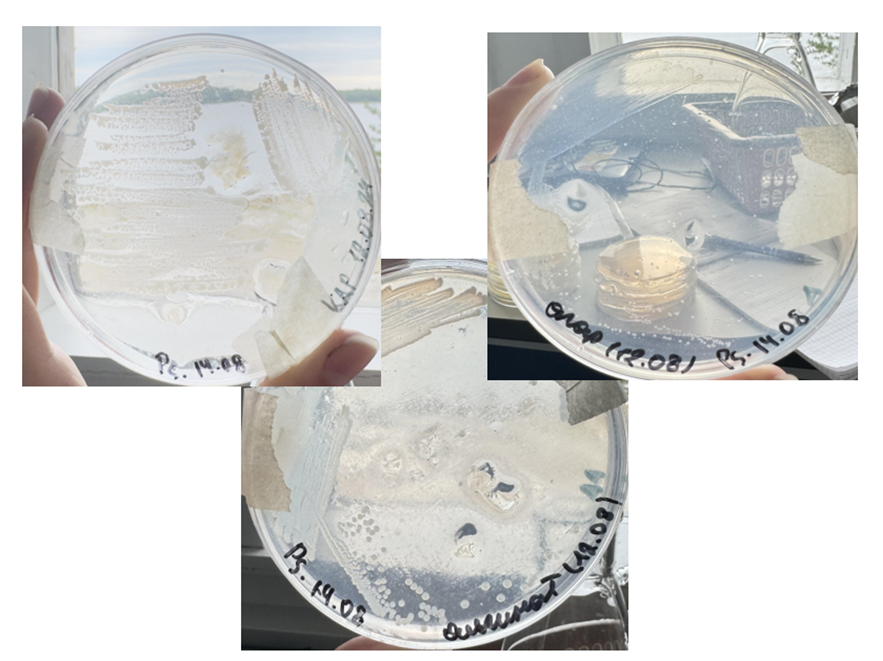
Рисунок 10. Рост Pseudoalteromonas sp. на твердой среде с каррагинаном, альгинатом и агаром (слева направо).
фото авторов
При этом рост на бедных твердых средах с каррагинаном, альгинатом и агаром был лучше при пересеве с таких же сред, но с содержанием дрожжевого экстракта, чем со среды МХ на морской воде (рис. 11). Это объясняется тем, что при первом пересеве на полисахариды микроб успел адаптироваться к среде (образовал и выделил нужные гидролитические ферменты), поэтому при втором пересеве ему было уже легче расти.
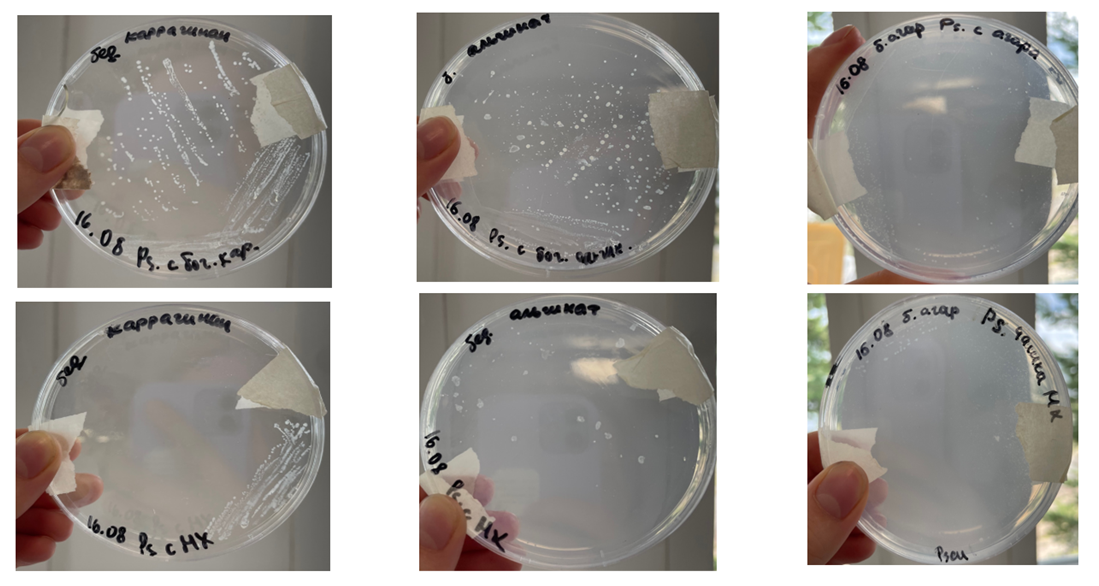
Рисунок 11. Рост Pseudoalteromonas sp. на бедных твердых средах с каррагинаном, альгинатом и агаром (слева направо). Верхний ряд чашек — пересев с таких же сред, но с дрожжевым экстрактом, нижний — со среды МХ на морской воде. На верхних чашках Pseudoalteromonas sp. растет лучше, успев синтезировать необходимые гидролитические ферменты.
фото авторов
Наличие гидролитических ферментов у нашего штамма представляет практический интерес: бактерия обладает внушительным набором ферментов, работающих при низких температурах, что может найти применение в энзимобиотехнологии.
Антимикробные вещества
Среди микроорганизмов существует интересная закономерность. Продуценты антимикробных веществ сами устойчивы к синтезированным ими веществам, но при этом могут обладать дополнительными механизмами защиты от других антибиотиков. Мы решили проверить, как с такой продукцией антибиотиков обстоят дела у нашего устойчивого штамма Pseudoalteromonas.
В качестве тест-культур мы выбрали значимые для человека бактерии: Pseudomonas aeruginosa, Escherichia coli и Staphylococcus aureus (рис. 11).
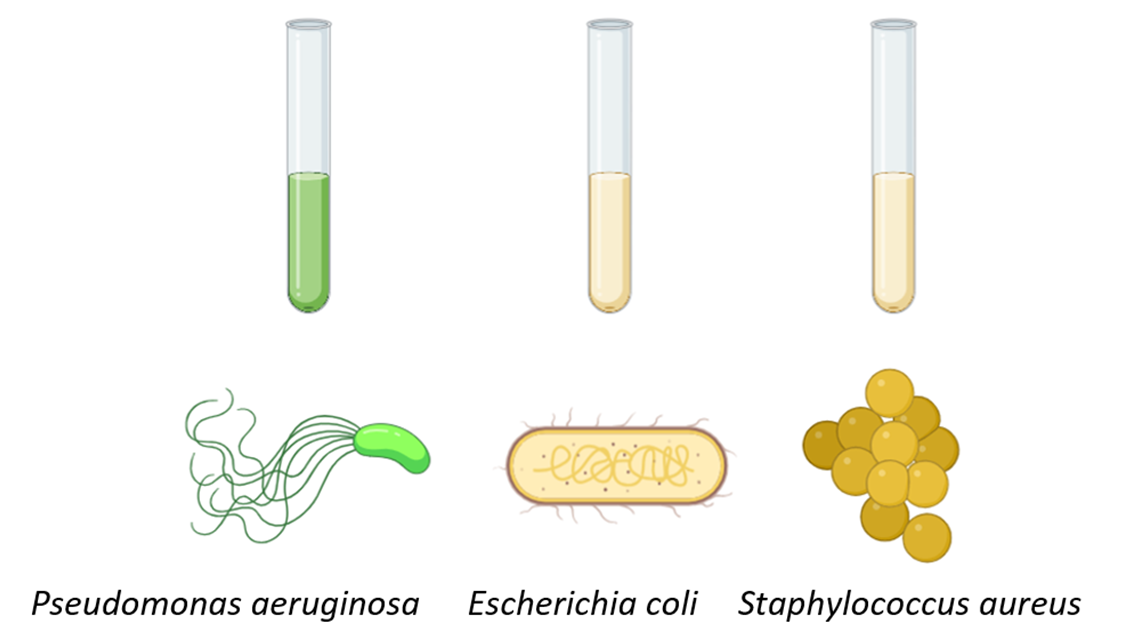
Рисунок 12. Жидкие культуры тест-культур Pseudomonas aeruginosa, Escherichia coli и Staphylococcus aureus.
рисунок авторов
Эксперимент ставили следующим образом: штамм Pseudoalteromonas культивировали на разных вариантах твердых питательных сред, жидкие тест-культуры вносили в расплавленную агаризованную среду и заливали в чашки (метод глубинного посева). После застывания среды с тест-культурами на нее ставили блочки с биомассой Pseudoalteromonas sp., вырезанные из разных сред (рис. 13). В качестве контроля использовали блочки чистых сред без «газона» Pseudoalteromonas sp.
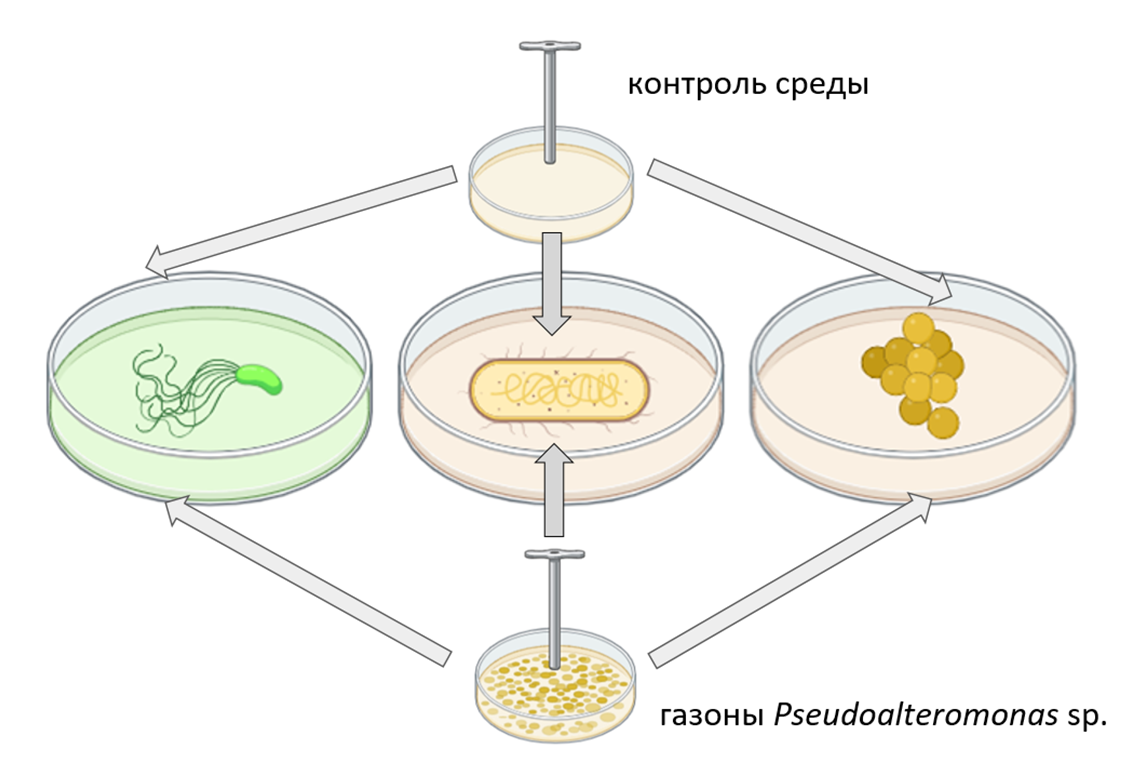
Рисунок 13. Эксперимент по продукции антимикробных веществ. Штамм Pseudoalteromonas культивировали на разных вариантах твердых питательных сред, жидкие тест-культуры вносили в расплавленную агаризованную среду и заливали в чашки (метод глубинного посева). После застывания среды с тест-культурами на нее ставили блочки с биомассой Pseudoalteromonas sp. из разных сред. В качестве контроля использовали блочки чистых сред без «газона» Pseudoalteromonas sp.
рисунок авторов
Результат эксперимента был отрицательный, ни в одном из случаев подавление роста тест-культуры газоном Pseudoalteromonas sp. не наблюдалось, а значит, наш штамм, к сожалению, не продуцирует антимикробных веществ.
Заключение
Изучение природных штаммов бактерий — важная область микробиологии. Это особенно актуально для морей, потому что микроорганизмы, обитающие в северных морях, довольно плохо изучены. Природные штаммы обладают интересными свойствами, которые могут принести человеку как пользу, так и вред. Особое место в этом вопросе занимает множественная устойчивость к антибиотикам. Из-за потенциальной опасности для человека исследования в этом направлении очень актуальны.
Таким образом, наша работа вносит вклад в изучение устойчивых к антибиотикам микроорганизмов. В ходе исследования было установлено, что штаммы бактерий с множественной антибиотикорезистентностью присутствуют в воде Белого моря на большой глубине, в месте с низкой антропогенной нагрузкой. Выделенный нами штамм Pseudoalteromonas обладает крайне высокой устойчивостью к антибиотикам с разным механизмом действия, при этом сам не способен к продукции антимикробных соединений.
Дальнейшие планы по изучению этого супермикроба направлены на поиск механизма устойчивости Pseudoalteromonas к антибиотикам. Для этого мы проведем полногеномное секвенирование ДНК этого штамма и сравним с геномом арктического штамма Pseudoalteromonas, который совсем не контактировал с человеком.
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Fernando De La Cruz, Laura S. Frost, Richard J. Meyer, Ellen L. Zechner. (2010). Conjugative DNA metabolism in Gram-negative bacteria. FEMS Microbiol Rev. 34, 18-40;
- Emanuele Bosi, Marco Fondi, Valerio Orlandini, Elena Perrin, Isabel Maida, et. al.. (2017). The pangenome of (Antarctic) Pseudoalteromonas bacteria: evolutionary and functional insights. BMC Genomics. 18;
- Charles Thomas Parker, Kara Mannor, George M Garrity Nomenclature Abstract for Pseudoalteromonas lipolytica Xu et al. 2010. — NamesforLife, LLC;
- Zhenshun Zeng, Jiayu Gu, Shituan Lin, Qian Li, Weiquan Wang, Yuexue Guo. (2023). Molecular basis of the phenotypic variants arising from a Pseudoalteromonas lipolytica mutator. Microbial Genomics. 9;
- Qi-Long Qin, Yang Li, Yan-Jiao Zhang, Zhe-Min Zhou, Wei-Xin Zhang, et. al.. (2011). Comparative genomics reveals a deep-sea sediment-adapted life style of Pseudoalteromonas sp. SM9913. The ISME Journal. 5, 274-284;
- Osita C. Eze, Dinebari P. Berebon, Stephen C. Emencheta, Somtochukwu A. Evurani, Chibundo N. Okorie, et. al.. (2023). Therapeutic Potential of Marine Probiotics: A Survey on the Anticancer and Antibacterial Effects of Pseudoalteromonas spp.. Pharmaceuticals. 16, 1091;
- Ricardo Sánchez-Díaz, Zinnia Judith Molina-Garza, Lucía Elizabeth Cruz-Suárez, Joseph Selvin, George Seghal Kiran, et. al.. (2019). Draft genome sequence of Pseudoalteromonas piscicida strain 36Y_RITHPW, a hypersaline seawater isolate from the south coast of Sonora, Mexico. Journal of Global Antimicrobial Resistance. 16, 83-86;
- A. J. O'Neill, J. H. Cove, I. Chopra. (2001). Mutation frequencies for resistance to fusidic acid and rifampicin in Staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 47, 647-650;
- Mengchen Li, Qiaoli Liu, Yanli Teng, Liuyang Ou, Yuanlin Xi, et. al.. (2019). <p>The resistance mechanism of <em>Escherichia coli</em> induced by ampicillin in laboratory</p>. IDR. Volume 12, 2853-2863;
- Leslie J Onan, Timothy M LaPara. (2003). Tylosin-resistant bacteria cultivated from agricultural soil. FEMS Microbiology Letters. 220, 15-20;
- Alessandro Busetti, George Shaw, Julianne Megaw, Sean Gorman, Christine Maggs, Brendan Gilmore. (2014). Marine-Derived Quorum-Sensing Inhibitory Activities Enhance the Antibacterial Efficacy of Tobramycin against Pseudomonas aeruginosa. Marine Drugs. 13, 1-28.









