
SciNat за январь 2025 #3: ИИ разрабатывает противоядия, новый редактор генома и секрет болезни Хантингтона
19 января 2025
SciNat за январь 2025 #3: ИИ разрабатывает противоядия, новый редактор генома и секрет болезни Хантингтона
- 299
- 0
- 0
Неформалы от мира моллюсков. Моллюски являются второй по разнообразию группой животных после членистоногих (насекомых, паукообразных и родственных им беспозвоночных), но их эволюция во многом остается загадкой, в основном потому, что мягкие ткани моллюсков плохо сохранились в палеонтологической летописи. В выпуске журнала Nature на этой недели Марк Саттон и его коллеги представляют окаменелости двух недавно описанных видов моллюсков, возраст которых составляет около 430 миллионов лет. Окаменелости были найдены в Херефордшире, Великобритания. Два вида сохранились в трехмерном виде, и исследователи смогли проанализировать и реконструировать их в виде виртуальных моделей, изображенных на обложке журнала. Новый вид — это червеобразные существа, характеризующиеся особыми шипами. Команда назвала одного из них Панком (слева на изображении на обложке), потому что его шипы напоминают прически, связанные с панк-роком, а другого — Эмо, потому что его шипы напоминают длинную бахрому, связанную с музыкальным жанром эмо. Вместе Панк и Эмо указывают на то, что ранние моллюски были более разнообразной биологической группой, чем их современные аналоги. — New Silurian aculiferan fossils reveal complex early history of Mollusca.
-
Автор
-
Редактор
Из нового январского выпуска дайджеста SciNat вы узнаете про новый метод редактуры генома и как он помогает лечить генетическую болезнь печени. Опасный ротавирус распространяется в северном полушарии, а искусственный интеллект научился моделировать противоядия от змеиного яда. Мы расскажем, как миостатин регулирует репродуктивную способность человека, а лимфоциты на пару с нейронами контролируют уровень глюкозы. Ученые наконец установили причину генетических сбоев и их развития в течение жизни при нейродегенеративной болезни Хантингтона.
Генетика
Новый метод редактуры генома для лечения генетических заболеваний
Биотехнологическая компания iECURE разработала генную терапию, которая позволяет вшивать лечебный ген в «безопасную гавань», определенное место хромосомы, где его интеграция вряд ли нарушит существующую ДНК таким образом, чтобы вызвать рак или другие проблемы. Поскольку ген был интегрирован в геном ребенка, в данном случае — в клетки печени мальчика, он должен сохраняться по мере роста органа — и человека.
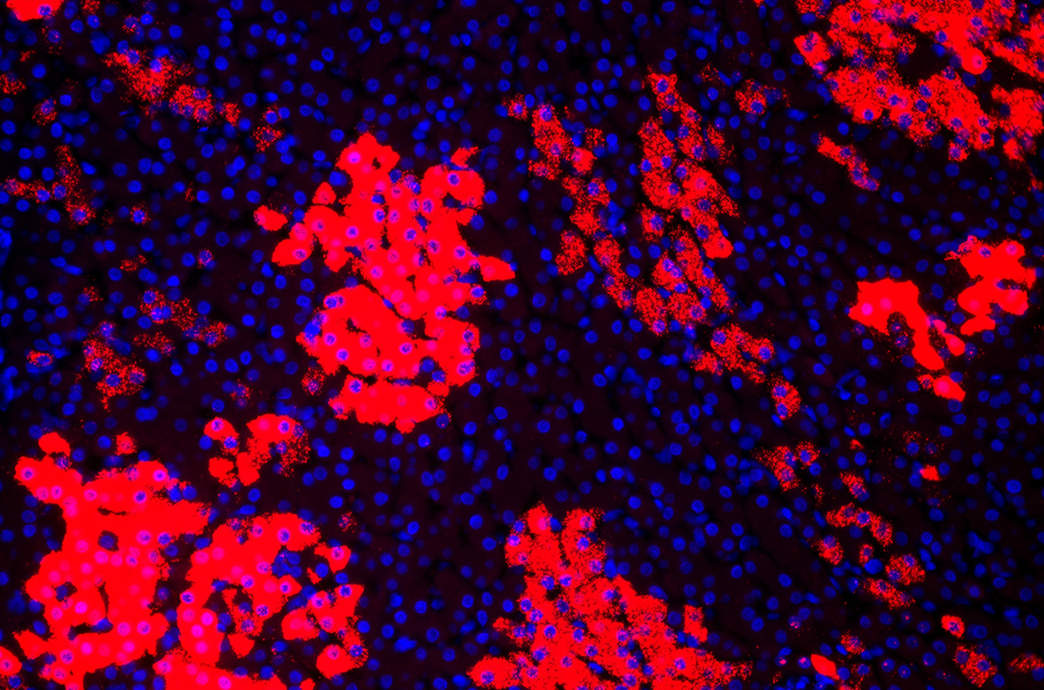
Клетки печени обезьяны светятся из-за встроенной флюоресцентной метки гена фермента, введенного в детеныша животного годом ранее с помощью аденовирусов и инновационного редактора генов ARCUS.
Генный редактор, получивший название ARCUS, представляет собой фермент из класса нуклеаз, который позволяет разрезать ДНК. Он в некотором смысле проще и потенциально лучше, чем более известная платформа CRISPR, и может также помочь в лечении других генетических нарушений обмена веществ. Доклинические испытания на обезьянах показали большой успех данного подхода в лечение генетических заболеваний печени.
После неудачи с CRISPR в исследованиях на животных исследователи компании обратились к ARCUS, нуклеазе из водоросли, которую ученые из Университета Дьюка идентифицировали два десятилетия назад и превратили в настраиваемый редактор генов. В то время как CRISPR нуждается в направляющей последовательности РНК, чтобы доставить свою нуклеазу к целевой последовательности ДНК, фермент ARCUS может самостоятельно попасть в нужное место. Редактор также меньше CRISPR, поэтому его проще упаковать в аденоассоциированных вирусах (AAV).
Лечение проводилось на пациенте, страдающим дефицитом фермента орнитинтранскарбамилазы (OTC) в печени. Ранний дефицит ОТС возникает из-за мутации, которая отключает фермент, необходимый для превращения опасного побочного продукта метаболизма, аммиака, в выводимую организмом мочевину. Без ОТС аммиак накапливается в крови и может вызвать судороги, повреждение мозга и смерть.
OTC, как и многие детоксицирующие ферменты, экспрессируется в печени. В традиционном подходе генной терапии, направленном на орган, терапевтический ген добавляют к клеткам в виде свободно плавающих петель ДНК, которые не попадают в хромосому. Эти гены могут постепенно теряться по мере деления и смерти клеток, приводя к повторному развитию болезни.
Младенец, которому сделали первую инъекцию генного редактирования, получил два вида AAV, один из которых нес ДНК ARCUS, а другой — ген OTC. В первые недели жизни до лечения младенец уже пережил две судороги, вызванные аммиаком. Но через три месяца после начала лечения уровень аммиака в его крови снизился, и он смог отказаться от специальной белковой диеты с ограниченным содержанием аммиака. Однако компания iECURE не будет представлять данные по прошедшему лечение младенцу до марта, поэтому выводы делать пока рано. — Gene editor may have cured infant of a deadly metabolic disorder, «Биомолекула»: «Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo».
Вирусология
Норовирус, вызывающий сильную диарею и рвоту, набирает обороты в северном полушарии
Норовирус процветает в холодном климате, вызывая взрывную диарею и рвоту, которые обычно длятся всего день. Но спустя несколько недель после выздоровления люди все еще могут распространять вирус. Сам вирус может оставаться заразным в течение длительного времени, находясь на различных поверхностях. Он известен своей устойчивостью ко многим дезинфицирующим средствам, а исследования на взрослых добровольцах показали, что даже следа вируса достаточно, чтобы вызвать у человека заболевание. Устрицы также являются источником инфекции, поскольку фильтрующие моллюски концентрируют вирус из зараженной воды в своих тканях. Это даже вызвало запрет добычи устриц на некоторых фермах во Франции.
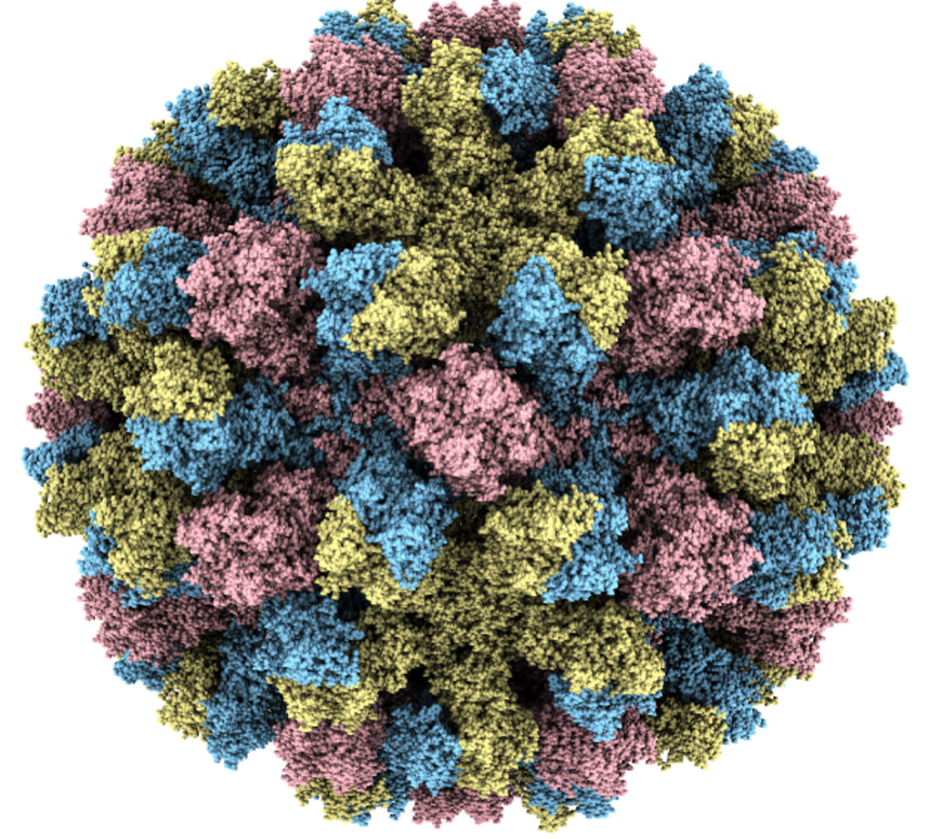
Созданная из основного поверхностного белка норовируса, эта вирусоподобная частица очень похожа по структуре на настоящий вирус и стала основой недавней вакцины-кандидата, которая не прошла клинические испытания.
Хотя смертность, связанная с норовирусом, невысока в богатых странах, он ежегодно убивает около 200 000 маленьких детей в развивающихся странах. Даже в США это основная причина госпитализации из-за диарейных заболеваний, особенно сильно поражающих маленьких детей и пожилых людей. У людей с ослабленным иммунитетом, особенно у онкологических больных, проходящих химиотерапию, или у реципиентов трансплантатов, принимающих препараты против отторжения, могут возникнуть хронические инфекции, которые присутствуют в организме месяцами или даже годами. Многие заболевшие люди также пропускают работу, что в мировом масштабе приводит к ежегодным потерям в размере около 60 миллиардов долларов.
Самый продвинутый кандидат на вакцину, содержащий «вирусоподобные частицы» из VP1, провалился в испытании эффективности на младенцах, сообщил его производитель HilleVax в июле 2024 года. Китайская компания Zhifei проводит испытание эффективности на детях кандидата в вакцины, содержащего смесь из четырех генотипов вируса, включая GII.4 и GII.17. А Moderna в сентябре 2024 года начала испытание эффективности на взрослых вакцины, которая использует матричные РНК, кодирующие VP1 из нескольких вариантов (хотя и не GII.17).
Даже если вакцина от норовируса окажется безопасной и эффективной, она будет противостоять одному из самых заразных вирусов в природе. Это означает, что вакцина вряд ли предотвратит все симптомы и полностью остановит передачу. Вероятно, также потребуются регулярные ревакцинации. Но, как и вакцины от COVID-19, вакцина от норовируса может замедлить распространение заболевания и уберечь людей от тяжелой формы заболевания или даже смерти, не давая одному дню страданий превратиться во что-то гораздо более худшее. — Why the ‘Ferrari of viruses’ is surging through the Northern Hemisphere.
In silico
ИИ может помочь разработать более дешевые, быстрые и эффективные противоядия от змеиных ядов

Плюющаяся кобра Naja nigricincta, которая водится в некоторых частях Южной Африки.
Укусы ядовитых змей убивают более 100 000 человек каждый год по всему миру и калечат бесчисленное множество жертв укуса. Однако противоядия, золотой стандарт лечения, производятся так же, как и 100 лет назад: путем инъекции яда животным, а затем сбора и очистки вырабатываемых ими антител. Сегодня в Nature исследователи сообщают о многообещающих результатах с другой стратегией, которая может оказаться быстрее, дешевле и эффективнее — синтетические противоядия, созданные с помощью искусственного интеллекта (ИИ).
В новом исследовании использовались небольшие белки, называемые «связующими», разработанные программой ИИ RFdiffusion. ИИ, которую создали лауреат Нобелевской премии Дэвид Бейкер и его коллеги из Вашингтонского университета. Здесь создают новые белковые структуры, соответствующие определенным спецификациям — в данном случае для связывания с определенным токсином яда. Бейкер и его коллеги говорят, что крошечный размер белков делает их более простыми и менее затратными в производстве, чем обычные антитела, а также может нести другие преимущества, включая лучшую биодоступность для организма.
Первая партия связующих веществ, которую опробовали ученые, полностью нейтрализовала так называемые трехпалые токсины, одно из самых смертоносных семейств ядовитых токсинов, которые вырабатывают кобры и многие другие смертоносные змеи. Связующие вещества работали лучше, чем антитела, защищая клетки, а затем и мышей, независимо от того, смешивались ли они с токсинами заранее (стандартный тест на потенциальные противоядия) или вводились через 15 минут (имитация настоящего укуса), и все это без видимых негативных последствий для животных. После разработки новые противоядия производятся всего за несколько недель. А поскольку их можно массово производить с помощью бактерий или дрожжей, цена конечного продукта может быть очень низкой. — AI could help develop cheaper, faster, and more effective snake antivenoms, «Биомолекула»: «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов».
Физиология
Мышечный гормон миостатин контролирует репродуктивную систему млекопитающих.
Гипоталамо-гипофизарно-гонадная ось млекопитающих контролирует выработку половых гормонов и функцию мужской и женской репродуктивной системы. Гипофиз выделяет фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон в ответ на выработку гипоталамусом гонадотропин-рилизинг-гормона. В свою очередь, гонады вырабатывают стероидные и нестероидные гормоны, которые по обратной связи с гипофизом подавляют выработку ФСГ. Последний тип гормона включает ингибин, который вырабатывается гранулезными клетками яичников у женщин и клетками Сертоли яичек у мужчин. В новой статье журнала Science ученые сообщают, что миостатин влияет на эту классическую эндокринную петлю обратной связи. Миостатин вырабатывается скелетными мышцами и блокирует рост и дифференцировку мышечных клеток. Исследование выявляет перекрестные помехи между мышцами и репродуктивной системой и поднимает вопросы о вмешательствах для увеличения мышечной массы, которые могут повлиять на фертильность. — Myostatin’s flex on the reproductive hormone axis, «Биомолекула»: «Тестостероновая недостаточность. Нужен ли женщинам главный „мужской“ половой гормон?».
Геронтология
Панорамный обзор динамики клеточной популяции при старении млекопитающих
По мере того, как мы стареем, определенные типы клеток в разнообразном клеточном ландшафте различных органов претерпевают существенные изменения. Эти изменения не только влияют на общую функцию организма, но и играют решающую роль в развитии возрастных заболеваний. Каталогизация этих уязвимых типов клеток имеет важное значение для понимания клеточной основы патологий, связанных со старением, и для определения потенциальных вмешательств. Однако присущая гетерогенность и различные пропорции клеток в каждом органе затрудняют выявление редких, но важных типов клеток, связанных со старением. Хотя исследования геномики отдельных клеток изучали влияние старения на различные органы, традиционные исследования сталкиваются с такими проблемами, как несбалансированное половое распределение, предвзятая возрастная выборка и ограниченный охват типов клеток. Эти ограничения препятствуют всестороннему и систематическому анализу процесса старения на клеточном уровне.
Чтобы установить панорамную клеточную характеристику старения организма у млекопитающих и определить типы клеток, связанные с процессом старения, ученые оптимизировали недорогой высокопроизводительный метод EasySci для создания унифицированной платформы профилирования отдельных ядер для всех основных органов млекопитающих. Исследователи собрали и профилировали образцы тканей и органов у мышей на протяжении всей их жизни, используя сбалансированную по половым различиям когорту с множественными повторностями. Чтобы препарировать межклеточные регуляторные сети, ученые использовали стратегию нокдауна клеток для выборочного истощения зрелых лимфоцитов in vivo у взрослых и старых мышей, что позволило исследовать роль лимфоцитов в регулировании динамики популяции других типов клеток во время старения. Исследователи дополнительно изучили регуляторную роль иммунной системы в старении и выявили специфические возрастные расширения популяций клеток, зависящих от лимфоцитов. — A panoramic view of cell population dynamics in mammalian aging.
Тканевая иммунология
Взаимодействие нейронов и ILC2 регулирует гомеостаз глюкагона и глюкозы в поджелудочной железе
Эндокринная часть поджелудочной железы — это орган, который способствует метаболическому гомеостазу глюкозы, высвобождая гормоны поджелудочной железы инсулин и глюкагон. Глюкагон секретируется в кровь альфа-клетками, расположенными в островке Лангерганса поджелудочной железы. Голодание или занятия спортом с высоким потреблением энергии могут привести к снижению концентрации глюкозы в плазме, и в ответ стимулируется секреция глюкагона, что способствует выработке эндогенной глюкозы в печени. Повышенный уровень глюкагона способствует печеночному гликогенолизу и глюконеогенезу, посредством которых гликоген и неуглеводные субстраты, соответственно, трансформируются в эндогенную глюкозу. Центральная нервная система также играет важную роль в регуляции гомеостаза глюкозы, регулируя секрецию гормонов поджелудочной железы в соответствии с системными метаболическими потребностями в глюкозе. Адаптивные и врожденные лимфоциты могут формировать гомеостаз глюкозы, модулируя поглощение глюкозы, расход энергии и эндокринную активность. Взаимодействия между нервной и иммунной системами в периферических органах стали основными регуляторами физиологии организма, расхода жировой энергии и защиты тканей. Эти наблюдения выдвинули гипотезу о том, что нервная и иммунная системы могут сотрудничать для интеграции уровней энергии тела, тем самым модулируя эндокринную функцию и устанавливая пути межорганной коммуникации, которые контролируют гомеостаз глюкозы.
Используя мышей с разным уровнем дефицита лимфоцитов, ученые определили, что врожденные лимфоидные клетки (ILC) способствуют поддержанию физиологических уровней глюкозы в крови натощак и глюкагона. В частности, мыши, лишенные адаптивных и врожденных лимфоцитов, показали снижение уровня глюкагона в крови, нарушение глюконеогенеза из пирувата и низкие уровни глюкозы в крови натощак. Трансплантация и подходы условно-специфического деления клеток показали, что врожденные лимфоидные клетки группы 2 (ILC2) были достаточными и необходимыми для сохранения физиологических уровней глюкозы в крови, индукции секреции глюкагона поджелудочной железой и стимулирования глюконеогенеза в печени. Исследователи обнаружили ILC2 в островках Лангерганса, а цитокины, полученные из ILC2, заставляли альфа-клетки поджелудочной железы секретировать глюкагон in vitro. Генетические эксперименты по фотоконверсии показали, что голодание индуцировало миграцию кишечных ILC2 в поджелудочную железу, что было связано с экспрессией генов, связанных с резидентностью кишечной ткани, которая была снижена в ILC2. Трассировка, химические, генетические и хемогенетические манипуляции показали, что кишечные нейроны, соединяющиеся с мозгом, были необходимы и достаточны для управления увеличенным количеством ILC2 в поджелудочной железе в течение 16-часового периода голодания. Генетическая делеция адренергического бета 2 рецептора (ADRB2) в ILC2 показала, что ILC2-автономная адренергическая сигнализация была необходима для миграции ILC2 в поджелудочную железу, вызванной голоданием и сигналами нейронов. — Neuronal-ILC2 interactions regulate pancreatic glucagon and glucose homeostasis, «Биомолекула»: «Трансплантация островков поджелудочной железы: как, кому и почему не всем?».
Нейробиология
Почему фатальному гену Хантингтона требуется так много времени, чтобы нанести вред?
Почему люди, которые наследуют болезнь мозга Хантингтона, часто начинают проявлять симптомы только в зрелом возрасте, между 30 и 50 годами? Ответ кроется в неисправном механизме восстановления ДНК в нейронах, который набирает силу до тех пор, пока количество ошибок не достигает критического порога и нейроны не начинают умирать.
Исследование нейронов, наиболее пострадавших от болезни, опубликованное в Nature, предполагает, что белки репарации ДНК могут быть перспективными целями для лечения болезни Хантингтона, а также десятков подобных генетических расстройств. Нацеливание на эти белки «имеет потенциал отсрочить начало болезни или замедлить ее прогрессирование», — говорит Кристофер Пирсон, молекулярный генетик человека в Больнице для больных детей в Торонто, Канада.
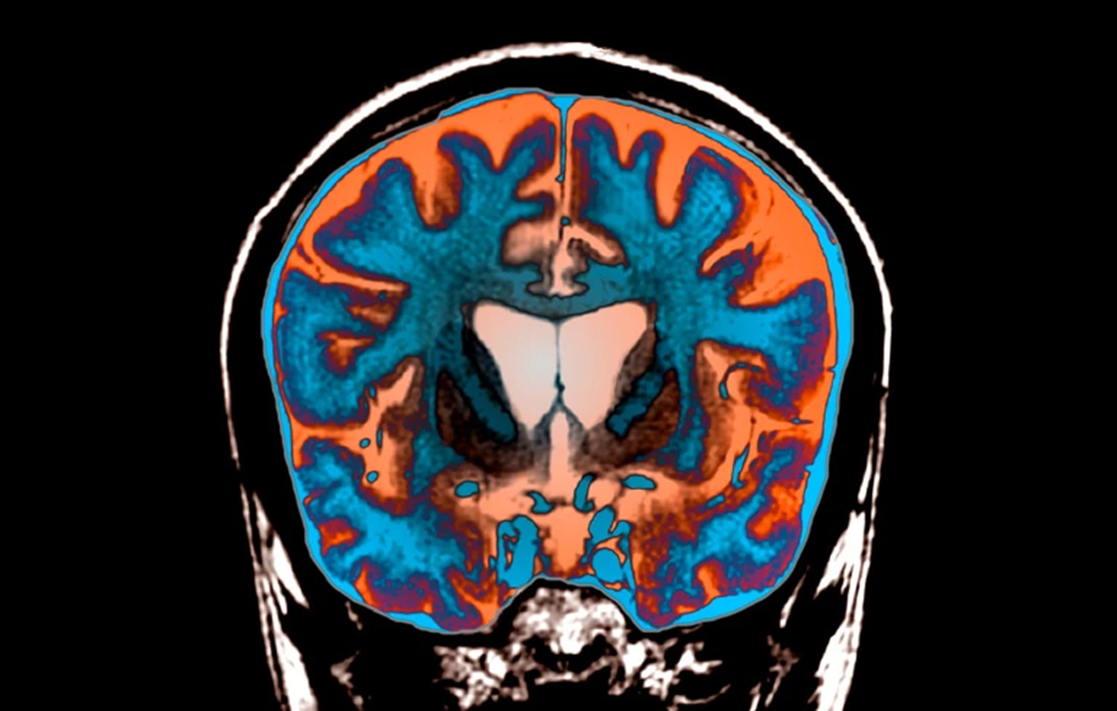
МРТ снимок мозга с болезнью Хантингтона.
Болезнь Хантингтона — неизлечимое и фатальное генетическое заболевание, которое постепенно влияет на движение, равновесие и познавательные способности. Она вызвана наследственной мутацией в аллеле гена HTT , в котором последовательность из трех оснований ДНК, C, A и G, повторяется не менее 36 раз.
Исследователи изучили профили CAG нейронов в определенной области мозга шести человек, умерших от болезни Хантингтона и пожертвовавших свои тела для исследований. Они разработали методику, которая могла определить, сколько повторов CAG накопилось в одном ядре — даже очень длинных цепочек повторов — и одновременно секвенировать все транскрипты РНК в этом ядре. Количество повторов CAG в большинстве нейронов было не так уж и велико от того, с каким они родились, но определенные нейроны, которые, как считалось, первыми умирают в ходе болезни Хантингтона — стриарные проекционные нейроны — накопили гораздо больше повторов к моменту смерти. До 98% накопили около 60–73 CAG, а некоторые — сотни. Нейроны могут накапливать эти повторяющиеся ошибки, когда ДНК разделяется для создания РНК, но две нити не застегиваются обратно правильно, создавая петлю с одной стороны. Затем белки репарации ДНК приходят, чтобы «исправить» проблему, но часто добавляют последовательности, которых ранее не было.
Моделируя прогрессирование заболевания, исследователи обнаружили, что нейроны стриарной проекции десятилетиями медленно накапливают CAG — им может потребоваться до 50 лет, чтобы добавить 20 дополнительных CAG. Но этот процесс ускоряется по мере того, как они набирают больше CAG, пока не достигают порога в 150 повторов. Примерно в течение 95% жизни нейрона ген HTT не оказывает токсического эффекта. Это объясняет, почему людям с заболеванием требуется так много времени, чтобы проявить симптомы, говорит МакКэрролл. Нейроны кажутся здоровыми, пока не достигают порога в 150 CAG. Главный вывод исследования заключается в том, что методы лечения, блокирующие накопление CAG, могут помочь отсрочить появление симптомов. — Revealed: Why the fatal Huntington’s gene takes so long to cause harm, «Биомолекула»: «Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона)».






