
SciNat за январь 2024 #1: дофамин заставляет рисковать, живородящие улитки и хитрые хищные растения
07 января 2024
SciNat за январь 2024 #1: дофамин заставляет рисковать, живородящие улитки и хитрые хищные растения
- 369
- 0
- 0
На обложке — плотоядное растение Nepenthes gracilis, которое развило у себя интересный способ охоты. Насекомые прячутся от дождя под крышкой кувшина, а падающие сверху капли сбрасывают животных в ловушку. Исследователи обнаружили, что этот необычный механизм, основанный на трех независимых признаках, эволюционировал дважды, а случайное совпадение высокопластичных признаков способствовало появлению нового признака. Работа ученых раскрывает нам секреты эволюционного появления сложных признаков и то, как они конвергентно возникают у различных неродственных видов. — Evolutionary paths to new phenotypes, Convergence in carnivorous pitcher plants reveals a mechanism for composite trait evolution.
-
Автор
-
Редактор
Первый выпуск SciNat в 2024 году порадует нас очередными достижениями биологии и медицины. На повестке дня — иммунологические исследования. Из выпуска вы узнаете, как побороть аутоиммунные заболевания, зачем создавать иммунологическую базу данных и как можно нивелировать неприятный побочный эффект иммунотерапии рака. Нейробиологи разобрались, почему обезьяны рискуют, а генетики отследили эволюционное появление новых функций у хищных растений и улиток. Кроме того, наблюдается прогресс в создании новых классов антибиотиков — на этот раз мишенью стала липополисахаридная оболочка грамотрицательных бактерий.
Иммунология
Тестируются стратегии лечения, которые модулируют доставку антигена, чтобы обратить вспять аутоиммунные реакции
Аутоиммунные заболевания охватывают широкий спектр иммунологических заболеваний, от которых страдают от 4 до 10% населения во всем мире. Они возникают, когда нарушается иммунологическая толерантность к собственным антигенам, что приводит к иммунному ответу против клеток, тканей или органов организма. Результатом такого состояния служит дисфункция органов и/или разрушение тканей. Целью терапии аутоиммунных заболеваний является восстановление толерантности к аутоантигену, вызывающему патологию, путем воздействия на аутореактивные Т-клетки при сохранении их иммунной компетентности для предотвращения появления инфекций и злокачественных новообразований. Основная задача этих стратегий заключается в выборе способа доставки вызывающего болезнь антигена, чтобы он мог инициировать удаление или перепрограммирование аутореактивных Т-клеток. Лечение также может привести к индукции и/или экспансии антигенспецифических регуляторных Т-клеток для подавления активности аутореактивных Т-клеток. Хотя потенциал подходов антигенной иммунотерапии для восстановления толерантности был продемонстрирован при лечении аллергии на арахис, опосредованной иммуноглобулином E (IgE), антигенная терапия аутоиммунных заболеваний все еще разрабатывается. Подробнее о передовых стратегиях лечения в этой области читайте в статье Science. — Restoring tolerance with antigen delivery, «Биомолекула»: «Иммунитет: борьба с чужими и… своими».
Гигантский проект изучит иммунное разнообразие человека для улучшения лекарств и вакцин
Вакцина против гепатита B является одним из самых мощных видов иммунизации, обычно обеспечивающим десятилетия защиты от смертельного вируса, убивающего печень. Но примерно у 10% людей она не работает. Поэтому в 2020 году Эми Хуэй-И Ли, системный биолог из Университета Саймона Фрейзера, и ее коллеги решили научиться предсказывать потенциальную пользу вакцин. Ученые обнаружили, что данные об иммунной системе реципиентов, такие как содержание определенных белков и характер активности нескольких генов, предсказывают, будут ли они генерировать защиту от вируса. «Мы поняли, какие факторы влияют на реакцию к вакцине, а какие нет», — говорит Ли.
Ей и ее коллегам удалось провести измерения лишь у нескольких пациентов, но амбициозная работа, которую планируется начать в начале этого года, позволит собрать такие данные у сотен тысяч добровольцев по всему миру. Проект, получивший название «Проект Иммунома Человека» (HIP) и поддерживаемый международным консорциумом компаний, правительственных учреждений и университетов, будет исследовать тысячи иммунных переменных в образцах крови и тканей. Результатом, вероятно, станет крупнейшая и наиболее полная в мире иммунологическая база данных, ресурс для ученых, исследующих различия в иммунной системе и то, как они влияют на нашу реакцию на вакцины и лекарства, а также на нашу уязвимость к болезням. «Здесь открываются огромные возможности с точки зрения понимания болезней человека», — говорит иммунолог Марк Дэвис из Стэнфордского университета, который не участвует в проекте.
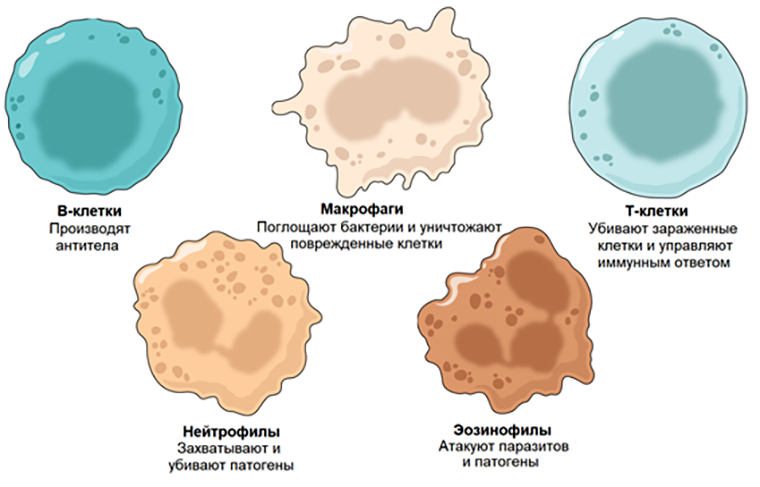
Иммунные клетки выполняют множество функций, и их каталогизация способна помочь исследователям получить представление о состоянии иммунной системы.
И это только начало усилий, которые в настоящее время финансируются примерно на 5 миллионов долларов в год, но в конечном итоге могут привлечь миллиарды. HIP, который является ответвлением предыдущего проекта, известного как «Проект человеческих вакцин», также будет использовать эти данные в качестве основы для новых моделей искусственного интеллекта (ИИ), которые смогут прогнозировать реакцию иммунной системы среди всего населения. Таким образом, они предоставят ценную информацию не только для фармацевтических компаний и правительства, но для врачей и пациентов. «Последствия будут ощущаться во всем мире», — говорит нейробиолог Ханс Кейрстед, генеральный директор проекта в Ирвайне, штат Калифорния. — Giant project will chart human immune diversity to improve drugs and vaccines.
Зависимая от микробиоты активация CD4+ Т-клеток индуцирует колит, связанный с блокадой CTLA-4, через Fcγ-рецепторы
Иммунотерапия рака с использованием ингибиторов иммунных контрольных точек блокирует негативные сигналы активации Т-клеток и вызывает иммунный ответ против опухолей, но также может привести к иммунопатологиям. Колит — это острое или хроническое воспаление слизистой оболочки толстого кишечника. Он является частым и тяжелым нежелательным явлением у пациентов, принимающих терапию антителами, нацеленными на ингибитор контрольной точки цитотоксического белка Т-лимфоцитов 4 (CTLA-4), но основные механизмы, приводящие к этой реакции, остаются неясными. В новой статье ученые продемонстрировали, что колит, вызванный блокадой CTLA-4, у мышей зависит от состава микробиоты кишечника. Воспаление кишечника обусловлено неограниченной активацией IFNγ-продуцирующих CD4+ Т-клеток и истощением периферически индуцированных регуляторных Т-клеток посредством передачи сигналов рецептора Fcγ. Соответственно, нанотела анти-CTLA-4, у которых отсутствует домен Fc, могут стимулировать противоопухолевые реакции, не вызывая колита. Эта работа предлагает стратегию смягчения кишечных патологий при сохранении противоопухолевого стимулирующего эффекта блокады CTLA-4. — Microbiota-dependent activation of CD4+ T cells induces CTLA-4 blockade–associated colitis via Fcγ receptors, «Биомолекула»: «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль».
Нейробиология
Дофамин регулирует отношение приматов к риску
То, как нервная система справляется с неопределенностью при совершении действий, до сих пор является фундаментальным вопросом когнитивной нейробиологии. Рискованные решения представляют собой компромисс между затратой сил и полученной в их результате выгодой. При этом в мозгу может сопоставляться польза от риска и готовность на него пойти, пожертвовав безопасностью и определенностью. Этот компромисс полностью субъективен и зависит от готовности человека принять риск. На отношение к риску очень сильно влияет контекст, но о лежащих в его основе нейронных схемах известно очень мало. На странице 55 свежего выпуска журнала Science авторы Сасаки и др. сообщают, что две соседние области лобной коры японских макак (Macaca fuscata) могут влиять на отношение к риску конкурентным образом. При этом побудительная активность вызывается в основном дофаминергическими нейронами. Это открытие дает нам возможность понять механизм нейронных цепей, лежащих в основе отношения приматов к риску и принятию решений. — Balancing risk-return decisions by manipulating the mesofrontal circuits in primates, «Биомолекула»: «Дофаминовые болезни».
Фармакология
Новый антибиотик эффективно уничтожает грамотрицательные бактерии
Грамотрицательные бактерии чрезвычайно трудно уничтожить, поскольку их цитоплазматическая мембрана окружена внешней оболочкой, которая блокирует проникновение большинства антибиотиков. Непроницаемая природа внешней мембраны обусловлена наличием большого количества амфипатического гликолипида, называемого липополисахаридом (LPS). Сборка внешней мембраны требует транспорта ЛПС через белковый мостик, идущий от цитоплазматической мембраны к поверхности клетки. Поддержание целостности внешней мембраны имеет важное значение для жизнеспособности бактериальных клеток, а ее разрушение может повысить чувствительность к другим антибиотикам. Таким образом, уже давно ведутся поиски ингибиторов семи белков-транспортеров липополисахаридов (Lpt), которые образуют этот защитный слой. Недавно был идентифицирован новый класс антибиотиков, нацеленных на механизм транспорта ЛПС у Acinetobacter. Используя структурные, биохимические и генетические подходы, ученые показали, что новые антибиотики улавливают связанную с субстратом конформацию транспортера ЛПС и останавливают его активность. Ингибиторы достигают этого за счет распознавания сложного сайта связывания, состоящего как из транспортера Lpt, так и из его субстрата ЛПС. В совокупности результаты идентифицируют необычный механизм ингибирования транспорта липидов, выявляют лекарственную конформацию транспортера Lpt и обеспечивают основу для распространения этого класса антибиотиков на другие грамотрицательные патогены. — A new antibiotic traps lipopolysaccharide in its intermembrane transporter, «Биомолекула»: «Антибиотики и антибиотикорезистентность: от древности до наших дней».
Эволюционная биология
Генетическая основа недавнего перехода морских улиток к живорождению
Изменчивость признаков — обычное дело в популяциях. Однако появление признака, обеспечивающего новую биологическую функцию — это куда более редкое явление. В настоящее время два исследования изучают, как возникают такие черты. О первом мы упомянули в описании обложки к выпуску — там изучается эволюция ловушек хищных растений. В этом исследовании ученые обнаружили, что спонтанное возникновение трех переменных признаков создало новый механизм отлова насекомых в растениях с ловушками-кувшинами, который возник отдельно у двух разных видов. В другом новом исследовании ученые идентифицировали множественные области генома, связанные с переходом от яиц к живорождению в кладе улиток, продемонстрировав полигенную основу воспроизводства живородящих с аллелями, которые накапливались в ответ на отбор с течением времени. Недавний переход морских улиток (Littorina spp.) от яйцекладки к живорождению дает возможность изучить генетическую архитектуру этой инновации, которая неоднократно развивалась у различных животных. Особи не группируются по репродуктивному признаку в полногеномной филогении, но локальный генеалогический анализ выявил многочисленные небольшие геномные области, где все живородящие особи несут один и тот же основной гаплотип. Эти потенциальные области демонстрируют доказательства положительного отбора, специфичного для живородящих, и богаты генами, которые по-разному экспрессируются в яйцекладущих и живородящих репродуктивных системах. Возраст селективного отбора позволяет предположить, что аллели, специфичные для живородящих улиток, накапливались в течение более чем 200 000 поколений. Последние результаты показывают, что новые функции развиваются за счет рекрутирования многих аллелей, а не за один эволюционный шаг. Подробнее — The genetic basis of a recent transition to live-bearing in marine snails.






