
РНК-полимераза, горизонтальный перенос генов и связь поколений в лаборатории молекулярной генетики микроорганизмов ИМГ РАН
07 февраля 2016
РНК-полимераза, горизонтальный перенос генов и связь поколений в лаборатории молекулярной генетики микроорганизмов ИМГ РАН
- 4705
- 0
- 5
рисунок Елены Беловой
-
Автор
-
Редакторы
Темы
Транскрипция — это не только способ написать слова на разных языках, но и важнейшее событие в жизни генов: ведь именно благодаря транскрипции информация из ДНК переписывается в РНК, которая, в свою очередь, направляет синтез белков и выполняет множество других функций в клетке. Поэтому РНК-полимераза — молекулярная машина, осуществляющая транскрипцию, — любимый объект исследований молекулярных биологов. Понять, как работает РНК-полимераза, — значит в большой степени понять, как работают и регулируются гены, живут и взаимодействуют с окружающим миром клетки и целые организмы. Исследования РНК-полимеразы зачастую напоминают игру с молекулами, но их результаты не только помогают узнать, как устроен мир, но и служат основой для создания новых антибиотиков и других лекарств. В лаборатории молекулярной генетики микроорганизмов ИМГ РАН на площади Курчатова в Москве много лет занимаются фундаментальными исследованиями транскрипции и ее регуляции. И хотя уже сделано много захватывающих открытий, работа с каждым годом становится все интереснее.

Андрей Кульбачинский
О механизмах транскрипции и исследованиях лаборатории рассказывает Андрей Кульбачинский, доктор биологических наук, заведующий лабораторией молекулярной генетики микроорганизмов (ЛМГМ) Института молекулярной генетики РАН, профессор кафедры молекулярной биологии Биологического факультета МГУ, профессор РАН.
— Все известные нам формы жизни строго зависят от точности передачи генетической информации и ее реализации через синтез РНК и белков. Это нашло свое отражение в эволюционной консервативности аппарата, выполняющего такие функции. Процессы репликации и транскрипции относятся к матричным реакциям, в ходе которых новые молекулы ДНК или РНК копируются с исходной ДНК-матрицы на основании принципа комплементарности. Эти процессы происходят при участии специальных ферментов: ДНК- и РНК-полимераз. Благодаря различиям в строении и взаимодействиях с другими факторами, эти ферменты выполняют очень разные функции. Однако в основе работы любых ДНК- или РНК-полимераз лежит единый механизм катализа. Более того, структура РНК-полимераз оказалась очень похожей у всех клеточных организмов: РНК-полимераза кишечной палочки и наши с вами полимеразы являются прямыми эволюционными родственниками. Это позволяет понять общие механизмы транскрипции, исследуя избранные модельные организмы и системы.
Наша лаборатория работает с микроорганизмами. Бактерии — прекрасный объект для изучения: вы до сих пор можете сделать совершенно неожиданные открытия, даже работая с кишечной палочкой. Многие результаты верны и для эукариот (в том числе человека), а нетерпеливые исследователи могут наслаждаться быстротой получения результатов: клетки кишечной палочки растут всего несколько часов, а не дни, месяцы и годы, как при работе с животными. Ну и, как пишут в фильмах, «в ходе съемок ни одно животное не пострадало» — это тоже про работу с бактериями! Бактерии замечательны еще и тем, что у них происходит интенсивный «горизонтальный» обмен генетической информацией, то есть передача генов «по знакомству», а не только по наследству. Всё это позволяет увидеть молекулярную генетическую эволюцию буквально «на глазах» , в пробирках и чашках Петри.
В статье «Бактерии способны заменить утраченный белок всего за 96 часов» [1] рассказывается, как лишённые жгутиков бактерии Pseudomonas fluorescens с помощью мутаций всего за 4 дня выращивают себе новые. Самая настоящая эволюция в реальном времени! — Ред.

РНК-полимераза Thermus thermophilus — бактерии, живущей в горячих источниках на Камчатке.
фотография Л. Минахина, рисунок А. Кульбачинского
Наши исследования носят фундаментальный характер: ведь изучение механизмов транскрипции и горизонтального переноса генов приближает нас к пониманию того, как устроена живая природа. В то же время ярким прикладным аспектом изучения обоих процессов является понимание природы устойчивости бактерий к антибиотикам. Существует довольно обоснованное мнение, что человечество может вновь оказаться беззащитным перед бактериями вследствие неконтролируемого применения антибиотиков и роста числа суперустойчивых штаммов. Исследования горизонтального переноса генов проливают свет на механизмы такого быстрого распространения устойчивых бактерий. Некоторые антибиотики действуют именно на РНК-полимеразу бактерий, связываясь с ней в таких местах, которые сильно отличаются от РНК-полимераз эукариот. Мы исследуем взаимодействия известных антибиотиков с РНК-полимеразой и разрабатываем методы для поиска новых ингибиторов транскрипции. Сейчас работа идет весело и легко (по крайней мере, с точки зрения руководителя лаборатории): доступен весь арсенал методов молекулярной биологии, известно строение РНК-полимеразы, многих регуляторов транскрипции, мобильных генетических элементов, генов устойчивости к антибиотикам. Однако начиналось всё не так. На заре молекулярной биологии не было даже известно, есть ли в клетке РНК-полимераза, а доступные методы анализа транскрипции ограничивались измерением радиоактивности в сцинтилляционных счетчиках.
Немного истории
— Лаборатория возникла в середине 50-х годов благодаря выдающемуся отечественному ученому Роману Бениаминовичу Хесину — основоположнику молекулярной генетики в нашей стране. О Хесине более подробно можно прочитать во многих публикациях [2], [3], я скажу только, что учился он у выдающегося генетика Александра Сергеевича Серебровского, а после разгрома генетики в 1948 году стал биохимиком — это и позволило ему впервые объединить генетические и биохимические исследования в одной лаборатории. Р.Б. Хесину удалось привлечь к работе многих выпускников МГУ и Физтеха и создать замечательный коллектив талантливых и увлеченных наукой молодых людей. Попробую перечислить основных из них: О.Б. Астаурова, И.А. Басс, Е.С. Богданова, Ж.М. Горленко, О.Н. Данилевская, Ю.Н. Зограф, Т.С. Ильина, Э.С. Каляева, Б.A. Лейбович, В.Г. Никифоров, М.Ф. Шемякин. И конечно нельзя не вспомнить Ж.Г. Шмерлинг, разделившую с Р.Б. Хесиным все невзгоды и удачи многолетней совместной работы.
Именно под руководством Р.Б. Хесина уровень исследований в лаборатории вышел на передовые мировые позиции, а написанные им классические статьи 60–70-х годов до сих пор цитируются в обзорах и учебниках по молекулярной биологии [4–6]. Многое может рассказать Софья Захаровна Миндлин, которая принимала непосредственное участие в этих работах и внесла огромный вклад в исследования механизмов транскрипции, горизонтального переноса генов, устойчивости к антибиотикам. Софье Захаровне посчастливилось закончить кафедру генетики МГУ имени М.В. Ломоносова до августовской сессии ВАСХНИЛ 1948 года. Еще в 50-е годы Софья Захаровна совместно с Сосом Исааковичем Алиханяном выполнила цикл работ, посвященных генетике и селекции продуцентов антибиотиков, причем часть их была опубликована в Nature [7], [8]. В 1967 году Софья Захаровна перешла в лабораторию Хесина, чтобы соединить вместе генетику и биохимию в исследованиях транскрипции. И сегодня Софья Захаровна активно участвует в работе и служит примером для подражания для всех сотрудников лаборатории. Можно себе представить, с каким интересом мы слушаем ее рассказы о развитии генетики в нашей стране!

Роман Бениаминович Хесин

Вручение премии за лучшую фундаментальную работу в 1977 г. Слева направо: Ж.М. Горленко, О.Н. Данилевская, Р.Б. Хесин, С.З. Миндлин, И.А. Басс.
Софья Захаровна Миндлин — д.б.н., ведущий научный сотрудник ЛМГМ.
— Хотя о нашей истории можно говорить очень долго, и многие результаты вошли в книги и учебники, я постараюсь кратко суммировать основные достижения лаборатории Р.Б. Хесина в 1962–1984 гг.:
- Экспериментально показана смена работы генов в развитии бактериофагов. На примере фагов Т2 и Т4 обнаружено, что синтез определенных групп белков (предранних, ранних, поздних) включается в определенные моменты времени после заражения клетки. При этом происходит образование различных групп информационных РНК, которые транскрибируются с различных областей генома фага (ранние и поздние информационные РНК). Эта работа, опубликованная в 1962 году, фактически стала первым свидетельством переключения активности генов!
- Проведен огромный цикл исследований по функциональной генетике РНК-полимеразы. С помощью мутантов обнаружена субъединичная структура РНК-полимеразы бактерий. В генах субъединиц РНК-полимеразы получены мутации устойчивости к антибиотикам. Обнаружено, что одна из субъединиц выполняет регуляторную функцию — так была открыта сигма-субъединица РНК-полимеразы, ответственная за узнавание промоторов. Именно в исследованиях нашей лаборатории были впервые клонированы и секвенированы гены РНК-полимеразы. Эти результаты опубликованы в самом начале 1980-х годов и были настолько передовыми, что недавно на одной из международных конференций по транскрипции один очень известный профессор из Висконсина рассказывал, как они по буквам переписывали последовательность нуклеотидов генов РНК-полимеразы из нашей статьи на русском языке.
- На примере дрозофилы сформулированы представления о двух уровнях регуляции активности генов эукариот. Первый уровень регуляции определяется путем изменения общей структуры хромосомы; второй — более тонкий механизм регуляции транскрипции, основанный на участии белков-регуляторов, специфичных к отдельным генам. Замечательно, что Р.Б. Хесин вернулся к работе с дрозофилой после долгого перерыва и положил начало многолетним исследованиям молекулярной генетики дрозофилы, которые очень успешно продолжаются и в настоящее время в Лаборатории биохимической генетики животных, возглавляемой его учеником — Владимиром Алексеевичем Гвоздевым.
- Начаты исследования горизонтального переноса генов на модели генов устойчивости к ртути у бактерий. Создана книга «Непостоянство генома», в которой ярко показана роль мобильных генетических элементов в изменчивости и наследственности у прокариот и эукариот. Этот грандиозный труд содержит почти 4000 ссылок, и все эти статьи Хесин нашел и лично прочитал — хотя не было ни компьютеров, ни интернета, ни автоматических поисковых систем.

А.В. Кульбачинский и С.З. Миндлин
РНК-полимераза как молекулярный конструктор (современные исследования)
— Должен сказать, — продолжает свой рассказ Андрей Кульбачинский, — что две основные темы исследований Р.Б. Хесина — механизмы регуляции экспрессии генов и горизонтальный перенос генов у бактерий — оказались чуть ли не главными проблемами молекулярной генетики и не теряют актуальности и сегодня. Уже в последнее время произошли крупные открытия в области транскрипции: была расшифрована трехмерная структура РНК-полимеразы и ее комплексов с разными факторами и антибиотиками, открыты механизмы синтеза и редактирования РНК. Сейчас, имея «на руках» структурную и геномную информацию, мы можем сравнивать работу РНК-полимераз и связанных с ней факторов и выяснять тонкие механизмы регуляции генов у разных бактерий. Я перечислю несколько наиболее интересных проектов на эту тему:
- Мы пытаемся понять, как работают РНК-полимеразы экстремофильных бактерий, и что помогает им выживать в необычных условиях.
- Исследуем, как РНК-полимераза начинает синтез РНК — в отличие от ДНК-полимераз — без затравки!
- Изучаем влияние повреждений ДНК на процессы транскрипции и репликации.
- Выявляем связь транскрипции, репарации и репликации ДНК.
- Получаем аптамеры к РНК-полимеразе и факторам транскрипции и новые ингибиторы транскрипции на их основе.
Лучше всего об этих проектах могут рассказать сами участники работы.
Наталия Миропольская — к.б.н., старший научный сотрудник ЛМГМ. Наталия — автор статей в ведущих международных журналах (включая Molecular Cell, PNAS, NAR), в 2012 г. получила премию Европейской академии для молодых ученых, а в 2015 г. — национальную стипендию Лореаль-Юнеско «Для женщин в науке». Наталия исследует механизмы работы активного центра РНК-полимеразы, получает аптамеры к РНК-полимеразе и новые ингибиторы транскрипции.

Наталия Миропольская за работой по исследованию устройства активного центра РНК-полимеразы
— В ходе транскрипции РНК-полимераза последовательно присоединяет рибонуклеотиды к растущей цепи РНК, при этом длина транскрипта может достигать многих тысяч нуклеотидов. В отличие от ДНК-полимераз, РНК-полимераза не имеет права прекратить синтез, а потом продолжить его снова с того же места — вся молекула РНК должна появиться за один раз. Чтобы понять, как работает активный центр РНК-полимеразы, я сравниваю ферменты термофильных и мезофильных бактерий, которые сильно различаются по скоростям синтеза РНК — из-за того, что в норме работают при разных температурах. Путем «скрещивания» таких РНК-полимераз мне удалось получить химерные варианты фермента с самыми разными свойствами, в том числе медленные и быстрые РНК-полимеразы. В результате были найдены как раз те районы активного центра, которые участвуют в синтезе РНК и отвечают за отличия в свойствах полимераз термофилов [9].
Другое направление нашей работы — аптамеры к РНК-полимеразе, которые можно использовать для исследований транскрипции. Аптамеры — это своего рода аналог белковых антител, но в отличие от антител они состоят из нуклеиновых кислот (в нашем случае — это короткие однонитевые молекулы ДНК) и могут быть получены с помощью отбора в пробирке, без использования живых систем. Мы получили аптамеры к РНК-полимеразе, которые очень крепко с ней связываются и при этом различают ферменты разных бактерий. В результате мы смогли увидеть различия в узнавании ДНК разными РНК-полимеразами. Оказалось, что аптамеры можно использовать и для быстрого выделения РНК-полимераз из клеток бактерий. А благодаря тому, что они связываются с теми же участками фермента, что и матричная ДНК, аптамеры с большой эффективностью подавляют активность РНК-полимеразы [10–12]. Теперь их можно использовать для получения новых антибиотиков и ингибиторов РНК-полимеразы!
Дарья Есюнина недавно защитила кандидатскую диссертацию и является автором статей в ведущих международных журналах [13], [14]. Работа Дарьи посвящена изучению процессов транскрипции и ее регуляции у разных бактерий, в том числе экстремофилов — микроорганизмов, которые способны жить в экстремальных условиях: при высоких температурах, огромных дозах радиации. О некоторых результатах работы Дарьи можно прочитать в статье про регуляцию транскрипции белками бактериофагов [15].

Дарья Есюнина. Женская половина лаборатории очень любит разноцветные бактерии.
— Синтез РНК — не единственная активность РНК-полимеразы во время транскрипции. Иногда полимераза ошибается, вставляя напротив основания матричной цепи ДНК неправильный нуклеотид. При этом синтез останавливается, а РНК-полимераза смещается назад по матричной ДНК, благодаря чему 3’-конец РНК покидает активный центр фермента. Это позволяет клетке избежать появления нефункциональных транскриптов и сэкономить энергию и нуклеотиды. Однако стоящая на месте РНК-полимераза тоже не нужна клетке. Поэтому в активном центре фермента происходит отщепление фрагмента РНК, содержащего ошибку, после чего РНК-полимераза может продолжить синтез. В моей работе мне удалось понять, какие участки активного центра отвечают за реакцию расщепления и как эта реакция регулируется различными клеточными факторами [14].
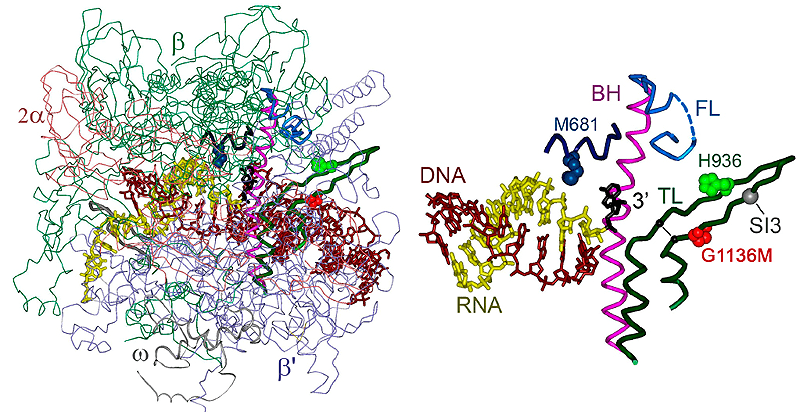
Эти элементы РНК-полимеразы нужны для расщепления РНК-транскрипта. Слева — структура полимеразы, справа — активный центр крупным планом.
Кажущиеся иногда однообразными эксперименты при появлении первых важных результатов вдохновляют на получение всё новых и новых мутаций в РНК-полимеразе — как бы так ее элегантно поломать, чтобы работала только наполовину, или только при подогреве, или на холоде, или только с помощью других белков. Вариантов масса, и за каждым скрывается ответ на вопрос, как устроена и работает эта молекулярная машина. Кто-то скажет, что это слишком детально, сложно интерпретируемо, вообще не про человека и тем более не про рак. Но, во-первых, стόит помнить, что в каждом из нас живет пара килограммов бактерий, миллиарды миллиардов РНК-полимераз которых каждую секунду что-то синтезируют, где-то останавливаются, сталкиваются с другими полимеразами, а иногда мутируют, чтобы стать устойчивыми к новому антибиотику. Во-вторых, они так похожи на РНК-полимеразы эукариот, что многие фундаментальные данные, полученные на бактериях, могут найти подтверждение и в «человеческой» транскрипции. Понимание работы РНК-полимеразы кишечной палочки — это как первый уровень в компьютерной игре — не пройдя его, невозможно пройти десятый: например, понять, как регулируется экспрессия генов в мозге игрока (ну или в нашем случае — молекулярного биолога).
Продолжает Алексей Агапов, аспирант:
— Разнообразие в работу молекулярного биолога вносит интересный объект. Несомненно, кишечная палочка, на которой до сих пор проводится большинство «бактериальных» работ, — прекрасный организм. Но мир настолько разнообразен, и границы жизни так широки, что будет непростительно не узнать, каким образом это оказывается возможным с молекулярной точки зрения. Что может быть особенного в транскрипции у экстремофилов, что обеспечивает их приспособление к суровым (конечно, с нашей точки зрения) условиям существования? В качестве одного из объектов мы используем уникальную бактерию Deinococcus radiodurans. Она интересна тем, что обладает феноменальной устойчивостью к ионизирующему излучению, ультрафиолетовому свету, обезвоживанию, окислительному стрессу [16]. Еще бы — ведь она была обнаружена в стерилизованных гамма-облучением консервах! В последнее время довольно много работ было посвящено выявлению механизмов такой удивительной стрессоустойчивости на молекулярном уровне. Примечательно, что каких-то уникальных механизмов пока так и не найдено — похоже, что работает сумма факторов: эффективные системы репарации, защита от окислительного стресса. Однако про механизмы регуляции транскрипции у дейнококка известно очень мало. Поэтому мы просто не могли удержаться от исследования работы РНК-полимеразы и транскрипционных факторов этой замечательной бактерии. Выращивали десятки литров прекрасной розовой культуры, похожей на свежевыжатый грейпфрутовый сок и особенно полюбившейся женской половине лаборатории, чтобы после нескольких неудачных попыток наконец-то получить желанную пробирку с парой десятков микролитров РНК-полимеразы. В результате нам удалось показать, что полимераза дейнококка способна гораздо быстрее расщеплять синтезируемую РНК, чем полимераза кишечной палочки, что, вероятно, позволяет быстро исправлять ошибки транскрипции (иначе в ядерном реакторе не выжить!) [14], [17]. Мы на этом не останавливаемся и продолжаем поиск уникальных свойств транскрипционного аппарата D. radiodurans.

Алексей Агапов измеряет очень быструю кинетику синтеза РНК
Еще одна важная проблема — понять, как повреждения в молекуле ДНК влияют на работу РНК-полимеразы: останавливается ли она, синтезирует ли неправильную молекулу РНК или привлекает факторы репарации? Хорошо известно, что РНК-полимераза служит сенсором повреждений ДНК [18], но как именно происходит узнавание повреждений, взаимодействие с регуляторными факторами? Этим вопросам, в частности, посвящена кандидатская диссертация еще одного аспиранта нашей лаборатории, Артема Игнатова. Чтобы понять, как работает РНК-полимераза, в ход идут самые изощренные методы: и флуоресценцию измеряем, и межмолекулярные сшивки делаем, и гамма-радиацией клетки облучаем. Последние приобретения лаборатории — высокочувствительный флуориметр и прибор для измерения быстрых ферментативных реакций. Их разрешающая способность — несколько миллисекунд. Так что теперь от нас никакая полимераза не ускользнет.

Данил Пупов представляет свои результаты на конференции в Кембридже
Данил Пупов — к.б.н., старший научный сотрудник ЛМГМ, проводит исследования инициации транскрипции РНК-полимеразой:
— От меня точно ни одна полимераза не ускользнет! Благодаря мутациям, которые я внес в бактериальный сигма-фактор — главный фактор инициации транскрипции, — РНК-полимераза не может начать синтез РНК без добавления готовой РНК-затравки. Как известно, сигма-субъединица необходима для узнавания промоторных участков на ДНК — особых знаков для РНК-полимеразы, указывающих ей с какого места нужно начать транскрипцию. Представьте, насколько это важно: можно долго и старательно присоединять нуклеотиды и растить РНК, но всё не будет иметь смысла, если начать это делать в неправильном месте. Работы нашей лаборатории внесли вклад в понимание механизмов узнавания промоторов. А теперь мы еще знаем, каким именно образом происходит связывание первых нуклеотидов РНК после узнавания промотора. Оказалось, что сигма-субъединица играет в этом самую непосредственную роль и помогает удержать нуклеотидные субстраты и короткие РНК в активном центре фермента [19], то есть ее функции не ограничиваются только узнаванием промотора! В совместной работе с нашими американскими коллегами была расшифрована трехмерная структура инициаторного комплекса РНК-полимеразы, которая полностью согласуется с биохимическими данными [20].
Надо сказать, что после начала синтеза РНК проблемы РНК-полимеразы не заканчиваются: теперь надо оторваться от промотора, с которым она крепко связана за счет той же самой сигма-субъединицы. Оказалось, что и здесь сигма-фактор принимает активное участие: происходит столкновение растущей РНК и сигма-субъединицы, что вызывает ее диссоциацию и разрыв контактов с промотором.
В настоящее время я занимаюсь исследованием сигма-субъединицы и инициации транскрипции новыми методами флуориметрии и начал разработку тестов, чтобы понять, как это работает в живых клетках. Но помимо этого в лаборатории я помогаю студентам и сотрудникам победить страхи при работе со сложными приборами!
Иван Петушков, аспирант:
— Я хочу продолжить рассказ Данила и пояснить, что происходит после инициации транскрипции. Даже после ухода с промотора синтез РНК прерывается паузами. Сейчас известно, что полимераза останавливается примерно через каждые 100–200 нуклеотидов. Для некоторых пауз была показана регуляторная роль, но функции большинства остаются загадочными. Первым известным примером регуляторной роли пауз стало открытие хорошо известного явления аттенюации в триптофановом опероне. Пауза нужна для того, чтобы рибосома могла догнать полимеразу перед последовательностью аттенюатора, иначе никакой точной и аккуратной регуляции концентрации триптофана в клетке не будет. Также паузы нужны для того, чтобы полимераза могла дождаться связывания транскрипционных факторов — например «антитерминаторов», которые подавляют преждевременную остановку транскрипции.
В нашей работе мы исследуем как сами механизмы образования пауз транскрипции, так и регуляцию этого процесса разными клеточными и фаговыми белками. Например, в недавнем исследовании с моим участием было обнаружено, что за узнавание определенного нуклеотида ДНК в точке паузы отвечает специальный карман в РНК-полимеразе [21]. Еще недавно считалось, что контакты полимеразы с ДНК в ходе синтеза РНК должны быть неспецифическими («иначе всё застрянет»), но оказалось, что это не так! Другая распространенная разновидность пауз — сигма-зависимые паузы. Долгое время все были уверены, что при уходе с промотора сигма-субъединица обязательно отделяется от РНК-полимеразы (ведь промотор уже опознан, ДНК расплавлена, синтез РНК начался) — но и это не так! Последние данные говорят о том, что большая часть элонгационных комплексов, покинувших промотор, содержит сигма-субъединицу. Более того, это не просто безбилетная пассажирка: сигма-субъединица может узнать участки ДНК, напоминающие промотор, и остановить в них полимеразу. Мы показали: когда сигма-фактор «цепляется» за ДНК, транскрипция останавливается не сразу — РНК-полимераза отчаянно пытается продолжить синтез РНК и «проглатывает» лишнюю ДНК. В результате образуется напряженный комплекс, и либо сигма-субъединица «отпускает» сигнал паузы, либо полимераза смещается назад и надолго останавливается. Наше последнее открытие показывает, что такие паузы могут образовываться не только с участием главной, но и с некоторыми альтернативными сигма-субъединицами (а их в разных бактериях может быть очень много — больше 100!). Теперь надо понять, какую роль в регуляции генов могут играть эти паузы.
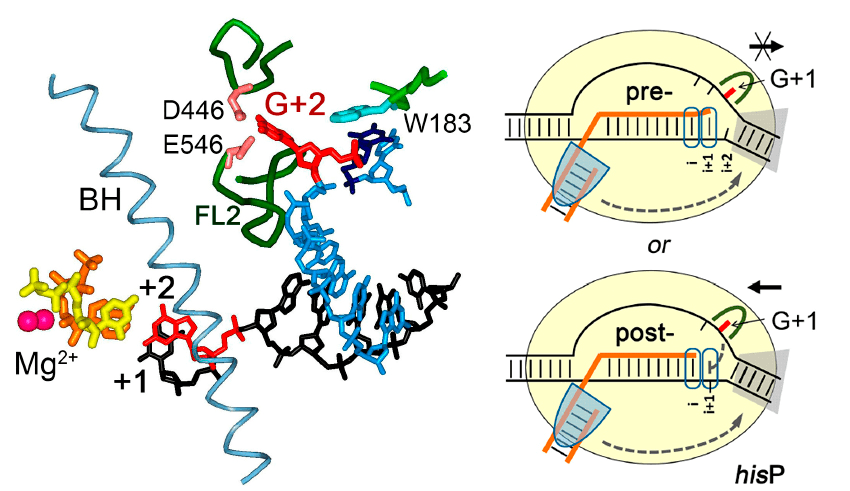
Так происходит узнавание сигналов пауз транскрипции.
Антибиотики и горизонтальный перенос генов
Рассказывает Майя Петрова, д.б.н., заведующая Сектором анализа и хранения микроорганизмов, входящим в ЛМГМ.

Майя Петрова отбирает образцы вечной мерзлоты — холодно даже летом
— Еще одно направление работы нашей лаборатории — исследование механизмов горизонтального переноса генов у бактерий, изучение структуры и эволюции генов устойчивости к тяжелым металлам и антибиотикам. Горизонтальный перенос генов — это процесс, в котором организм передает генетический материал другому организму, не являющемуся его потомком. Центральную роль в этом процессе играют различные мобильные генетические элементы — плазмиды, транспозоны, IS-элементы, интегроны [22]. В последние годы появилось четкое понимание того, что горизонтальный перенос генов относится к ведущим механизмам эволюции бактерий. Одно из самых нежелательных для человека последствий этого явления — быстрое распространение множественной устойчивости к антибиотикам среди клинических штаммов [23].
В ЛМГМ исследования горизонтального переноса генов у природных бактерий были начаты еще в 1983 г. по инициативе Р.Б. Хесина. Основные усилия были направлены на изучение структуры генов устойчивости к ртути и мобильных элементов, участвующих в их горизонтальном переносе. Позже данная работа получила очень интересное развитие — мы стали искать гены устойчивости в бактериях, выделенных из вечной мерзлоты. Такой подход позволил нам исследовать бактерии, не подвергавшиеся антропогенным воздействиям, и выяснить природные пути происхождения и переноса различных генов устойчивости к тяжелым металлам и антибиотикам. В результате этой работы впервые в мире у древних бактерий были обнаружены гены устойчивости к антибиотикам и участвующие в их переносе мобильные элементы. Замечательно, что многие из них оказались идентичны генам, найденным в современных клинических бактериях [24–26]. Это прямо подтверждает гипотезу о том, что гены антибиотикоустойчивости попали в патогенные клинические штаммы из природных бактерий. Резистентность к антибиотикам имеет глубокие эволюционные корни и существовала задолго до начала их применения человеком!
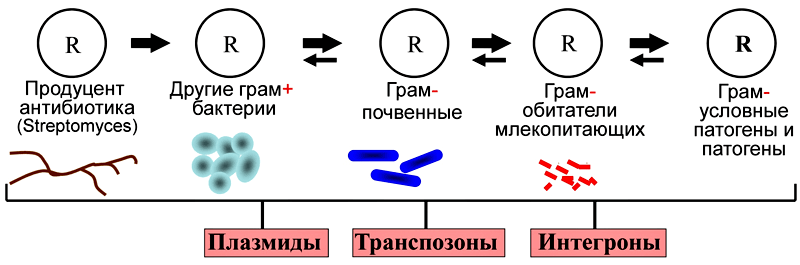
Схема переноса генов устойчивости к антибиотикам из природных бактерий в клинические штаммы
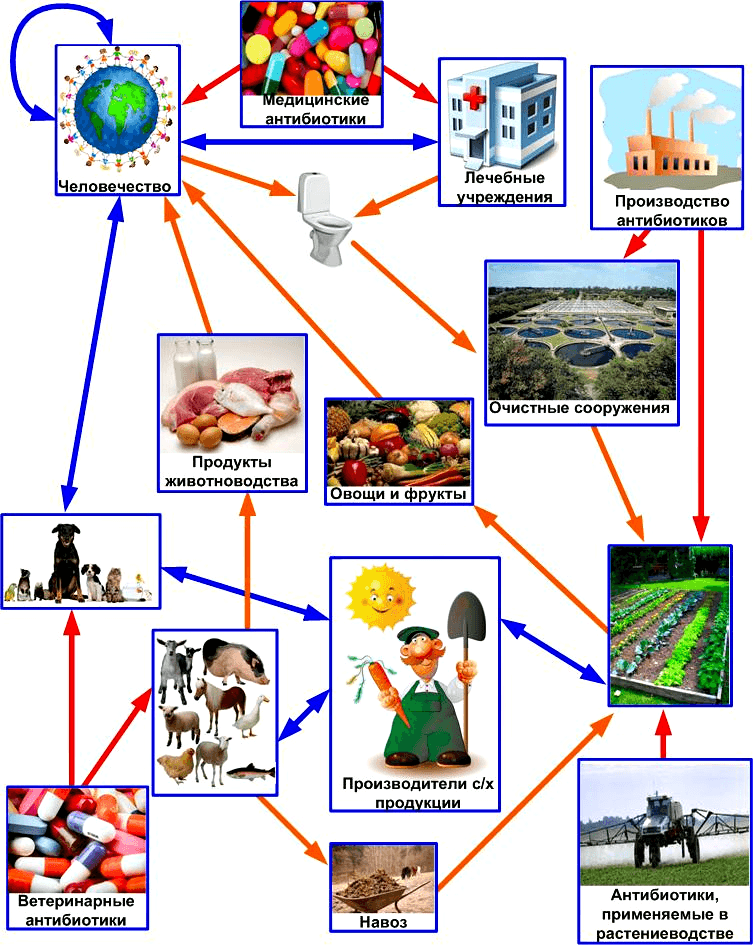
Основные источники поступления антибиотиков в биосферу и глобальная сеть путей горизонтального переноса генов устойчивости к ним. Красными стрелками показано поступление антибиотиков, оранжевыми — перемещение антибиотиков и генов устойчивости к ним, голубыми — передача только генов устойчивости.
Сотрудничество, гранты
— И это далеко еще не всё, чем занимается наша лаборатория, — продолжает Андрей Кульбачинский. — Мы начинаем новые проекты в различных областях бактериальной транскрипции, стараемся не пропустить чего-то интересного. К сожалению, не на всё хватает времени, «рук» и лабораторного пространства. Совсем недавно в лаборатории образовалась новая группа — специализированных ДНК-полимераз, — которую возглавляет к.б.н. Алена Макарова. Интересно, что ДНК-полимеразы в принципе катализируют ту же самую реакцию полимеризации нуклеотидов, что и РНК-полимеразы, и поэтому исследуются похожими методами. Но, конечно, они выполняют совсем другие функции — например, специализированные ДНК-полимеразы эукариот, которые исследует Алена, обеспечивают репликацию поврежденных участков ДНК в стрессовых условиях и ответственны за мутагенез [28]. После защиты кандидатской диссертации (которую она выполняла в Лаборатории репликации и репарации генома в нашем институте) Алена работала в ведущих зарубежных лабораториях, занятых проблемами репликации ДНК, а потом вернулась в наш институт и получила собственные гранты — в том числе гранты фонда «Династия» и программы «Молекулярная и клеточная биология». Будем надеяться, что наше с ней сотрудничество продолжится, и в дальнейшем мы узнаем что-то о взаимодействиях ДНК- и РНК-полимераз (которые постоянно встречаются на матрице ДНК).
Должен сказать, что наша работа на современном уровне была бы невозможна без двух факторов: поддержки со стороны научных фондов (РФФИ, РНФ, программа «Молекулярная и клеточная биология» Президиума РАН, гранты Президента РФ для молодых ученых) и активного сотрудничества с нашими коллегами в России и других странах: США, Великобритании, Франции, Финляндии, Литве. Благодаря этим контактам мы можем научиться самым современным методам исследований, обменяться необходимыми опытом и материалами. Многие сотрудники лаборатории за ее долгую историю разъехались по разным странам, стали там заведующими лабораториями, но мы стараемся не терять с ними связи и выполнять совместные исследования.
Проблемы
— Не могу не рассказать и о непрекращающихся проблемах в нашей научной жизни. К сожалению, после передачи институтов РАН в ФАНО у нас совершенно нет уверенности в благополучном существовании. Возникает ощущение, что в любой момент может произойти очередная реорганизация, слияние, ликвидация и тому подобное. Как заведующий лабораторией, я всё время вынужден участвовать в ответах института на непрерывные формальные запросы ФАНО. Единственный положительный результат этих преобразований — это то, что ничего по-настоящему плохого пока не случилось. Но есть и отрицательные: например, успешная программа РАН по предоставлению жилья молодым ученым была полностью формализована, и сейчас получить субсидию на квартиру в Москве практически невозможно. Большинство моих молодых сотрудников и аспирантов приехали из других городов, и их дальнейшая работа очень сильно зависит от того, найдут ли они себе жилье или нет.
Недавняя проблема — резкое сокращение финансирования программ фундаментальных исследований РАН, в частности, программы «Молекулярная и клеточная биология». А ведь эти программы являются сейчас чуть ли не единственным способом прямого участия РАН в научных исследованиях. По всем критериям — и по научной значимости результатов, и по уровню публикаций, и по оценке экспертов, — в программе «Молекулярная и клеточная биология» участвуют действительно ведущие научные коллективы нашей страны в этой области (а их не так много). И что же — в 2015 году деньги на исследования приходят в урезанном виде в сентябре, а финансирование на 2016 год сокращается еще как минимум в 2 раза! В 2015 году ликвидирован фонд «Династия» — а он, в частности, поддерживал молодых биологов, работающих в области молекулярной биологии.
Сейчас в связи с колебаниями курсов валют цены на большинство необходимых реактивов (не говоря уже о приборах) возросли в 2–3 раза, хотя объемы грантов не увеличиваются, а сокращаются. При этом не исчезает и проблема с доставкой материалов из-за границы: некоторые реактивы по-прежнему приходится ждать месяцами, наш рекорд прошлого (и позапрошлого!) года — 13 месяцев.
В последнее время все академические институты заняты еще и подготовкой документов по аспирантуре по новому образовательному стандарту. Я не берусь критиковать этот стандарт сам по себе, но число формальных и часто бессмысленных бумажек зашкаливает: это более 100 документов (некоторые по 200 страниц), которые нужно писать, подписывать, сканировать и т.д. При этом совсем не учитываются особенности аспирантуры в научных учреждениях. Ну что же — приходится тратить время, оформлять документы и надеяться, что и это мы тоже переживем!
Перспективы
— К счастью, несмотря на проблемы, мы не останавливаемся и продолжаем работать. Состав лаборатории постоянно обновляется: у нас работают студенты и аспиранты МГУ имени М.В. Ломоносова, МИТХТ имени М.В. Ломоносова, многих из них нам удается удержать в лаборатории и после защиты диссертации. Три молодых сотрудника, ведущих основные исследования в области бактериальной транскрипции, стали кандидатами наук под моим руководством, еще три аспиранта работают над диссертациями. Вообще, сейчас бóльшая часть людей в лаборатории уже младше меня — хотя, кажется, совсем недавно все были старше. Именно общение со студентами, семинары и лекции, которые я читаю в МГУ и в научно-образовательном центре нашего института, помогают быть в курсе современных исследований в различных областях молекулярной биологии. Уже не раз происходило так, что рассказ о каких-то последних открытиях на лекции для студентов становился началом нового проекта в лаборатории.
Мы исследуем центральные механизмы, лежащие в основе генетической регуляции у всех организмов. А это значит, что тема не теряет своей актуальности и сейчас, в постгеномную эру. Наоборот, появление геномных данных позволяет обнаружить новые, совершенно неожиданные факторы и системы генетической регуляции. Возможно, наиболее интересным сейчас является изучение связи транскрипции с другими генетическими процессами в клетке — а у бактерий транскрипция связана буквально со всем: репликацией, репарацией, рекомбинацией ДНК, горизонтальным переносом генов, трансляцией. Парадоксально, но до последнего времени ученые, исследующие эти процессы, очень мало взаимодействовали друг с другом (в отличие от молекул!). Мы стараемся этот пробел восполнить и сейчас собираем все эти системы в одной пробирке.

«Игроки» — работа в лаборатории глазами заведующего
Из смешного
- Данил Пупов: Личность Р.Б. Хесина продолжает вдохновлять наши исследования. У двери комнаты, в которой мы сейчас работаем, висит памятная табличка с его именем, в самом кабинете сохранился архив Хесина, стоит его портрет. Что не помешало зашедшей «на огонек» представительнице какой-то компании вежливо меня спросить: «Роман Бениаминович — это Вы?»
- Андрей Кульбачинский: Ну это еще неплохо — когда мы печатали программу конференции памяти Хесина к его юбилею, в типографии мне сказали: «Как здорово! Мы и для Вас такую напечатаем!» Вообще, в лаборатории можно раскопать много «исторических» предметов: то всплывут какие-то удивительные яды из славного биохимического прошлого лаборатории, то экзотические реактивы середины прошлого века, а недавно при ремонте нашли шерсть мамонта в пробирке — из вечной мерзлоты, найдена в ходе экспедиций за древними бактериями.
Заходите на наш сайт! Ну и читайте научные публикации!
Статья написана при участии И. Петушкова, Д. Есюниной, А. Агапова, М. Петровой и С.З. Миндлин.
Литература
- Бактерии способны заменить утраченный белок всего за 96 часов;
- Хесин-Лурье Роман Бениаминович (Вениаминович). Сайт биологического факультета МГУ;
- Миркин С.М. (2002). Размышляя о Р.Б. ... Молекулярная биология. 36, 347–360;
- Хесин Р.Б. и Шемякин М.Ф. (1962). Некоторые свойства информационных рибонуклеиновых кислот и их комплексов с дезоксирибонуклеиновыми кислотами. Биохимия. 27, 761–779;
- Khesin R.B., Gorlenko Z.M., Shemyakin M.F., Stvolinsky S.L., Mindlin S.Z., Ilyina T.S. (1969). Studies on the functions of the RNA polymerase components by means of mutations. Mol. Gen. Genet. 105, 243–261;
- Ovchinnikov Yu.A., Monastyrskaya G.S., Gubanov V.V., Lipkin V.M., Sverdlov E.D., Kiver I.F. et al. (1981). Primary structure of Escherichia coli RNA polymerase nucleotide substitution in the beta subunit gene of the rifampicin resistant rpoB255 mutant. Mol. Gen. Genet. 184, 536–538;
- Alikhanian S.I. and Mindlin S.Z. (1957). Recombinations in Streptomyces rimosus. Nature. 180, 1208–1209;
- Alikhanian S.I., Orlova N.V., Mindlin S.Z., Zaitzeva Z.M. (1961). Genetic control of oxytetracycline biosynthesis. Nature. 189, 939–940;
- Miropolskaya N., Esyunina D., Klimašauskas S., Nikiforov V., Artsimovitch I., Kulbachinskiy A. (2014). Interplay between the trigger loop and the F loop during RNA polymerase catalysis. Nucl. Acids Res. 42, 544–552;
- Pupov D., Esyunina D., Feklistov A., Kulbachinskiy A. (2013). Single-strand promoter traps for bacterial RNA polymerase. Biochem. J. 452, 241–248;
- Pupov D. and Kulbachinskiy A. (20150. Single-stranded DNA aptamers for functional probing of bacterial RNA polymerase. Methods Mol. Biol. 1276, 165–183;
- Miropolskaya N. and Kulbachinskiy A. (2015). Aptamers to the sigma factor mimic promoter recognition and inhibit transcription initiation by bacterial RNA polymerase. Biochem. Biophys. Res. Commun. 469, 294–299;
- Esyunina D., Klimuk E., Severinov K., Kulbachinskiy A. (2015). Distinct pathways of RNA polymerase regulation by a phage-encoded factor. Proc. Natl. Acad. Sci. USA. 112, 2017–2022;
- Esyunina D., Turtola M., Pupov D., Bass I., Klimašauskas S., Belogurov G., Kulbachinskiy A. (2016). Lineage-specific variations in the trigger loop modulate RNA proofreading by bacterial RNA polymerases. Nucleic Acids Res. 44, 1298–1308;
- Корягин В. (2015). РАН победит вирусы. «Газета.ru»;
- Агапов А.А. и Кульбачинский А.В. (2015). Механизмы стрессоустойчивости и регуляция экспрессии генов у радиорезистентной бактерии Deinococcus radiodurans. Биохимия. 80, 1461–1479;
- Есюнина Д.М. и Кульбачинский А.В. (2015). Выделение и характеристика рекомбинантной РНК-полимеразы Deinococcus radiodurans. Биохимия. 80, 1542–1550;
- Хроматин — сенсор повреждений ДНК;
- Pupov D., Kuzin I., Bass I., Kulbachinskiy A. (2014). Distinct functions of the RNA polymerase σ subunit region 3.2 in RNA priming and promoter escape. Nucleic Acids Res. 42, 4494–4504;
- Basu R.S., Warner B.A., Molodtsov V., Pupov D., Esyunina D., Fernández-Tornero C. et al. (2014). Structural basis of transcription initiation by bacterial RNA polymerase holoenzyme. J. Biol. Chem. 89, 24549–24559;
- Petushkov I., Pupov D., Bass I., Kulbachinskiy A. (2015). Mutations in the CRE pocket of bacterial RNA polymerase affect multiple steps of transcription. Nucleic Acids Res. 43, 5798–5809;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Петрова М., Ржешевский А. (2015). Резистентность бактерий: опасность, которая рядом. Троицкий вариант. 179, 10;
- Kholodii G., Mindlin S., Petrova M., Minakhina S. (2003). Tn5060 from the Siberian permafrost is most closely related to the ancestor of Tn21 prior to integron acquisition. FEMS Microbiol. Lett. 226, 251–255;
- Petrova M., Gorlenko Zh., Mindlin S. (2011). Tn5045, a novel integron-containing antibiotic and chromate resistance transposon isolated from a permafrost bacterium. Res. Microbiol. 162, 337–345;
- Petrova M., Kurakov A., Shcherbatova N., Mindlin S. (2014). Genetic structure and biological properties of the first ancient multiresistance plasmid pKLH80 isolated from a permafrost bacterium. Microbiology. 160, 2253–2263;
- Cantas L., Shah S.Q., Cavaco L.M., Manaia C.M., Walsh F., Popowska M. et al. (2013). A brief multi-disciplinary review on antimicrobial resistance in medicine and its linkage to the global environmental microbiota. Front. Microbiol. 4, 96;
- Makarova A.V., Ignatov A., Miropolskaya N., Kulbachinskiy A. (2014). Roles of the active site residues and metal cofactors in noncanonical base-pairing during catalysis by human DNA polymerase iota. DNA Repair (Amst). 22, 67–76.






