Пространственный контакт
19 ноября 2018
Пространственный контакт
- 1565
- 1
- 4
Метафорическая иллюстрация опосредованного белковым взаимодействием пространственного контакта
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Ранее не осознаваемая нами ультрамикроскопическая жизнь генома с развитием науки оказывается все более важным фактором управления генетическим аппаратом клетки. Теперь весь геном можно рассматривать как сеть пространственных взаимодействий генетических элементов, что принципиально изменяет наше понимание событий внутри ядра. Биология трехмерности генома в тренде — в этой статье разберемся, почему это круто с точки зрения эволюции.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Главную роль в жизни хроматина, как это ни удивительно, играет вовсе не ДНК, а белки. Они садятся на ДНК, ползают по ней, таскают ее в разных направлениях, склеиваются друг с другом и отклеиваются. Оказалось, в поведении этих белков нет даже намека на случайность, — они точно контролируют положение ДНК в ядре, и если мы «нарисуем» карту переулков хроматина, то она окажется практически одинаковой для разных клеток. Так, на наше представление о геноме как о последовательности букв стало накладываться новое измерение — распределение пространственных контактов между локусами.
Что мы понимаем под пространственным контактом? Это отнюдь не просто маленькое евклидово расстояние между участками ДНК. Хроматин мобилен, и у любых двух локусов произвольного размера всегда существует какая-то вероятность оказаться близко друг к другу. Эту вероятность можно оценить с помощью технологий захвата конформации хромосом, каковым является, например, метод Hi-C. Подробно об этом методе и его блестящем применении можно прочитать в статье «Половая жизнь хроматина» [1]. Если коротко, то мы можем резко остановить любые перемещения в ядре: сначала делаем «снапшот» пространственного состояния хроматина в определенный момент времени. Потом разрезаем ДНК на небольшие кусочки, около 250 нуклеотидов. А затем добавляем лигазу, которая находит два рядом расположенных конца ДНК и соединяет их в одну молекулу. Дальше все просто: немного танцев с биотином и секвенированием нового поколения, и мы можем посчитать все события лигирования, произошедшие между разными кусочками ДНК. Собрав эти данные из сотни–другой миллионов ядер и пересчитав их в вероятности, получаем среднюю по популяции клеток картину распределения пространственных контактов в геноме.
Из этой картины можно сделать интересные выводы. Если два локуса имеют неожиданно высокую или низкую вероятность пространственного контакта, значит, за этим должно скрываться функциональное значение. Кропотливый анализ таких явлений позволил установить ряд определяющих закономерностей пространственной жизни генома — закономерностей, играющих не последнюю роль в эволюционном процессе и, конечно, сформированных именно им.
Советы по быстрой приборке в ядре
Объем информации, содержащейся в геноме, превосходит возможности человеческого понимания. В геноме человека содержится 30 тысяч генов белков, куча генов некодирующих РНК, повторенных последовательностей, остатков вирусов и транспозонов. Есть даже сломанные гены предков, которые ни разу не используются в онтогенезе, но выбросить жалко. Каждая клетка в своей деятельности использует крошечную часть своего генома, поэтому сталкивается с проблемой «приборки»: как сохранить ненужные части генома, чтобы они не мешались, и как быстро находить среди них то, что действительно нужно? На эти вопросы позволяет ответить изучение картины распределения пространственных контактов в ядре.
Оказалось, что активные в плане транскрипции участки ДНК контактируют с такими же активными участками и избегают контактов с неактивными; для последних справедливо обратное. Следовательно, клетки пространственно отделяют используемые и неиспользуемые участки ДНК. Изюминка в том, что каждый тип геномной информации маркируется с помощью модификаций гистоновых белков — метилирования и ацетилирования. В общем случае гистоны, помеченные метильными группами и не помеченные вовсе, слипаются вместе, а помеченные ацетильными, наоборот, пытаются отделиться от метилированных. Ненужная в данных условиях информация метилируется и в интерфазе «выпадает в осадок», образуя хроматиновые глыбки, — они в основном расположены на периферии ядра и вокруг ядрышек. ДНК, содержащая активные гены и регуляторные элементы, «всплывает» над всем остальным. Этот гениальный метод позволяет быстро прибрать в ядре, что является критически важным после каждого деления, и поддерживать этот порядок в интерфазе.
Хроматиновые глыбки окружает интерхроматиновый компартмент — ядерный матрикс, в котором расположены функциональные агрегаты — транскрипционные фабрики, ядерные спеклы, тельца Кахаля. Интерхроматиновое пространство можно рассматривать как сеть тоннелей, начинающихся от ядерных пор и пронизывающих все ядро. Поверхности хроматиновых глыбок непроницаемы для крупных белковых комплексов, поэтому все взаимодействие между ними и ДНК происходит именно в интерхроматине. Кстати, именно туда обращены ацетилированные участки хроматина — они покрывают глыбки «ворсом» из петель ДНК. Этим всё и объясняется: ненужная информация плотно укладывается внутрь глыбок, где находится в выключенном состоянии и контактирует сама с собой. Активная же часть генома направлена из глыбок наружу, в интерхроматин, где так же может контактировать с другими активными участками и с функциональными белками (рис. 1).
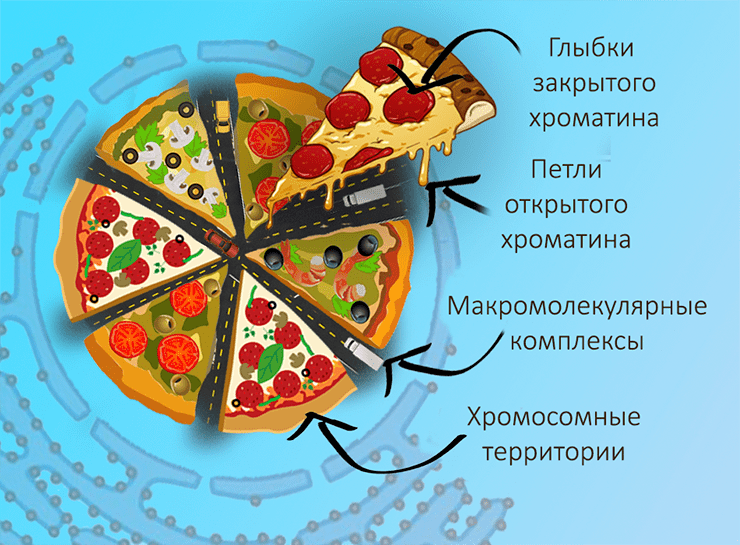
Рисунок 1. Метафорическая иллюстрация организации ядра в целом. Хромосомные территории разделены интерхроматиновым компартментом, который можно представить себе как сеть автомагистралей, по которым перемещаются функциональные макромолекулярные комплексы и транспортируются мРНК к ядерным порам. Внутри хромосомных территорий располагаются глыбки закрытого хроматина, а на периферии — петли открытого.
Такая сортировка становится эволюционным трендом — она проявляется на уровне целых хромосом. Еще методы FISH-микроскопии позволили сформулировать положение, что хромосомы в ядре не перемешиваются между собой. Действительно, Hi-C показывает, что внутрихромосомные контакты даже отдаленных локусов, гораздо более вероятны, чем межхромосомные. О хромосомных территориях читатели «Биомолекулы» давно знают [2], но необходимо заострить внимание на нескольких моментах. У человека гомологичные хромосомы занимают две разные хромосомные территории, которые обычно даже не соседствуют. Таким образом, один и тот же локус в одной клетке может одновременно взаимодействовать как минимум с двумя другими. Кроме того, если внутрихромосомные контакты обычно воспроизводятся после митоза, то межхромосомные нет, так как хромосомные территории распределяются в каждом клеточном цикле случайным образом [3]. Тот факт, что изредка можно обнаружить выраженные межхромосомные контакты, намекает, что для этого должны быть таинственные и очень веские эволюционные причины.
Есть еще одно правило: чем сильнее хромосома или ее участок обогащены активными генами, тем ближе они окажутся к центру ядра [4]. Интересно, что чем больше на хромосоме в целом активных генов, тем сильнее она «перемешивается» внутри себя, — вероятно, для того, чтобы разделить активные и неактивные участки. Противоположное поведение демонстрируют хромосомы, бедные генами, — в интерфазе расположение их участков относительно друг друга остается почти таким же, что и в метафазе (рис. 2) [5].
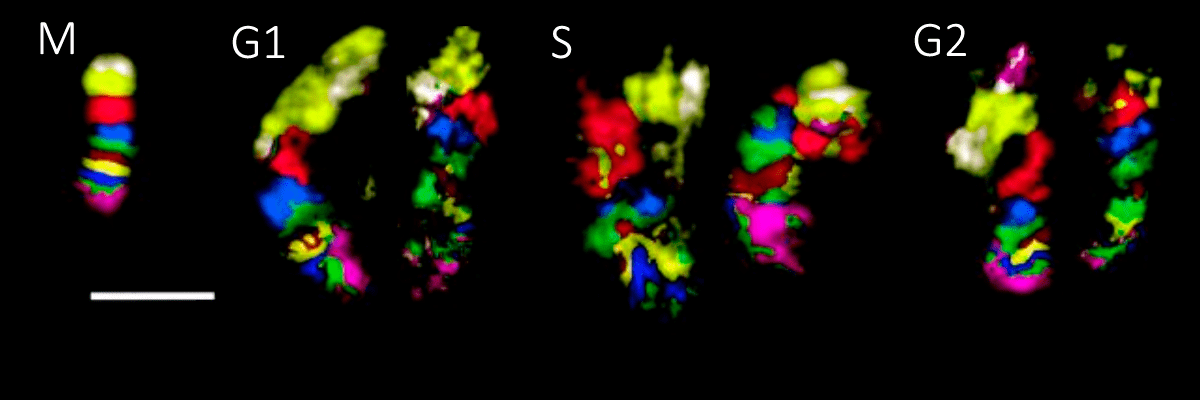
Рисунок 2. FISH-бендинг хромосомы 5 человека (самой генетически неактивной) в метафазе (М) и разных стадиях интерфазы (G1–S–G2). Иллюстрирует сохранение относительного положения участков малоактивной хромосомы в клеточном цикле.
[5], рисунок с изменениями
Пресловутая фибрилла
Общеизвестно, что ДНК находится в ядре в очень сильно компактизированном состоянии. Если поставить друг на друга 12 Останкинских башен, взять паутинку получившейся длины и затолкать ее в спичечный коробок, то уровень компактизации будет примерно таким же, что и у ДНК в ядре. Биологическая эволюция уловчилась засунуть в ядро еще огромное количество белков, — и все равно осталась гора свободного пространства! Каким же образом ей это удалось?
В интернете можно найти много картинок, иллюстрирующих уровни упаковки ДНК в ядре. Подавляющее большинство из них безнадежно устарело, как и традиция описания этого феномена в учебниках. Старые представления таковы: ДНК наматывается на нуклеосомы, получается фибрилла в виде бусин на нитке, диаметром 10 нм. Она сворачивается за счет взаимодействия с гистоном H1 в 30-нанометровую спираль, которая затем сворачивается в еще бóльшую спираль, и так несколько раз, — получается некий фрактальный пружинный провод. Однако в настоящее время известно, что 30-нанометровая фибрилла — артефакт, возникающий в нефизиологических условиях [6].
В современном представлении, хроматин существует в виде очень мало упорядоченной 10-нанометровой фибриллы. Нужно помнить, что в очень маленьком объеме ядра собрано огромное количество молекул: разнообразных белков, ДНК и РНК. Возникают условия макромолекулярного скопления, когда крупные молекулы собираются в агрегаты под действием энтропийных сил, то есть без затрат энергии. На пальцах это можно объяснить так: в жидкости маленькие молекулы двигаются по-броуновски хаотично и при соударении с крупными молекулами передают им импульс. Одна макромолекула в таком состоянии испытывает давление со всех сторон и находится в покое. При случайном приближении к ней второй такой же макромолекулы вероятность столкновения с небольшой молекулой со стороны второй макромолекулы уменьшается, а следовательно, уменьшается и давление, испытываемое молекулой с этой стороны. Так крупные молекулы собираются в скопления в условиях эукариотического ядра [7].
In vitro в гипотоническом растворе хроматин действительно собирается в 30-нанометровую фибриллу. Однако этого не происходит в растворе с большой концентрацией солей или небольших полимеров, а также если использовать хроматиновую фибриллу с ацетилированными гистонами. Как уже было сказано, неацетилированные нуклеосомы слипаются, но для такого слипания им необходимо встретиться друг с другом. В гипотоническом растворе нуклеосома не имеет особо шансов налететь ни на какую другую нуклеосому, кроме как на сидящую на ДНК по соседству. Это приводит к упорядочиванию их в 30-нанометровую фибриллу. Если добавить других молекул, то по вышеописанному принципу они «столкают» нуклеосомы в одно место, вследствие чего образуются условия макромолекулярного скопления. Нуклеосомы будут слипаться с кем попало, и 30-нанометровая фибрилла не образуется (рис. 3).
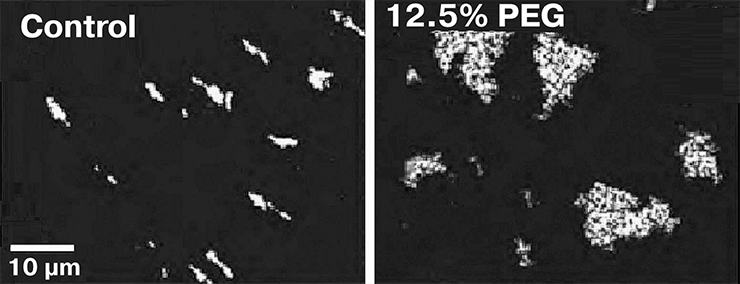
Рисунок 3. Участки 10-нанометровой фибриллы в гипотоническом растворе (слева) и в 12,5% растворе полиэтиленгликоля (справа). Видно, что во втором случае, имитирующем состояние хроматина в ядре, нуклеосомы собираются в неупорядоченные скопления, что иллюстрирует механизм макромолекулярного скопления.
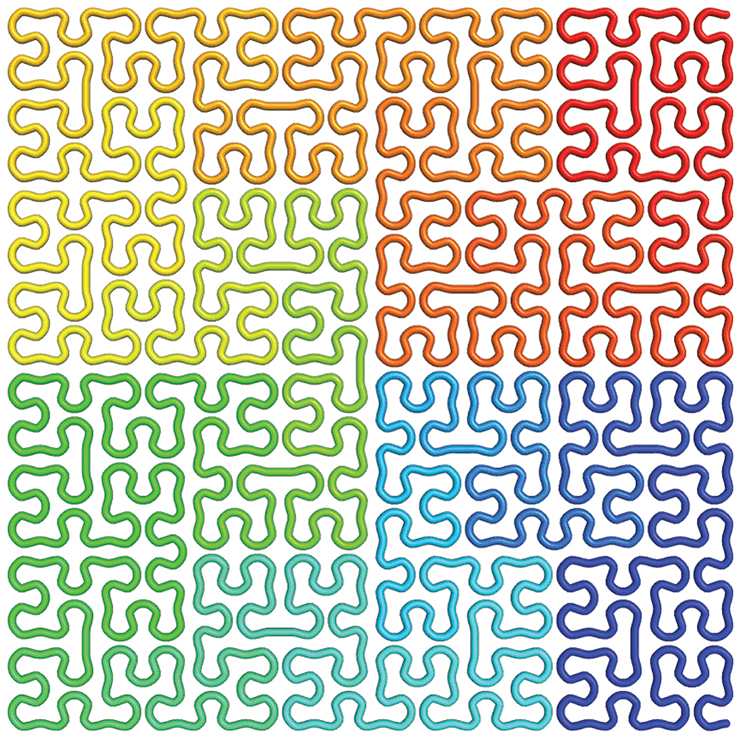
Рисунок 4. Кривая Гильберта — аналог фрактальной глобулы в двумерном пространстве.
Метод Hi-C так же показывает, что 30-нанометровой фибриллы в ядре нет. Реальная картина распределения контактов на самых низких уровнях организации хроматина оказывается иной, нежели ожидаемая от 30-нанометровой фибриллы в связи с ее большей, чем у хроматина in vivo, жесткостью. Оказывается, что 10-нанометровая фибрилла в условиях макромолекулярного скопления образует мелкие неустойчивые петли. Эти петли вкладываются в еще бóльшие петли, и так далее по фрактальному принципу. Таким образом частота контактов локуса с соседями падает логарифмически при увеличении геномного расстояния. Такая укладка хроматина получила название фрактальной глобулы [8], и она отвечает предсказаниям, полученным с помощью компьютерной симуляции для 10-нанометровой фибриллы (рис. 4).
Петля и энхансер
В настоящее время развивается вызывающая много споров и восхищений теория loop extrusion [9]. Она описывает активный механизм образования и существования достаточно крупных петель, которые продолжают фрактальную традицию упаковки хроматина. На хроматин в условно случайном месте загружаются моторные белки, которые изгибают его и продавливают сквозь себя, образуя растущую петлю. Но эти белки могут останавливаться в определенных местах хроматина — обычно там, где сидит инсуляторный белок CTCF, — что стабилизирует петлю. Однако внутри этих петель начинается рост новых, и так далее. С помощью стабильных петель достигается разделение всего генома на маленькие «клубочки», которые обогащены внутренними контактами, но обеднены внешними. Эти структуры получили название топологически ассоциированных доменов, или ТАДов. ТАДы являются дискретными единицами практически всех событий в ядре, так что не стоит недооценивать их значимость.
Таким образом, хроматин представлен многократно вложенными динамическими петлями. Среди ученых нет согласия в том, какой эволюционный смысл несет такая организация, зато существует множество спекуляций на этот счет. Может быть, такая организация облегчает поиск концов разорванной ДНК в процессе репарации. Может быть, помогает ДНК не перепутываться, — было бы удобно использовать подобный механизм для укладки наушников в кармане, если бы не изобрели Bluetooth. Возможно, такая упаковка обеспечивает легкий доступ к информации: петли ДНК легко могут быть извлечены из общего клубка для транскрипции содержащихся в них генов. Чтобы лучше себе представить это, советую посмотреть ролик от исследовательской группы Эреза Либермана Айдена.
Видео. Как складывется ДНК? Модель loop extrusion
Бесспорным значением пространственного контакта остается регуляция транскрипции путем взаимодействия энхансеров с промоторами. Энхансер может находиться на расстоянии до миллиона нуклеотидов от целевого промотора. Понятно, что его эффект проявляется только при пространственном сближении — образовании петли. Такой способ регуляции встречается уже у бактерий, а у эукариот становится основным. С помощью механизма активного образования петель ядерные организмы научились «помогать» промоторам найти себе энхансеры. Описаны случаи, когда одна сторона растущей петли фиксируется в области промотора, а вторая протаскивает ДНК мимо него, тем самым «примеряя» все находящиеся на ней энхансеры к этому промотору. Однако энхансерный элемент обычно регулирует активность генов, расположенных в одном с ним ТАДе, и не будет связываться с промоторами генов, даже расположенных ближе к нему в нуклеотидной последовательности, но отделенных от него границей ТАДа.
Интересен вопрос: в чем эволюционное преимущество регуляции экспрессии с помощью механизмов образования петель? Важно помнить, что далеко не сама нуклеотидная последовательность энхансера взаимодействует с областью промотора, а белки-активаторы, связанные с ней, — транскрипционные факторы (ТФ). Они присутствуют на энхансере только тогда, когда он «включен». Расстояние между активным энхансером и промотором влияет на вероятность их пространственного контакта, а следовательно, и на степень активирующего эффекта энхансера [10]. Альтернативный метод регуляции — связывание ТФ непосредственно с промотором. Степень активации гена в таком случае зависит от концентрации белков-активаторов. Это предполагает регуляцию уровня экспрессии самого белка, что в свою очередь вызывает проблемы. Кроме того, с промотором в один момент может быть связана только одна молекула ТФ, а остальные просто бесполезно плавают в ядре или даже мешаются, неспецифически взаимодействуя с чем-нибудь еще.
Энхансеры помогают увеличить эффективную локальную концентрацию транскрипционного фактора, то есть позволяют достигнуть высокой вероятности его взаимодействия с промотором даже при низкой концентрации самого белка в ядре. Энхансерная последовательность крепко связывается с ТФ и держит его в близости от промотора. При необходимости можно быстро «приложить» ТФ к промотору и не ждать, когда его принесет броуновским течением из другой части ядра. Из этого же следует, что регуляция с помощью энхансеров снижает стохастические флуктуации экспрессии. Таковые возникают, например, из-за случайных изменений локальной концентрации ТФ. На широком промежутке его концентрации, когда ТФ уже стабильно связывается с энхансером, но еще не связывается сам с промотором, регуляция экспрессии гена нечувствительна к флуктуациям концентрации ТФ.
Еще один довод в пользу энхансеров — преодоление одномерного диффузионного предела — звучит весьма претенциозно, словно он выдернут из контекста космической саги. Поиск ТФ своего промотора начинается с диффузии в трехмерном пространстве. Затем он связывается с рандомным участком ДНК и «сканирует» его на предмет промотора. За один акт он может проехать 50 нуклеотидов, что достаточно мало в геномных масштабах. Сайты связывания ТФ здесь выполняют роль антеннок: они ловят ТФ и передают его на искомый промотор.
Использование множества энхансеров для одного гена может увеличивать эволюционный потенциал вида. Мутации внутри тела гена или промотора обычно летальны или ведут к тяжелым нарушениям. Однако можно позволить себе эволюционные эксперименты с энхансерами. Так, например, мутации в энхансере гена Sonic Hedgehog (Shh) приводят к увеличению количества пальцев, что может быть даже полезно для музыкантов или киберспортсменов.
Как нам известно, выпетливание ДНК ограничивает зону влияния энхансеров. Границы петли, часто образованные белками-инсуляторами, могут быть барьерами для множества разных явлений, таких как распространение гетерохроматиновых меток, элонгация РНК-полимераз, движение различных моторных белков. Заключение гена внутрь петли защищает его от генетического окружения [11].
Межхромосомный пространственный контакт
Контакты между хромосомами очень сложно зафиксировать. Порой может показаться, что авторам, их описывающим, было откровение, или они испытывали легкие инсомнические галлюцинации. Но эти контакты существуют, что доказывается таким ярким примером, как хромоцентр у двукрылых насекомых (рис. 5) [12]. В человеческих клетках межхромосомные контакты выражены гораздо слабее, и искать их нужно, только сравнивая между собой. Во многих случаях они ассоциированы с крупными эволюционными событиями в геноме.
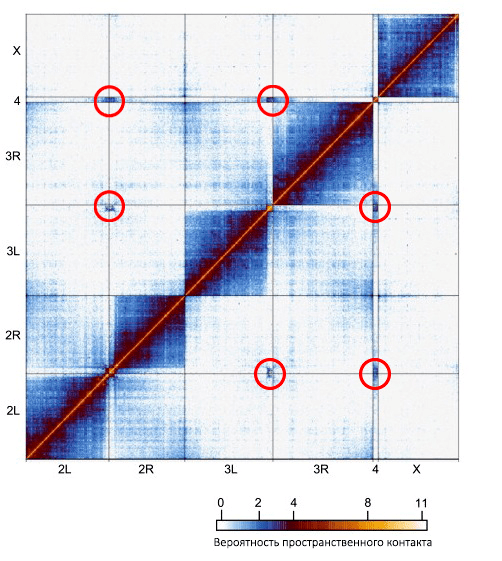
Рисунок 5. Карта пространственных контактов генома эмбриона дрозофилы. По осям — хромосомы и хромосомные плечи. Отмечены области повышенных пространственных контактов между центромерами.
[12], рисунок с изменениями
Если посмотреть на синтеничные локусы у мыши и человека (те места генома, где порядок генов сохраняется), то окажется, что и распределение пространственных контактов в этих локусах оказывается одинаковым. Это не очень удивительно, так как считается, что пространственную организацию во многом определяет сама последовательность ДНК. С другой стороны, зачастую даже в синтеничных регионах сохраняется очень мало нуклеотидной гомологии. Изредка встречается такая ситуация, что локусы с разных хромосом нарочито контактируют друг с другом вопреки всяким ожиданиям. Исследования показали, что во многих случаях такие участки в предковом геноме были соседями в нуклеотидной последовательности. Это явление получило название пространственной синтении — сохранения близости генов после разделения их в ходе эволюционной перестройки хромосом [13].
Синтения пространственных контактов, видимо, важна, но не вполне понятно, почему. Можно предположить, что пространственная близость каким-то образом регулирует коэкспрессию генов. Допустим, необходима коэкспрессия двух генов, требующая их пространственного контакта, например, через попадание в одну транскрипционную фабрику. После хромосомной перестройки выживут только те особи, у которых по каким-либо причинам такое условие продолжает выполняться. Однако ни механизмы, ни эволюционный смысл пространственной синтении остаются не ясны.
Кроме того, показано, что в эволюции места прошедших хромосомных перестроек часто ассоциированы с границами ТАДов. Это может происходить потому, что именно локусы на границах больше всего подвержены разрывам ДНК. Но есть и более интересная гипотеза. При перестройке между двумя локусами внутри ТАДов происходит нарушение регуляции генов — гены из старого ТАДа подвергаются воздействию энхансеров из нового и наоборот. Таким образом, в ходе естественного отбора выживают только такие варианты, у которых в точке перестройки возникает граница ТАДов и нарушения регуляции нивелируются [14].
Не секрет, что хромосомные перестройки — частое явление вообще и в соматических клетках в частности. Обычно такие мутации приводят к апоптозу или обнаруживаются иммунной системой, поэтому организм остается в безопасности. Выяснено, что на вероятность хромосомных перестроек влияет пространственный контакт [15]. Для двух участков геномной ДНК вероятность того, что при их разрыве концы будут перепутаны при репарации, определяется в большой степени их пространственной близостью, предшествующей разрыву. В разных типах клеток пространственная структура генома может в определенных рамках различаться, что объясняет существование характерных перестроек для разных типов клеток. Интересен вопрос, почему за тысячелетия эволюции все сближенные в геноме локусы просто не перестроились друг на друга. Видимо, не все так просто, и в эволюции перестройки по этим локусам приводят к снижению жизнеспособности их обладателей.
Конечно же, говоря о хромосомных перестройках, нельзя не упомянуть о раке. Есть очень грустный пример на эту тему: известно, что лимфома Бёркитта ассоциирована с ВИЧ-инфекцией. Однако ВИЧ инфицирует только Т-лимфоциты, в то время как лимфома развивается из В-клеток. Оказалось, что ВИЧ экспрессирует один интересный белок, который попадает в кровь, а оттуда — в ядро В-лимфоцитов. Там он вызывает изменения в пространственной архитектуре генома, индуцируя контакт между онкогеном MYC с 8 хромосомы и промотором гена иммуноглобулина с 14-й. При этом он провоцирует разрывы ДНК в онкогене, что пугающе повышает риск хромосомной перестройки. В результате MYC попадает под контроль промотора иммуноглобулина. И когда клетка из самых благородных побуждений хочет наработать антител, события поворачиваются к трагическому исходу: включается онкоген, который превращает В-лимфоцит в раковую клетку [16].
Пространственный контакт и манипулирование им
Открытие пространственной организации генома и ее важной роли пробудили имманентное стремление человечества взять все под свой контроль. Уже произведено много попыток экспериментального манипулирования контактами хроматина. Одним из первых подходов стало делетирование области границы ТАДов. При этом подтвердилась гипотеза о том, что между энхансерами и промоторами, ранее разделенными границей, происходит незаконное пространственное взаимодействие, ведущее к нарушениям регуляции экспрессии генов и фенотипическим аномалиям [17]. Интересно, что часто при прицельном удалении сайтов связывания белка CTCF граница ТАДов сохраняется [18]. Это может означать, что границы ТАДов поддерживаются не только благодаря динамике петель и что в этом могут участвовать пока слабо понимаемые нами механизмы.
Традиция исследования пространственного контакта сложилась на нескольких модельных локусах: генов гемоглобина человека, гена Shh, локуса BX-C дрозофилы. Самые интересные результаты в стезе экспериментального изменения структуры ТАДов были получены на случаях наследственных нарушений развития кисти [19]. На хромосоме 2 человека есть интересный участок: три ТАДа, очень близко соседствующих и имеющих очень строгие границы. Один содержит гены Wnt6 и Ihh, другой — ген Epha4 с комплексом его энхансеров, а третий — ген Pax3. Экспериментальные нокауты по этим генам приводят к различным патологиям, в их числе и нарушениям развития кисти. Обнаружено несколько случаев наследуемых пороков развития кисти у человека, ассоциированных с перестройками в этом локусе. Однако сами гены не пострадали — были нарушены границы между ТАДами, и промоторы Wnt6, Ihh и Pax3 незаконно взаимодействовали с энхансерами гена Epha4 (рис. 6).
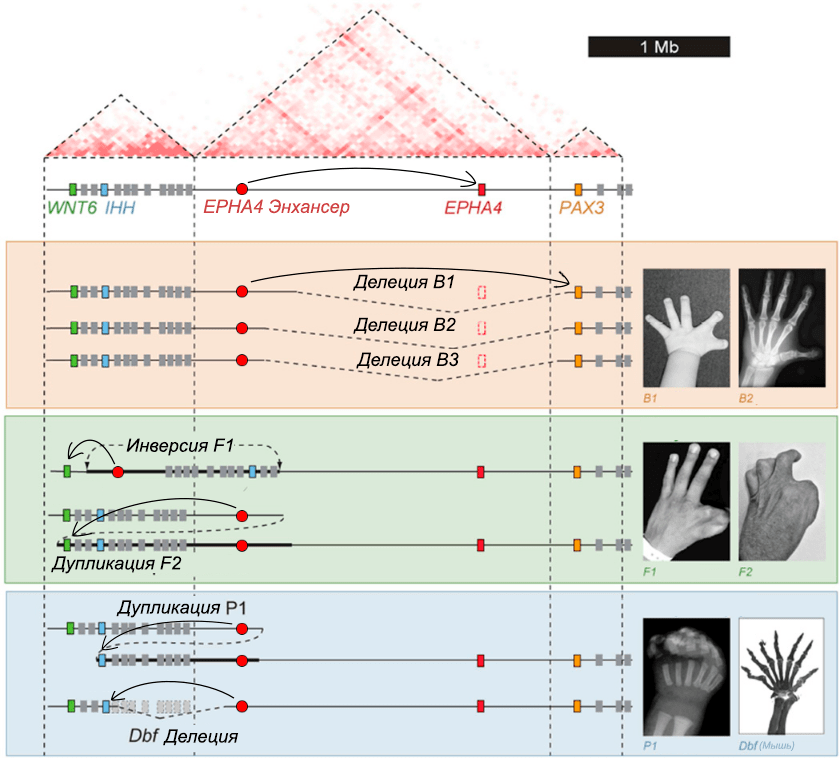
Рисунок 6. Схема исследованных аберраций в локусе Wnt6–Ihh–Epha4–Pax3. Наверху — карта пространственных контактов локуса в норме. Выделяются три ТАДа. Ниже — перестройки, приводящие к фенотипам: брахидактилии (случаи B1, B2, B3), F-синдрому (F1, F2), полидактилии (P1, Dbf). Стрелка показывает взаимодействие между энхансером Epha4 в норме и в патологии.
[19], рисунок с изменениями
С помощью небезызвестной системы CRISPR/Cas9 была смоделирована та же генетическая ситуация на синтеничном локусе мыши. Потрясающе, но это вызвало схожие отклонения в развитии кисти! Также ученые продемонстрировали следующий факт: профиль экспрессии этих генов в зачатках конечностей у мышиных эмбрионов значительно отличался от нормы. Это является очень сильным доказательством в пользу того, что нарушения распределения пространственных контактов могут вызывать серьезные дефекты развития.
Уже более года назад начали появляться публикации о синтетических молекулярных системах, способных программируемо индуцировать пространственный контакт между двумя определенными локусами генома. Эти системы основаны на использовании CRISPR/Cas9, лишенной нуклеазной активности, но зато способной крепко связываться с целевым участком ДНК. Затем ее модифицируют так, чтобы два белка Cas9 могли сцепляться друг с другом. В ядре живой клетки эта система связывается с двумя определенными локусами, а затем сближает их, индуцируя пространственный контакт, — прямо как на заглавной иллюстрации. Понятно, что эффективность этой технологии зависит от расстояния между локусами, которые необходимо сблизить, и никогда не бывает достигнуто сближение одновременно во всех клетках. Сейчас разработаны системы, позволяющие либо индуцировать стабильный пространственный контакт [20], либо даже управлять им путем добавления в среду химических агентов [21] или облучения светом определенной длины волны [22]. Это открывает большие возможности в исследованиях иерархии и динамики пространственной архитектуры хроматина, ее изменениях в клеточной дифференциации и развитии болезней.
С помощью одной из этих систем был получен очень интересный результат. В клетках эритролейкемии индуцировали пространственный контакт между промотором гена HBB (бэта-гемоглобина) и его энхансером. Это привело к резкому повышению экспрессии HBB. Однако даже после «выключения» индуцирующей контакт системы экспрессия сохранялась на том же уровне, и энхансер остался сближен с промотором. Однако ни повышения экспрессии, ни стабилизации контакта не происходило в других, не связанных с кроветворением, клетках. Следовательно, в клетках эритролейкемии промотор и энхансер гена HBB находятся в «подготовленном» к активации состоянии, для которой достаточно индукции пространственного контакта. При этом после однократного получения такого сигнала, система способна самоподдерживаться во «включенном» состоянии. Очередной интересный пример бистабильности в природе.
Сейчас наука о пространственной организации ядра находится в нестабильной фазе развития, — множество разрозненных фактов накладываются друг на друга, разным иерархическим уровням сложно уживаться в единой теории, идет борьба между различными взглядами, и единой картины не возникло по сию пору. Но использование новых подходов и развитие технологий ежечасно приближают нас к большим открытиям, и создание единой картины жизни ядра и эволюционного значения пространственного контакта всего лишь вопрос времени. И упорного труда.
Литература
- Половая жизнь хроматина;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Johan H. Gibcus, Job Dekker. (2013). The Hierarchy of the 3D Genome. Molecular Cell. 49, 773-782;
- Hideyuki Tanabe, Felix A Habermann, Irina Solovei, Marion Cremer, Thomas Cremer. (2002). Non-random radial arrangements of interphase chromosome territories: evolutionary considerations and functional implications. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 504, 37-45;
- Johannes Lemke, Jan Claussen, Susanne Michel, Ilse Chudoba, Peter Mühlig, et. al.. (2002). The DNA-Based Structure of Human Chromosome 5 in Interphase. The American Journal of Human Genetics. 71, 1051-1059;
- Sergey V Razin, Alexey A Gavrilov. (2014). Chromatin without the 30-nm fiber. Epigenetics. 9, 653-657;
- R. Hancock. (2018). Crowding, Entropic Forces, and Confinement: Crucial Factors for Structures and Functions in the Cell Nucleus. Biochemistry Moscow. 83, 326-337;
- E. Lieberman-Aiden, N. L. van Berkum, L. Williams, M. Imakaev, T. Ragoczy, et. al.. (2009). Comprehensive Mapping of Long-Range Interactions Reveals Folding Principles of the Human Genome. Science. 326, 289-293;
- Организовать геном: запутанная история гипотез и экспериментов;
- Karsten Rippe. (2001). Making contacts on a nucleic acid polymer. Trends in Biochemical Sciences. 26, 733-740;
- A. Cournac, J. Plumbridge. (2013). DNA Looping in Prokaryotes: Experimental and Theoretical Approaches. Journal of Bacteriology. 195, 1109-1119;
- Tom Sexton, Eitan Yaffe, Ephraim Kenigsberg, Frédéric Bantignies, Benjamin Leblanc, et. al.. (2012). Three-Dimensional Folding and Functional Organization Principles of the Drosophila Genome. Cell. 148, 458-472;
- Amélie S Véron, Claire Lemaitre, Christian Gautier, Vincent Lacroix, Marie-France Sagot. (2011). Close 3D proximity of evolutionary breakpoints argues for the notion of spatial synteny. BMC Genomics. 12;
- Nathan H. Lazar, Kimberly A. Nevonen, Brendan O'Connell, Richard Edward Green, Thomas J. Meyer, et. al. The genomic false shuffle: epigenetic maintenance of topological domains in the rearranged gibbon genome — Cold Spring Harbor Laboratory;
- Yu Zhang, Rachel Patton McCord, Yu-Jui Ho, Bryan R. Lajoie, Dominic G. Hildebrand, et. al.. (2012). Spatial Organization of the Mouse Genome and Its Role in Recurrent Chromosomal Translocations. Cell. 148, 908-921;
- D Germini, T Tsfasman, M Klibi, R El-Amine, A Pichugin, et. al.. (2017). HIV Tat induces a prolonged MYC relocalization next to IGH in circulating B-cells. Leukemia. 31, 2515-2522;
- Darío G. Lupiáñez, Malte Spielmann, Stefan Mundlos. (2016). Breaking TADs: How Alterations of Chromatin Domains Result in Disease. Trends in Genetics. 32, 225-237;
- A. Rasim Barutcu, Philipp G. Maass, Jordan P. Lewandowski, Catherine L. Weiner, John L. Rinn. (2018). A TAD boundary is preserved upon deletion of the CTCF-rich Firre locus. Nat Commun. 9;
- Darío G. Lupiáñez, Katerina Kraft, Verena Heinrich, Peter Krawitz, Francesco Brancati, et. al.. (2015). Disruptions of Topological Chromatin Domains Cause Pathogenic Rewiring of Gene-Enhancer Interactions. Cell. 161, 1012-1025;
- Nan Hao, Keith E. Shearwin, Ian B. Dodd. (2017). Programmable DNA looping using engineered bivalent dCas9 complexes. Nat Commun. 8;
- Stefanie L. Morgan, Natasha C. Mariano, Abel Bermudez, Nicole L. Arruda, Fangting Wu, et. al.. (2017). Manipulation of nuclear architecture through CRISPR-mediated chromosomal looping. Nat Comms. 8, 15993;
- Mayuri Rege, Ji Hun Kim, Jacqueline Valeri, Margaret Dunagin, Aryeh Metzger, et. al. LADL: Light-activated dynamic looping for endogenous gene expression control — Cold Spring Harbor Laboratory.