
Прокариотические антивирусные системы на службе нашего иммунитета
26 января 2021
Прокариотические антивирусные системы на службе нашего иммунитета
- 626
- 0
- 7
cGAS и виперины — редкие примеры известных противовирусных систем прокариот, унаследованных эукариотами
иллюстрация Анны Олиной
-
Автор
-
Редактор
Статья на конкурс «Био/Мол/Текст»: Список известных науке прокариотических систем противовирусной защиты не ограничивается системами рестрикции-модификации и CRISPR-Cas. В последние годы этот список активно пополняется, причем большинство белков, защищающих микробов от вирусов, отсутствуют у эукариот. Есть, однако, и исключения, о двух из которых и пойдет речь в этой статье: распространенные среди бактерий и архей сGAS и виперины — важные компоненты врожденного антивирусного иммунитета животных.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что мы знаем об иммунитете прокариот?
Что объединяет грипп [1], оспу [2], бешенство [3], краснуху [4], геморрагическую лихорадку Эбола и COVID-19? Правильно, все эти заболевания человека вызываются вирусами. Есть названия и у некоторых вирусных инфекций других многоклеточных организмов: чума собак, паралич сверчка, табачная мозаика. Однако никто не придумал имена инфекционным заболеваниям прокариот. Между тем, вирусы и им изрядно досаждают. Разумеется, и прокариоты, и эукариоты обзавелись целым арсеналом средств для борьбы с паразитами, причем о защитных системах последних, а особенно об иммунной системе человека, науке известно куда больше, и информация о принципах работы врожденного и приобретенного иммунитетов давно вошла в школьный учебник.
А что у прокариот? Любой молекулярный биолог знает системы рестрикции-модификации и CRISPR-Cas, поскольку их компоненты нашли широкое применение в лабораторной практике [5], [6]. Однако это далеко не все антивирусные приспособления прокариот, известные ученым. Долгое время поиск был сосредоточен на Escherichia coli и еще нескольких модельных бактериях, но даже в такой узкой группе микроорганизмов удалось обнаружить несколько антивирусных систем с различными механизмами действия. Настоящую революцию в поиске новых антифаговых систем произвело обнаружение защитных островков (defence islands) — участков геномов прокариот, которые кодируют компоненты защитных систем [7]. Таким образом, если какой-то ген Х находится вблизи генов уже известных защитных систем в большом количестве прокариотических геномов, можно предположить, что Х тоже кодирует какой-то белок, участвующий в борьбе с вирусами. Поскольку количество прочитанных прокариотических геномов в последнее время растет как на дрожжах, этот подход позволяет ученым ежегодно находить новые гены, вовлеченные в защиту от вирусов . Так, в одной из статей 2018 года авторы описали сразу девять новых защитных систем [8], а в 2020 году одновременно две группы сообщили об обнаружении антифаговой активности у некоторых ретронов — крайне странных генетических элементов прокариот, казавшихся ранее абсолютно бесполезными [9], [10].
Про прокариотические системы защиты от фагов можно почитать в материалах «Биомолекулы» [11–13], а про ретроны и другие примеры обратной транскрипции в обзоре [14].
Еще в 2011 году обнаружили, что в защитных островках часто находятся гены, кодирующие белки-аргонавты , и с тех пор были получены убедительные свидетельства их роли в защите клеток от фагов [7], [15]. Эта находка интересна тем, что в отличие от остальных известных нам антивирусных систем прокариот, аргонавты широко распространены и среди эукариот. Странно, что до недавнего времени белки-аргонавты были единственным подобным примером. К счастью, два недавних открытия устранили это недоразумение.
Про прокариотические белки-аргонавты можно узнать больше из обзора «Биомолекулы» [16].
cGAS — универсальный сигнальный компонент антивирусных систем
Узнавание вирусной нуклеиновой кислоты — важнейший этап активации врожденного антивирусного иммунитета у животных. Один из рецепторов, узнающих двунитевую ДНК в цитоплазме, получил название cGAS (cyclic GMP-AMP synthase), поскольку после связывания мишени начинает синтезировать циклический динуклеотид cGAMP (циклический гуанозинмонофосфат-аденозинмонофосфат, цГАМФ) из АТФ и ГТФ. cGAMP в свою очередь запускает сигнальный каскад, который активирует синтез интерферонов, необходимых в борьбе с вирусом [17].
Ученые из Weizmann Institute of Science в Израиле проанализировали 38 167 микробных геномов и обратили внимание, что из 637 прокариотических гомологов гена cGAS 417 (65,5%) находятся в защитных островках в составе оперона из 2–4 генов (рис. 1) [18]. Предположив, что такая локализация может указывать на антифаговую активность, они решили проверить, будет ли cGAS обеспечивать иммунитет штамму E. coli, в норме не содержащему такой системы. Для этого были выбраны два оперона: один из штамма E. coli TW11681, а другой из холерного вибриона Vibrio cholerae El Tor. Оказалось, что оба оперона повысили устойчивость лабораторного штамма E. coli к некоторым бактериофагам, то есть действительно функционируют как защитная система. Ученые дали этой системе название CBASS (cyclic-oligonucleotide-based antiphage signalling system).

Рисунок 1. Опероны, кодирующие cGAS, находятся в защитных островках. Желтым показаны известные системы противофаговой защиты.
Теперь предстояло понять механизм действия CBASS. Первым делом исследователи проверили, появляется ли cGAMP в клетках с CBASS в ответ на фаговую инфекцию. Для этого они проанализировали состав клеточных лизатов методом масс-спектрометрии. Как и предполагалось, cGAMP обнаружился только в клетках, содержащих систему CBASS, и только после заражения фагом.
Интересно, что в обоих исследованных оперонах ген cGAS соседствовал с геном фосфолипазы CapV, которая активируется cGAMP’ом и расщепляет липиды клеточной мембраны. Выходит, что зараженная вирусом бактерия включает систему самоубийства.
Такое поведение — не редкость в мире прокариот: известен целый класс антифаговых систем под названием Abi (abortive infection), принцип действия которых заключается в том, что клетка, обнаружив фаговую инфекцию, совершает суицид до того, как фаг успеет размножиться. Таким образом, ценой жизни одной клетки достигается защита целой популяции.
Для доказательства функционирования CBASS по механизму абортивной инфекции клетки смешали с разными концентрациями фаговых частиц. В случае, когда на пять бактериальных клеток приходилась одна фаговая частица (multiplicity of infection, MOI = 0,2), то есть зараженной оказывалась лишь часть клеток, популяция бактерий, обладающих CBASS, успешно справлялась с инфекцией, а когда концентрация фаговых частиц вдвое превышала концентрацию бактерий (MOI = 2), то есть заражались сразу все клетки, лизис культуры произходил еще быстрее, чем в штамме без CBASS (рис. 2). Это означает, что суицидальная система CBASS в первом случае спасла популяцию от полного уничтожения, а во втором спровоцировала немедленную гибель всех клеток в культуре.
Хотя ученым и удалось обнаружить новую защитную систему прокариот, многое всё еще непонятно. Во-первых, остается загадкой, что является триггером для активации cGAS. Вряд ли это двунитевая ДНК, как у эукариот, ведь у прокариот ядра нет, и отличить геномную ДНК от вирусной не так-то просто. Во-вторых, неясно, во всех ли случаях CBASS ведет себя как система абортивной инфекции. Дело в том, что вместо фосфолипазы в состав CBASS могут входить другие белки с неизвестной активностью.
Так или иначе, cGAS заслужил место в ряду белков, вовлеченных в антивирусную защиту у представителей и прокариот, и эукариот.
Виперины — универсальная защита против вирусных РНК-полимераз
Виперин — один из белков, продуцируемый клетками животных в ответ на обработку интерферонами. Известно, что виперин подавляет репликацию многих вирусов за счет продукции ddhСTP (3′-deoxy-3′4′-didehydro-CTP, 3′-дезокси-3′4′-дидегидро-ЦТФ, ддгЦТФ) — производного одного из четырех нуклеотидов, из которых РНК-полимеразы строят РНК. ddhCTP узнается вирусными РНК-полимеразами и включается в состав РНК, но из-за отсутствия 3′-концевого гидроксила фермент не может продолжить синтез. Один из вирусов, с которым борется человеческий виперин — печально известный вирус Зика , [19].
«Биомолекула» писала про вирус Зика в материалах [20], [21].
Всё те же исследователи из Израиля заметили, что некоторые гомологи виперинов у прокариот кодируются генами, находящимися в защитных островках (рис. 3) [22]. Для подтверждения их участия в борьбе с вирусами ученые помещали гены 59 представителей прокариотических виперинов в лабораторный штамм E. coli и проверяли, придают ли они устойчивость к фаговым инфекциям. Около половины исследуемых белков показали хорошие результаты в защите от целого ряда фагов, что позволило заявить об открытии новой антивирусной системы прокариот.

Рисунок 3. Прокариотические виперины локализуются в защитных островках. Желтым выделены гены известных систем противофаговой защиты.
Для выяснения механизма работы виперинов ученые вновь прибегли к масс-спектрометрическому анализу клеточных лизатов после заражения фагом Т7. На этот раз искали ddhСTP, но нашли не только его: оказалось, что разные прокариотические виперины синтезируют производные разных нуклеотидов: ЦТФ, УТФ и ГТФ (рис. 4). Забавно, что среди продуктов виперинов не обнаружили производных АТФ. Сами авторы работы предполагают, что это связано с несовершенством системы детекции.

Рисунок 4. Филогенетическое дерево виперинов. Обозначены человеческий виперин и исследованные в работе прокариотические виперины, а также их субстратная специфичность.
Чтобы проверить эффект виперинов на работу фаговой РНК-полимеразы, исследователи экспрессировали под контролем промотора фага Т7 ген зеленого флуоресцентного белка GFP в клетках E. coli, кодирующих РНК-полимеразу фага Т7, и наблюдали, что клетки флуоресцируют. Но если в таких клетках экспрессировать один из генов виперинов, GFP не синтезируется (рис. 5).
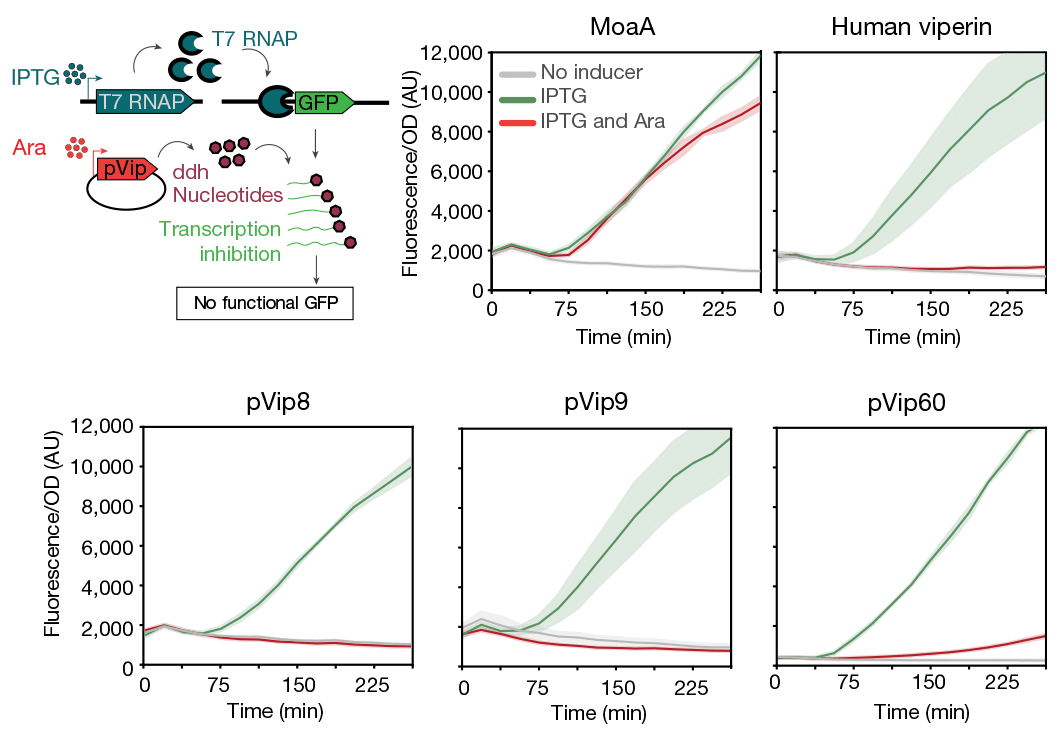
Рисунок 5. Виперины подавляют активность РНК-полимеразы Т7 in vivo. МоаА — отрицательный контроль. В присутствии виперинов снижается экспрессия гена GFP, находящегося под контролем промотора Т7-РНК-полимеразы.
Полученные данные подтверждают, что прокариотические виперины борются с вирусами по тому же принципу, что и виперины животных. Хотя правильнее будет сказать, что виперины животных работают как прокариотические: филогенетический анализ свидетельствует о том, что эукариотические виперины — лишь небольшая веточка на разветвленном дереве этого белкового семейства (рис. 4).
Микробы — это модно
Людям свойственно интересоваться прежде всего собой, и уж если не видом Homo sapiens, то хотя бы животными или на худой конец растениями. Однако во все времена находились энтузиасты, исследующие необъятный мир микробов. Может, этим энтузиастам следует заняться какими-то действительно важными проблемами? Неужели мы уже все болезни научились лечить? Только вот без любителей микробов не было бы у нас ни эндонуклеаз рестрикции для клонирования, ни термофильных ДНК-полимераз для ПЦР, ни CRISPR-Cas для редактирования геномов. Если хорошенько поискать, то у прокариот непременно найдется еще много интересного и полезного! А искать сейчас удобно как никогда: информация о новых секвенированных геномах поступает непрерывным потоком, только успевай анализировать. Исследования в области прокариотических систем защиты от фагов — отличный пример такого поиска. Открытие новых антивирусных систем, общих для бактерий, архей и эукариот, показывает, что можно узнавать что-то новое про нас с вами, изучая захватывающе разнообразный мир микробов.
Литература
- Неуловимый грипп;
- Оспа — забытая победа (небольшой эпидемиологический детектив);
- Бешенство. Всё еще непобедимый монстр;
- Дети Грегга: долгая история победы над краснухой;
- Просто о сложном: CRISPR/Cas;
- РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020;
- K. S. Makarova, Y. I. Wolf, S. Snir, E. V. Koonin. (2011). Defense Islands in Bacterial and Archaeal Genomes and Prediction of Novel Defense Systems. Journal of Bacteriology. 193, 6039-6056;
- Shany Doron, Sarah Melamed, Gal Ofir, Azita Leavitt, Anna Lopatina, et. al.. (2018). Systematic discovery of antiphage defense systems in the microbial pangenome. Science. eaar4120;
- Adi Millman, Aude Bernheim, Avigail Stokar-Avihail, Taya Fedorenko, Maya Voichek, et. al.. (2020). Bacterial Retrons Function In Anti-Phage Defense. Cell. 183, 1551-1561.e12;
- Linyi Gao, Han Altae-Tran, Francisca Böhning, Kira S. Makarova, Michael Segel, et. al.. (2020). Diverse enzymatic activities mediate antiviral immunity in prokaryotes. Science. 369, 1077-1084;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- Свой среди чужих, чужой среди своих: как система BREX защищает бактерию от фагов и самой себя;
- Белок Ocr — швейцарский нож бактериофага T7;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- Anton Kuzmenko, Anastasiya Oguienko, Daria Esyunina, Denis Yudin, Mayya Petrova, et. al.. (2020). DNA targeting and interference by a bacterial Argonaute nuclease. Nature. 587, 632-637;
- Спасайся кто может!;
- L. Sun, J. Wu, F. Du, X. Chen, Z. J. Chen. (2013). Cyclic GMP-AMP Synthase Is a Cytosolic DNA Sensor That Activates the Type I Interferon Pathway. Science. 339, 786-791;
- Daniel Cohen, Sarah Melamed, Adi Millman, Gabriela Shulman, Yaara Oppenheimer-Shaanan, et. al.. (2019). Cyclic GMP–AMP signalling protects bacteria against viral infection. Nature. 574, 691-695;
- Anthony S. Gizzi, Tyler L. Grove, Jamie J. Arnold, Joyce Jose, Rohit K. Jangra, et. al.. (2018). A naturally occurring antiviral ribonucleotide encoded by the human genome. Nature. 558, 610-614;
- Вирус Зика — глобальная угроза?;
- Вирус Зика: мнимая паника или реальная угроза?;
- Aude Bernheim, Adi Millman, Gal Ofir, Gilad Meitav, Carmel Avraham, et. al.. (2021). Prokaryotic viperins produce diverse antiviral molecules. Nature. 589, 120-124.









