Последний путь тромбоцита
24 октября 2019
Последний путь тромбоцита
- 1293
- 1
- 1
Вытеснение умирающих тромбоцитов, появившихся внутри тромба, на его поверхность
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Механизм остановки кровотечений необходим для выживания организма, однако, несмотря на историю исследования, насчитывающую десятилетия, многие детали этой системы остаются неясными. Восемь лет назад о свертывании крови «Биомолекуле» рассказал Михаил Пантелеев. С тех пор в этой области накопилось много новых данных. В этой статье мы расскажем, как молодой коллектив ученых из МГУ приоткрыл завесу тайны сразу над двумя загадочными явлениями в сложной системе формирования артериального тромба, показав, как в нем перемещаются умирающие клетки.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Партнер номинации — Российский научный фонд.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Специалистам и неспециалистам хорошо известно зловещее слово «тромбоз». Слово «тромб» традиционно воспринимается как что-то опасное. Однако не все тромбы представляют угрозу. При повреждении сосудистой стенки организм должен быстро сформировать что-то наподобие затычки, которая не даст крови вытекать из артерии или вены. Таким образом, формирование затычек, или, говоря научным языком, гемостатических тромбов, является ключевой задачей, которую решает система гемостаза человека (и, разумеется, не только человека). Однако иногда эта система дает сбой, и повреждение сосуда приводит к формированию массивного внутрисосудистого тромба, который практически полностью блокирует кровоток. Если этот процесс происходит в крупной артерии, питающей кровью жизненно-важный орган, такой тромб может стать причиной серьезных осложнений и даже смерти. Инфаркт миокарда и ишемический инсульт являются, пожалуй, самыми известными и распространенными осложнениями, вызванными артериальным тромбозом, которые сегодня являются наиболее частой причиной смерти и инвалидности людей в развитых странах [1].
Почему в некоторых случаях в ответ на повреждение система гемостаза срабатывает избыточно и формирует смертельно опасную пробку в сосуде? Несмотря на многие десятилетия исследований, данный вопрос остается без ответа. Отсутствие понимания механизмов, которые регулируют формирование тромба, приводит к тому, что сегодня не существует надежного способа предотвращения тромбоза: прием существующих антитромботических препаратов связан с достаточно высоким риском возникновения кровотечений — в том числе опасных для жизни.
Две загадки тромбообразования
Для формирования тромба в артерии необходимо слаженное протекание целой совокупности процессов: тромбоциты должны прикрепиться к месту повреждения, активироваться («включиться») и слипнуться между собой (агрегировать), в то время как в плазме крови в результате каскада биохимических реакций свертывания должна образоваться желеобразная фибриновая сеть, способная прочно скреплять тромбоциты друг с другом и прикреплять весь агрегат к месту повреждения сосуда (подробнее о свертывании можно узнать из упомянутой в аннотации статьи Михаила Пантелеева: «Как работает свертывание крови?» [2]). По-настоящему сложной задача становится, если вспомнить, что все перечисленные процессы должны развиваться в условиях пульсирующего потока крови, который оказывает существенное влияние на характер их протекания [3].
Ключевую роль здесь играют тромбоциты — небольшие, размером 1–2 микрометра, клетки крови. Преимущественно из них формируется сгусток, называемый белым тромбом. Несмотря на малый размер, тромбоциты демонстрируют широкий спектр функциональных ответов, включающий секрецию гранул, изменение формы и свойств внешней мембраны, а также механическую активность: благодаря наличию особых белковых молекул тромбоцит способен сокращаться подобно мышце и развивать при этом достаточно большие по меркам клеток силы — более 10 нН. Этот механизм приводит к механическому сжатию тромба — процессу, который физиологи называют контракцией, но физиологическая роль которого до сих пор остается предметом дискуссий.
Другим загадочным явлением является формирование так называемых прокоагулянтных тромбоцитов — умирающих клеток, подставляющих свою поверхность для протекания биохимических реакций свертывания крови, которое таким образом существенно ускоряется (отсюда и название). Прокоагулянтные тромбоциты слабо взаимодействуют с другими активированными тромбоцитами, которые способны не только агрегировать, но и проявлять механическую активность [4]; иными словами, для других тромбоцитов они становятся скользкими, и прочно зацепиться друг за друга больше не могут. Умирающим тромбоцитам посвящено большое количество исследований, однако сегодня нет ясного понимания, какую именно роль они играют в системе гемостаза. Появление прокоагулянтных тромбоцитов происходит при сильной активации клеток, которая может происходить в непосредственной близости от места повреждения сосуда — то есть в самом «сердце» тромба, — но наблюдаются эти клетки преимущественно на поверхности тромбов. Как же они там оказываются? До недавнего времени ответа на этот вопрос не было.
Что мы обнаружили и как нам это удалось
Биофизический подход
Как и любая сложная система, формирование тромба в артерии нуждается в управлении. Выявление механизмов, регулирующих биологические процессы, является одной из традиционных задач биофизики, поэтому проблема регуляции артериального тромбообразования уже давно привлекает внимание не только врачей и физиологов, но и биофизиков. На кафедре биофизики физического факультета МГУ на протяжении более двух десятилетий развивается направление, связанное с анализом принципов устройства и регуляции системы гемостаза: например, в ставших классическими работах профессора Ф.И. Атауллаханова и его учеников была продемонстрирована автоволновая природа распространения процесса свертывания плазмы крови в отсутствии потока [5], [6].
Установление механизмов, регулирующих тромбообразование в условиях артериального кровотока, — одна из главных задач нашего научного коллектива, участниками которого являются профессор кафедры медицинской физики М.А. Пантелеев, профессор кафедры биофизики Ф.И. Атауллаханов, с.н.с. кафедры биофизики Д.Ю. Нечипуренко, а также студенты и аспиранты физического факультета.
Исследование in vitro и in silico
Связать поверхностное распределение умирающих тромбоцитов с процессом сжатия тромба позволили недавние исследования, выполненные нами в сотрудничестве с коллегами из Франции и США [7]. При помощи конфокальной микроскопии в экспериментах по тромбообразованию in vitro мы показали, что прокоагулянтные тромбоциты формируются в различных частях растущего тромба, после чего перемещаются на его поверхность (рис. 1).
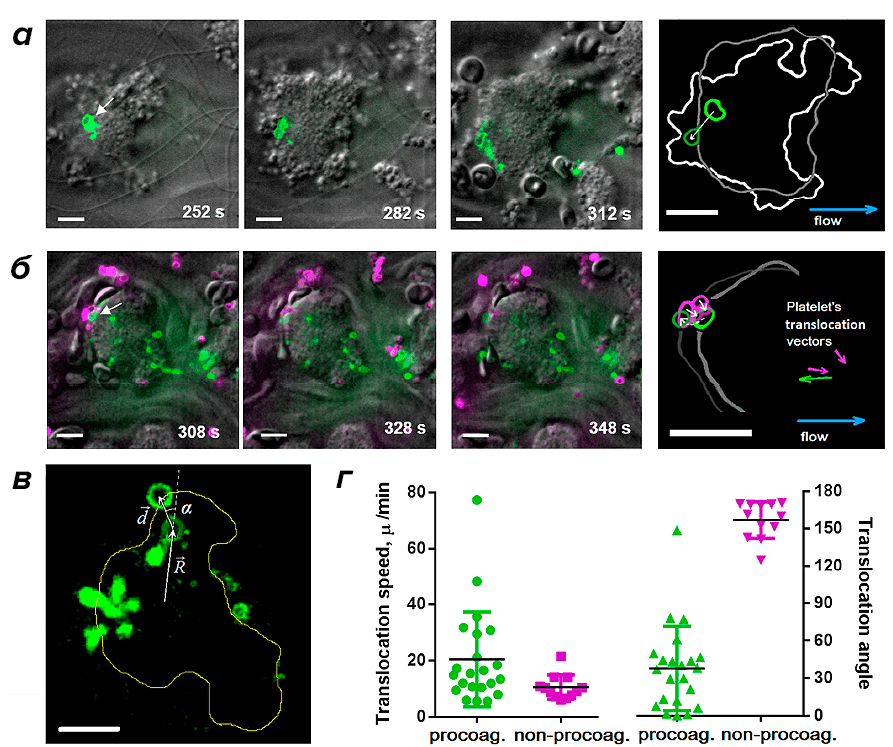
Рисунок 1. Динамика перемещения прокоагулянтных тромбоцитов в тромбе. а — Конфокальные микрофотографии тромбов в различные моменты времени. Зеленый цвет соответствует флуоресценции умирающих клеток (используется флуоресцентный маркер клеточной смерти). б — Тромбы в различные моменты времени. Зеленый цвет соответствует флуоресценции умирающих клеток, фиолетовый цвет — флуоресценции прикрепившихся к тромбу тромбоцитов (используется флуоресцентно-меченное антитело к поверхностным белкам тромбоцита). в — Основные величины, используемые для анализа перемещения тромбоцитов — вектор перемещения d, угол транслокации α между направлением перемещения и начальным радиус-вектором центра умирающей клетки, проведенным из центра тромба. г — Результаты анализа модулей средних скоростей перемещения и углов транслокации умирающих клеток (зеленый цвет) и «свежих» тромбоцитов, прикрепившихся к поверхности тромба (фиолетовый цвет). Масштаб — 10 микрометров.
Такое перераспределение сопровождается формированием фибрина на поверхности тромба. Так как умирающие (прокоагулянтные) тромбоциты достаточно слабо взаимодействуют с другими клетками и не участвуют в процессе контракции, было высказано предположение, что их перераспределение является результатом механического вытеснения в процессе активного сжатия тромба. Для проверки этой гипотезы была создана компьютерная модель сжатия тромбоцитарного агрегата, которая продемонстрировала работоспособность сформулированной гипотезы (рис. 2).
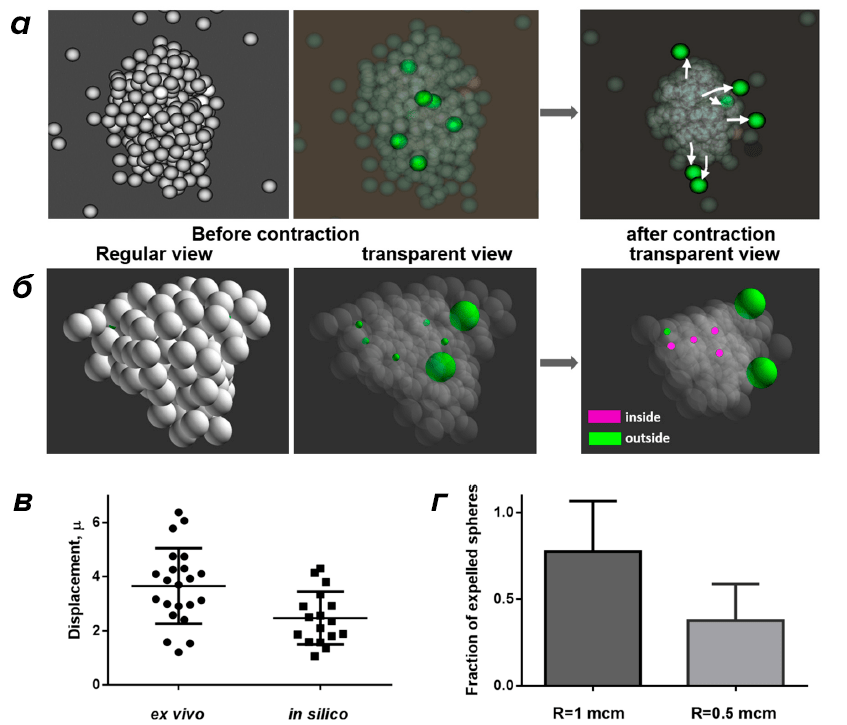
Рисунок 2. Моделирование контракции клеточного агрегата. а — Тромбоцитарный агрегат до и после сжатия. Зеленым цветом отмечены сферы, имитирующие прокоагулянтные клетки, которые не участвуют в процессе контракции и относительно слабо взаимодействуют с другими сферами. Контракция описывается как уменьшение равновесной длины парного потенциала (Морзе) взаимодействия между центрами сфер. б — Агрегат до и после контракции, в котором «прокоагулянтные» сферы, изначально расположенные внутри агрегата, имели различные радиусы. Фиолетовым цветом отмечены сферы, которые после контракции остались внутри агрегата, а зеленым — вне агрегата. в — Значение абсолютных величин перемещений прокоагулянтных тромбоцитов в экспериментах (ex vivo) и «прокоагулянтных» сфер в модели (in silico). г — Доля сфер, вытесненных в результате сжатия агрегата на его поверхность. Показаны результаты расчета для сфер различного радиуса.
Важной доказательной базой работы стали эксперименты с кровью уникальных генетически модифицированных мышей, тромбоциты которых лишены возможности проявлять механическую активность и, следовательно, обеспечивать контракцию тромба. В соответствии с предсказаниями модели и сформулированной гипотезы, умирающие клетки не перемещались к поверхности тромба в случае отсутствия контракции (рис. 3). Отсутствие поверхностного распределения умирающих тромбоцитов также сопровождалось отсутствием поверхностной локализации фибрина.
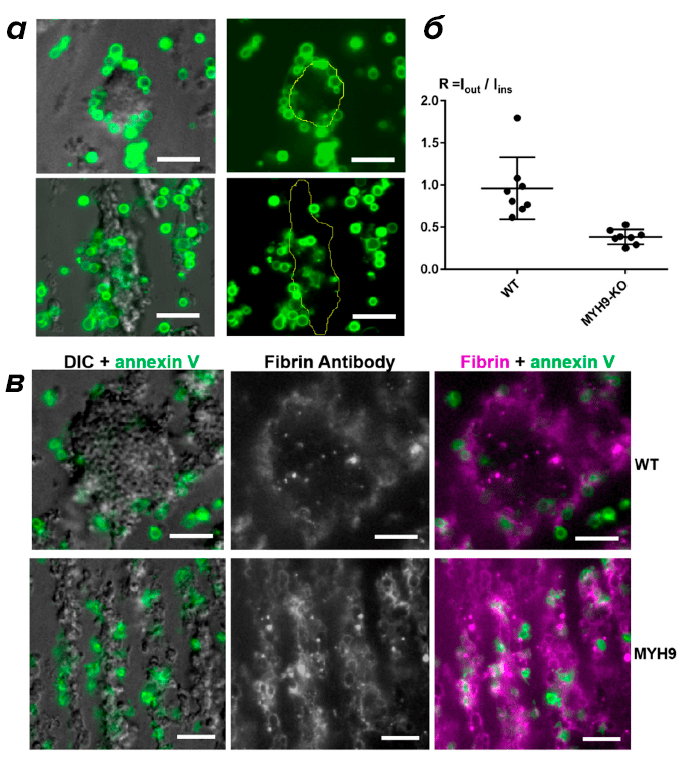
Рисунок 3. Сравнение распределения прокоагулянтных клеток и фибрина для нормальных и генетически модифицированных мышей. а — Распределение прокоагулянтных тромбоцитов (зеленый цвет) в нормальных мышах (верхняя панель) и модифицированных мышах (нижняя панель). Желтым цветом отмечен контур тромба, построенный по изображению в режиме дифференциально-интерференционного контраста. б — Анализ величин отношения суммарной флуоресценции поверхности умирающих клеток, находящихся вне плотной части тромба к флуоресценции таких же поверхностей внутри тромба для нормальных (WT) и генетических модифицированных мышей (MYH9). в — Распределение прокоагулянтных поверхностей (зеленый цвет) и фибрина (фиолетовый цвет) в тромбах мышей дикого типа (верхняя панель) и тромбах генетически модифицированных мышей (нижняя панель). Масштаб — 10 микрометров.
Подведение итогов
Проведенное нами исследование позволило описать новый механизм перераспределения клеток в составе тромба: в процессе контракции «скользкие» прокоагулянтные тромбоциты механически выдавливаются на поверхность тромба, формируя гетерогенную структуру его внешней части.
Но точка в определении роли прокоагулянтных тромбоцитов в гемостазе еще не поставлена. Формирование слабоадгезивного, то есть малопригодного к налипанию новых клеток, слоя из умирающих клеток и фибрина на поверхности тромба может способствовать остановке его роста путем уменьшения эффективности закрепления приносимых потоком крови неактивированных тромбоцитов. Однако данная гипотеза требует дальнейших исследований.
Приятно отметить, что в данную работу важный вклад внесли молодые соавторы — студенты кафедры биофизики физического факультета МГУ — Роман Керимов и Александра Якушева, а также студентка факультета фундаментальной медицины МГУ Таисья Шепелюк (рис. 4). Результаты работы опубликованы в одном из ведущих журналов американской сердечно-сосудистой ассоциации и доложены на нескольких международных конференциях, включая Гордоновскую конференцию по гемостазу.

Рисунок 4. Роман Керимов, Александра Якушева, Таисья Шепелюк и Дмитрий Нечипуренко
Эта версия является модификацией заметки, которая вышла в физфаковской газете «Советский физик».
Автор выражает благодарность Анастасии Масальцевой и Юрию Нечипоренко за помощь в редактировании статьи, а также всем своим коллегам — соавторам оригинальной работы.Литература
- Shaun P Jackson. (2011). Arterial thrombosis—insidious, unpredictable and deadly. Nat Med. 17, 1423-1436;
- Как работает свертывание крови?;
- А. Н. Свешникова, А. В. Беляев, М. А. Пантелеев, Д. Ю. Нечипуренко. (2018). Роль трансмембранных гликопротеинов, интегринов и серпентинов в адгезии и активации тромбоцита. Биол. мембраны. 35, 351-363;
- Alena O. Yakimenko, Faina Y. Verholomova, Yana N. Kotova, Fazoil I. Ataullakhanov, Mikhail A. Panteleev. (2012). Identification of Different Proaggregatory Abilities of Activated Platelet Subpopulations. Biophysical Journal. 102, 2261-2269;
- Атауллаханов Ф.И. и Гурия Г.Т. (1994). Пространственные аспекты динамики свертывания крови. I. Гипотеза. «Биофизика». 39, 89–96;
- N.M. Dashkevich, M.V. Ovanesov, A.N. Balandina, S.S. Karamzin, P.I. Shestakov, et. al.. (2012). Thrombin Activity Propagates in Space During Blood Coagulation as an Excitation Wave. Biophysical Journal. 103, 2233-2240;
- Dmitry Y. Nechipurenko, Nicolas Receveur, Alena O. Yakimenko, Taisiya O. Shepelyuk, Alexandra A. Yakusheva, et. al.. (2019). Clot Contraction Drives the Translocation of Procoagulant Platelets to Thrombus Surface. ATVB. 39, 37-47.