Поймать звук: от молекул до импланта, слышащего свет
09 ноября 2018
Поймать звук: от молекул до импланта, слышащего свет
- 4232
- 3
- 6
Автор статьи (Марина Слащева) и ее коллега по программе (Elisabeth Fritsch) работают над заморозкой образцов кортиева органа, подготовкой их к электронной томографии и последующей обработкой данных.
иллюстрация Manasi Pethe
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Слух кажется таким естественным, что мы никогда не задумываемся о нем. В статье вы узнаете не только о том, как работает ухо, но и познакомитесь с современными методами изучения молекулярных процессов передачи звука и передовыми технологиями коррекции патологий слуха с помощью оптогенетики.
Конкурс «био/мол/текст»-2018
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2018.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Листья шепчут вдоль тротуаров в три часа ночи, похоронный караван катится по пустынным рельсам, и сверчки внезапно, без всякой на то причины, замолкают, да так, что ты слышишь стук своего сердца, хотя лучше бы его не слышать.
Рей Бредбери. Дзен в искусстве написания книг
Каждый день мы окунаемся в мир звуков не меньше, чем в мир визуальных образов. Задумайтесь на секунду, какое обилие звуков окружает вас прямо сейчас: от тихого дуновения ветра до раздражающего гудения машин за окном. Вы пытаетесь отбиться от них, сосредоточиться, но звуки налетают со всех сторон и врываются в сознание — от них невозможно избавиться также просто, как от картинок, закрыв глаза. Как устроено ухо и как работает слух? Как ученые бьются над загадками восприятия звуков и нарушения слуха? В этой статье я расскажу о своей работе в Институте нейробиологии слуха в Гёттингине и передовых исследованиях на самых разных уровнях: от того, как мы ловим молекулярные механизмы передачи звука с помощью новейших технологий, до оптогенетического импланта (имплантата): невероятного устройства, позволяющего «слышать» свет. Танцующие волосковые клетки, говорящее ухо, мартышки-киборги с оптогенетическими имплантами — присоединяйтесь к безумному шоу звука и света!
Часть 1. Обзорная: как мы слышим?
Чтобы разобраться в самых передовых исследованиях в области слуха, необходимо понять, как работает ухо человека. Ухо является невероятно сложной системой и состоит из нескольких отделов; оно улавливает звуки из окружающего мира, усиливает их, преобразует в сигнал, понятный нейронам, и отправляет в мозг. Для начала давайте разберемся, что представляет собой звук и как его можно измерить, а потом перейдем к описанию работы самого уха и к нескольким интересным фактам о нем.
Что такое звук с точки зрения физики
Первая фраза о слухе в любом учебнике по нейрофизиологии сообщает о том, что человеческое ухо воспринимает звуки в диапазоне частот от 16(20) до 20 000 герц. По-видимому, этот диапазон велик, но что эти цифры в действительности означают? Частота звука выражается в количестве циклов колебаний, которые звук проделывает за одну секунду. Для порогов восприятия человека это будет 20 или 20 тысяч циклов в секунду, и такой звук будет восприниматься как низкий и высокий соответственно. При этом реально данный порог не зафиксирован, а зависит от громкости звука, которую измеряют в децибелах. Громкость звука можно понимать как давление, оказываемой волной звука на барабанную перепонку: чем сильнее давление, тем громче звук. Так, в диапазоне от 0 (тишина) до 130 децибел (болевой порог) громкость нормальной речи располагается на уровне 50–60, а концерт рок-группы — 110–120 децибел (рис. 1).

Рисунок 1. «Термометр» шума: громкость различных звуков, окружающих нас, в децибелах
Однако нейробиологам этого было не достаточно, и они придумали измерять громкость звука в фонах. Дело в том, что человеческое ухо — это не абстрактная мембрана в вакууме, а биологический объект, который воспринимает разные частоты звука с разной чувствительностью, и измерение громкости звука в фонах делает на это поправку. График взаимоотношений между частотой звука, децибелами и фонами можно порассматривать по этой ссылке. Так что нижним порогом хоть и считается звук частотой в 20 герц, услышать его можно только при уровне звука в 70 децибел и выше. Тем не менее, списывать герцы со счетов не стоит: дальше мы увидим, где в нейробиологии слуха звук удобно описывать в герцах.
Из чего состоит ухо и как оно усиливает звук?
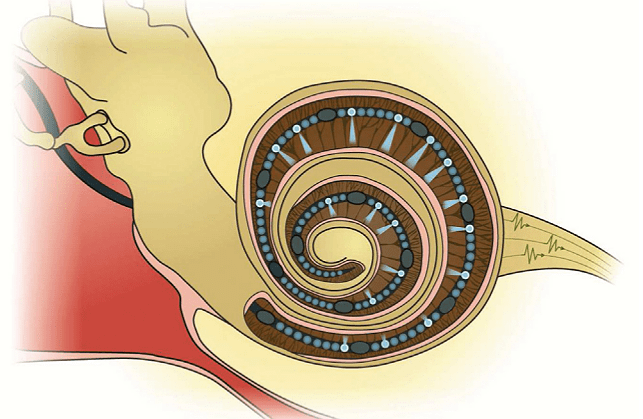
Теперь от устройства звука перейдем к уху — органу чувств, этот звук воспринимающему. В учебниках принято делить ухо на три отдела: наружное, среднее и внутреннее ухо (рис. 2) [1]. Все самое интересное происходит во внутреннем ухе, и ему будет посвящена бóльшая часть статьи, но тут я коротко опишу предназначение других отделов.
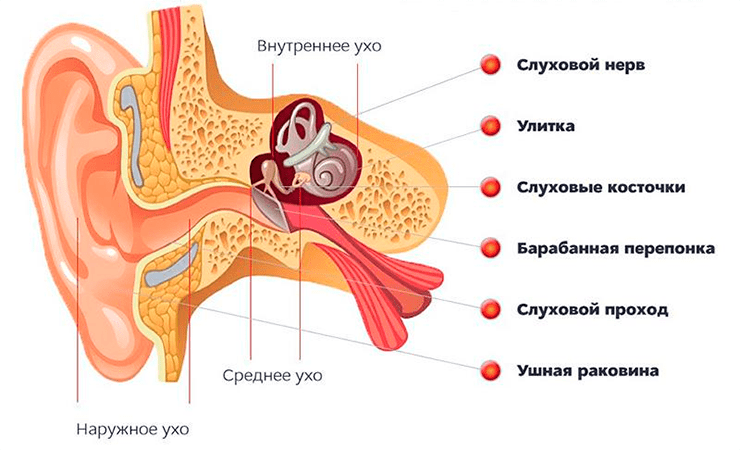
Рисунок 2. Основные отделы уха: наружное, среднее и внутреннее
Наружное ухо знакомо всем и не нуждается в особом представлении — это ушная раковина и наружный слуховой проход. Ушная раковина благодаря своей форме улавливает окружающие звуки. Многие животные, возьмем хотя бы собак, могут ею двигать и контролировать поступающие звуковые волны — способность, утерянная большей частью представителей Homo sapiens.
Среднее ухо отделено от наружного барабанной перепонкой и содержит три самые маленькие косточки в организме: молоточек, наковальню и стремечко, — на которые с барабанной перепонки передается звуковое колебание воздуха. Косточки работают как система рычагов, за счет чего улавливают звук и передают его к следующей мембране — овальному окошечку. Любая сенсорная система человека и животных — это об усилении сигнала, полученного извне, поэтому дизайн среднего уха несет еще один механизм усиления: площадь наружной барабанной перепонки в разы больше площади овального окошечка, и за счет этого звук как бы «туннелируется». В итоге полученные барабанной перепонкой колебания усиливаются в 200 раз!
Овальное окошечко — это тонкая мембрана, через колебание которой звук передается во внутреннее ухо, невероятно сложный и изящный отдел, в котором помимо процесса восприятия звука также расположен вестибулярный аппарат. Работу внутреннего уха можно описывать с бесконечным количеством деталей, но я объясню только самые необходимые для понимания следующих разделов, а также расскажу некоторые увлекательные факты.
Итак, как мы уже сказали, звук — это колебательные волны, сжимающие воздух, то есть механическое явление. Но мозг не умеет воспринимать звук таким, какой он есть, так же как мозг не воспринимает фотоны света, химические молекулы ароматов и давление на кожу. Вообще, все, что может мозг, — это получать и передавать электрические сигналы, почти как по проводам [2]. С таким инструментарием далеко не уедешь, мозгу нужен «переводчик», и в случае слуха эту роль выполняет внутреннее ухо: оно трансформирует энергию механических колебаний в электрический сигнал, понятный мозгу. Теперь прыгаем за мной в кроличью нору и разбираемся, как!
Вся магия происходит в органе под названием «улитка» — неудивительно, что по внешнему виду он напоминает улитку (рис. 3). Косточки среднего уха крепятся к улитке через овальное окошечко и колебание передается дальше, в спиральный лабиринт улитки. Для удобства представьте, что мы размотали панцирь улитки, вытянули его в трубку длиной примерно 30 мм и разрезали поперек. На рисунке 3 справа показан как раз такой срез: внутри лабиринт улитки разделен на три отдела, заполненные жидкостью. Самый главный — средний, где расположены клетки, отвечающие за восприятие и преобразование звука, в то время как боковые отделы чисто механистически поддерживают колебания и сбрасывают давление от звуковых волн через круглое окошечко, тоже закрытое мембраной и выходящее в среднее ухо. Таким образом, звуковые колебания мимолетно входят во внутреннее ухо через овальное окошечко и покидают его через круглое — вот вам и вся гамма окружающих нас звуков.
Рисунок 3. Внутреннее ухо и улитка. Слева показана улитка — структура, находящаяся во внутреннем ухе и преобразующая механические колебания звука в электрический сигнал. Справа показана улитка в поперечном разрезе, с тремя компартментами, главный из которых — средний — несет в себе кортиев орган.
Как внутреннее ухо трансформирует и передает сигнал мозгу

Рисунок 4. Кортиев орган. Слева оранжевым показаны три ряда наружных волосковых клеток, справа — один ряд внутренних волосковых клеток, передающих электрический сигнал, кодирующий звук, нейронам спирального ганглия.
В среднем отделе улитки расположен кортиев орган — так собирательно называют все клетки, расположенные внутри. Нас интересуют только два типа клеток — внутренние и наружные волосковые клетки (на рисунке 4 показаны оранжевым). Внутренние волосковые клетки (рис. 4, справа) — это рецепторы звука, которые как раз и преобразуют механические колебания жидкости в улитке в электрический сигнал. Они называются волосковыми благодаря расположенным на их верхушке волоскам — стереоцилиям, похожими на антенны клетки. В покое клетка спокойно сидит себе в улитке, а при прохождении звуковой волны в жидкости стереоцилии отклоняются, и в их основании механически открываются ионные каналы. Клетка активируется благодаря тому, что ионы калия начинают течь в клетку по градиенту концентрации и делать заряд клетки внутри более положительным. Этот процесс называется деполяризацией и его можно сравнить с током электронов по проводам, только в случае живой клетки ток проводится с помощью ионов калия.
Деполяризация распространяется по всей мембране внутренней волосковой клетки сверху вниз и достигает основания клетки, где находятся другие каналы, которые открываются уже в ответ на деполяризацию (они «чувствуют» более положительный заряд клетки изнутри) и теперь в клетку начинает поступать кальций. А если уж в клетке увеличилась концентрация кальция, это верный признак, что полученный сигнал пора передавать дальше по цепочке — следующей клетке. Здесь уже происходит полноценный процесс передачи нервного импульса: волосковая клетка выделяет пузырьки с нейромедиатором, который возбуждает следующую клетку — нейрон спирального ганглия, и сигнал о полученном звуке несется прямо в мозг по слуховому нерву. Подробнее про механизмы становления потенциала покоя и передачу нервного сигнала в обычных нейронах можно почитать на «Биомолекуле» в статье «Мозг, общение нейронов и энергетическая эффективность» [2]. Именно синаптической передачей я занималась в Институте нейробиологии слуха, и этому посвящен второй раздел, а пока — еще немного деталей о слухе!
Как танцующие клетки уха помогают бороться с патологиями слуха
Я упомянула, что главную роль в восприятии и преобразовании звукового сигнала играют внутренние волосковые клетки, расположенные в один ряд, но есть еще наружные волосковые клетки. Их больше, они расположены в три ряда. Что же делают они? Наружные волосковые клетки — настоящие тусовщики, я не шучу! Да, они тоже воспринимают звук по тому же механизму, но практически не посылают его дальше в мозг (мы знаем это, потому что только 5% слухового нерва подходит к ним). Так вот, они звук амплифицируют за счет удивительного белка в мембране под названием «престин» [3]. Когда клетка деполяризуется из-за отклоненных стереоцилий и тока ионов калия, престин «чувствует» изменение потенциала и начинает механически удлиняться и укорачиваться, как бы сокращаясь и раскачивая волосковую клетку, тем самым заставляя ее «танцевать»! Это создает более активный ток жидкости в улитке, который, в свою очередь, более резво раскачивает стереоцилии внутренних волосковых клеток, амплифицируя звук для них. Наружные волосковые клетки «танцуют», даже если их извлечь из улитки и немного простимулировать в чашке Петри — посмотрите, как они пляшут на видео 1!
Видео 1. Танцующие наружные волосковые клетки
Из этого забавного свойства престина в наружных волосковых клетках вытекает еще одно интересное явление со страшным названием — «отоакустическая эмиссия». Не пугайтесь, этот термин всего лишь означает, что наше ухо способно генерировать звуки само по себе, без внешнего стимула! Престин, по неизвестным пока науке причинам, иногда решает посокращаться сам по себе (возможно, из-за нормальных или патологических колебаний потенциала на мембране наружной волосковой клетки — и это не что иное, как генерация звука: не звука в физическом смысле, а звука как нервного импульса — того, что наш мозг воспринимает как звук). В норме этот звук слишком слаб и не слышен, а при патологии может вылиться в состояние под названием «тиннитус», при котором пациент слышит шум или звуки, не вызванные никаким внешним стимулом.
Явление отоакустической эмиссии полезно тем, что позволяет выявлять патологии слуха практически сразу после рождения, когда критический период еще не прошел и глухота поддается лечению. Наружные волосковые клетки можно стимулировать слабым звуком и ждать их ответа, похожего на эхо. Если клетки «ответили» — значит, слуховой аппарат младенца в порядке, а если нет — возможна патология. Такой тест очень прост, дешев и обязателен после рождения ребенка, прибор напоминает небольшой наушник. Явление «говорящего уха» спасает миллионы младенцев по всему миру от вечной тишины.
Как звуки картируются в ухе и мозге
Наконец, помните, в начале я говорила, что скучные герцы нам еще пригодятся? Так вот, когда звук достигает уха в качестве волны, его частота (а значит и высота) еще заложена в физических качествах самой волны. Но когда колебания преобразуются в нервный импульс, это различие стирается, так как нервный импульс идентичен во всех клетках. Как же наш мозг способен различать высоту звуков? Представьте, что улитка, которую мы развернули раньше в длинную трубку — это пианино, и звуки на нем упорядочены. Основание улитки воспринимает высокие звуки, а верхушка — низкие. Чисто биологически это реализуется за счет разных свойств мембраны улитки по ее длине. Основание — более жесткое, и звуку приходится «вкладывать» больше энергии, чтобы его поколебать, поэтому основание воспринимает высокие звуки, а верхушка — более тонкая и легко возбудимая, она чувствительна к низким звукам. Далее разделение разных частот сохраняется и на уровне нерва, который подходит к разным участкам улитки. Какие-то веточки нерва несут в мозг сигналы о звуках низкой частоты с верхушки улитки, а какие-то — высокой, с основания улитки. Этот принцип называется тонотопией, которая отлично показана в видео 2. Таким образом, улитка — это еще и пространственная карта, на которую нанесены разные частоты звуков окружающего нас мира.
Видео 2. Иллюстрация принципа тонотопии во внутреннем ухе
Часть 2. Молекулярная: исследования синаптической передачи
В этой части я расскажу про исследования синаптической передачи во внутреннем ухе — того самого высвобождения пузырьков с нейротрансмиттером из внутренних волосковых клеток для передачи сигнала следующему нейрону. Для этого нам придется спуститься в самые дебри молекулярного мира: процессы, которые я изучала в своем проекте, происходят в нано- и микрометровом пространстве и по времени занимают миллисекунды! Для того чтобы запечатлеть события на таком уровне, ученым приходится использовать целый набор сложных и необычных методов и проявлять фантазию — на методах и целесообразности их использования я и сделаю акцент в этом разделе. Но если молекулярная биология совсем не ваше — смело переходите к последнему разделу про оптогенетические импланты! А для самых любопытных и отважных — оптогенетическая стимуляция, ультрабыстрая заморозка биологических образцов под высоким давлением и электронная томография.
Как классические нейроны общаются друг с другом?
Нейроны в мозге постоянно сообщаются с друг другом путем передачи химических молекул — нейротрансмиттеров. Длинный отросток нейрона, посылающий сигнал, называется аксоном, а отростки, принимающие сигнал — дендритами. Место, где аксон и дендрит подходят друг к другу почти вплотную, называется синапсом. По сути, синапс — это два небольших компартмента, называющиеся соответственно пре- и постсинаптической терминалями, разделенные синаптической щелью размером в 20–30 нанометров (рис. 5). Пресинаптическая терминаль буквально забита небольшими пузырьками — везикулами с нейротрансмиттером (допустим, глутаматом, самым распространенным возбудительным трансмиттером). Когда нервный импульс доходит до пресинаптической терминали, кальций начинает поступать извне в клетку (через потенциал-чувствительные кальциевые каналы). Везикулы с глутаматом «чувствуют» увеличение концентрации кальция, для них это верный сигнал о том, что пора высвобождаться: везикулы сливаются с мембраной, глутамат попадает в синаптическую щель, связывается с рецепторами на постсинаптической мембране дендрита, и нервный импульс передается дальше. Процесс высвобождения везикул из пресинаптической терминали называется экзоцитозом, на «Биомолекуле» про него можно посмотреть комикс [4]!

Рисунок 5. Химический синапс
«Синапс»
Так сигнал распространяется по нервной системе (за исключением электрических синапсов, которых в мозге млекопитающих очень мало). Везикулы с глутаматом размером 40–60 нанометров удалось увидеть только с развитием электронной микроскопии — на электронных фотографиях по их присутствию можно надежно различить пре- и постсинаптическую терминали, как показано на рисунке 6 слева. Везикулы расположены повсюду в пресинаптической терминали и на первый взгляд кажутся совершенно неупорядоченными. На самом деле, с развитием более изощренных методов микроскопии и молекулярной биологии обнаружилось, что везикулы бывают разных типов (рисунок 6, справа): менее одного процента «сидит» на мембране и готово к экзоцитозу в любой момент, еще до 10% находятся рядом с мембраной и также могут сливаться с ней, а около 90% пузырьков на самом деле никогда в естественных условиях в мозге не высвобождаются и, более того, связаны друг с другом «липкими» белковыми филаментами [5], [6]. Таковым было и остается представление о классическом синапсе.
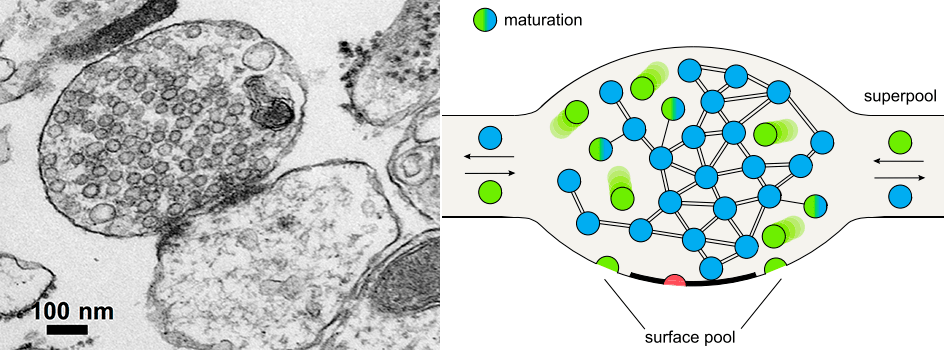
Рисунок 6. Синапс и пресинаптическая терминаль. Слева показана электронная микрофотография синапса: пресинаптическая терминаль заполнена синаптическими пузырьками. Справа показана модель пресинаптической терминали с тремя пулами пузырьков: красные находятся на мембране и готовы к высвобождению, зеленые сольются с мембраной при более сильной стимуляции, и голубые — резервный пул — в реальном нейроне скорее всего никогда не будут задействованы в процессе синаптической передачи.
Ленточный синапс, или риббон
Позже, после описания классического синапса, ученые случайно обнаружили в пресинаптической терминали странную структуру, не похожую ни на что [7], [8]: электроннотемная область 200–400 нанометров в диаметре, окруженная по периметру везикулами. Когда они присмотрелись внимательней, то увидели, что некоторые везикулы еще и связаны с ней загадочными нитями-филаментами (рис. 7). Электроннотемной областью в трансмиссионной электронной микроскопии называют любой участок, задерживающий прохождение электронов и часто не опознанный биологически. Вот и про это облако ничего не знали, только подозревали, что в нем собрано большое количество белков. Такую же структуру нашли в фоторецепторах сетчатки, в клетках электрических органов рыб, и во внутренних волосковых клетках улитки. Ее назвали лентой (от англ. ribbon), а сам синапс — ленточным синапсом (ribbon synapse); и уже с девяностых годов появилось множество статей с электронными фотографиями хорошего разрешения, показывающими риббон во всей красе. Но какова функция этого риббона, почему вокруг него толпятся везикулы, что там вообще происходит? Существуют разные гипотезы о функциях риббона: говорят, что он помогает «сконцентрировать» пузырьки у места их экзоцитоза, увеличивает скорость их выделения, работает как конвейер и так далее. Многие вопросы по-прежнему остаются без ответов из-за технической сложности изучения синапса, хотя очевидно, что именно благодаря риббону мы способны воспринимать звук с великолепным временным разрешением [9]. Только сейчас технические возможности стали позволять нам взглянуть на этот процесс в динамике. Именно этим занимается группа Каролины Вихтман из Института нейробиологии слуха в Гёттингене, где я работала два месяца на практике.
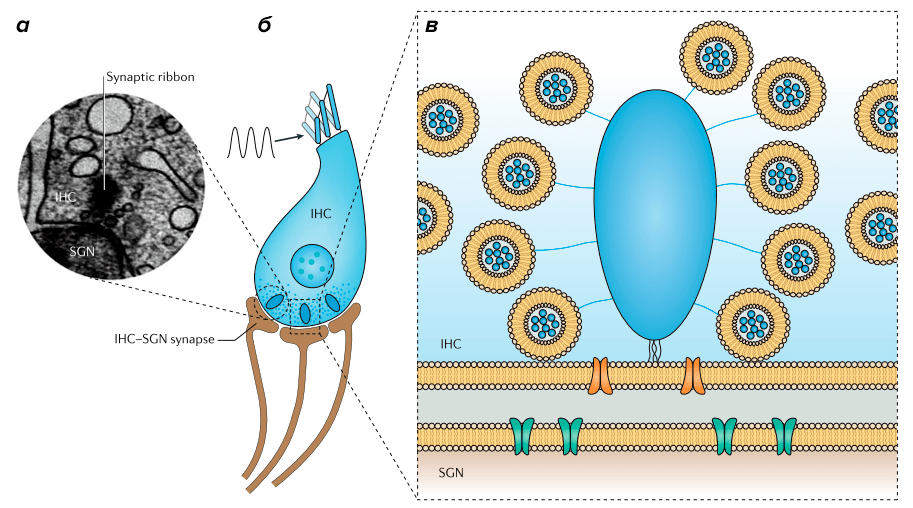
Рисунок 7. Риббон. а — Электронная микрофотография риббона. б — Схема внутренней волосковой клетки (inner hair cell, IHC) с риббонами на пресинаптической мембране и дендритами нейронов спирального ганглия (spiral ganglion neuron, SGN), образующими синапсы с волосковой клеткой. в — Схема риббона (голубой) с окружающими его синаптическими везикулами, заякоренными с помощью специальных филаментов (они называются tethers).
Так как процесс синаптической передачи при восприятии звуков похож у всех млекопитающих, в лаборатории его проще всего изучать на мышиных органах слуха. После препарирования кортиев орган мыши хранится какое-то время в питательной среде, и из него можно либо сразу сделать образцы для электронной микроскопии, либо «возбудить» клетки, симулируя нервный импульс и инициируя экзоцитоз синаптических везикул, и уже потом готовить образцы для электронной микроскопии. Так как статических изображений ленточного синапса в научной литературе уже полно (рис. 7), нам было интересно стимулировать экзоцитоз и попробовать запечатлеть ленточный синапс на разных стадиях высвобождения везикул. Так мы надеялись увидеть, что происходит с пулом пузырьков, окружающих сам риббон, что происходит с филаментами, привязывающими пузырьки к риббону, становится ли пузырьков меньше, двигаются ли они к мембране или наоборот. Но тут возникала проблема, которая долго была камнем преткновения исследований всех динамических молекулярных процессов. Дело в том, что экзоцитоз — процесс невероятно быстрый, при стимуляции клеток в чашке Петри все пузырьки выделяются за десятки миллисекунд, а технически даже самые продвинутые методы заморозки образцов (как, например, заморозка под высоким давлением, описанная далее), которые останавливают все молекулярные процессы в клетке, занимают около 500 миллисекунд. Всего полсекунды, но пул синаптических везикул успевает истощиться. Поезд, как говорится, ушел.
От стандартной фиксации образцов к Flash-and-Freeze
Группа ученых из Японии под руководством Шигеки Ватанабэ [11] нашла невероятно изящное решение этой проблемы с использованием оптогенетики, но сначала нам нужно взглянуть на достаточно трудоемкий процесс подготовки кортиева органа к электронной микроскопии (рис. 8). Главная цель, преследуемая при подготовке образцов на протяжении десятков лет, — сохранить структуры тканей и клеток в состоянии, максимально близком к нативному. Это всегда сложная задача, так как стандартные химические агенты, используемые для фиксации ткани (как, например, глутаральдегид) образуют сшивки между белками и могут вносить артефакты. Ученые придумали разные методы заморозки для фиксации образцов, но и тут есть сложности — при заморозке вода в тканях образует кристаллы, которые повреждают молекулярные структуры клетки.
Один из способов обойти образование кристаллов — замораживать ткань при ультранизкой температуре и под огромным давлением. Такой метод называется «заморозка под высоким давлением» (high pressure freezing) и осуществляется в специальной машине, наполненной жидким азотом и генерирующей давление в 1700 бар. Именно в этой машине живой фрагмент ткани превращается в полностью замороженный образец за полсекунды без образования кристаллов — это называется витрификацией. Потом этот образец можно хранить в жидком азоте либо подвергнуть процедуре под названием «замораживание-замещение» (freeze substitution). Цель последнего — заменить всю воду в образце сначала органическими растворителями, а потом смолой, которая впоследствии застынет и сделает образец похожим на насекомое, заключенное в янтарь.

Рисунок 8. Схема эксперимента. Кортиев орган стимулируется лазером, через 10–15 миллисекунд (в зависимости от протокола) происходит витрификация образца в системе для заморозки под высоким давлением (high-pressure freezing). Затем витрифицированная вода заменяется органическими растворителями и далее смолой в процессе замораживания-замещения (freeze substitution). После окраски, контрастирования и подготовки срезов толщиной 200 микрометров образцы готовы к электронной томографии.
Ritu Chakrabarti, Gerhard Hoch, Kai Bodensiek (рисунок с модификациями)
Я не буду подробно описывать все этапы замораживания-замещения, но полезно знать, что для этой процедуры тоже требуется специальная машина, которая контролирует температуру. А именно медленное ее поднятие с −90 °C до +4 °C позволяет органическому растворителю (в данном случае мы использовали ацетон) начать пропитывать образец. Весь процесс последовательного замещения воды растворителем и смолой занимает неделю. В растворитель также добавляют тетраоксид осмия — краситель, который позволяет сделать структуры клетки контрастными. В противном случае ткань на электронном микроскопе выглядит практически прозрачной. Из-за использования тетраоксида осмия весь процесс проводится в специальном помещении, в полном обмундировании и невероятно аккуратно. После замещения воды образцы помещают в эпоксидную смолу, которая полимеризуется при 70 °C и позволяет нарезать ткань на срезы толщиной 200 микрометров. Эти срезы подкрашивают менее токсичными соединениями типа ацетата уранила и монтируют на медные решетки для электронной микроскопии. Дальше остается только положить их в микроскоп, но давайте вернемся к проблеме времени при заморозке образцов.
Оптогенетика приходит на помощь
Итак, экзоцитоз происходит за 15–20 миллисекунд, заморозка образца занимает 500 миллисекунд. Что придумали японские ученые? Они решили стимулировать образец попозже, когда он уже находится внутри машины для заморозки под высоким давлением. Но как это возможно внутри огромного и сложного прибора, если классически экзоцитоз стимулируют при помощи электрода? Тут на помощь приходит оптогенетика — совершенно чудесная вещь, про которую сказано уже много [12], [13]. Вкратце, чтобы клетка возбудилась, у нее должны открыться ионные каналы, пропускающие ионы калия и натрия и в норме открывающиеся при деполяризации клетки. Но ученые открыли тип ионного канала у бактерий, который открывается, если на него посветить светом определенной длины волны (чаще всего используется голубой). Потом этот канал, под названием «каналородопсин», научились при помощи генной инженерии встраивать в мембрану нейронов млекопитающих (похожие рецепторы — родопсины — можно найти в фоторецепторах сетчатки; про них писала «Биомолекула» [14]). Существуют даже специальные линии мышей, у которых нейроны возбуждаются и проводят нервный импульс, если на них посветить голубым лазером! Вот группа Шигеки Ватанабэ [11] и догадалась встроить внутрь машины для заморозки голубой лазер и использовать модифицированную линию мышей для стимуляции экзоцитоза. Методику назвали Flash-and-Freeze, и работает она следующим образом.
Образец отправляется внутрь машины для заморозки и «ждет» там своего часа, пока прибор набирает в резервуар жидкий азот и надстраивает необходимое давление. В сам прибор помимо голубого лазера встроен акселерометр, по показаниям которого можно судить о внутренних этапах работы машины и поймать момент, когда азот на месте, давление в норме и до заморозки осталось, скажем, 100 миллисекунд. Так, мы можем включить лазер за 50 миллисекунд до заморозки и стимулировать ткань на протяжении 10 миллисекунд — тогда между стимуляцией и заморозкой образца пройдет всего 40 миллисекунд. Можно придумывать бесконечное количество протоколов стимуляции, но Flash-and-Freeze позволяет добиться невероятного временнóго разрешения!
Трехмерная микроскопия — электронная томография
Далее, после замещения воды смолой, окраски и нарезания, срезы толщиной 200 микрометров наконец готовы к электронной микроскопии. Тут эксперты в микроскопии могут заметить, что для электронного микроскопа такие срезы, скажем так, толстоваты. А все дело в том, что мы используем не просто трансмиссионную электронную микроскопию, а электронную томографию [15]. Разница в том, что внутри микроскопа решеточка с образцом может наклоняться под разными углами, и микроскоп делает не одну фотографию, а сотни. Как показано на рисунке 9, микроскоп наклоняет образец на 60 градусов в обе стороны и делает снимок с разницей в градус. После этого с помощью специальных программ все снимки можно спроецировать друг на друга и восстановить трехмерное изображение риббона и окружающих его везикул.
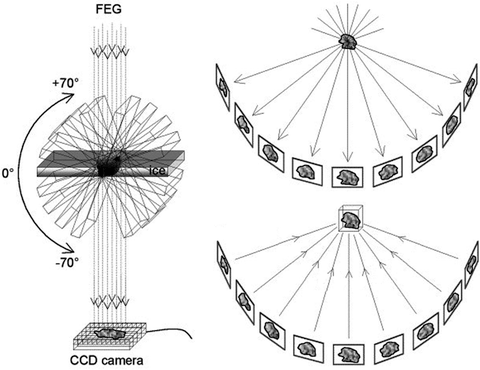
Рисунок 9. Принцип электронной томографии. Образец в электронном микроскопе наклоняется под разными углами, и с каждый наклоном на один градус делается электронная микрофотография. Затем иллюстрации проецируются друг на друга и реконструируются в трехмерное изображение.
Но и на этом еще не все. В научном мире одними картинками и красивым видео никого не удивишь. Поэтому от трехмерной томограммы мы переходим к модели синапса: в специальных программах мы можем полуавтоматически восстановить интересующие нас элементы — в нашем случае это пресинаптическая мембрана, сам риббон и окружающие его везикулы (как показано на рисунке 10). Используя большое количество томограмм, можно классифицировать везикулы, посчитать, сколько пузырьков принадлежит к каждой категории с разными протоколами стимуляции, и, подобно следователю, попытаться восстановить сцену происходящего в этом загадочном ленточном синапсе. Так, нам удается опровергнуть некоторые гипотезы о механике экзоцитоза в ленточном синапсе и по шагам определить ход развития событий.
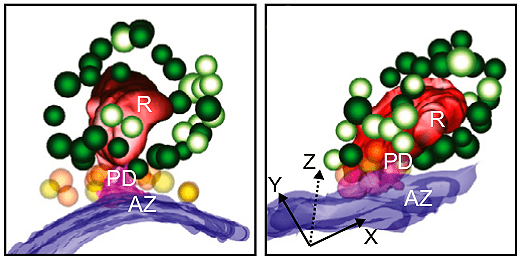
Рисунок 10. Модель риббона и пресинаптической мембраны, реконструированная с помощью электронной томографии. Красный — риббон; синий — пресинаптическая мембрана; зеленые везикулы — пул риббон-ассоциированных пузырьков (темно-зеленые заякорены к риббону); оранжевые и желтые везикулы — пул, ассоциированный с мембраной. Слева показана модель риббона в состоянии покоя, справа — после оптогенетической стимуляции. Видно, что почти все везикулы из пула, ассоциированного с мембраной, высвободились, однако чтобы сделать достоверные научные выводы, необходим количественный анализ везикул из разных пулов и статистика.
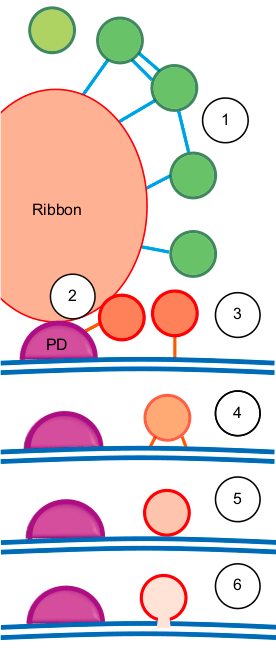
Рисунок 11. Предложенная модель транспорта синаптических везикул вокруг риббона, основанная на методах, описанных выше. Объяснения модели смотрите в тексте.
Модель экзоцитоза, предложенная на основании описанных выше методов, изображена на рисунке 11. Везикулы, расположенные вокруг риббона, заякорены филаментами (1), причем после стимуляции количество филаментов на одну везикулу увеличивается. Вероятно, с помощью заякоривания везикулы перемещаются из риббон-ассоциированного пула ближе к пресинаптической мембране (2) и закрепляются на ней сначала одним филаментом (3), а затем многими (4). Уже находясь в пуле, ассоциированном с мембраной, везикулы «стыкуются» с мембраной (5; по-английски этот процесс называется docking) и сливаются (fusion) с ней при стимуляции клетки, высвобождая нейромедиатор в синаптическую щель (6) [16].
Распутать эту хитрую динамику помогают также новейшие методы микроскопии сверхвысокого разрешения, например, STORM (STochastic Optical Reconstruction Microscopy) и STED (Stimulated Emission Depletion Microscopy — микроскопия на основе подавления спонтанного испускания) [17], [18], которые тоже используются в нашей лаборатории. Такие исследования помогают перебросить мостик от простого (хоть и очень непростого технически) описания структурного устройства синаптической передачи к ее функциональному значению. В исследованиях слуха это особенно важно: ведь передача звука закодирована необычайно сложно, и именно такой особенный ленточный синапс, судя по всему, позволяет нам воспринимать звуки с необычайно высоким частотным и временным разрешением. Нарушения же слуха зачастую лежат в нарушении синаптической передачи и называются синаптопатиями — о них пойдет речь в последнем разделе. Одним словом, чтобы научиться эффективно лечить глухоту, полезно понимать, каким образом механизмы синаптической передачи обеспечивают восприятие звука.
Кстати, возможно, вы задалиcь вопросом, а что же представляет собой сам риббон? Более точного ответа, чем «набор разнообразных белков», не существует по сей день. Ученым удалось идентифицировать некоторые белки в его составе. Некоторые из них уникальные, другие — нет. Но мы так и не знаем, как эта структура появилась и какую точно функцию выполняет. Однако у мышей-мутантов с риббоном, плавающим посередине клетки (не заякоренном на мембране), слух утерян, следовательно, риббон просто необходим для нормального развития и поддержания слуха [19].
Часть 3. Клиническая: как вернуть слух при помощи света
В этой части я расскажу, как фундаментальные исследования молекулярного устройства уха, а также их совмещение с новейшими биотехнологическими разработками помогают бороться с патологиями слуха. Сначала мы совсем коротко обсудим разные уровни, на которых слух может повреждаться, а также насколько легко каждый из них поддается коррекции. Затем мы бегло взглянем на устройство кохлеарного импланта, чтобы в конце концов перейти к описанию оптогенетического импланта, разрабатываемого группой Тобиаса Мозера в Институте нейробиологии слуха в Гёттингене.
Нарушения слуха на разных уровнях
Ухо — очень сложная система, где много чего может пойти не так, и тяжесть нарушений часто зависит от уровня, на котором они происходят. Самый «простой» уровень, который современная медицина освоила достаточно хорошо, — это патологии наружного и среднего уха. Такие патологии называются кондуктивными и включают нарушения проведения звука через наружное и среднее ухо. К этой категории относятся, например, повреждение ушной раковины, иногда требующее хирургического вмешательства, или ушная пробка, часто возникающая у детей и вызывающая тугоухость.
Следующий, более «глубинный» уровень патологий возникает на уровне внутреннего уха и называется нейросенсорным. Сюда включают патологии улитки, в частности гибель внутренних волосковых клеток, ведущую к частичной или полной глухоте. Патологии могут затрагивать нейроны спирального ганглия, и часто потеря волосковых клеток ведет к атрофии слухового нерва. Такие нарушения лечить уже гораздо сложнее, и именно на этот уровень нацелены слуховые аппараты и кохлеарные импланты, описанные в следующем разделе.
Еще один уровень нарушений слуха, который слабо поддается нашему пониманию и еще меньше — вмешательству, — это обработка звука в слуховой коре, в высших отделах головного мозга. В этом случае восприятие звука в физическом смысле может быть совершенно нормальным, но при этом понимание речи — нарушенным. Сюда можно отнести сенсорную афазию — нарушение в зоне Вернике слуховой коры, при которой пациент нормально воспринимает звук на уровне уха, но не может расшифровать услышанного. Для лечения таких патологий ученым требуется детальное понимание того, как кора головного мозга кодирует и хранит информацию, но для этого понадобятся еще годы исследований.
Старая эра: кохлеарный имплант
На сегодняшний день кохлеарный имплант является самым успешным примером нейропротезирования — им уже пользуются более 300 000 человек по всему миру. Следует подчеркнуть отличие кохлеарного импланта от слухового аппарата: последний является неинвазивным прибором и, по сути, просто усиливает звук, который далее улавливается внутренними волосковыми клетками, даже если их количество уменьшено, и передается нейрону спирального ганглия. Кохлеарный имплант позволяет исправить патологии слуха даже в том случае, если волосковые клетки повреждены, но сам нерв еще не атрофировался [20]. Звуки улавливаются микрофоном, расположенным снаружи, на коже или волосах, и при помощи речевого процессора преобразуются в электрический сигнал. Далее электрический сигнал передается на очень тонкий провод, протянутый спирально по всей длине улитки (поэтому имплант и называется кохлеарным) и способный стимулировать нейроны спирального ганглия напрямую, в обход волосковых клеток. Помните, в конце первого раздела мы упоминали тонотопию — кодирование определенных звуковых частот разными участками улитки? Имплант использует тот же принцип, и после преобразования звука стимулирует именно ту часть слухового нерва улитки, которая кодирует специфическую частоту звука.
На этом этапе и выплывают главные ограничения кохлеарного импланта. Хорошо известно, что люди, носящие имплант, могут без труда различать отчетливую разговорную речь, но восприятие речи в шумной среде, так же как восприятие музыки и звучания музыкальных инструментов для них остается недоступным. Во-первых, это определяется низким пространственным разрешением кохлеарного импланта: обычно по длине улитки стимуляция осуществляется только в 10–20 точках (рис. 12а), а электрический сигнал помимо этого имеет свойство «переливаться» через край, то есть стимулировать не только нейроны, воспринимающие определенную частоту звука, но и их соседей. Во-вторых, звук имеет сложную временнýю организацию, и ее передача при помощи электрического импланта очень ограничена. В-третьих, кохлеарный имплант плохо справляется с кодированием интенсивности звука: динамический диапазон электродов ограничен десятью децибелами [21].
Чтобы вернуть пациентам способность наслаждаться сонатами Баха или трясти головой в такт Led Zeppelin, необходимо найти способы увеличения каналов стимуляции слухового нерва для лучшего пространственного разрешения и улучшить временнýю динамику передаваемого звука. Именно тут на помощь ученым неожиданно приходит свет.
Новая эра: оптогенетический имплант
Итак, давайте будем считать, что основной проблемой электрического кохлеарного импланта является низкое пространственное разрешение, вызванное тем фактом, что в улитку возможно вместить только 10–20 сайтов электрической стимуляции (рис. 12а). Таким образом, ученым необходимо придумать, как увеличить количество таких мест стимуляции слухового нерва. В Институте нейробиологии слуха в Гёттингене решили отказаться от идеи электрической стимуляции и вместо этого использовали оптогенетику: стимуляцию нейронов спирального ганглия светом. Мы уже упоминали принцип работы оптогенетики ранее в этой статье. Чтобы заставить нейроны спирального ганглия «слышать» свет, в них необходимо встроить специальный ионный канал — каналородопсин, который открывается, пропускает ионы в клетку и таким образом вызывает возбуждение в нейроне при освещении его светом. Несколько лет назад эта идея выглядела достаточно безумной, потому что она требует генетической модификации клеток внутреннего уха человека — процедуры, балансирующей на лезвии этических вопросов биологии. Но к 2015 году Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) уже одобрило [21] более 50 клинических испытаний, включающих модификацию человеческих клеток при помощи аденоассоциированных вирусов.
Главное условие работы такого импланта — сохранность слухового нерва. После модификации нейронов спирального ганглия они приобретают способность возбуждаться и проводить нервный сигнал далее в мозг при их освещении голубым светом. Для этого в улитку вводится длинный и очень тонкий светодиод, по сути похожий на электрод в электрическом импланте, но излучающий голубой сфокусированный свет вместо электрического сигнала. За счет того что свет может быть хорошо «прицелен», количество каналов оптогенетической стимуляции может быть увеличено в несколько раз — до сотни, с меньшим эффектом «переливания» между разными каналами (рис. 12б).
Помимо увеличения числа сайтов стимуляции, для восприятия музыки и звуков в шумной среде необходимо также улучшение временнóго разрешения импланта. Тут оптогенетике тоже есть что предложить. Каналородопсины, встраиваемые в мембрану — на любой вкус и цвет. В данном случае главный параметр, интересующий ученых, — это молекулярная динамика канала: как быстро канал может открываться и закрываться. Чем скорее канал реагирует на вспышки света, тем лучше временное разрешение проводимого звукового сигнала. Так, например, интернейроны в коре головного мозга могут поддерживать возбуждение с частотой 200 потенциалов действия в секунду, синтезируя искусственно модифицированный каналородопсин ChETA [22], а самыми многообещающими вариантами для оптогенетической стимуляции в улитке являются каналородопсины Chronos или CatCh (calcium translocating ChR).
Самое главное — когда же оптогенетический имплант начнут использовать на людях? Пока сложно сказать, но в начале 2018 года группа Тобиаса Мозера выпустила статью в Science Translational Medicine, где описала работу импланта на песчанках [23]. Ученые выбрали этих грызунов в качестве модели, так как, в отличие от мышей и крыс, диапазон звуков, воспринимаемых песчанками, покрывает низкие частоты и близок к человеческому. Кроме того, улитка песчанок больше по размеру и опять же приближается к человеческой (но все еще в 2,5 раза меньше). Было показано, что оптогенетический имплант вызывает возбуждение слухового нерва в ответ на звуковую стимуляцию и в поведенческих экспериментах позволяет глухим животным избегать угрожающих звуковых стимулов. Кроме того, не так давно группа Тобиаса Мозера начала работать с мартышками и адаптировать оптогенетический имплант под приматов. Первые данные, свидетельствующие об успехах импланта на этой модели, представили на симпозиуме в Гёттингене в мае 2018 года, и пока что эти данные только готовятся к публикации. Стоит заметить, что от идейного прототипа оптогенетического импланта до его применения на приматах коллектив Института нейробиологии слуха дошел всего за три–четыре года, так что не удивляйтесь, если кто-то вокруг вас в ближайшее время ненароком подметит, что он способен слышать свет!
Видео 3. Слышать свет: модель оптогенетического импланта размером с человеческое ухо в действии. На заднем плане — директор Института нейробиологии слуха Тобиас Мозер.
Заключение
В заключение, для самых стойких, дочитавших до конца, мне следует признаться кое в чем. Я занимаюсь биологией пять лет, и всегда, на всех курсах, слух и ухо были моими самыми нелюбимыми темами. Ухо казалось каким-то невероятно сложным, с кучей непонятных косточек и мембран, описание звука в герцах, децибелах и фонах — запутанным и непонятным. Я думала «Ну и зачем мне все это знать, если я не собираюсь заниматься слухом?» до тех пор, пока жизнь не завела меня на проект в Институт нейробиологии слуха в Гёттингене, да и «повелась» я в основном на незнакомые и сложные методы с красивыми картинками на выходе. Мне довелось работать с чудесными людьми, и я поняла, что сложность перестает пугать и превращается во что-то присущее биологической системе, когда осознаешь, как элегантно и необычайно все устроено. Благодаря этой сложности мы каждый день соприкасаемся с миром вокруг и помогаем людям, эту способность утратившим. За проект и поддержку во всем, включая эту статью, я выражаю огромную благодарность директору института Тобиасу Мозеру, лидеру моей группы Каролине Вихтман и доктору Риту Чакрабарти за каждодневную помощь в работе над собой и проектом.
Литература
- Kandel E.R. Principles of neural science (5th Edition). NY: McGraw-Hill Medical, 2012. — 1760 p.;
- Мозг, общение нейронов и энергетическая эффективность;
- J. F. Ashmore, G. S. G. Geleoc, L. Harbott. (2000). Molecular mechanisms of sound amplification in the mammalian cochlea. Proceedings of the National Academy of Sciences. 97, 11759-11764;
- Как происходит выделение нейромедиатора;
- Silvio O. Rizzoli, William J. Betz. (2005). Synaptic vesicle pools. Nat Rev Neurosci. 6, 57-69;
- Denker. (2010). Synaptic vesicle pools: an update. Front. Syn. Neurosci.;
- C. Wichmann, T. Moser. (2015). Relating structure and function of inner hair cell ribbon synapses. Cell Tissue Res. 361, 95-114;
- Gary Matthews, Paul Fuchs. (2010). The diverse roles of ribbon synapses in sensory neurotransmission. Nat Rev Neurosci. 11, 812-822;
- Philippe Jean, David Lopez de la Morena, Susann Michanski, Lina María Jaime Tobón, Rituparna Chakrabarti, et. al.. (2018). The synaptic ribbon is critical for sound encoding at high rates and with temporal precision. eLife. 7;
- Tobias Moser, Arnold Starr. (2016). Auditory neuropathy — neural and synaptic mechanisms. Nat Rev Neurol. 12, 135-149;
- U. Valentin Nägerl, Antoine Triller Nanoscale Imaging of Synapses — Springer New York, 2014;
- 12 методов в картинках: нейробиология;
- Свет, камера, … нервный импульс!;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Lauren H. Sansing, Tajie H. Harris, Frank A. Welsh, Scott E. Kasner, Christopher A. Hunter, Katalin Kariko. (2011). Toll-like receptor 4 contributes to poor outcome after intracerebral hemorrhage. Ann Neurol.. 70, 646-656;
- Rituparna Chakrabarti, Susann Michanski, Carolin Wichmann. (2018). Vesicle sub‐pool organization at inner hair cell ribbon synapses. EMBO Rep.. 19, e44937;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Z. Jing, M. A. Rutherford, H. Takago, T. Frank, A. Fejtova, et. al.. (2013). Disruption of the Presynaptic Cytomatrix Protein Bassoon Degrades Ribbon Anchorage, Multiquantal Release, and Sound Encoding at the Hair Cell Afferent Synapse. Journal of Neuroscience. 33, 4456-4467;
- Что такое нейропротезирование? Это вредно?;
- Marcus Jeschke, Tobias Moser. (2015). Considering optogenetic stimulation for cochlear implants. Hearing Research. 322, 224-234;
- Lisa A Gunaydin, Ofer Yizhar, André Berndt, Vikaas S Sohal, Karl Deisseroth, Peter Hegemann. (2010). Ultrafast optogenetic control. Nat Neurosci. 13, 387-392;
- Christian Wrobel, Alexander Dieter, Antoine Huet, Daniel Keppeler, Carlos J. Duque-Afonso, et. al.. (2018). Optogenetic stimulation of cochlear neurons activates the auditory pathway and restores auditory-driven behavior in deaf adult gerbils. Sci. Transl. Med.. 10, eaao0540.