
Под «генную гармошку»
11 ноября 2014
Под «генную гармошку»
- 1836
- 1
- 2
Чем же на самом деле является амплификация гена — сбоем в ДНК-матрице или полезным приобретением?
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Генетическая информация в геномах живых организмов постоянно пребывает в состоянии динамического равновесия. Ее количество может возрастать за счет «самоцитирования» (копирование своей собственной ДНК) или «плагиата» (приобретения чужеродной ДНК), а может сокращаться за счет счет удаления балластной, с точки зрения клетки, информации. И если смысл обогащения генома за счет чужой ДНК интуитивно понятен, то назначение множественного копирования своих собственных генов далеко не очевидно. Однако этот процесс, получивший название «амплификации генов», чрезвычайно широко распространен в природе, а стало быть, для чего-то клеткам нужен.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Копируем — правим
Один из важнейших вопросов эволюции живого мира — как именно возникают новые признаки и появляются новые гены? Общепринятым на сегодняшний день является тезис о возникновении новых генов из дополнительных копий уже имеющихся. Впервые четко эту мысль оформил в своей книге Evolution by Gene Duplication Сусуму Оно. Он обрисовал модель, согласно которой удвоение существующего гена создает потенциальную мишень для «выковывания» новой кодирующей последовательности за счет мутаций (рис. 1). Появление таких копий — продукт спонтанных хромосомных перестроек, в результате которых определенный участок хромосомы удваивается (дупликация) или даже многократно копируется (амплификация). При этом ген-предшественник работает в полную силу, а дочерняя копия подвергается произвольным изменениям, что дает возможность экспериментировать с новыми функциями, не рискуя нарушить метаболизм клетки [1]. Иными словами, и волки сыты, и овцы целы.
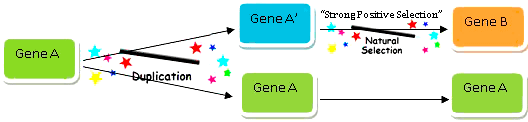
Рисунок 1. Возникновение нового гена из предшественника за счет дупликации
Не удивительно, что эта гипотеза оказалась невероятно привлекательной для множества генетиков, молекулярных биологов и микробиологов. Кроме того, анализ геномов [2], [3] самых разнообразных организмов демонстрирует, что для каждого гена можно найти «прародителя». Или даже — «прародителей», поскольку при формировании новых генов могут происходить и перемешивание генных фрагментов, и слияние или расщепление генов, и перемещение мобильных генетических элементов [4]. Однако по сути своей это всё то же удвоение имеющейся генетической информации. Разумеется, и это правило без исключения не обошлось. По крайней мере, недавно проведенные исследования свидетельствуют в пользу того, что некоторые гены все-таки образуются de novo — из некодирующей ДНК, но они — безусловное меньшинство (см. врезку) [5].
Но, как и любая модель, версия с дупликациями не избежала своих «проклятых вопросов». Как должна обеспечиваться генетическая стабильность удвоений? Все-таки, клетка чистоту своего генома блюдет и старается по возможности избавляться от балласта [6]. При этом известно, что повторяющиеся последовательности ДНК в геномах являются своеобразными очагами нестабильности. Каким образом дупликация умудряется продержаться настолько долго, что успевает стать новым геном или, по крайней мере, новым вариантом прежнего гена? Как она избегает отсева естественным отбором, ведь подобные мутации зачастую снижают жизнеспособность организма?
И хорошо бы на все эти «как?» ответить соответствующими эволюционными экспериментами, да только временные рамки эволюции новых генов слишком велики — ведь надо отследить судьбу тысяч и десятков тысяч поколений.
Прокариоты как модель: за и против
Здесь на помощь приходят одноклеточные организмы, прежде всего, бактерии. В частности, на них была проведена масса эволюционных экспериментов и выявлен ряд закономерностей динамики популяций [7], [8]. В то же время, использование бактерий для изучения роли дупликаций в эволюции генов наталкивается на целый ряд сложностей, обусловленных принципиальными различиями прокариотического и эукариотического планов строения. Так, например, дупликации генов прокариот еще менее стабильны, чем дупликации эукариотических генов. А контроль целостности прокариотического генома еще более жесткий (не зря в бактериальной хромосоме так мало «балластной» ДНК — весь геном при деле).
Удивительная стабильность и зарегулированность бактериального генома парадоксально сочетаются с его пластичностью, постоянной изменчивостью, особенно выраженной в условиях стресса. И наконец, в отличие от многоклеточных организмов, бактерии интенсивно практикуют горизонтальный перенос генов [4], то есть способны обмениваться генетическим материалом между собой. Все эти особенности ставят под вопрос тезис о том, что новые гены бактерий возникают за счет дупликации и последующего мутагенеза [9]. Вместе с тем, амплификация генов — чрезвычайно широко распространенное среди прокариот явление [10]. Так в чем же ее назначение?
Вспоминая Ламарка
Всплеск интереса к явлению амплификации в бактериальных системах возникает в конце 1990-х — начале 2000-х годов при изучении так называемого адаптивного мутагенеза. Феномен адаптивного мутагенеза был обнаружен в 1980-е годы Дж. Каинсом и П. Фостер на модели кишечной палочки (Escherichia coli), лишенной способности усваивать лактозу и несущей конъюгативную F’-плазмиду с поврежденным геном фермента галактозидазы lacZ− [11]. Оказалось, что при инкубации на среде с лактозой как единственным источником питания появлялось очень много (в 100 раз больше ожидаемого) мутантов, сумевших восстановить неработающий lacZ и начать усваивать единственный доступный дисахарид. То есть, речь шла о том, что среда стимулирует клетку к приобретению необходимой мутации. Обнаруженный феномен возобновил разнообразные толки об адаптивной направленности мутагенеза, о возможной правоте Ламарка и недостатках «дарвинизма» [12]. Безусловно, это не могло не привлечь внимания исследователей, занимающихся мутагенезом бактерий.
При изучении мутантов выявили, что у многих из них «лактозоядность» крайне неустойчива, и в благоприятных условиях зачастую пропадает. Кроме того, обнаружилось, что количество мутантов резко падает при повреждении генов, регулирующих процесс рекомбинации (то есть перестройки) ДНК. И, наконец, оказалось, что до 40% всех выявленных мутантов несут на F′-плазмиде множество копий гена lacZ−.
С этого момента началась острая полемика по поводу природы так называемого адаптивного мутагенеза. И здесь наиболее отчетливо выделялись несколько точек зрения. Группа исследователей, возглавляемых Патрисией Фостер, объясняли наблюдаемый феномен мутациями, возникающими при активизации процессов перестройки ДНК. Тогда как амплификация гена lacZ− предполагалась следствием этого процесса, а не его причиной [13]. Коллектив Сьюзен Розенберг предложил несколько другую модель, согласно которой большинство «лактозоядных» мутантов возникали в результате общего повышения интенсивности мутагенеза. А что касается процесса амплификации, то его вклад в общий пул мутантов оценивался не более чем в 10% [14].
Согласно гипотезе, выдвинутой группой исследователей под руководством Джона Рота и Дэна Андерсона, большое количество возникающих мутантов объяснялось простым увеличением числа копий гена lacZ− (больше копий — выше вероятность попасть в цель) [15]. Исследователи отмечали, что процесс повышения копийности гена начинается задолго до попадания бактерий в стрессовые условия. Тогда как на среде с лактозой выживают именно те мутанты, в которых произошла необходимая дупликация. А уж наличие дупликации — благодатная почва для амплификации генного фрагмента.
Приобретение мутаций по модели Рота и Андерсона напоминало своеобразный «мозговой штурм», при котором бактериальная клетка генерирует большое количество (до 50) повторов гена lacZ− на F′-плазмиде, и это увеличение копийности способствует выработке «правильного» решения в виде мутации, восстанавливающей работу гена lacZ. Как только одна из копий lacZ− приобретает необходимую мутацию, клетка избавляется от балласта в виде уже ненужных повторов неработающего гена.
Единственный принципиальный пункт, по которому все исследователи адаптивного мутагенеза согласились между собой, состоял в том, что ортогенез Ламарка здесь, по сути, ни при чем: явление вполне укладывалось в оригинальную концепцию Дарвина. Ирония заключалась в том, что при этом оно противоречило «дарвинизму».
«Растяжимый» геном
Изучая процесс адаптивного мутагенеза E. coli и Salmonella enterica [16], Рот и Андерсон трактовали его как последовательность нескольких этапов: 1) случайное удвоение необходимого для выживания гена; 2) отбор вариантов с дупликацией под воздействием того или иного стрессового фактора; 3) спонтанная амплификация дуплицированных генов; 4) приобретение мутации, способствующей выживанию в неблагоприятных условиях; 5) избавление от лишних копий первоначального, неадаптированного гена.
Этот цикл изменения копийности, при котором нить ДНК, содержащая тот или иной ген, то увеличивает свою длину за счет идущих подряд повторов, то снова сокращает, навел Н. Элдэ и соавторов, работавших с поксвирусом, на интересную аналогию с игрой на гармони (рис. 2). А соответствующий механизм получил название «генного аккордеона» (gene accordion) [17].
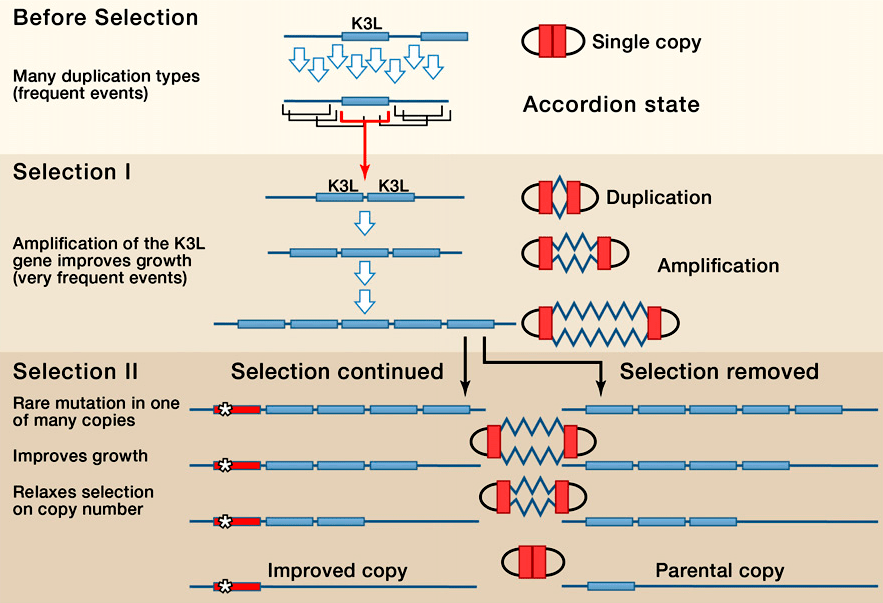
Рисунок 2. Модель «генного аккордеона» на примере гена K3L поксовируса. Дупликации гена K3L спонтанно возникают в популяции поксвирусов. Когда микроорганизм сталкивается с защитными системами организма — хозяина, естественный отбор способствует выживанию тех поксвирусов, которые предварительно успели обзавестись дупликацией K3L. Удвоенные гены легко подвергаются процессу спонтанной амплификации. Если в одной из амплифицированных копий возникает полезная мутация, способствующая преодолению защитных систем организма — хозяина, тогда прежние, не мутировавшие копии удаляются из генома поксвируса как балластные. То же самое происходит в случае снятия селективного давления и помещения поксвируса в оптимальные условия.
Что касается одного из «проклятых вопросов» гипотезы Оно — каким образом обеспечивается стабильность нестабильной по своей природе дупликации — то для него даже попытались предложить решение. По мнению У. Бергторсона, Дж. Рота и Д. Андерсона, важнейшим условием сохранения в клетке амплифицированных копий является селекция [18]. А именно: если в новых условиях усиление экспрессии гена за счет увеличения количества его копий оказывается выгодным, тогда амплификация будет сохраняться, покуда условия среды не изменятся. Множественное копирование гена здесь выступает как временная адаптация, способная проложить дорогу полезным мутациям.
В 2012 году было опубликовано впечатляющее исследование шведских ученых, выполненное в соавторстве с Ротом и Андерсоном и опирающееся на их теоретическую модель «инновация — амплификация — дивергенция» (innovation—amplification—divergence, или IAD) [19]. Сама схема IAD — не что иное, как развитие описанной выше гипотезы «селекции амплификации», только здесь в качестве дополнительного начального требования выдвигается так называемая «инновация». Под ней подразумевается спонтанное возникновение у фермента некоторой бифункциональности. Ген, отвечающий за функцию А, приобретает способность реализовывать дополнительную подфункцию b. При помещении организмов в среду, требующую для выживания функций А и В, белок эволюционирует в сторону превращения b — в B. Тогда как амплификация генов позволяет делать это без нарушения первичной функции А (рис. 3).
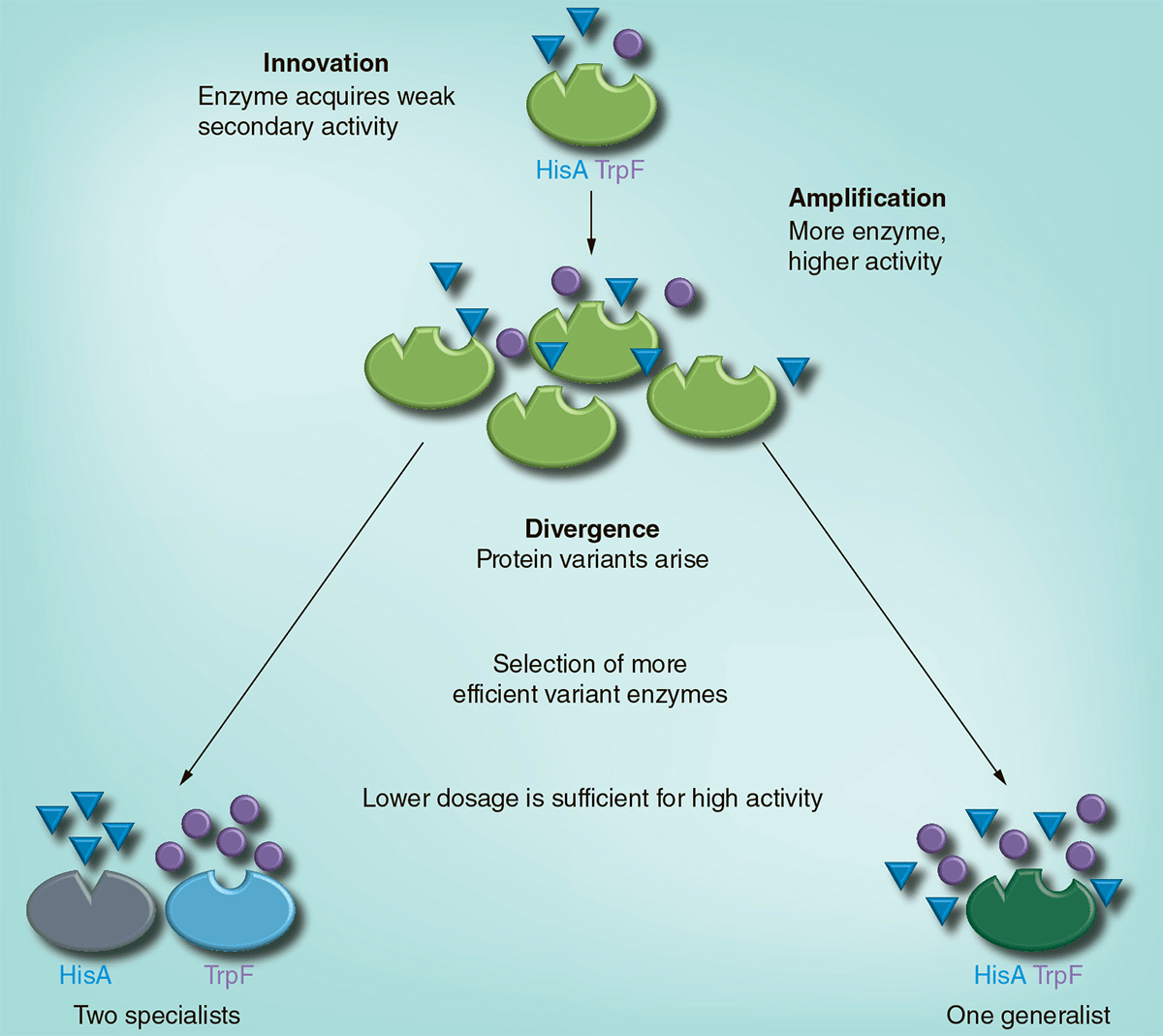
Рисунок 3. Эволюция бифункционального фермента (HisA/TrpF) по модели «инновация — амплификация — дивергенция». Спонтанная мутация, возникающая в гене hisA Salmonella enterica, приводит к тому, что кодируемый им белок HisA приобретает слабо выраженную функцию белка TrpF, участвующего в синтезе триптофана. При выращивании таких мутантов на среде, лишенной аминокислот гистидина и триптофана, происходит амплификация гена со сдвоенной фукнцией. Большое количество копий повышает вероятность возникновения необходимых мутаций. В результате формируются два различных варианта первичного гена hisA: один из них специализируется на синтезе гистидина, а другой — на синтезе триптофана. Помимо этого, в эксперименте были получены варианты, в клетках которых эволюционировал белок — «генералист», способный одинаково хорошо выполнять обе функции.
Эксперимент с Salmonella enterica на практике продемонстрировал метаморфозы фермента HisA, принимающего участие в синтезе аминокислоты гистидина, но постепенно выработавшего функцию фермента TrpF (один из ферментов синтеза триптофана). При этом бактерии сохранили способность к полноценной работе гена hisA. То есть, под воздействием длительной селекции произошло «размежевание» дуплицированных генов. Однако вопрос о том, насколько широко распространены подобные процессы в природе, по-прежнему остается нерешенным.
Эволюция генов прокариот: «самоцитирование» или «плагиат»?
Что касается происхождения генов прокариот, то в этой области идут давние споры сторонников моделей дупликации и горизонтального переноса генов. Теоретические построения свидетельствуют в пользу второго механизма: ведь чужеродная последовательность ДНК, будучи встроенной в бактериальный геном, оказывается более стабильной по сравнению с дупликацией. Она, из-за своей чужеродности, воспринимается клеткой как более или менее уникальная последовательность (то есть, меньше подвержена гомологической рекомбинации), а потому сохраняется.
Однако ряд научных работ, опубликованных в начале 2000-х годов и основанных на анализе последовательностей ДНК, указывали на то, что количество бактериальных генов, произошедших за счет удвоения имеющихся, как минимум в два раза превышает количество генов, приобретенных посредством горизонтального переноса [7]. Как справедливо отметили в своей публикации Е. Лерат с коллегами из Университета Аризоны, крупным недостатком всех этих работ явился тот факт, что анализируемые бактериальные виды были довольно далеки друг от друга в плане генетического родства [20]. А в этом случае гены-ортологи (гомологичные гены в геномах разных видов) зачастую неправомерно записываются в гены-паралоги (гомологичные гены, возникшие за счет дупликации в пределах одного генома). Если же исследование охватывает близкородственные виды, то тогда оказывается, что случаи возникновения новых генов в результате дупликации крайне редки (т.е. ортологов — много, а паралогов — очень мало).
Однако и здесь все не просто: чужеродный ген, попав в организм, как правило, работает крайне плохо, а потому для его «благоустройства» на новой почве необходимы дополнительные адаптации. И в роли таких адаптаций может выступать тот самый процесс амплификации, который, посредством увеличения копийности, способствует сглаживанию «несовместимости» нового гена и генома хозяина [21].
Природа «генной гармошки»...
Как возникает амплификация гена? Стартовой точкой для этого процесса служит так называемый «ампликон» — генетический фрагмент, окруженный двумя идентичными последовательностями нуклеотидов (повторами). Поскольку ДНК представляет собой двойную спираль, в которой каждое звено (нуклеотид) одной цепи однозначно соответствует нуклеотиду (аденин — тимину, гуанин — цитозину) на другой цепи, то наличие повторяющихся последовательностей может спровоцировать их «путаницу». В этом случае нуклеотиды одного повтора случайно выстраиваются напротив нуклеотидов другого повтора. В результате возникают сбои в работе молекулярных машин, призванных поддерживать точность копирования и «ремонта» ДНК. Такие сбои могут приводить либо к потере генного фрагмента, заключенного между двумя повторами, либо к его удвоению.
Например, если два повтора в составе ампликона характеризуются протяженностью и отдаленностью друг от друга, то они могут спровоцировать появление дупликации в результате ошибок системы гомологической рекомбинации (рис. 4).
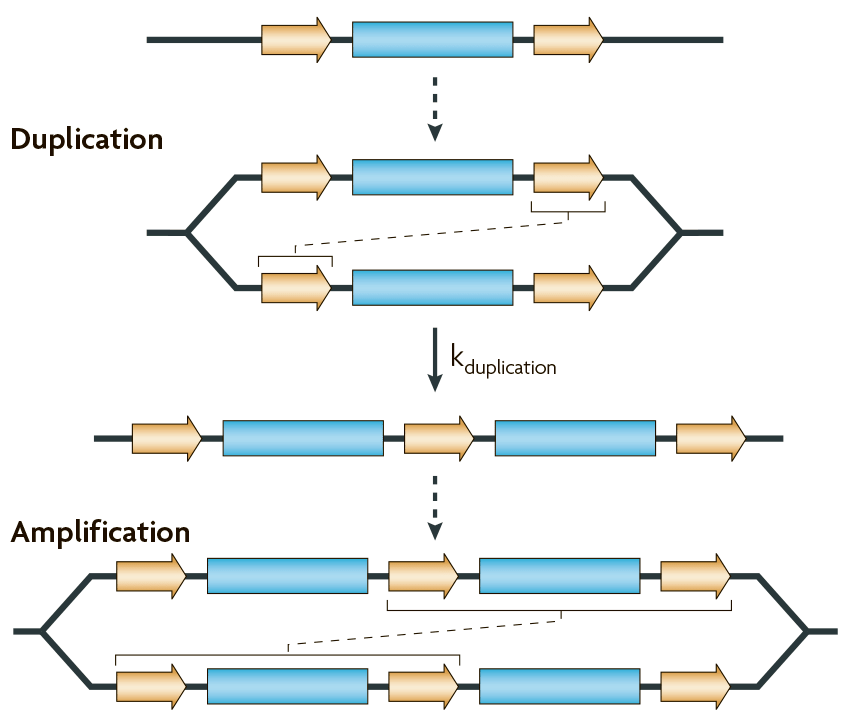
Рисунок 4. Возникновение дупликаций и амплификаций генов за счет гомологичной рекомбинации
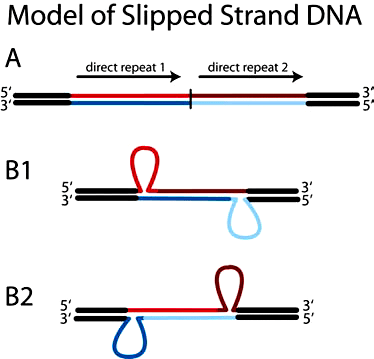
Рисунок 5. «Проскальзывание» нити ДНК за счет неправильного спаривания
Если повторы невелики и расположены неподалеку, то они могут инициировать процесс «проскальзывания» нити ДНК при ее копировании (репликации) (рис. 5). В данном случае, при неправильном спаривании нуклеотидов двух разных повторов, молекулярная машина репликации может дважды пройтись по одному и тому же участку ДНК-матрицы, образовав дупликацию.
В литературе также описан вероятный механизм амплификации генов по типу «катящегося кольца» (rolling-cycle amplification) (рис. 6). Здесь предполагается, что неправильное спаривание повторов приводит к «зацикливанию» обрывка ДНК при ее копировании. В результате один и тот же фрагмент может реплицироваться снова и снова.
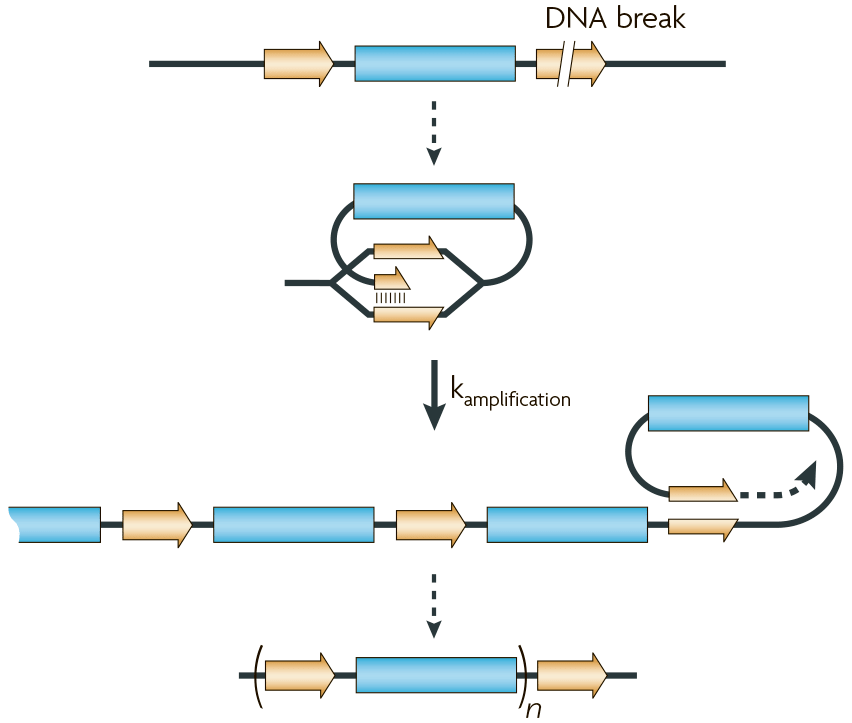
Рисунок 6. Механизм амплификации генов по типу «катящегося кольца»
Дупликации могут быть обязаны своим происхождением мобильным генетическим элементам — транспозонам (Tn) и инсерционным последовательностям (IS). Как правило, такие удвоения генетической информации характеризуются очень большой протяженностью, порою в сотни тысяч пар нуклеотидов [9].
Всевозможные повторы нуклеотидных последовательностей представлены в геномах очень обильно, поэтому мишенью для амплификации может оказаться любой ген. Как только произошла дупликация, мы получаем два идентичных и протяженных тандемных повтора, а это, можно сказать, любезное приглашение к работе ферментов гомологичной рекомбинации. Таким образом, регион становится крайне неустойчивым, подверженным различным видам хромосомных перестроек: как дупликациям, так и делециям (удалению генетического материала). Иными словами, удвоенный ампликон — отправной пункт для стремительной, взрывной амплификации, однако он с тем же успехом может вернуться в первичное, стабильное состояние единичного ампликона.
...и «генная гармошка» в природе
Несмотря на явные технологические сложности обнаружения амплификации генов, сегодняшние данные анализа множества геномов позволяют судить о том, что в бактериальном мире это дело вполне обычное. Согласно недавним исследованиям, более 20% клеток бактериальных популяций содержат в своем геноме дупликации, несмотря на отсутствие отбора, направленного на их сохранение в ряду поколений.
В клинической практике часто встречаются штаммы, демонстрирующие увеличение копийности генов, отвечающих за устойчивость к антибиотикам или толерантность к тяжелым металлам. Нередко это явление обнаруживается в бактериальных штаммах, прошедших через «голодание» или попавших в новую среду обитания (в человеческий организм, например). Отмечены случаи дупликаций генов, отвечающих за устойчивость к стрессам, в процессе адаптации E. coli к высоким температурам. Или даже не надо далеко ходить — прекрасный пример позитивной роли и стабильности амплификации — гены 16S-субъединицы рибосомной РНК — rnn [1], [9], [20]. К слову, исключительная консервативность этих последовательностей, повсеместно используемых в качестве универсального «дневника» эволюции микроорганизмов, в немалой степени обусловлена наличием дополнительных копий.
Тандемные удвоения фрагметов ДНК широко встречаются и в геномах эукариотических организмов. Их появление было обнаружено у дрожжей в ответ на ограничение по питанию, у арктической трески в ответ на холод, у простейших — лейшманий и малярийных плазмодиев — в ответ на химиотерапию. Зафиксировано возникновение дупликаций у москитов в результате воздействия пестицидов, у коров в процессе одомашивания и у множества других эукариот, подвергшихся или подвергающихся направленному отбору. Разумеется, и Homo sapiens в этом смысле не исключение. Установлено было, например, что множественные дупликации возникают в клетках раковых опухолей после интенсивной терапии. Кроме того, в геноме человека обнаружено обилие генных повторов, предположительно играющих адаптивное значение. Так, индивиды с амплифицированным геном CCL3L1 оказываются более устойчивы к ВИЧ-инфекции и склонны к более длительному развитию СПИДа. А геномы людей из популяций, употребляющих в пищу большое количество крахмала, демонстрируют увеличение копийности гена амилазы слюны AMY1 [1].
Разумеется, эти и многие другие примеры генной амплификации всего лишь указывают на то, что в определенных условиях (особенно, при заселении новых экологических ниш) «размножение» необходимых для выживания генов несет самостоятельное адаптивное значение. Меж тем, случаи фиксации эволюционных событий, происходящих за счет мутации амплифицированных копий, по-прежнему остаются редкими и спорными. Однако модель «генного аккордеона», едва появившись, сразу завладела вниманием многих исследователей. А значит, в ближайшее время мы можем ожидать новых открытий и достижений на этом пути.
Литература
- Fyodor A. Kondrashov. (2012). Gene duplication as a mechanism of genomic adaptation to a changing environment. Proc. R. Soc. B.. 279, 5048-5057;
- «Омики» — эпоха большой биологии;
- Код жизни: прочесть не значит понять;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- A. Siepel. (2009). Darwinian alchemy: Human genes from noncoding DNA. Genome Research. 19, 1693-1695;
- Сколько сора в нашей ДНК;
- Z. D. Blount, C. Z. Borland, R. E. Lenski. (2008). Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences. 105, 7899-7906;
- Colin Raeside, Joël Gaffé, Daniel E. Deatherage, Olivier Tenaillon, Adam M. Briska, et. al.. (2014). Large Chromosomal Rearrangements during a Long-Term Evolution Experiment with Escherichia coli. mBio. 5;
- Todd J. Treangen, Anne-Laure Abraham, Marie Touchon, Eduardo P.C. Rocha. (2009). Genesis, effects and fates of repeats in prokaryotic genomes. FEMS Microbiol Rev. 33, 539-571;
- Song Sun, Rongqin Ke, Diarmaid Hughes, Mats Nilsson, Dan I. Andersson. (2012). Genome-Wide Detection of Spontaneous Chromosomal Rearrangements in Bacteria. PLoS ONE. 7, e42639;
- Cairns J. and Foster P.L. (1991). Adaptive reversion of a frame shift mutation in Escherichia coli. Genetics 128, 695–701;
- Марков А.В. (2008). От Ламарка к Дарвину... и обратно. «Экология и жизнь». 1;
- Jeffrey D. Stumpf, Anthony R. Poteete, Patricia L. Foster. (2007). Amplification of lac Cannot Account for Adaptive Mutation to Lac+ in Escherichia coli. JB. 189, 2291-2299;
- Susan M. Rosenberg, P. J. Hastings. (2004). Adaptive Point Mutation and Adaptive Amplification Pathways in the Escherichia coli Lac System: Stress Responses Producing Genetic Change. JB. 186, 4838-4843;
- M. Wrande, J. R. Roth, D. Hughes. (2008). Accumulation of mutants in "aging" bacterial colonies is due to growth under selection, not stress-induced mutagenesis. Proceedings of the National Academy of Sciences. 105, 11863-11868;
- Semarhy Quiñones-Soto, Andrew B. Reams, John R. Roth. (2012). Pathways of Genetic Adaptation: Multistep Origin of Mutants Under Selection Without Induced Mutagenesis inSalmonella enterica. Genetics. 192, 987-999;
- Nels C. Elde, Stephanie J. Child, Michael T. Eickbush, Jacob O. Kitzman, Kelsey S. Rogers, et. al.. (2012). Poxviruses Deploy Genomic Accordions to Adapt Rapidly against Host Antiviral Defenses. Cell. 150, 831-841;
- U. Bergthorsson, D. I. Andersson, J. R. Roth. (2007). Ohno's dilemma: Evolution of new genes under continuous selection. Proceedings of the National Academy of Sciences. 104, 17004-17009;
- J. Nasvall, L. Sun, J. R. Roth, D. I. Andersson. (2012). Real-Time Evolution of New Genes by Innovation, Amplification, and Divergence. Science. 338, 384-387;
- Emmanuelle Lerat, Vincent Daubin, Howard Ochman, Nancy A Moran. (2005). Evolutionary Origins of Genomic Repertoires in Bacteria. PLoS Biol. 3, e130;
- Kathryn T Elliott, Laura E Cuff, Ellen L Neidle. (2013). Copy number change: evolving views on gene amplification. Future Microbiology. 8, 887-899;
- Linus Sandegren, Dan I. Andersson. (2009). Bacterial gene amplification: implications for the evolution of antibiotic resistance. Nat Rev Microbiol. 7, 578-588;
- Friedberg E.C., Walker G.C., Siede W. DNA repair and mutagenesis. Washington, D.C.: ASM Press, 1995. — 698 p.;
- Senka Dzidic S., Bacun-Druzina V., Petranovic M. (2003). The Role of Mismatch Repair in Bacterial Evolution. Food Technol. Biotechnol. 41, 177–182;
- John R. Roth, D.I. Andersson. (2012). Poxvirus Use a “Gene Accordion” to Tune Out Host Defenses. Cell. 150, 671-672;
- Richard, R. Sinden. (2007). Slipped strand DNA structures. Front Biosci. 12, 4788.








