Почему у коршуна острое зрение: отвечает метаболомика
16 января 2023
Почему у коршуна острое зрение: отвечает метаболомика
- 1075
- 0
- 3
Изучение метаболомного состава хрусталиков птиц выявило необычный и отличающийся от нашего УФ-фильтр — восстановленный никотинамидадениндинуклеотид (НАДН). Этот метаболит в наибольшей концентрации содержится в хрусталиках некоторых дневных хищников и водоплавающих птиц. НАДН полностью поглощает УФ-А излучение, проходящее через хрусталик, защищая сетчатку от опасного излучения и снижая хроматические аберрации.
Рисунок в полном размере.
коллаж автора с использованием изображения Rare gallery
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Часто, восхищаясь превосходным зрением хищных птиц, мы задаемся вопросом: какие же особенности глаза позволяют им так хорошо видеть. Многие находят ответ в анатомическом строении. Однако даже с максимально точной и чувствительной матрицей глаза — сетчаткой — выследить мелкую добычу в траве может быть сложно из-за хроматической аберрации. Мы — ученые Лаборатории протеомики и метаболомики — подошли к изучению вопроса остроты зрения на молекулярном уровне и искали ответ в метаболомном строении хрусталика. Оказалось, что за счет высокого содержания метаболита НАДН хрусталик коршуна играет роль фильтра и полностью поглощает ближний ультрафиолет. Казалось бы, какая здесь связь с остротой зрения? А на самом деле, именно ультрафиолет в большей степени создает хроматическую аберрацию изображения, а НАДН героически не подпускает его к сетчатке, сохраняя точность видимой картинки и повышая остроту зрения птиц.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2022/2023 и будет опубликована в журнале «Наука и жизнь».
Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2022/2023 и будет опубликована в журнале «Наука и жизнь».

Партнер номинации — компания «Хеликон»: — один из ведущих российских поставщиков продукции и услуг для молекулярно-биологических и клеточных лабораторий.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Анатомически глаз приспособлен фантастически
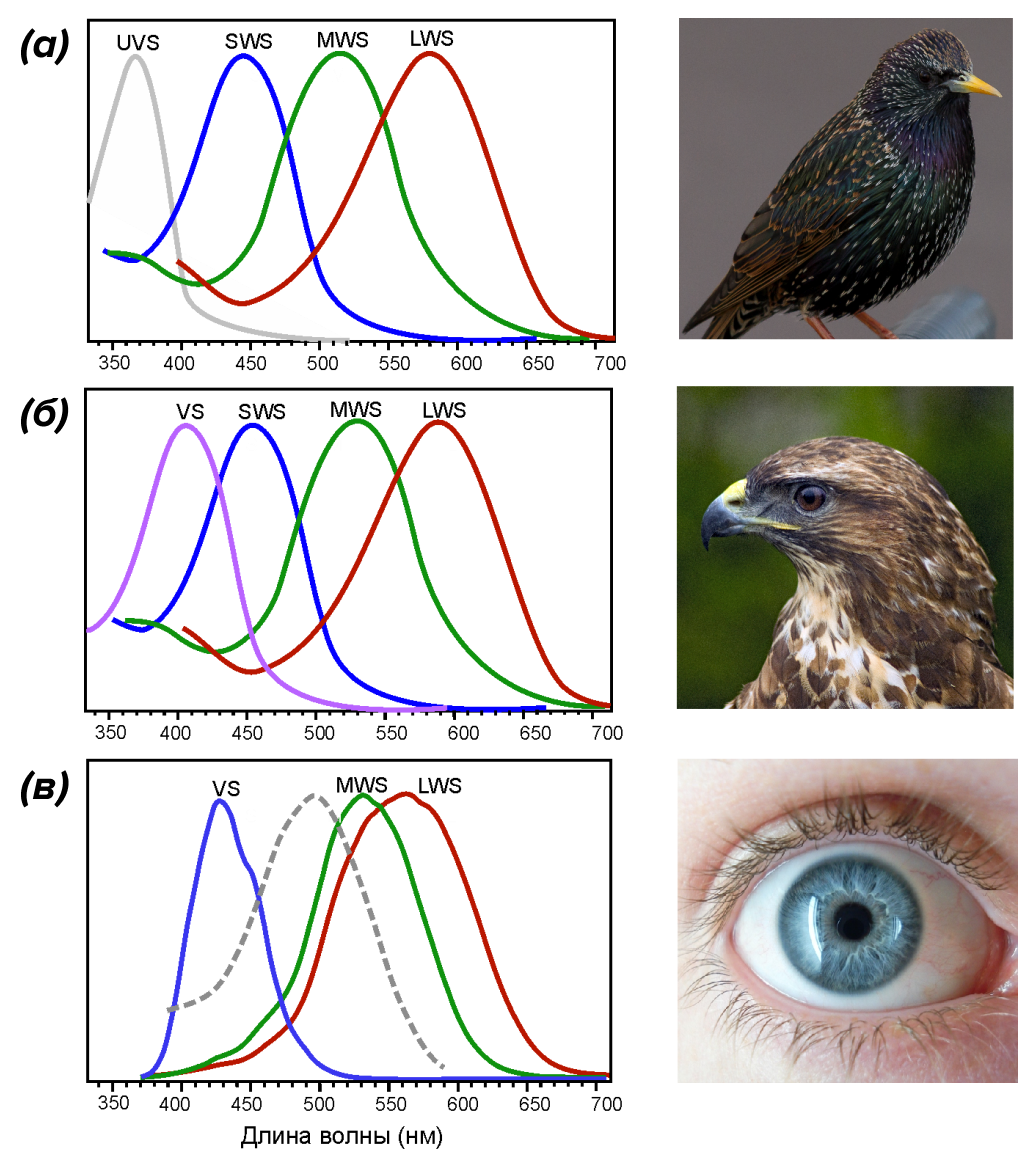
Глаз, как у орла: недаром «особо зрячих» людей сравнивают с этими хищными птицами. Способен ли человек разглядеть маленькую мышь с расстояния в несколько десятков и даже сотню метров? Коршуны и орлы способны — это необходимо для безопасности их полета, успешной охоты и выживания в целом. Строение глаза у этих птиц поистине уникально и заметно отличается от человеческого. Что касается анатомии: птицы имеют наибольший размер глаза по отношению к телу среди всего царства животных; высочайшую плотность фоторецепторов на сетчатке; цилиарные мышцы обеспечивают мгновенную аккомодацию хрусталика, а специальное гребенчатое тело разгружает сетчатку от кровеносных сосудов и повышает ее чувствительность [1–3]. Сетчатка птиц так же, как и у большинства других животных, содержит два вида фоторецепторов — палочки и колбочки. Первые нечувствительны к цвету и отвечают, в первую очередь, за ночное зрение, тогда как вторые полностью обеспечивают цветное зрение [4]. Ярким отличием глаза птицы является наличие не трех (как у человека), а четырех или даже пяти типов одинарных колбочек (рис. 1): «красные» (LWS), «зеленые» (MWS) и «синие» (SWS), а также «фиолетовые» (VS) и «ультрафиолетовые» (UVS) [5]. В состав фоторецепторных клеток птиц входят еще и двойные колбочки, но останавливаться на них мы не будем (подробности можно найти в обзорах [1], [3], [6–8], а также в статье «Биомолекулы» «Особенности механизмов зрения птиц» [5], с которой всем рекомендуем предварительно ознакомиться.
«Палитра» колбочек у птиц отличается от вида к виду: некоторые видят так же, как человек, другие видят больше оттенков фиолетового, а часть из них видит даже ультрафиолет (УФ) [7], [8]. У последних УФ-излучение, а точнее, его часть, наиболее близкая по энергии к видимому излучению (УФ-А), проникает через все оптические элементы глаза — роговицу, хрусталик, водянистую влагу и стекловидное тело — и беспрепятственно доходит до сетчатки (рис. 2). Там свет поглощается и преобразуется в нервный импульс. Такая картина характерна для большинства воробьиных, голубей, колибри и многих других видов птиц [7–12].
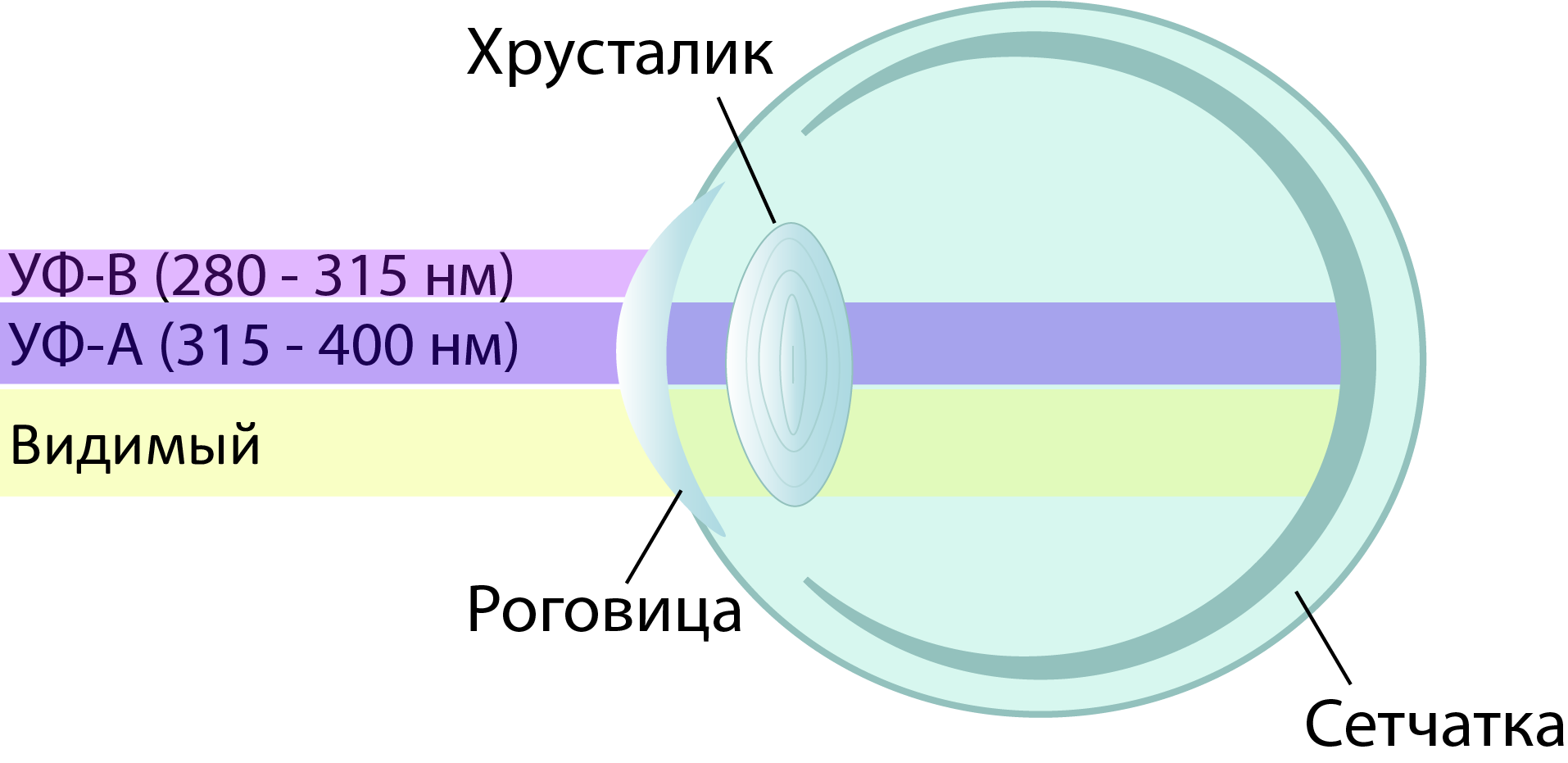
Рисунок 2. Схема глаза с прозрачными для УФ-А излучения оптическими элементами, характерная для многих видов птиц.
Восприятие УФ играет большую роль в жизни этих пернатых для коммуникации, поиска пищи, охоты, обнаружения хищника и т.д. Но реальность такова, что сетчатка дневных хищных птиц, как правило, настроена на не такой «жесткий» ультрафиолет: «ультрафиолетовые» колбочки заменяются «фиолетовыми» с максимумом восприятия около 400 нм (рис. 1в) [3]. Обратим внимание, что, хотя максимум и не попадает в УФ-область, ширина спектра всё же обеспечивает поглощение данного типа излучения колбочками. Кроме того, палочки тоже имеют достаточно широкий спектр восприятия: от 300 до 600 нм [6]. Выходит, что у многих птиц, в частности, дневных хищников, сетчатка всё-таки восприимчива к излучению, начиная с ближнего УФ-А диапазона. Но всем ли птицам так необходимо видеть УФ?
О хрусталике и хроматической аберрации

Рисунок 3. Разложение белого светового луча в цветной спектр при прохождении через стеклянную призму.
Мы уже поняли, что глаз птицы — почти идеальная оптическая система, но даже в ней существуют свои недостатки. Например, дисперсия света в хрусталике приводит к хроматической аберрации. Что это такое и почему это плохо? Хроматическая аберрация — это искажение изображения при прохождении света через преломляющие оптические элементы, вызванное зависимостью показателя преломления от длины волны излучения — дисперсией. Представим пучок белого света. Этот свет полихроматический, то есть состоит из множества лучей разных цветов и, соответственно, длин волн. Что происходит с таким светом, когда он проходит через прозрачную призму? Один поток раскладывается на цветовой спектр (рис. 3), потому что каждый лучик преломляется со своим коэффициентом преломления. Так выглядит наиболее яркое проявление дисперсии.
То же самое, только в меньших масштабах, происходит при прохождении света через собирающую линзу: цветные лучи будут сфокусированы на разном расстоянии от линзы, и световой поток будет собран не в точку, а в пятно конечного размера.
Чем хрусталик отличается от обычной собирающей линзы? Только своим биологическим происхождением. Поэтому, к сожалению, в хрусталике никуда не деться от дисперсии света. Свет, рассеянный на каком-либо предмете, не всегда белый, но, как правило, полихроматический. Поэтому после прохождения через все преломляющие элементы глаза изображение на сетчатке будет размытым и не совсем точным (рис. 3). И здесь в игру вступает тот самый ультрафиолет — высокоэнергетичный и коротковолновый. Показатель преломления УФ-излучения наибольший, по сравнению со всеми цветами видимого диапазона. Именно поэтому УФ вносит наибольший вклад в хроматические аберрации и размытие изображения на сетчатке. Это, конечно, относится только к тем животным, сетчатка которых воспринимает УФ, но таких в мире достаточно много, включая птиц, о которых мы и говорим.
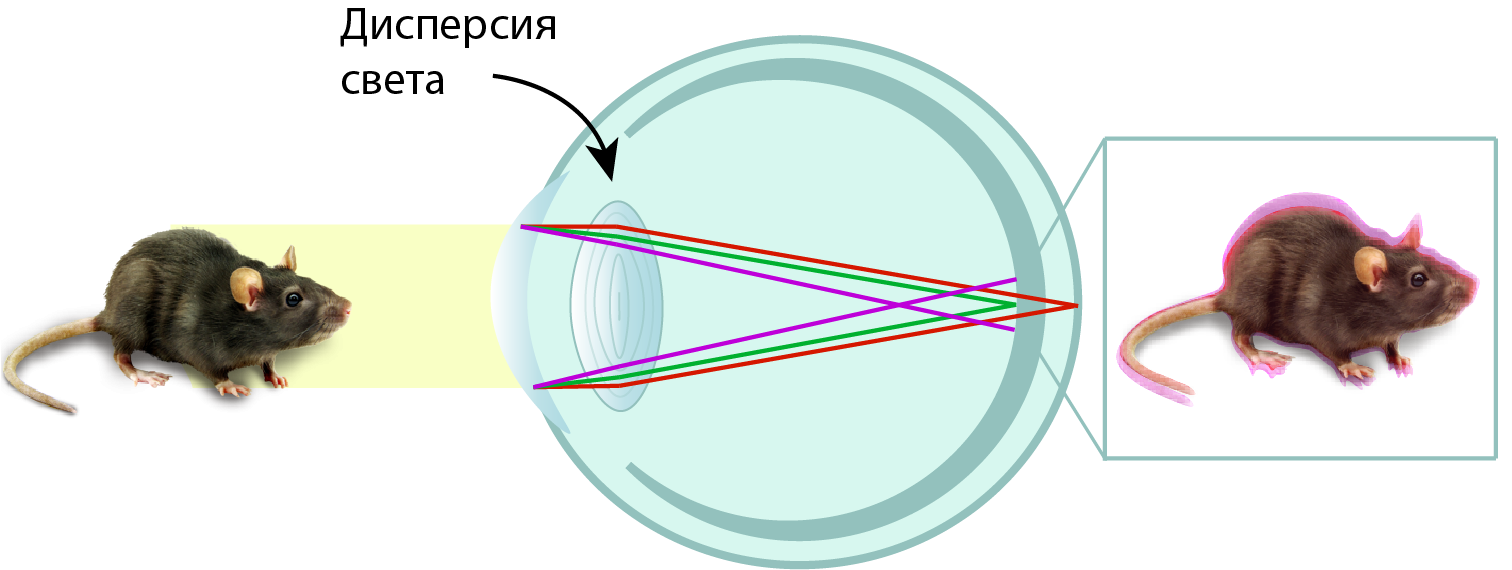
Рисунок 4. Проявление хроматических аберраций при формировании изображения мыши на сетчатке птиц с хрусталиком, прозрачным для УФ.

Рисунок 5. Повышение точности фотографии за счет компенсации хроматических аберраций в линзах объектива. Изображение до (сверху) и после (снизу) корректировки.
Инженеры, работающие с оптическими приборами, давно придумали, как бороться с паразитным явлением хроматической аберрации (рис. 5). В телескопах и микроскопах стандартная преломляющая линза дополняется специальным ахроматическим объективом, а в объективах фотоаппаратов в сочетании с линзами используются дифрагирующие элементы. Надевать на животных очки с ахроматическим линзами было бы по меньшей мере абсурдно, и природная инженерия по-своему решила задачу хроматических аберраций в зрительной системе.
Одно из решений — это использование мультифокального хрусталика [13]. В этом случае хрусталик состоит из концентрических зон с различной преломляющей силой, и фокусное расстояние каждой зоны настроено на свой спектральный диапазон. Однако, в силу той же самой дисперсии, четкое сфокусированное изображение будет формироваться на фоне расфокусированного света, прошедшего через «неправильные» зоны. «Красная» зона будет фокусировать красные лучи точно на сетчатке, а синие ближе, чем нужно, и т.п. (рис. 6а) [14]. Поэтому мультифокальный хрусталик вряд ли позволит различать мельчайшие детали на больших расстояниях, но увидеть четкие границы близко стоящих предметов точно поможет.
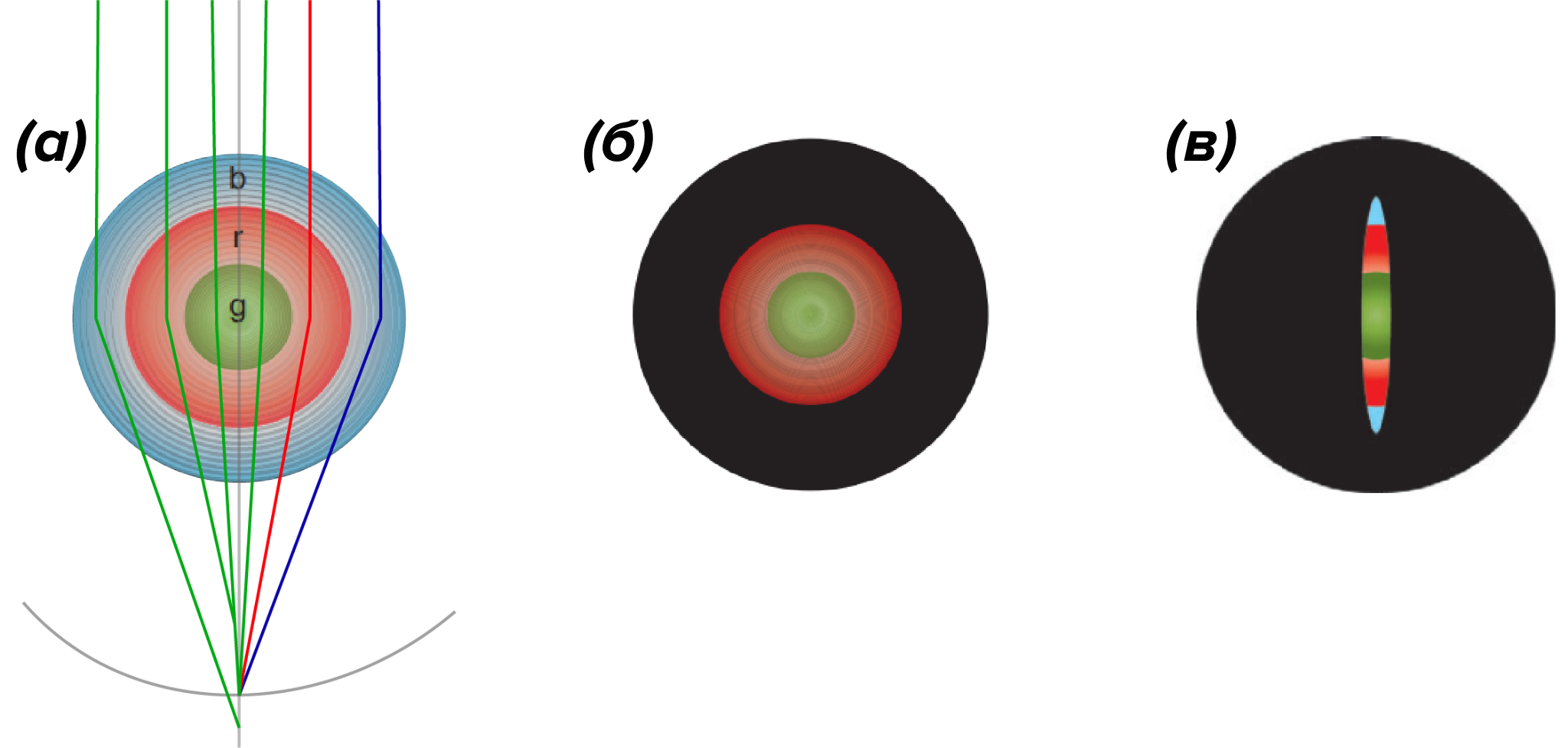
Рисунок 6. Схема функционирования мультифокального хрусталика, состоящего из трех концентрических зон, настроенных на синий, красный и зеленый цвета.
(а) — «красная» зона фокусирует зеленый свет ближе сетчатки, а «синяя» зона — дальше; таким образом формируется размытый фон на сетчатке.
(б) — в системе мультифокального хрусталика и круглого зрачка происходит перекрывание зон при сужении зрачка.
(в) — наиболее оптимальная система мультифокального хрусталика с щелевидным зрачком, когда даже при ярком освещении открыты все зоны.
Такое решение прекрасно работает с щелевидным зрачком, когда апертура охватывает все зоны хрусталика. Однако у многих животных, в частности, у попугаев, сов и многих других птиц, мультифокальный хрусталик идет в комплекте с круглым зрачком. Насколько выигрышна такая оптическая система — вопрос открытый, но ее откровенный недостаток — это потеря точности, когда при ярком освещении зрачок сужается, и радужка закрывает одну или даже несколько зон хрусталика.
Более кардинальное решение проблемы хроматических аберраций — усечение диапазона длин волн, доходящих до сетчатки. И здесь за примером далеко ходить не надо. Наш хрусталик полностью поглощает УФ-А излучение (да-да!), именно поэтому мы его не видим. А если бы видели (как, например, люди с афакией, то, скорее всего, страдали бы нечетким зрением, потому что привычное нам изображение дополнялось бы фоном несфокусированного УФ-излучения.
Поглощение в нашем хрусталике обеспечено его уникальным метаболомным составом, а именно — высоким содержанием кинуренина и ряда его производных [15–17]. Кинуренины — это низкомолекулярные соединения, поглощающие свет в УФ-А диапазоне и преобразующие его энергию в тепло без повреждения ткани (а это очень важно!) — так называемые молекулярные УФ-фильтры хрусталика. Для нашего глаза они крайне необходимы, так как защищают хрупкую сетчатку от фотоиндуцированных повреждений, а также не дают молекулам самого хрусталика (например, белкам, которых там около 65%), поглотить УФ и перейти в реакционно активные формы — или вовсе разрушиться.
Кроме человека, кинуренины были обнаружены также в хрусталиках приматов [18–20], и некоторых грызунов [16], [17]. Среди других животных, УФ-А поглощают хрусталики некоторых земноводных [21], змей [22] и рыб [23–26]. Как оказалось, и хрусталики некоторых птиц, включая таких хищников, как красный коршун, орлан-белохвост и ряд соколов, почти полностью поглощают ультрафиолет вплоть до 400 нм [3], [27], [28]. Вероятно, для этих птиц поглощение УФ — наиболее эффективный способ борьбы с хроматическими аберрациями, ведь на большом расстоянии даже малейшее искажение зрительной картинки может обернуться провалом в охоте. Представим, хищник выслеживает свою жертву, и хорошо, если это крупный кролик, а если мелкая мышь? И размер маленький, и лететь высоко нужно, а тут еще и хроматические аберрации мешают рассмотреть свою цель. А пигменты поглощают ультрафиолет, уменьшают хроматические аберрации и повышают остроту зрения хищника (рис. 7). Какова же молекулярная природа пигментации хрусталиков птиц — до сих пор являлось открытым вопросом. Исторически сложилось, что в область интересов Лаборатории протеомики и метаболомики МТЦ СО РАН входит биохимическое строение ткани хрусталика. Уверенно овладев методами метаболомного анализа и подробно изучив УФ-фильтры хрусталика человека, мы решили взяться и за птиц.
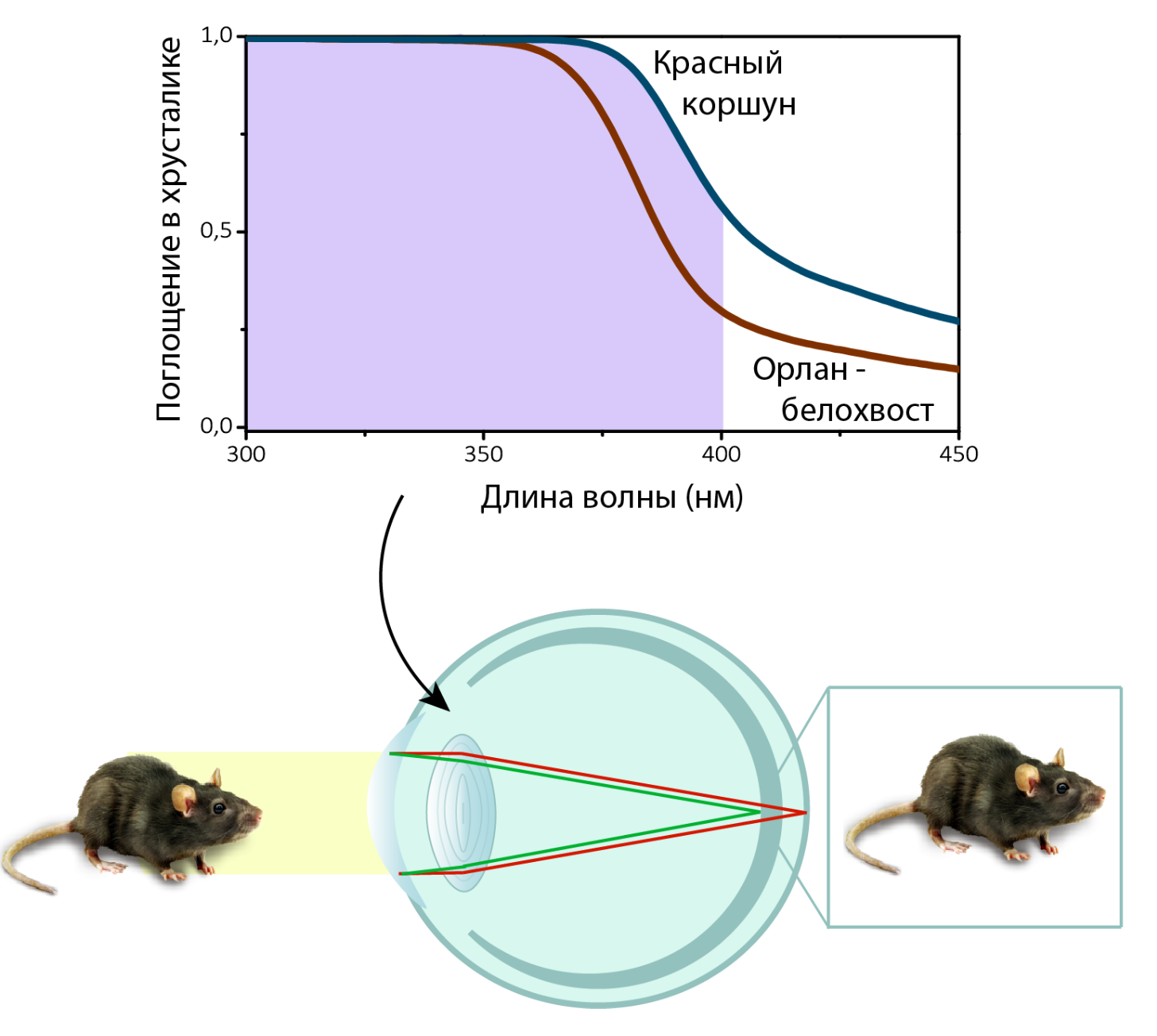
Рисунок 7. Компенсация хроматических аберраций при формировании изображения мыши на сетчатке птиц за счет поглощения УФ в хрусталике.
на основе данных из работы P. Olsson и др. [27]
Ищем, кто же виноват
Что же обеспечивает поглощение УФ-А света в хрусталике птиц и замешаны ли здесь кинуренины? В круг «подозреваемых» в первую очередь попадают метаболиты — низкомолекулярные соединения (условно, меньше 1,5 кДа), такие, как, например, аминокислоты, спирты, органические кислоты и многие другие. Стоит отметить, что хрусталик — весьма специфичная ткань, клетки которой лишены органелл (ядра, митохондрий, ЭПР) в угоду прозрачности. Это делает ткань инертной для белкового обмена (новое синтезировать нечем, поврежденное починить негде). При этом и эффективного транспорта белков из хрусталика не существует, поэтому все нежелательные модификации накапливаются в ткани с возрастом, что может привести к различным заболеваниям глаза. Следовательно, все «мобильные» функции (в частности, УФ-фильтрация) в хрусталике выполняются метаболитами, которые могут «накачиваться» и «откачиваться» из ткани хрусталика в «живой» периферийный слой хрусталика из эпителиальных клеток.
Мы начали «расследование» с того, что набрали лабораторный банк хрусталиков из 13 видов птиц (рис. 8). С точки зрения поиска УФ-фильтров, наибольший интерес представляют те виды птиц, которым крайне необходимо избавиться от хроматических аберраций и чей глаз подвержен наиболее сильному воздействию солнечного света. Выбор пал на хищные виды птиц, нуждающиеся в особо остром зрении для охоты, а также на водоплавающие виды, чей глаз постоянно сталкивается со множеством отраженных от поверхности воды ярких солнечных лучей. Мы выделили из хрусталиков водорастворимые метаболиты, очистив их от белков и липидов, а затем измерили концентрации 60 «мажоров» с использованием метода протонной ЯМР-спектроскопии [29].

Рисунок 8. В работе мы обратили внимание на хищные и водоплавающие виды птиц, чей глаз в наибольшей степени подвержен солнечному излучению и кому требуется точное зрение для охоты. Хрусталики этих 13 видов были исследованы на наличие УФ-фильтров.
Для некоторых видов птиц была обнаружена интересная особенность метаболома, которая сразу же бросилась в глаза. Это аномально высокая концентрация никотинамидадениндинуклеотида, или НАДH, обнаруженная в хрусталиках черного коршуна и всех поганковых птиц: от 400 до 1650 нмоль/г (рис. 9). В хрусталике коршуна НАДH в 400 раз больше, чем у голубя сизого, и почти в 120 раз больше, чем в хрусталиках чаек! Совпадение? Не думаем. Та же особенность встретилась и в хрусталике хищного обыкновенного канюка. Однако утверждать, что высокий уровень НАДH является атрибутом хрусталиков всех хищных и водоплавающих птиц, мы не можем. В хрусталиках болотного луня — родственника коршуна из семейства ястребиных — и другого хищника — серого сорокопута — содержание НАДH настолько низкое, что его даже не удалось измерить (рис. 9). А в хрусталиках чаек трех разных видов уровень НАДH хоть и ненулевой, но находится в пределах от 10 до 40 нмоль на грамм ткани, что на порядок меньше, чем у тех же водоплавающих поганковых.
В хрусталиках с высоким уровнем НАДН было обнаружено соотношение НАД+/НАДН <1 (исключение — только обыкновенный канюк). Это тоже крайне необычный показатель, так как в нормальной концентрация НАД+ в хрусталике в единицы или даже в десятки раз превосходит концентрацию НАДH. Это только подчеркивает уникальность наблюдаемой картины в хрусталиках коршуна и поганковых птиц.
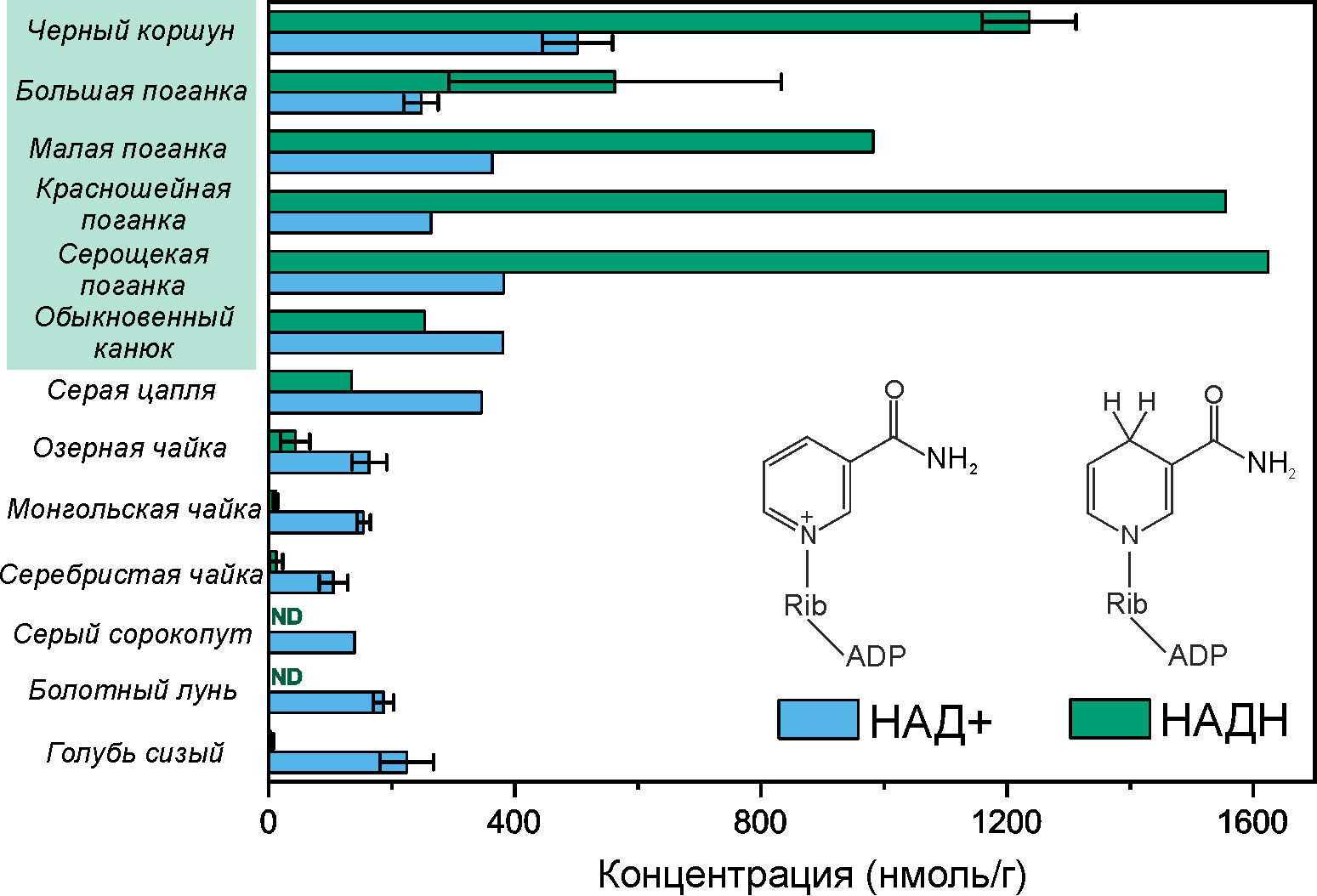
Рисунок 9. В работе были измерены концентрации основных метаболитов хрусталиков 13 видов птиц. Здесь представлено содержание НАДН и НАД+ — наиболее интересных метаболитов в хрусталиках черного коршуна, обыкновенного канюка и поганковых птиц.
ND — не обнаружен.
Самое время ответить на вопрос: зачем же НАДH накапливается в хрусталиках птиц? НАДН является достойным кандидатом в УФ-фильтры. Здесь стоит вспомнить характерный для данной молекулы спектр оптического поглощения, в котором имеется интенсивная полоса с максимумом на 340 нм. Кроме того, вещества в хрусталике, скажем, коршуна, достаточно много, чтобы полностью поглотить весь УФ, попадающий в зрачок.
Теперь вглядимся в спектр поглощения метаболитов хрусталика коршуна (рис. 10). Что-то он напоминает, не правда ли? Да! Поглощение в хрусталике коршуна имеет максимум именно на 340 нм и почти полностью обеспечивается присутствующим в его составе НАДH. Хрусталики голубя сизого и луня болотного с очень низкой концентрацией НАДH являются полностью прозрачными для излучения с длиной волны более 300 нм, что также видно на рис. 10. Можем сделать вывод, что НАДH — это главный хромофор в УФ-А диапазоне в хрусталике черного коршуна, а также поганковых птиц, обыкновенного канюка и серой цапли.
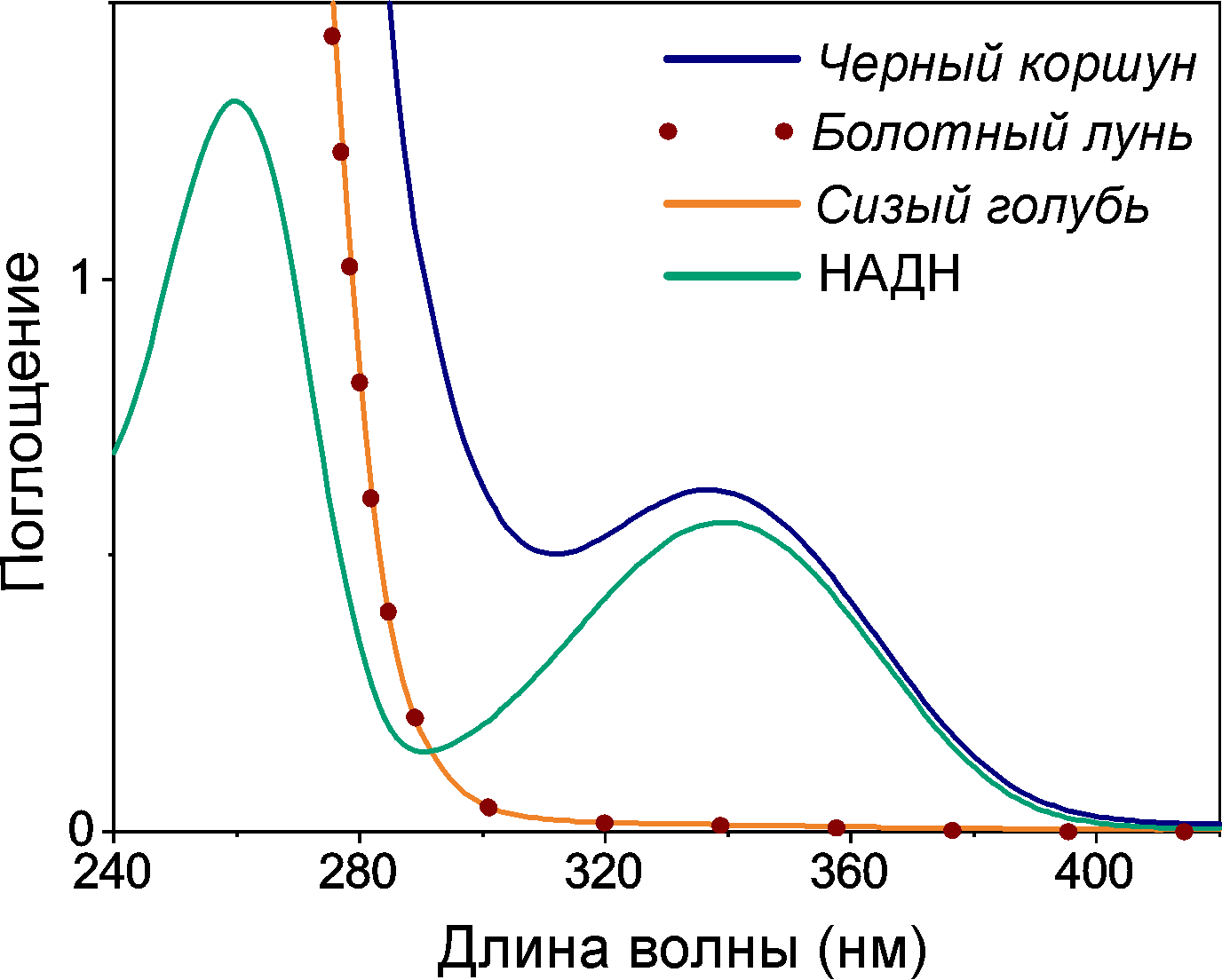
Рисунок 10. Спектр оптического поглощения водных растворов метаболитов хрусталика черного коршуна имеет максимум поглощения на 340 нм. При этом спектральная полоса в УФ-А диапазоне почти совпадает со спектром НАДН в соответствующей концентрации. Водные растворы метаболитов хрусталиков болотного луня не имеют поглощения в УФ-А, что видно на приведенных спектрах.
НАДH в хрусталике напрямую взаимодействует с ультрафиолетовым излучением. Такое взаимодействие должно быть безопасно для окружающих молекул и для клеток хрусталика в целом, а потому должен выполняться ряд требований. Первое — это фотостабильность: после поглощения света НАДH не должен распадаться на фрагменты. Второе — это низкий выход флуоресценции и других излучательных каналов распада возбужденного состояния, ведь лишняя засветка портит изображение. Третье — это низкий выход реакционно-активных форм молекулы (возбужденных триплетных состояний, радикалов и т.п.), которые очень охотно реагируют с окружающими белками, образуя «тяжеловесные» нежелательные продукты. НАДH удовлетворяет каждому из этих пунктов и даже ничуть не хуже, чем основной УФ-фильтр хрусталика человека — кинуренин. Коэффициент поглощения НАДH в максимуме выше [31], [32] (рис. 11), квантовый выход флуоресценции не превосходит 2% [33], [34], НАДH вовсе не образует триплетных состояний и является крайне фотостабильным соединением. Другими словами, НАДH проявил себя в такой неожиданной роли, как УФ-фильтр, и весьма эффективно выполняет свои функции.
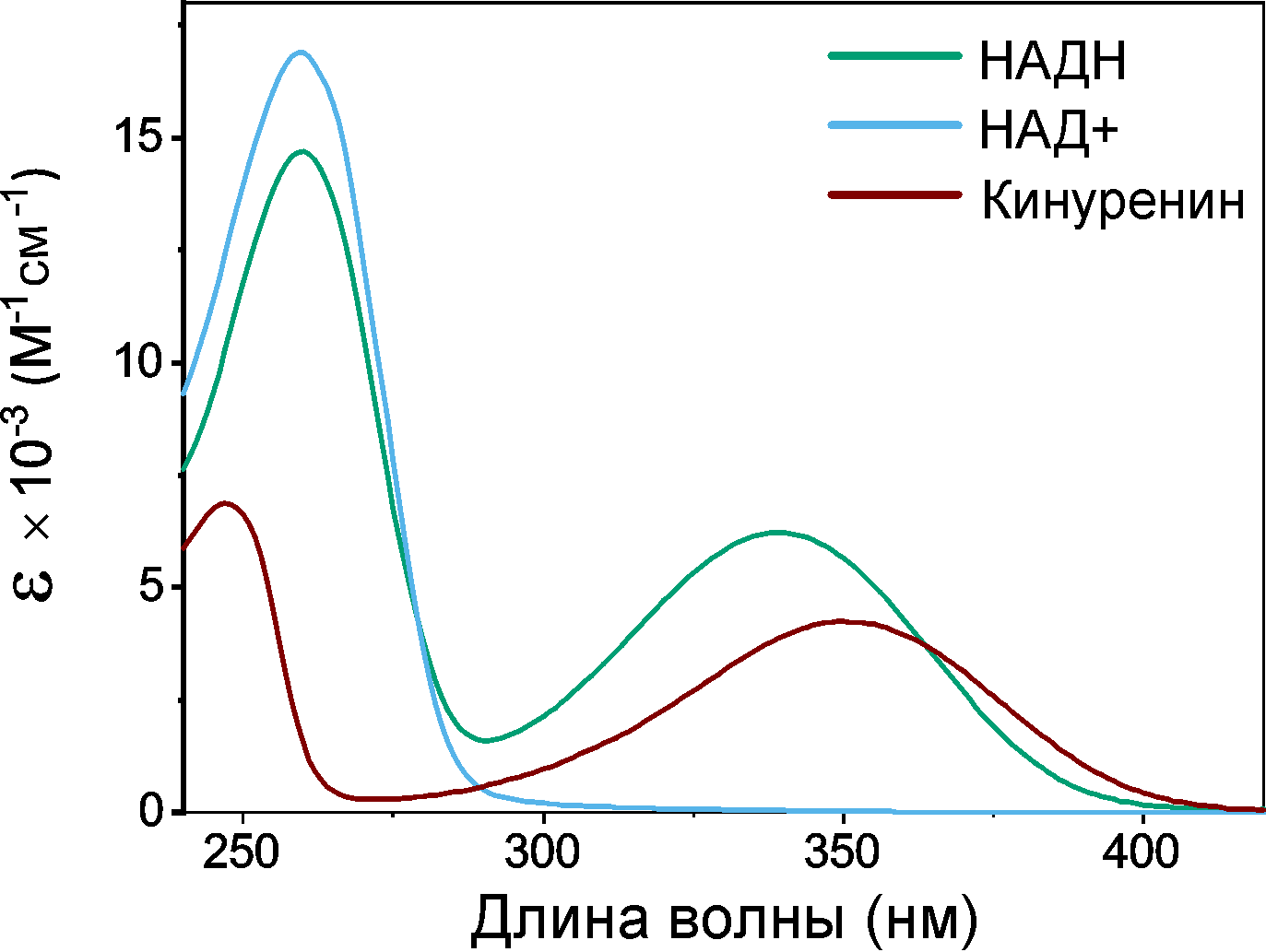
Рисунок 11. Спектры поглощения основных УФ-фильтров хрусталиков птиц (НАДН) и человека (кинуренин) обладают интенсивным поглощением в УФ-А диапазоне — в отличие от НАД+, поглощающего УФ только до 300 нм.
Теперь может возникнуть вполне резонный вопрос: поглощая УФ в хрусталиках птиц, не уменьшает ли НАДH чувствительность глаза? И здесь стоит обратиться к спектральному диапазону, на который реагируют коротковолновые колбочки и палочки сетчатки. Можно заметить, что он лишь частично перекрывается со спектром поглощения НАДH: УФ-фильтр сужает диапазон реакции фоторецепторов в УФ, оставляя чувствительность в максимумах нетронутой (рис. 12).
И, в конце концов, можно сделать два уверенных предположения насчет роли НАДH в хрусталике птиц. Во-первых, поглощая ультрафиолет, метаболит защищает сетчатку от избыточного воздействия опасного и высокоэнергетического излучения, высокий уровень которого присутствует в атмосфере — особенно в верхних слоях. Во-вторых, НАДH снижает те самые хроматические аберрации, что в связке с анатомическими особенностями глаза обеспечивает невероятную точность зрения птиц.
Не оставим без внимания хищных — болотного луня и серого сорокопута. Неужели они не такие уж хищные? Конечно же, нет! Что касается сорокопута, то он сильно отличается от остальных изученных в работе хищников по таксономии; это-то и является ключевым фактором. По всей видимости, сорокопут из отряда воробьинообразных сильно нуждается в ультрафиолетовом зрении, как и свои сородичи, и не готов от него так легко отказаться. А может быть, сорокопутовые еще не прошли своего эволюционного пути «хищников», поскольку являются единственным семейством из воробьинообразных, перешедших на мясную диету. В случае болотного луня отсутствие УФ-фильтра в хрусталике, вероятно, можно объяснить необычным стилем охоты. Лунь не выслеживает жертв с большой высоты, как делает его близкий родственник — коршун; данная птица поступает более хитро: предпочитает притаиться в кустах и болотных зарослях и подкараулить добычу. Возможно, из-за стиля «близкой охоты» глаз луня не приспособился избавляться от лишнего УФ-излучения.
Заключение
Итак, с целью поиска УФ-фильтров птиц мы впервые изучили метаболомный состав 13 видов птиц, включая дневных хищников и водоплавающих. Очень интересно, что хрусталики некоторых из них содержат аномально высокую концентрацию НАДH — важнейшего для живых клеток и хорошо известного кофермента. В дополнение к роли незаменимого участника метаболических циклов клетки была открыта необычная роль НАДH как УФ-фильтра хрусталика птиц. НАДH поглощает свет вплоть до 400 нм (в отличие от своей окисленной формы НАД+), при этом остается стабильным и не образует нежелательные молекулярные формы. Неспроста именно птицы обладают таким мощным УФ-фильтром: их глаз подвержен повышенному воздействию ультрафиолета, а зрение для них является важнейшим органом для жизнедеятельности. НАДH защищает сетчатку от фотоиндуцированных повреждений и снижает хроматические аберрации, что может заметно сказываться на остроте зрения птиц. Возможно, именно присутствие НАДH в хрусталике делает зрение коршуна настолько точным, что ему ничего не мешает разглядеть мышь с расстояния в несколько десятков метров.
Работа была выполнена при поддержке Российского научного фонда (Грант № 22-23-00021).
Литература
- Michael P. Jones, Kenneth E. Pierce, Daniel Ward. (2007). Avian Vision: A Review of Form and Function with Special Consideration to Birds of Prey. Journal of Exotic Pet Medicine. 16, 69-87;
- S G. Kiama, J. N. Maina, J. Bhattacharjee, K. D. Weyrauch. (2001). Functional morphology of the pecten oculi in the nocturnal spotted eagle owl ( Bubo bubo africanus ), and the diurnal black kite ( Milvus migrans ) and domestic fowl ( Gallus gallus var. domesticus ): a comparative study. Journal of Zoology. 254, 521-528;
- Mindaugas Mitkus, Simon Potier, Graham R. Martin, Olivier Duriez, Almut Kelber. (2018) Raptor Vision;
- Разные глаза — разные возможности;
- Особенности механизмов зрения птиц;
- J.K. Bowmaker, L.A. Heath, S.E. Wilkie, D.M. Hunt. (1997). Visual pigments and oil droplets from six classes of photoreceptor in the retinas of birds. Vision Research. 37, 2183-2194;
- Innes C. Cuthill, Julian C. Partridge, Andrew T.D. Bennett, Stuart C. Church, Nathan S. Hart, Sarah Hunt. (2000). Ultraviolet Vision in Birds. Advances in the Study of Behavior. 159-214;
- J. Rajchard. (2009). Ultraviolet (UV) light perception by birds: a review. Veterinarni Medicina. 54, 351-359;
- Timothy H. Goldsmith. (1980). Hummingbirds See Near Ultraviolet Light. Science. 207, 786-788;
- E.J. Maier, J.K. Bowmaker. (1993). Colour vision in the passeriform bird, Leiothrix lutea: correlation of visual pigment absorbance and oil droplet transmission with spectral sensitivity. J Comp Physiol A. 172, 295-301;
- Remo Probst, Mihaela Pavlicev, Jussi Viitala. (2002). UV reflecting vole scent marks attract a passerine, the great grey shrike Lanius excubitor. Journal of Avian Biology. 33, 437-440;
- Olle Håstad, Emma Ernstdotter, Anders Ödeen. (2005). Ultraviolet vision and foraging in dip and plunge diving birds. Biol. Lett.. 1, 306-309;
- Olle E. Lind, Almut Kelber, Ronald H. H. Kröger. (2008). Multifocal optical systems and pupil dynamics in birds. Journal of Experimental Biology. 211, 2752-2758;
- Tim Malmström, Ronald H. H. Kröger. (2006). Pupil shapes and lens optics in the eyes of terrestrial vertebrates. Journal of Experimental Biology. 209, 18-25;
- Andrew M. Wood, Roger J.W. Truscott. (1993). UV Filters in Human Lenses: Tryptophan Catabolism. Experimental Eye Research. 56, 317-325;
- Boettner E.A. Wolter J.R. (1962). Transmission of the Ocular Media. Investigative Ophthalmology & Visual Science. 1, 776–783;
- Andrew M. Wood, Roger J.W. Truscott. (1994). Ultraviolet filter compounds in human lenses: 3-hydroxykynurenine glucoside formation. Vision Research. 34, 1369-1374;
- Elizabeth R. Gaillard, John Merriam, Lei Zheng, James Dillon. (2011). Transmission of Light to the Young Primate Retina: Possible Implications for the Formation of Lipofuscin. Photochemistry and Photobiology. 87, 18-21;
- R. H. Douglas, G. Jeffery. (2014). The spectral transmission of ocular media suggests ultraviolet sensitivity is widespread among mammals. Proc. R. Soc. B.. 281, 20132995;
- G. F. Cooper, J. G. Robson. (1969). The yellow colour of the lens of man and other primates. The Journal of Physiology. 203, 411-417;
- Carola A. M. Yovanovich, Michele E. R. Pierotti, Almut Kelber, Gabriel Jorgewich-Cohen, Roberto Ibáñez, Taran Grant. (2020). Lens transmittance shapes ultraviolet sensitivity in the eyes of frogs from diverse ecological and phylogenetic backgrounds. Proc. R. Soc. B.. 287, 20192253;
- Bruno F. Simões, Filipa L. Sampaio, Ronald H. Douglas, Ullasa Kodandaramaiah, Nicholas R. Casewell, et. al.. (2016). Visual Pigments, Ocular Filters and the Evolution of Snake Vision. Mol Biol Evol. 33, 2483-2495;
- Walter C. Dunlap, David McB. Williams, Bruce E. Chalker, Anastazia T. Banaszak. (1989). Biochemical photoadaptation in vision: U.V.-absorbing pigments in fish eye tissues. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. 93, 601-607;
- A. Thorpe, R.H. Douglas. (1993). Spectral transmission and short-wave absorbing pigments in the fish lens—II. Effects of age. Vision Research. 33, 301-307;
- A. Thorpe, R.H. Douglas, R.J.W. Truscott. (1993). Spectral transmission and short-wave absorbing pigments in the fish lens—I. Phylogenetic distribution and identity. Vision Research. 33, 289-300;
- Andrea Thorpe, Roger J.W. Truscott, Ron H. Douglas. (1992). Kynurenine identified as the short-wave absorbing lens pigment in the deep-sea fish Stylephorus chordatus. Experimental Eye Research. 55, 53-57;
- Peter Olsson, Olle Lind, Mindaugas Mitkus, Kaspar Delhey, Almut Kelber. (2021). Lens and cornea limit UV vision of birds – a phylogenetic perspective. Journal of Experimental Biology. 224;
- Simon Potier, Mindaugas Mitkus, Almut Kelber. (2020). Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126;
- Olga A. Snytnikova, Anastasiya A. Khlichkina, Renad Z. Sagdeev, Yuri P. Tsentalovich. (2019). Evaluation of sample preparation protocols for quantitative NMR-based metabolomics. Metabolomics. 15;
- Nataliya A. Osik, Ekaterina A. Zelentsova, Kirill A. Sharshov, Yuri P. Tsentalovich. (2022). Nicotinamide adenine dinucleotide reduced (NADH) is a natural UV filter of certain bird lens. Sci Rep. 12;
- R B McComb, L W Bond, R W Burnett, R C Keech, G N Bowers. (1976). Determination of the molar absorptivity of NADH.. Clinical Chemistry. 22, 141-150;
- Yuri P. Tsentalovich, Olga A. Snytnikova, Peter S. Sherin, Malcolm D. E. Forbes. (2005). Photochemistry of Kynurenine, a Tryptophan Metabolite: Properties of the Triplet State. J. Phys. Chem. A. 109, 3565-3568;
- T. Gordon Scott, Richard D. Spencer, Nelson J. Leonard, Gregorio Weber. (1970). Synthetic spectroscopic models related to coenzymes and base pairs. V. Emission properties of NADH. Studies of fluorescence lifetimes and quantum efficiencies of NADH, AcPyADH, [reduced acetylpyridineadenine dinucleotide] and simplified synthetic models. J. Am. Chem. Soc.. 92, 687-695;
- A. J. W. G. Visser, A. van Hoek. (1981). THE FLUORESCENCE DECAY OF REDUCED NICOTINAMIDES IN AQUEOUS SOLUTION AFTER EXCITATION WITH A UV-MODE LOCKED Ar ION LASER. Photochem Photobiol. 33, 35-40.