Пневмококк и его инфекции
06 августа 2021
Пневмококк и его инфекции
- 13087
- 0
- 4
От пневмококка нас защищают две разные вакцины. Остается выбрать, чем привиться. Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Когда мы слышим слово «пневмококк», первое, что приходит на ум, — это пневмония. К сожалению, эта бактерия куда опаснее, и в некоторых случаях может стать причиной менингита и даже сепсиса, уносящего жизни за считанные часы. Спастись от пневмококка и детям, и взрослым помогают пневмококковые вакцины. Давайте разберемся, как они это делают — в продолжении нашего спецпроекта о вакцинации.
Вакцинация

Генеральный партнер спецпроекта — Zimin Foundation.
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Для соблюдения объективности мы пригласили стать кураторами спецпроекта Александра Соломоновича Апта — доктора биологических наук, профессора МГУ, заведующего лабораторией иммуногенетики Института туберкулеза (Москва), — Сусанну Михайловну Харит — доктора медицинских наук, профессора, руководителя отдела профилактики НИИ детских инфекций (Санкт-Петербург), — Сергея Александровича Бутрия — педиатра, автора блога «Заметки детского врача», — а также Рузанну Игоревну Аванесян — кандидата медицинских наук, педиатра клиники «Фэнтези».
Вакцины против пневмококка включены в бóльшую часть календарей вакцинации, и сделано это не просто так. Пневмококки — крайне распространенные бактерии: их можно назвать главной причиной детской пневмонии, особенно у детей младше пяти лет [1]. У взрослых 10–30% внебольничных пневмоний связаны именно с этими бактериями. Но борьба с пневмококком ведется не только из-за его способности вызывать инфекцию в легких. Например, в США каждый год регистрируется около 2000 случаев пневмококкового менингита, а в России пневмококк ответственен за 25% всех случаев менингита бактериального происхождения (подробнее о менингите читайте в нашей статье «Менингит: многоликий убийца» [2]). Кроме того, пневмококк — частая причина отитов и может вызывать осложнения при заражении гриппом, поскольку именно он нередко становится причиной вторичной инфекции.
Внебольничной называют пневмонию, которая возникла в повседневных для человека условиях, а внутрибольничной — ту, которая развилась после посещения больницы или во время пребывания в стационаре.
Неудивительно, что с конца XIX века изучению пневмококка уделялось крайне пристальное внимание, ведь связанные с ним инфекции и тогда уносили жизни сотен тысяч людей по всему миру. В 1881 году почти одновременно выделить и вырастить в лабораторных условиях этот микроорганизм удалось американскому врачу Джорджу Миллеру Штернбергу и всем известному французу Луи Пастеру (рис. 1). А примерно через 10 лет стало ясно, что пневмококк является главной причиной тяжелой формы воспаления легких — крупозной пневмонии (подробнее о ней — в главе о пневмококковых инфекциях). Эти знания стали толчком к изобретению вакцин против пневмококка.
Что мы знаем о пневмококке
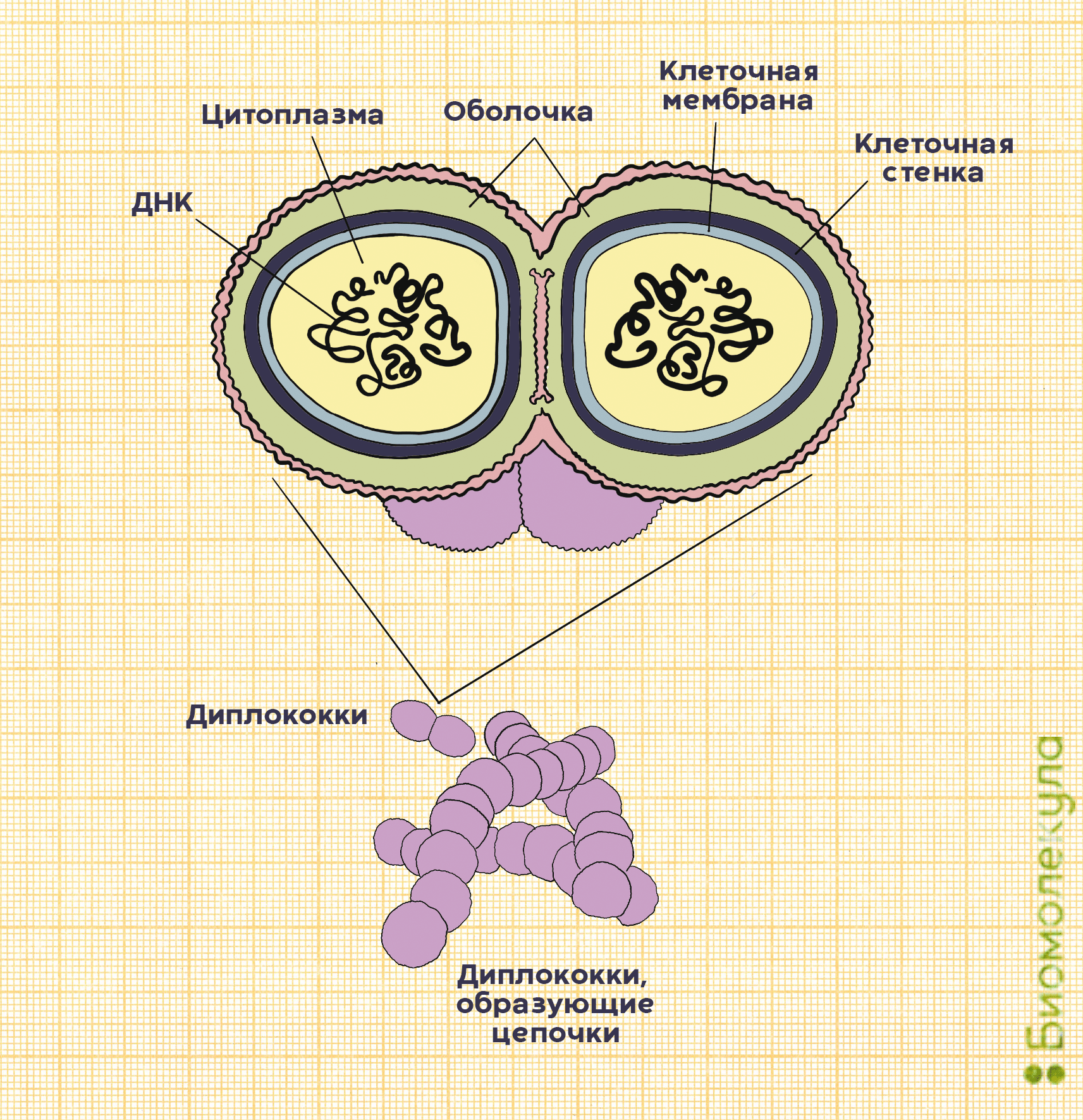
Пневмококки — это грамположительные аэробные бактерии вида Streptococсus pneumoniae. Они имеют шаровидную форму, что понятно из названия: «кокк» на древнегреческом означает «зерно». Корень «пневмо» здесь тоже не случаен, ведь именно пневмококки ответственны за развитие у детей тяжелых инфекций, часто заканчивающихся воспалением легких, — пневмоний.
На самом деле в каждой бактерии S. pneumoniae целых два кокка, объединенных полисахаридной оболочкой, защищающей микроорганизм от атаки иммунной системы (рис. 2). Так как пневмококк относится к стрептококкам, он обладает типичными свойствами для этого рода бактерий. Например, отдельные пневмококки способны собираться в цепочки.
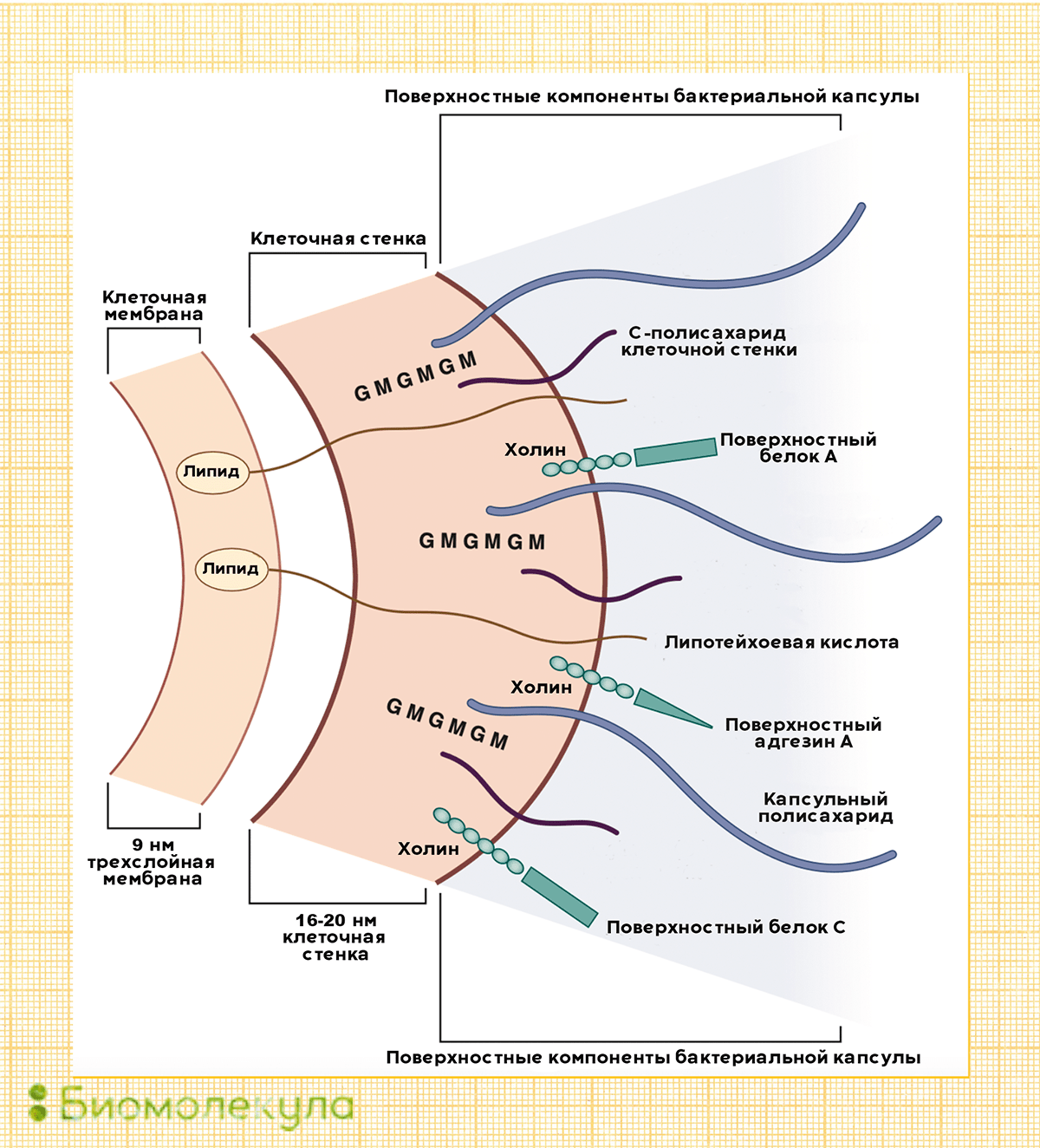
Основные факторы вирулентности пневмококка, влияющие на его способность вызывать заболевания, — это полисахариды оболочки. Именно в ответ на них у переболевшего или вакцинированного человека начинают вырабатываться антитела.
В зависимости от того, какие полисахариды входят в состав бактериальной капсулы, различают разные серотипы пневмококка. Всего насчитывается около 100 серотипов, но из них только некоторые наиболее часто (в 72% случаев) становятся причиной детских инвазивных инфекций [3]. Среди таких особенно вредоносных пневмококков можно выделить типы: 1, 3, 4, 5, 6А, 19А, 6В, 14, 19F, 23F, 18C и 9V.
Из-за того, что полисахаридные составы разных серотипов довольно сильно различаются, антипневмококковый иммунитет обычно эффективен по отношению только к отдельным вариантам бактерий. То есть если ребенок перенес инфекцию, вызванную бактерией с серотипом 1, он всё еще беззащитен перед остальными пневмококками. Однако иногда говорят и о перекрестном иммунитете для некоторых серотипов, например, 6А и 6В. Тогда иммунитет против одного защищает и от другого.
Как можно заразиться пневмококком
Пневмококки распространены в большинстве регионов мира. Основной путь их передачи — воздушно-капельный. С кашлем, чиханием или во время разговора бактерии изо рта человека-носителя попадают в воздух вместе с крохотными капельками слюны, а затем оседают на слизистых других людей (рис. 3).
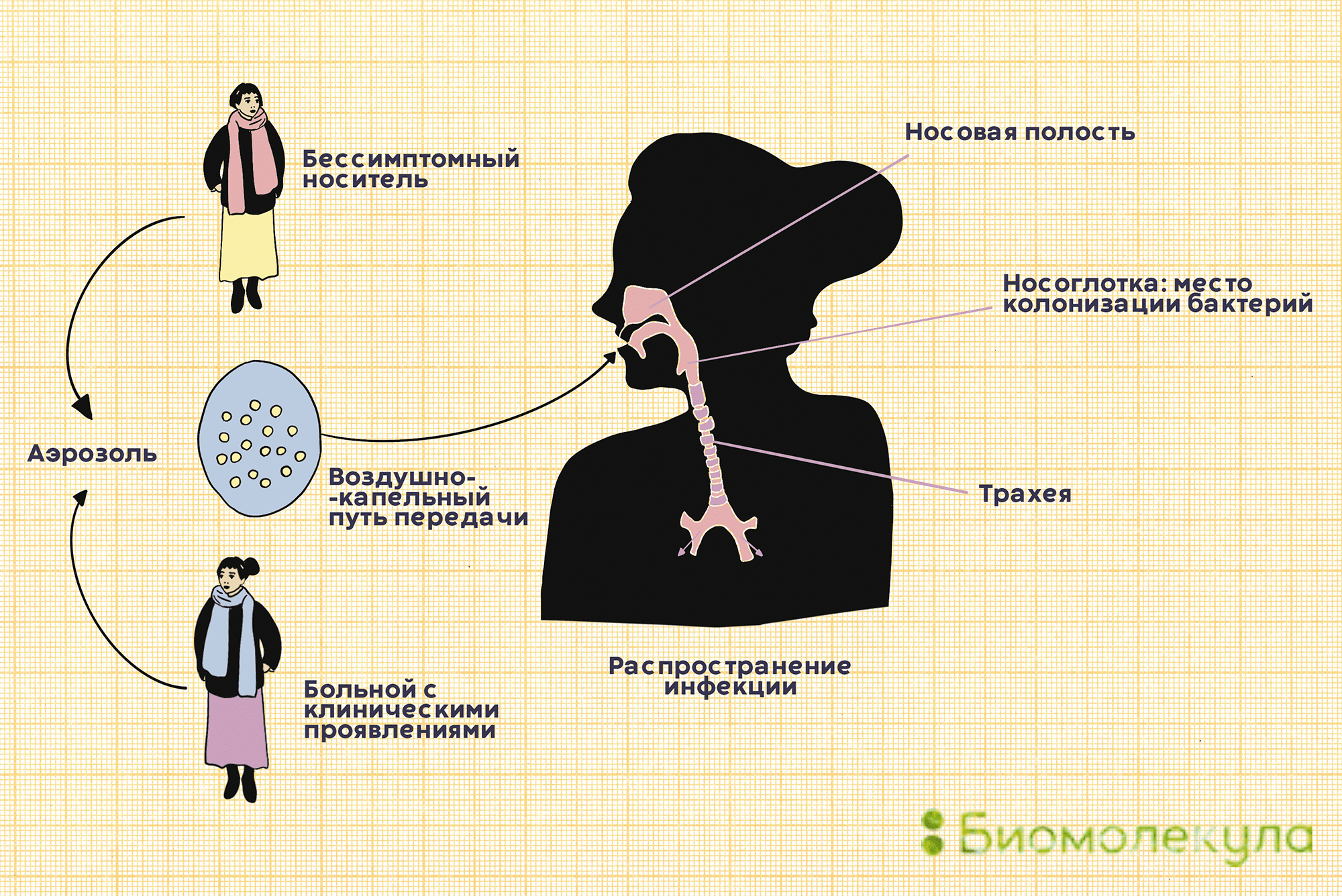
Рисунок 3. Пневмококк передается от человека к человеку воздушно-капельным путем. Заразиться можно как от больного с клиническими проявлениями, так и от бессимптомного носителя.
рисунок Ирины Ефремовой по презентации Sanofi Pasteur
Часто пневмококки обитают в нашей носоглотке, не причиняя никакого вреда. Считается, что с бактерией сталкиваются до 70% всех здоровых взрослых. Однако иногда они становятся причиной серьезной болезни.
Какими бывают пневмококковые инфекции
Пневмококки могут стать причиной тяжелых инвазивных заболеваний (табл. 1):
- пневмонии;
- менингита;
- септицемии (сепсиса);
- острого отита
и др.
Закрепившись на поверхности слизистых оболочек верхних дыхательных путей, бактерии попадают в легкие и кровоток, иногда добираясь даже до мозга (рис. 4) [4].
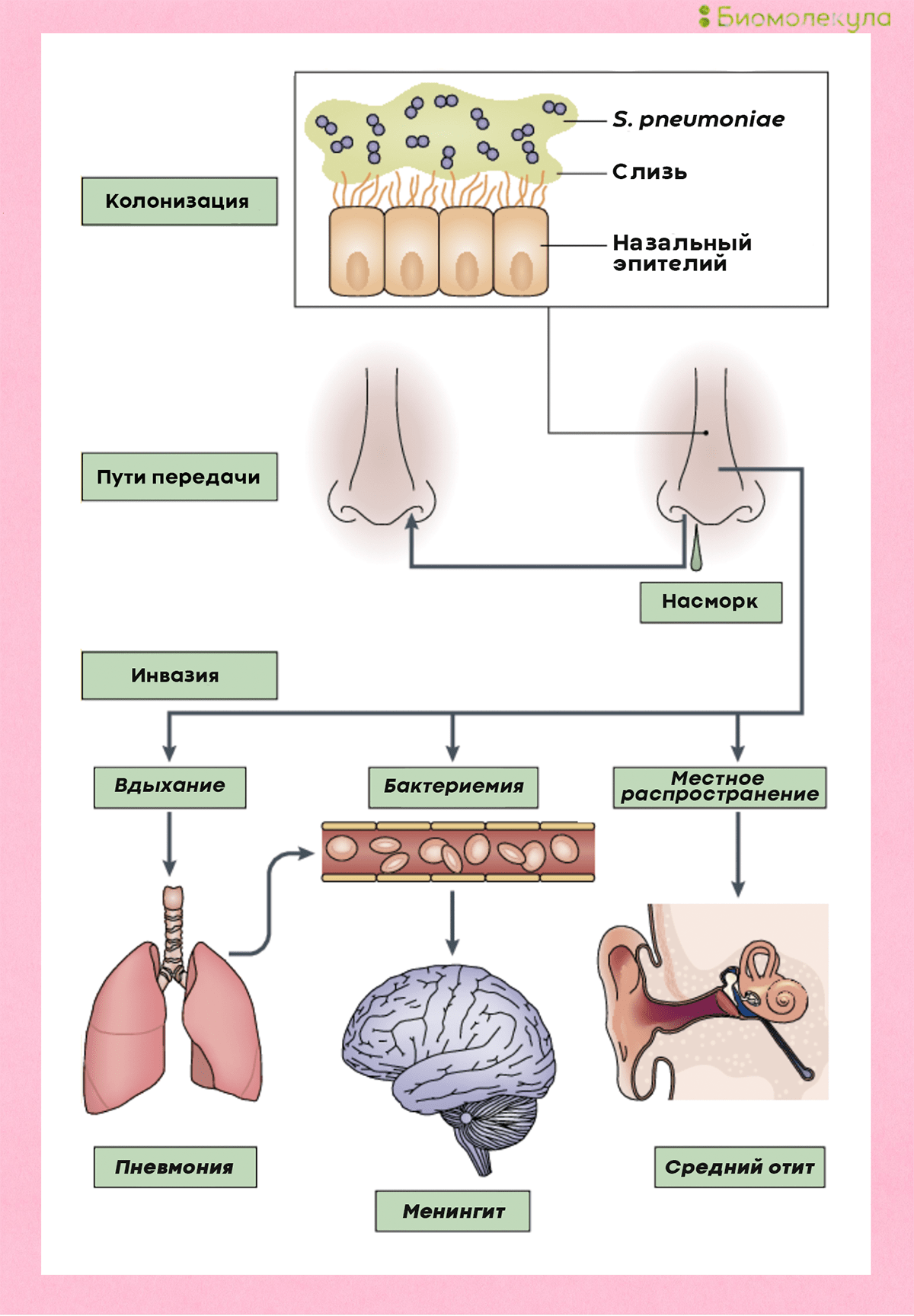
Рисунок 4. Развитие пневмококковой инфекции. Попадая в организм при вдыхании, бактерии колонизируют слизистую носа, откуда могут проникать в кровь, вызывая менингит, а также становиться причиной воспаления легких и отита.
[4], рисунок адаптирован
У больного регистрируют пневмококковую инфекцию, если бактерию удается выявить в обычно стерильном биологическом материале — крови, моче, мокроте, спинномозговой жидкости — в зависимости от того, где наблюдается воспаление (рис. 5).
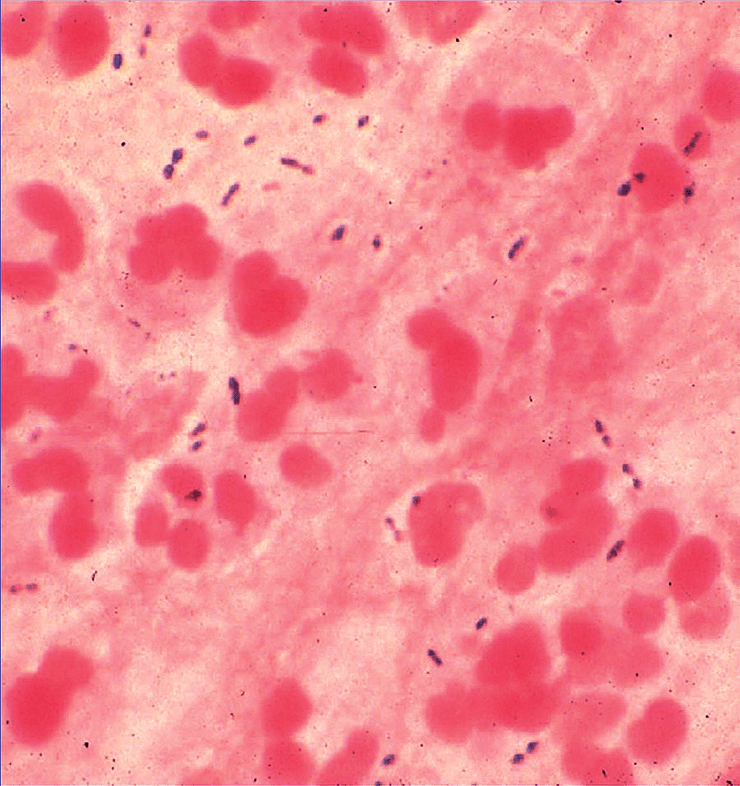
Рисунок 5. Образец мокроты больного с установленной пневмококковой инфекцией. Наряду с полиморфоядерными клетками четко видны немного удлиненные кокки, по отдельности и парами. Окраска по Граму, увеличение 440×.
| Заболевание | Какие органы поражает | Симптомы | Осложнения |
|---|---|---|---|
| Пневмония | Легкие | Кашель с выделением гнойной мокроты, высокая температура, боли в районе груди, одышка | Дыхательная и сердечная недостаточности, абсцесс легкого |
| Острый отит | Воспаление среднего уха — барабанной полости, слуховой трубы | Заложенность, шум и боль в ухе, повышение температуры тела, нарушение равновесия. Боль может быть очень сильной, отдавать в шею, челюсть, область глаз. В случае гнойного отита после прорыва гноя через барабанную перепонку — выделение гноя из уха | Инфекция внутреннего уха, при распространении инфекции на кости и в полость черепа — мастоидит, менингит, абсцесс мозга |
| Синусит | Воспаление слизистой оболочки околоносовых пазух и полости носа | Боль в районе переносицы или над глазом, головная боль, насморк, заложенность носа, чихание, повышение температуры тела | Конъюнктивит, неврит зрительного нерва, тромбоз сосудов головного мозга, менингит, абсцесс, сепсис |
| Менингит | Оболочки головного и спинного мозга | Сильная головная боль, высокая температура, напряженность затылочных мышц, чувствительность к свету и звуку, спутанность сознания, сонливость, раздражительность | Глухота или неполная потеря слуха (у 50% заболевших), эпилепсия, гидроцефалия, нарушения умственного развития |
| Сепсис | Системное воспаление, вызванное попаданием инфекции в кровь и ткани организма | Высокая или пониженная температура, учащенное сердцебиение и дыхание, снижение давления, рвота, невозможность есть, отказ органов, спутанность сознания | Артрит, эндокардит, полиорганная недостаточность, смертность среди детей может доходить до 20%, среди пожилых — до 30–40% |
Отдельного внимания здесь заслуживает пневмония — воспаление легких, — которой и прославились пневмококки. Помимо очаговых форм воспаления, эти бактерии способны вызывать и тяжелые формы болезни (например, крупозную пневмонию, летальность при которой колеблется в пределах 1–9%).
Крупозную пневмонию, сопровождающуюся сужением гортани, можно узнать по ее характерному течению. Болезнь длится 7–11 дней, и на ее первых стадиях в альвеолах пораженных легких скапливается много жидкости. Такая пневмония часто имеет масштабный характер и переносится очень тяжело. Часто ей сопутствует плеврит — воспаление плевральной оболочки, окружающей легкие [5]. При крупозной пневмонии температура тела повышается до 40 °C, а одышка становится заметной уже в первые сутки болезни. На 3–4 день появляется сильный кашель с отделением «ржавой» мокроты. Если поражено всё легкое целиком, во время кашля наблюдается колющая боль в груди.
Отит чаще всего встречается у детей, особенно до двух лет, и может рецидивировать. Пневмококки являются причиной заболевания примерно в 30–40% всех случаев. Болезнь может протекать тяжело, с очень сильной болью и временной потерей слуха, но прогноз, как правило, благоприятный. Тем не менее распространение инфекции за пределы среднего уха очень опасно, ведь уши находятся близко к мозгу. Если пневмококк попадет в полость черепа, может развиться менингит — воспаление оболочек головного мозга, о котором мы уже рассказывали в статье «Менингит: многоликий убийца» [2].
Синусит — воспаление носовых пазух — само по себе очень распространенное заболевание: в России им ежегодно болеют порядка 10 млн человек. При этом основной причиной синуситов являются вирусы. Бактерии вызывают всего около 10% всех случаев болезни [6]. Если синусит лечить, он не причинит особого вреда, но игнорирование гайморита и других его форм может приводить к неприятным последствиям — например, к воспалению зрительного нерва и ухудшению зрения.
Как лечат пневмококковые инфекции
Основное средство для лечения пневмококковых инфекций — антимикробные препараты: бета-лактамные антибиотики, макролиды или фторхинолоны [7]. Чтобы ускорить выздоровление, основное лечение проводят в комплексе с симптоматическим. Например, при пневмонии могут помочь муколитические средства, разжижающие мокроту. Другие полезные здесь препараты — жаропонижающие, противовоспалительные и обезболивающие.
После антибиотиков больным рекомендуют принимать пре- и пробиотики для того, чтобы поддержать микробиом кишечника [8], который антибактериальные препараты могут угнетать.
Перед тем, как назначить лечение, определяют, к каким именно препаратам чувствителен выделенный у пациента возбудитель. Микробная антибиотикорезистентность сегодня является одной из основных проблем при лечении бактериальных инфекций, в том числе пневмоний .
На «Биомолекуле» есть отдельный спецпроект, посвященный устойчивости к антибиотикам у бактерий и современным способам борьбы с этим опасным явлением.
Бремя пневмококка
Мировая заболеваемость пневмококковыми инфекциями велика, хотя с приходом нового коронавируса SARS-CoV-2 в 2020 году доля вирусных пневмоний, в общем, заметно выросла. Тем не менее, по приблизительным оценкам, в 2000–2015 годах пневмококк был причиной пневмонии у детей до пяти лет в 34% случаев [10]. А в 2018 году в США, где ведется тщательный учет всех случаев инвазивных пневмококковых инфекций, заболеваемость среди детей до пяти лет составила 7 на 100 тыс. населения. Не так много, если сравнивать с цифрами до начала широкого распространения пневмококковых вакцин: 235 случаев на 100 тысяч детей в возрасте 6–11 месяцев и 35,2 случая на 100 тысяч детей от 2 до 4 лет [11].
Если говорить о распространенности тех или иных серотипов, она постоянно меняется, и не последнюю роль здесь также играет вакцинация. В результате широкого охвата вакцинами на первый план выходят серотипы, которые не входят в состав профилактических препаратов. И со временем эта проблема может вылиться в снижение действенности программ по иммунизации как таковых [12]. В ответ на эту угрозу есть решение — разработка новых вакцин с дополнительными антигенами в составе. Правда, процесс этот не быстрый.
Основными носителями инфекции и раньше, и сейчас остаются дети. На распространенность болезни среди них сильно влияют условия жизни в регионах: в бедных, густонаселенных странах она может достигать 85% [13]. Сразу после детей следуют пожилые люди. Среди факторов риска, увеличивающих вероятность развития болезни, можно также выделить:
- сахарный диабет;
- хронические заболевания легких, сердца, печени или почек;
- онкологические заболевания;
- утечку спинномозговой жидкости;
- серповидно-клеточную анемию;
- иммунодефицитные состояния, в том числе ВИЧ-инфекцию, а также иммуносупрессивную терапию;
- трансплантацию органов или костного мозга, наличие слуховых имплантов;
- отсутствие селезенки — основного иммунного органа организма;
- алкоголизм, курение;
- длительное нахождение в стационаре.
Обычно вспышки пневмококка можно назвать спорадическими (иными словами, они возникают на ограниченной территории и довольно быстро затухают). Типичными местами распространения болезни являются тесные, сплоченные коллективы — например, детские сады, школы, закрытые поселения, дома престарелых. Всё же иногда пневмококк громко заявляет о себе — тогда мы наблюдаем заметные всплески заболеваемости, такие, как в Африканском менингитном поясе , где то и дело регистрируются многочисленные случаи воспаления оболочек головного мозга, вызванного инфекцией пневмококком серотипа 1.
Про менингитный пояс мы рассказывали в статье «Менингит: многоликий убийца» [2].
Вакцины против пневмококковой инфекции
Первые попытки массовой вакцинации против пневмококка предприняли в начале XX века; тогда для иммунизации взрослых мужчин в США и Африке пробовали использовать вакцины с цельными убитыми клетками пневмококков. Эти препараты показали достаточно высокую эффективность против пневмонии: 50–80% [14], [15].
Современные пневмококковые вакцины имеют с теми препаратами мало общего. Они не содержат в себе целых бактерий: в качестве антигенов в них используются фрагменты клеток возбудителя, а именно — полисахариды оболочки пневмококка. Такие вакцины называются субъединичными .
Подробнее о том, как изготавливают субъединичные вакцины, можно узнать из статьи «Разработка вакцин: чем и как имитировать болезнь?» [16].
Препараты против пневмококков делят на два типа: полисахаридные (полисахариды Streptococcus pneumoniae и вспомогательные вещества) и конъюгированные (пневмококковые конъюгаты — полисахарид + белок и вспомогательные вещества).
Полисахаридные вакцины
В 1920-е годы ученые, работавшие в США, показали, что гуморальный иммунитет к пневмококку вырабатывается в ответ на его полисахаридную капсулу [17]. Вскоре полисахариды этой капсулы были выделены и очищены для использования в качестве вакцины [18], и последующие исследования эффективности таких препаратов, содержащих вещества от пневмококков 3–6 штаммов, показали неплохие результаты: 59–89%, а для некоторых серотипов — еще больше [19], [20]. К сожалению, несмотря на действенность, вакцины еще долго не получали признания: поскольку пневмококк считался легко излечимой инфекцией, врачи уповали на всемогущий пенициллин. Только в 1977 году в США лицензировали 14-валентную полисахаридную вакцину для детей от двух лет и старше, на смену которой в 1983 году пришла нынешняя 23-валентная формула. Она защищает от 23 серотипов возбудителя: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F и 33F. Именно эти серотипы ответственны за 90% всех инфекций, связанных с пневмококками .
Со временем, с распространением конъюгированных вакцин и ростом охвата иммунизацией, этот показатель для штаммов полисахаридной 23-валентной вакцины заметно снизился [21].
Сегодня полисахаридные вакцины производят компании «Мерк» и «Санофи Пастер», на рынке Китая представлены собственные локальные вакцины, производимые Институтом биологических продуктов Чэнду и компанией Walvax Biotechnology. Все они включают бактериальные полисахариды, растворенные в изотоническом солевом растворе с добавлением фенола или тимеросала в качестве консерванта.
Главный недостаток полисахаридных вакцин — относительно быстрое снижение напряженности иммунитета, который вырабатывается после прививки. Ревакцинацию такими препаратами нужно проводить каждые 3–5 лет. Второй значимый минус их использования — низкая эффективность при вакцинации маленьких детей до двух лет, которые составляют основной резервуар инфекции.
Сегодня полисахаридные вакцины рекомендованы для иммунизации пожилых людей старше 65 лет, а также детей старше 2 лет и взрослых из группы риска.
Конъюгированные вакцины
Конъюгированные вакцины отличаются от полисахаридных тем, что полисахаридные антигены в них связаны с белком-носителем. Такие препараты обеспечивают более длительную защиту от инфекции (до 7 лет, и в течение 15 лет сглаживают течение болезни [22]), но включают антигены меньшего числа серотипов пневмококка — от 7 до 13 в сравнении с 23 серотипами в полисахаридной вакцине .
В настоящее время активно ведутся испытания новых конъюгированных пневмококковых вакцин, которые будут защищать от 20 серотипов и больше. В США и ЕС уже запущен процесс регистрации 20-валентной вакцины для взрослых от 18 лет и старше от компании Pfizer.
Вторым недостатком конъюгированных вакцин, помимо небольшого количества серотипов, является их относительно высокая цена из-за сложности технологии получения. Вопрос стоимости в этом случае стоит остро, ведь многие страны с низким уровнем доходов просто не могут позволить себе включить эти препараты в национальные календари иммунизации.
В мире наиболее популярна 13-валентная конъюгированная вакцина «Превенар 13» (Pfizer), в составе которой антигены 13 серотипов возбудителя: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F и 23F. Ее рекомендуют детям от 2 месяцев до 6 лет, пожилым людям старше 65 лет и взрослым из групп риска по пневмококку. В Китае компания Walvax Biotechnology производит собственный 13-валентный препарат. Для Африки и Азии не так давно разработали отдельную 10-валентную вакцину «Пневмосил», которая включает наиболее распространенные в этой части света штаммы пневмококка и отличается меньшей стоимостью, что позволяет широко применять ее в регионах с повышенным риском смертности от пневмонии.
Широкое внедрение конъюгированных вакцин против пневмококка началось в 2000 году, когда была введена 7-валентная вакцина (использование знакомой нам 13-валентной пневмококковой вакцины началось на 10 лет позже). Во многом толчком к введению новых препаратов послужили прекрасные результаты исследований эффективности вакцин против гемофильной палочки в 90-х годах, созданной по тому же принципу.
Эффективность конъюгированных вакцин в борьбе с инвазивными заболеваниями подтверждена множеством исследований [24], [25]. Например, в 2014 году было показано, что после введения широкой вакцинации против пневмококка конъюгированными 7- и 13-валентной вакцинами в южной части Израиля число случаев отита у детей младше двух лет сократилось на 60% [26]. При этом высеваемость штаммов, содержащихся в 13-валентной вакцине, заменившей 7-валентную, у детей со средним отитом сократилось на 85%. В США, в свою очередь, широкий охват вакцинами привел к практическому исчезновению вакцинных серотипов (рис. 6).
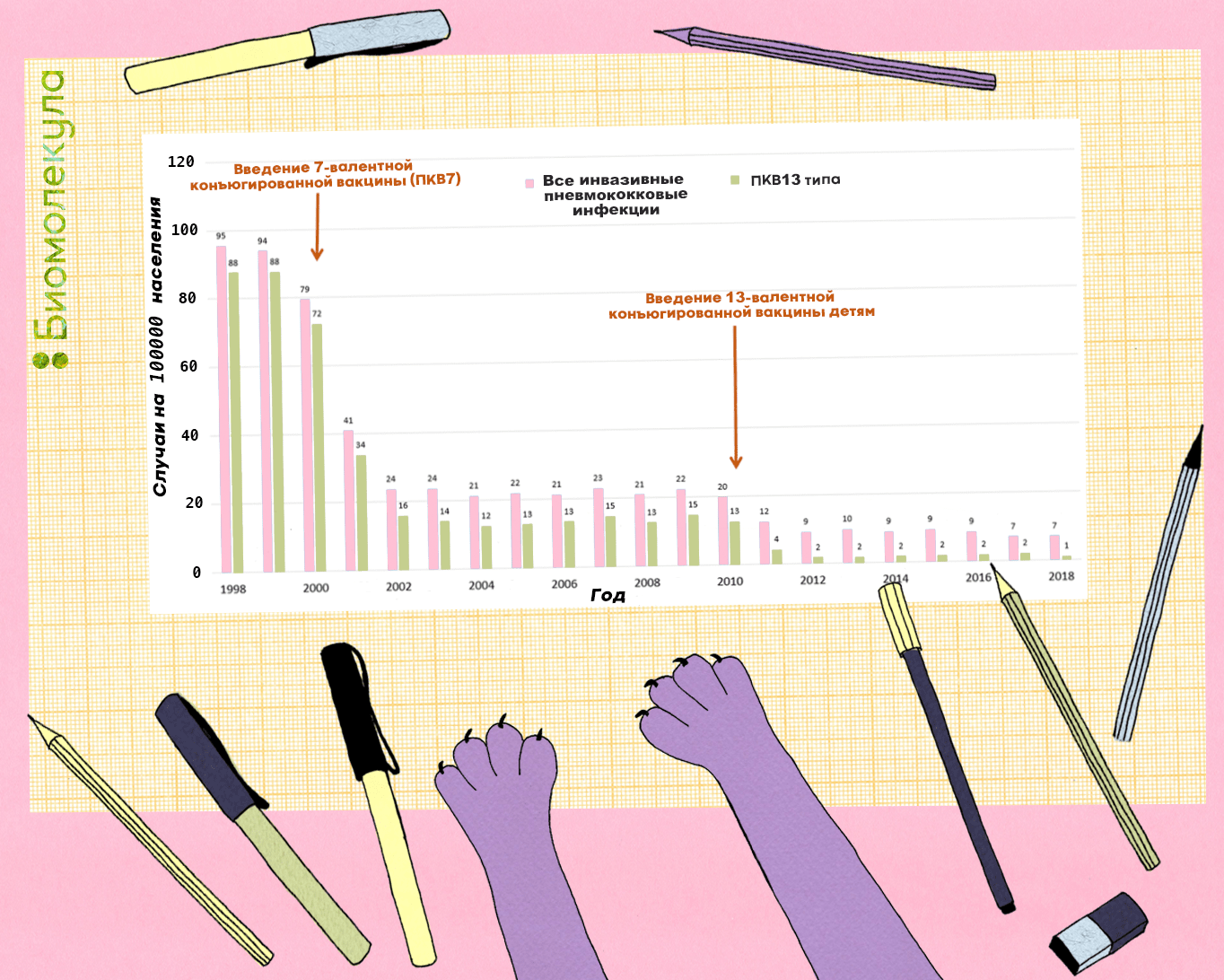
Рисунок 6. Распространенность инвазивных инфекций, вызванных пневмококком, среди детей до пяти лет в США, 1998–2018 гг. После введения 13-валентной конъюгированной вакцины число случаев детских инвазивных инфекций, ассоциированных с вакцинными штаммами, снизилось до 1 на 100 тыс. населения.
рисунок Ирины Ефремовой по Pneumococcal Disease
На сегодняшний день именно конъюгированные вакцины являются препаратами выбора при иммунизации детей до пяти лет с целью защиты от пневмококка. Их можно вводить, начиная с двухмесячного возраста, и они надежно защищают от самых агрессивных штаммов. Да, полисахаридные вакцины содержат антигены целых 23 серотипов возбудителя, но часть из них относительно безобидные, а потому эффективность прививок и длительность получаемого после конъюгированных вакцин иммунитета в данном случае перевешивают.
Отметим, что, чтобы достичь максимального эффекта после прививки конъюгированной вакциной, прививать детей следует до встречи с возбудителем, а не тогда, когда уже наблюдаются рецидивирующие отиты и синуситы бактериального происхождения. Вторичная вакцинация после спонтанного инфицирования гораздо менее эффективна, чем первичная (примерно на 20–30%) [27].
Как вакцинируют от пневмококка в мире
И детей, и взрослых во всем мире принято вакцинировать конъюгированными вакцинами. Полисахаридные вакцины применяют только для вакцинации детей и взрослых из групп риска, то есть тех, кому особенно важна защита от максимального числа штаммов пневмококка. В этом случае предпочтительно получить сперва конъюгированную вакцину, а затем, спустя какое-то время, — полисахаридную. Последняя вводится однократно.
Споры о том, какой график детской вакцинации лучше, пока всё еще ведутся. Так, в США «золотой стандарт» включает 3 дозы конъюгированной вакцины в младенчестве, как правило, с интервалом 4–8 недель, и одну ревакцинацию на втором году жизни. Графики 3+0 (3 дозы с интервалом 4 недели) и 2+1 (2 дозы с интервалом 8 недель, ревакцинация в 9–18 месяцев), рекомендованные ВОЗ, также считаются эффективными в странах с масштабными программами вакцинации [28]. Однако в некоторых исследованиях в странах с низким охватом вакцинами эти графики не позволяли сформировать надежный, длительный иммунитет ко всем вакцинным штаммам [29].
О коллективном иммунитете и важности широкого охвата вакцинацией мы рассказали в статье «Вакцинация перед школой: гайд для родителей» [30].
Спорным также остается вопрос возможности совмещения «Превенара 13» и «Менактры» — вакцины против менингококка. В США вводить эти вакцины в один день строго не рекомендуется детям с удаленной или плохо функционирующей селезенкой, а также детям с ВИЧ. Это связано с возможным снижением эффективности иммунизации против пневмококковой инфекции. В то же время в Австралии эти вакцины советуют вообще не совмещать.
Догоняющая вакцинация
Догоняющая вакцинация должна проводиться как можно раньше, так как риски осложнений после пневмококковой инфекции для маленьких детей выше.
В США, если первая доза вакцины была введена ребенку до возраста 12 месяцев, вторую дозу вводят с минимальным интервалом 4 недели. Интервал между 2 и 3 дозами зависит от срока получения второй дозы. Если она была получена до 7-месячного возраста, третью прививку делают через 4 недели, если позднее — через 8 недель (табл. 2).
| Возраст начала вакцинации | 1 доза | 2 доза | 3 доза | 4 доза |
|---|---|---|---|---|
| До 1 года | Как можно раньше после достижения ребенком 2 мес. | Не ранее, чем через 4 недели после 1 дозы | Не ранее, чем через 4 недели после 2 дозы, если она была введена до достижения возраста 7 мес. Не ранее, чем через 8 недель после 2 дозы, если она была введена в возрасте старше 7 мес. Вводится по достижении 12 мес. Не нужна, если вторая доза получена после 2 лет. |
Не ранее, чем через 8 недель после третьей дозы, показана детям от 1 до 5 лет, получившим все 3 предыдущие дозы до достижения возраста 12 месяцев, а также детям из групп риска |
| 1–2 года | Как можно раньше | Не ранее, чем через 8 недель после 1 дозы | — | — |
| Старше 2 лет | Как можно раньше до возраста 5 лет | — | — | — |
Если ребенок получает первую дозу вакцины поздно (после 12 месяцев), количество инъекций снижается до двух с минимальным интервалом 8 недель; если вакцинация начата после двух лет — потребуется всего одна доза вакцины. С одной стороны, это может показаться заманчивым. Зачем делать три прививки, если можно подождать и сделать всего одну? Однако здесь важно понимать, что чем младше ребенок, тем сложнее ему бороться с пневмококком, а значит, вакцина нужна как раз самым маленьким — детям до года.
Вакцинация против пневмококка в России
В России Национальным календарем профилактических прививок (НКПП) предусмотрена трехкратная вакцинация конъюгированными пневмококковыми вакцинами детей в возрасте 2, 4,5 и 15 месяцев. Из таких вакцин в РФ зарегистрированы «Превенар 13» и «Синфлорикс», получить их бесплатно в нашей стране стало возможным с 2014 года (табл. 3).
| Вакцина | Производитель | Характеристика | Показания к применению |
|---|---|---|---|
| Полисахаридные конъюгированные | |||
| «Превенар 13» | НПО «Петровакс Фарм», Россия (в рамках сотрудничества с компанией Pfizer, США) | 13 серотипов: 1, 3, 4, 5, 6А, 6B, 7F, 9V, 14, 18C, 19A,19F, 23F | Дети от 2 месяцев, взрослые из групп риска |
| «Синфлорикс» | GlaxoSmithKline Biologicals, Бельгия | 10 серотипов: 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F | Дети от 6 недель до 5 лет |
| Полисахаридные | |||
| «Пневмо 23» | Sanofi Pasteur, Франция | 23 серотипа: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F | Дети от 2 лет и взрослые из групп риска |
| «Пневмовакс 23» | Merck, США | ||
Если детские прививки не получены вовремя, ФМБА России также рекомендует пройти догоняющую вакцинацию по графику, представленному в таблице 4.
| Возраст начала догоняющей вакцинации | 1 доза | 2 доза | 3 доза |
|---|---|---|---|
| До 1 года | Как можно раньше | Не ранее, чем через 8 недель после 1 дозы | Не ранее возраста 15 мес., минимальный интервал между 2 и 3 дозой — 4 месяца |
| 1–2 года (для не привитых или привитых однократно) | Как можно раньше | Не ранее, чем через 8 недель после 1 дозы. | — |
| 2–5 лет (для не привитых или привитых однократно) | Как можно раньше | — | — |
| Дети старше 5 лет и взрослые из групп риска: не привитые ранее, страдающие иммунодефицитом | Как можно раньше | — | — |
Для детей старше двух лет и взрослых с иммунодефицитными состояниями дополнительно рекомендуется получение четырех доз 23-валентной полисахаридной вакцины с интервалами 3, 5 и еще 5 лет. Первую дозу следует вводить через 1 год после окончания основной вакцинации. Для непривитых взрослых из других групп риска (хронические заболевания сердца, легких, печени и почек) после введения конъюгированной вакцины предлагается однократная вакцинация полисахаридной вакциной. Для здоровых детей старше 5 лет догоняющая вакцинация против пневмококка не предусмотрена.
По эпидемическим показателям в России против пневмококка прививают:
- призывников на военную службу;
- пожилых людей старше 60 лет, страдающих хроническими заболеваниями легких;
- пожилых людей, проживающих в организациях социального обслуживания (домах престарелых).
Вакцинацию пожилых людей проводят, опираясь на их предшествующий опыт вакцинации. Если человек не прививался или не знает, какие прививки делал, его вакцинируют конъюгированной вакциной, а затем — полисахаридной с интервалом 6–12 месяцев. Если ранее человек уже прошел вацинацию полисахаридным препаратом, ему рекомендуют ввести «Превенар 13» с минимальным интервалом 12 месяцев после предыдущей дозы и затем, при необходимости, проходить ревакцинацию 1 раз в 5 лет (рис. 7).
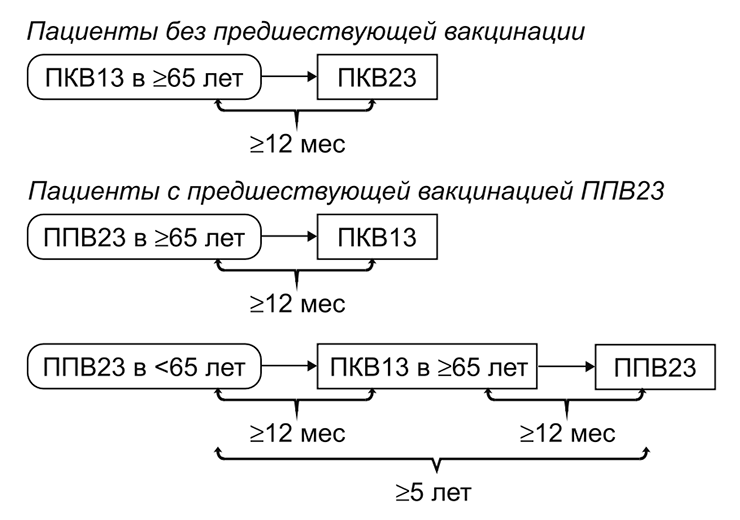
Рисунок 7. Рекомендации по вакцинации людей старшего возраста против пневмококка. ПКВ — пневмококковая конъюгированная вакцина; ППВ — пневмококковая полисахаридная вакцина.
Безопасность пневмококковых вакцин
Безопасность пневмококковых вакцин подробнее всего изучена для детей до двух лет, как у наиболее широко вакцинируемой группы населения. Самые частые реакции на конъюгированные вакцины — это покраснение, уплотнение и отек в месте инъекции. Кроме того, довольно часто после прививки наблюдаются:
- повышение температуры тела до 39 °C (20–30%);
- раздражительность, плаксивость (около 80%);
- сонливость или ухудшение сна (50–70%);
- снижение аппетита (45–50%).
Другие, более редкие побочные эффекты включают крапивницу, сыпь, потерю чувствительности (гипотонические-гипореактивные эпизоды), посинение кожи (цианоз), гранулоцитопению, респираторные симптомы, желудочно-кишечные расстройства и аллергические реакции [31]. Кроме того, при одновременном введении пневмококковых и противогриппозных вакцин может быть увеличен риск фебрильных судорог [32].
С полисахаридными вакцинами дела обстоят примерно также, однако здесь нужно учитывать, что получают такие вакцины в основном не маленькие дети, а взрослые и пожилые люди. Наиболее часто после прививки 23-валентной вакциной наблюдаются: боль, покраснение и уплотнение в месте укола, головная боль, озноб, утомляемость и боль в мышцах [33]. Такие симптомы могут сохраняться 2–3 дня после появления. Лихорадка наблюдается менее чем у 3% привитых. Известны также редкие случаи анафилактической реакции на вакцину у детей [34].
Как видно, пневмококковые вакцины отличаются довольно высокой реактогенностью (АКДС, о которой мы уже рассказывали [23], всё равно остается чемпионом по побочным эффектам), но все нежелательные явления после них временные и проходят сами через 1–3 дня без вмешательства врачей. Чтобы снять неприятные симптомы после прививки, специалисты иногда могут назначать противовоспалительные препараты (например, ибупрофен).
Противопоказания к вакцинации
Среди противопоказаний к вакцинации против пневмококка:
- острые инфекционные заболевания и обострение хронических заболеваний;
- негативные реакции на предыдущие дозы вакцины;
- беременность и лактация (кроме случаев, когда высок риск инфицирования);
- противопневмококковая вакцинация в последние 3 года (для полисахаридных вакцин).
Важно отметить, что прививать против пневмококка, начиная с двухмесячного возраста, можно недоношенных детей, детей с врожденной инфекцией, с гемолитической болезнью новорожденных, ВИЧ-инфекцией и других детей, имеющих по состоянию здоровья отвод от вакцинации БЦЖ. Все эти дети относятся к группе риска, а это значит, что заражение пневмококком у них чаще, чем у других, способно привести к летальному исходу.
Что ждет нас в будущем?
Несмотря на то, что современные вакцины успешно справляются с пневмококком, поиск новых вакцинных препаратов не прекращается. Ведь остаются нерешенными некоторые важные проблемы, влияющие на эффективность иммунизации. Главная из них — это ограниченное число штаммов возбудителя, против которых направлено действие конъюгированных и полисахаридных препаратов. Да, эти вакцины способны защищать от 75–90% всех бактерий, которые вызывают тяжелые детские инвазивные инфекции, но со временем этот показатель, скорее всего, будет продолжать падать. Не в пользу конъюгированных вакцин говорит и их высокая цена.
Поэтому, наряду с модифицированными вакцинами на основе поверхностных полисахаридов бактерий, ученые работают над получением совершенно новых вакцин-кандидатов. Среди наиболее перспективных сегодня платформ — вакцины на основе поверхностных пневмококковых белков [35] и цельноклеточные вакцины [36]. Белковые вакцины, как и цельноклеточные, в перспективе смогут защищать от более широкого спектра возбудителей, если в их составе будут содержаться консервативные белки, которые есть у большинства пневмококков. Кроме того, ожидается, что они смогут конкурировать с конъюгированными вакцинами по цене.
Как бы то ни было, добившись неоспоримого успеха в борьбе с детской пневмонией, ученые всего мира не позволят пневмококку взять реванш, и сделают все возможное, чтобы защитить будущие поколения от тяжелых инфекций, вызванных этой скромной и порой незаметной бактерией.
Литература
- Пневмококковая инфекция. (2018). ВОЗ;
- Менингит: многоликий убийца;
- Hope L. Johnson, Maria Deloria-Knoll, Orin S. Levine, Sonia K. Stoszek, Laura Freimanis Hance, et. al.. (2010). Systematic Evaluation of Serotypes Causing Invasive Pneumococcal Disease among Children Under Five: The Pneumococcal Global Serotype Project. PLoS Med. 7, e1000348;
- Jeffrey N. Weiser, Daniela M. Ferreira, James C. Paton. (2018). Streptococcus pneumoniae: transmission, colonization and invasion. Nat Rev Microbiol. 16, 355-367;
- Фесенко О.В. и Синопальников А.И. (2012). Крупозная пневмония: история изучения (от С.П. Боткина до наших дней). «Клиническая медицина». 9, 24–28;
- Клинические рекомендации: острый синусит. (2016). Министерство здравоохранения РФ;
- Bush L.M. and Vazquez-Pertejo M.T. (2019). Пневмококковые инфекции. Справочник MSD;
- Микробиом кишечника: мир внутри нас;
- Active bacterial core surveillance (ABCs) report emerging infections program network Streptococcus pneumoniae. (2018). CDC;
- Brian Wahl, Katherine L O'Brien, Adena Greenbaum, Anwesha Majumder, Li Liu, et. al.. (2018). Burden of Streptococcus pneumoniae and Haemophilus influenzae type b disease in children in the era of conjugate vaccines: global, regional, and national estimates for 2000–15. The Lancet Global Health. 6, e744-e757;
- Keith P. Klugman, Ron Dagan, Richard Malley, Cynthia G. Whitney. (2018). Pneumococcal Conjugate Vaccine and Pneumococcal Common Protein Vaccines. Plotkin's Vaccines. 773-815.e18;
- Shamez N Ladhani, Sarah Collins, Abdelmajid Djennad, Carmen L Sheppard, Ray Borrow, et. al.. (2018). Rapid increase in non-vaccine serotypes causing invasive pneumococcal disease in England and Wales, 2000–17: a prospective national observational cohort study. The Lancet Infectious Diseases. 18, 441-451;
- Пневмококковые конъюгированные вакцины для младенцев и детей в возрасте до 5 лет: документ по позиции ВОЗ. (2019). ВОЗ;
- AlmrothE. Wright, W. Parry Morgan, L. Colebrook, R.W. Dodgson. (1914). Observations ON PROPHYLACTIC INOCULATION AGAINST PNEUMOCOCCUS INFECTIONS. AND ON THE RESULTS WHICH HAVE BEEN ACHIEVED BY IT.. The Lancet. 183, 87-95;
- Russell L. Cecil, J. Harold Austin. (1918). RESULTS OF PROPHYLACTIC INOCULATION AGAINST PNEUMOCOCCUS IN 12,519 MEN. Journal of Experimental Medicine. 28, 19-41;
- Разработка вакцин: чем и как имитировать болезнь?;
- M. Heidelberger, O. T. Avery. (1923). THE SOLUBLE SPECIFIC SUBSTANCE OF PNEUMOCOCCUS. Journal of Experimental Medicine. 38, 73-79;
- Felton L.D. (1934). Studies on the immunizing substances in pneumococci. J. Immunol. 27, 379–393;
- G. M. Ekwurzel, J. S. Simmons, Louis I. Dublin, Lloyd D. Felton. (1938). Studies on Immunizing Substances in Pneumococci: VIII. Report on Field Tests to Determine the Prophylactic Value of a Pneumococcus Antigen. Public Health Reports (1896-1970). 53, 1877;
- MacLeod C.M., Hodges R.G., Heidelberger M., Bernhard W.G. (1945). Prevention of pneumococcal pneumonia by immunization with specific capsular polysaccharides. J. Exp. Med. 82, 445–465;
- J. D. Grabenstein, D. J. Weber. (2014). Pneumococcal Serotype Diversity Among Adults in Various Countries, Influenced by Pediatric Pneumococcal Vaccination Uptake. Clinical Infectious Diseases. 58, 854-864;
- Shabir A. Madhi, Peter Adrian, Locadiah Kuwanda, Wasilla Jassat, Stephanie Jones, et. al.. (2007). Long-term immunogenicity and efficacy of a 9-valent conjugate pneumococcal vaccine in human immunodeficient virus infected and non-infected children in the absence of a booster dose of vaccine. Vaccine. 25, 2451-2457;
- Коклюш: кашель, который убивает;
- John Hansen, Steven Black, Henry Shinefield, Thomas Cherian, Jane Benson, et. al.. (2006). Effectiveness of Heptavalent Pneumococcal Conjugate Vaccine in Children Younger Than 5 Years of Age for Prevention of Pneumonia. Pediatric Infectious Disease Journal. 25, 779-781;
- Arto A Palmu, Jukka Jokinen, Dorota Borys, Heta Nieminen, Esa Ruokokoski, et. al.. (2013). Effectiveness of the ten-valent pneumococcal Haemophilus influenzae protein D conjugate vaccine (PHiD-CV10) against invasive pneumococcal disease: a cluster randomised trial. The Lancet. 381, 214-222;
- Shalom Ben-Shimol, Noga Givon-Lavi, Eugene Leibovitz, Simon Raiz, David Greenberg, Ron Dagan. (2014). Near-Elimination of Otitis Media Caused by 13-Valent Pneumococcal Conjugate Vaccine (PCV) Serotypes in Southern Israel Shortly After Sequential Introduction of 7-Valent/13-Valent PCV. Clinical Infectious Diseases. 59, 1724-1732;
- Merja Väkeväinen, Anu Soininen, Marilla Lucero, Hanna Nohynek, Kari Auranen, et. al.. (2010). Serotype-Specific Hyporesponsiveness to Pneumococcal Conjugate Vaccine in Infants Carrying Pneumococcus at the Time of Vaccination. The Journal of Pediatrics. 157, 778-783.e1;
- Jennifer D. Loo, Laura Conklin, Katherine E. Fleming-Dutra, Maria Deloria Knoll, Daniel E. Park, et. al.. (2014). Systematic Review of the Effect of Pneumococcal Conjugate Vaccine Dosing Schedules on Prevention of Pneumonia. Pediatric Infectious Disease Journal. 33, S140-S151;
- K.P. Klugman, S.A. Madhi, R.A. Adegbola, F. Cutts, B. Greenwood, W.P. Hausdorff. (2011). Timing of serotype 1 pneumococcal disease suggests the need for evaluation of a booster dose. Vaccine. 29, 3372-3373;
- Вакцинация перед школой: гайд для родителей;
- Zhou W., Pool V., Iskander J.K., English-Bullard R., Ball R., Wise R.P. et al. (2003). Surveillance for safety after immunization: Vaccine Adverse Event Reporting System (VAERS) — United States, 1991-2001. MMWR Surveill Summ. 52, 1–24;
- Alison Tse, Hung Fu Tseng, Sharon K. Greene, Claudia Vellozzi, Grace M. Lee. (2012). Signal identification and evaluation for risk of febrile seizures in children following trivalent inactivated influenza vaccine in the Vaccine Safety Datalink Project, 2010–2011. Vaccine. 30, 2024-2031;
- Daniel M. Musher, Susan B. Manoff, Richard D. McFetridge, Charles L. Liss, Rocio D. Marchese, et. al.. (2011). Antibody persistence ten years after first and second doses of 23-valent pneumococcal polysaccharide vaccine, and immunogenicity and safety of second and third doses in older adults. Human Vaccines. 7, 919-928;
- C. Ponvert, P. Scheinmann, J. de Blic. (2010). Anaphylaxis to the 23-valent pneumococcal vaccine: A second explored case by means of immediate-reading skin tests with pneumococcal vaccines. Vaccine. 28, 8256-8257;
- Kristin L. Moffitt, Todd M. Gierahn, Ying-jie Lu, Paulo Gouveia, Mark Alderson, et. al.. (2011). TH17-Based Vaccine Design for Prevention of Streptococcus pneumoniae Colonization. Cell Host & Microbe. 9, 158-165;
- Keech C., Malley R., Anderson P., Flores J., Morrison R., Goldblatt D. et al. (2013). A phase 1 randomized, double-blind, dose-escalation, placebo-controlled study to assess the safety, tolerability and immunogenicity of inactivated Streptococcus pneumoniae whole cell vaccine formulated with alum (PATH-wSP) in healthy adults. ID Week, San Francisco;
- John D. Grabenstein, Daniel M. Musher. (2018). Pneumococcal Polysaccharide Vaccines. Plotkin's Vaccines. 816-840.e13;
- Yulia G. Belocerkovskaja, A. G. Romanovskih, E. A. Styrt. (2016). Pneumococcal vaccine in adults reduces the risk of infections caused by Streptococcus pneumoniae. Klin. med.. 94, 61-66.