Переварить неперевариваемое. Как разлагаются самые прочные виды пластика?
12 апреля 2022
Переварить неперевариваемое. Как разлагаются самые прочные виды пластика?
- 1478
- 0
- 4
-
Автор
-
Редакторы
В природе в последнее время накопилось очень много пластика, и микроорганизмы не упускают случая им полакомиться. Не так давно открыли бактерию Ideonella sakaiensis, способную разлагать полиэтилентерефталат при помощи фермента ПЭТазы. Этот процесс теперь изучен настолько хорошо, что уже разработаны технологии его промышленной микробиологической переработки, которые в ближайшем будущем, возможно, будут применены на практике. Однако с другими видами пластика дело обстоит гораздо хуже. Они более устойчивы к биодеградации, и о том, как они все-таки разлагаются, известно довольно немного. Многое еще предстоит изучить, прежде чем мы сможем использовать микроорганизмов для решения экологических проблем. Однако кое-что все-таки известно, и об этом сейчас и пойдет речь.
Введение
Мало кто будет спорить, что бытовые отходы в окружающей среде — это плохо. Наибольшую проблему представляет пластик, то есть различные синтетические полимеры [1]. В условиях полигона они почти не разлагаются, и переработка очень часто невозможна из-за сложности сортировки. Главная трудность — огромное разнообразие полимеров. Разные виды должны перерабатываться отдельно, а внешне они почти не различаются. При этом отдельную маркировку имеют только пять наиболее распространенных полимеров, а все остальное великое многообразие почти всегда обозначается одинаково и в принципе не перерабатывается. Не говоря уже о том, что многие виды упаковки являются смесью разных видов пластика и других материалов.
Самым простым решением кажется стандартизация упаковки — использование небольшого числа полимеров, которые будет легко сортировать и перерабатывать. Однако для производителей упаковка часто оказывается чуть ли не важнее самого продукта, поэтому отказаться от использования редких видов пластика в ближайшем будущем смогут не все. К тому же нужно что-то делать с уже образовавшимся мусором.
Сжигать мусор с полигонов — не самая лучшая идея, потому что неизвестно, какие вещества входят в его состав и что получится при их сгорании. Из-за этого сложно создать надежную систему очистки. Гораздо лучше, если мусор все-таки разложится сам, только нужно как-то ускорить этот процесс и еще, желательно, извлечь из него дополнительную выгоду.
Разложение пластика происходит хоть и медленно, но верно. Более чем для 60 синтетических полимеров, включая и самые распространенные, найдены микроорганизмы, способные ими питаться. Известно более 430 видов микроорганизмов, разлагающих какой-либо вид пластика [2–4].
Все полимеры можно разделить на две основные группы: гидролизуемые и негидролизуемые. К первым относятся ПЭТ, полиуретан, полилактид и все прочие полимеры, образующиеся в реакции поликонденсации, то есть с отрыванием молекул воды. Микроорганизмы могут относительно легко разрушать такие полимеры, обратно присоединяя воду. Этот процесс широко распространен в природе и очень хорошо изучен. Он носит название гидролиз, и осуществляют его ферменты гидролазы. Сейчас известны ферменты, специфично расщепляющие конкретный вид пластика, например, ПЭТ-гидролаза, ПВА-гидролаза и другие. Получены модифицированные ферменты с увеличенной активностью и даже разработаны методы промышленной микробиологической переработки пластика в ценные продукты [5].
Гораздо труднее дело обстоит с негидролизуемыми полимерами, в которых мономеры связаны углерод-углеродными связями. К ним относятся полиэтилен, полипропилен (ПП), полистирол (ПС), поливинилхлорид (ПВХ), всевозможные каучуки и др. Разорвать связи в таких полимерах очень тяжело. Это можно сделать только путем окисления. Тем не менее микроорганизмы с этим справляются, хотя и не так хорошо, как с гидролизуемыми полимерами.
Рекордсменами в этой области являются бактерии из родов Pseudomonas и Bacillus: они могут разлагать все основные виды пластика и много других полимеров и ксенобиотиков вообще.
Лучше всего разлагается полиэтилен, он же наиболее распространен и наиболее изучен. Способность питаться полиэтиленом показана примерно для 70 видов микроорганизмов, а каждым из остальных распространенных полимеров — лишь для около 15. Чтобы разорвать связи в полиэтилене, используются следующие ферменты: алканмонооксигеназы AlkB (они же алкангидролазы), лакказы и марганцевые пероксидазы. Для других негидролизуемых полимеров ферменты неизвестны, но, скорее всего, это те же ферменты, что и для полиэтилена, или что-то очень на них похожее. Эти ферменты, во-первых, имеются у некоторых микроорганизмов, для которых показана способность разлагать ПП, ПС и ПВХ, а во-вторых, обладают очень низкой специфичностью, то есть окисляют много разных субстратов. Но вообще тема разложения негидролизуемых полимеров довольно плохо изучена [2].
Полиэтилен и нефть
В природе ничто не берется из ниоткуда, поэтому способность разлагать пластик логичнее всего искать среди ферментов, расщепляющих что-то похожее. Полиэтилен, по сути, является очень длинным алканом, поэтому неудивительно, что его могут расщеплять ферменты, отвечающие за окисление углеводородов.
Алканы с большой длиной углеродной цепи являются основными компонентами нефти. Кроме того, они входят в состав кутикулы некоторых растений и животных, где защищают от потери влаги. Микроорганизмы, способные питаться углеводородами, широко распространены в природе. Особенно хорошо они чувствуют себя в местах антропогенного загрязнения нефтепродуктами, и люди уже научились использовать их, чтобы эти загрязнения ликвидировать.
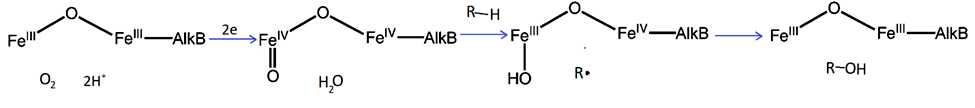
Способность разлагать полиэтилен показана для монооксигеназ AlkB. Они наиболее распространены среди ферментов, окисляющих алканы. AlkB — это мембранный фермент, осуществляющий следующую реакцию:
Алкан + О2 + 2Н++ 2е = алкан-1-ол + Н2О
Помимо этого, AlkB могут гидроксилировать большое разнообразие алифатических, алициклических и алкилароматических соединений, деметилировать метиловые эфиры и окислять алкены с двойной связью на конце до альдегидов и эпоксидов. Эти ферменты родственны некоторым десатуразам жирных кислот и эпоксидазам, имеют похожее строение активного центра и каталитический механизм [6].
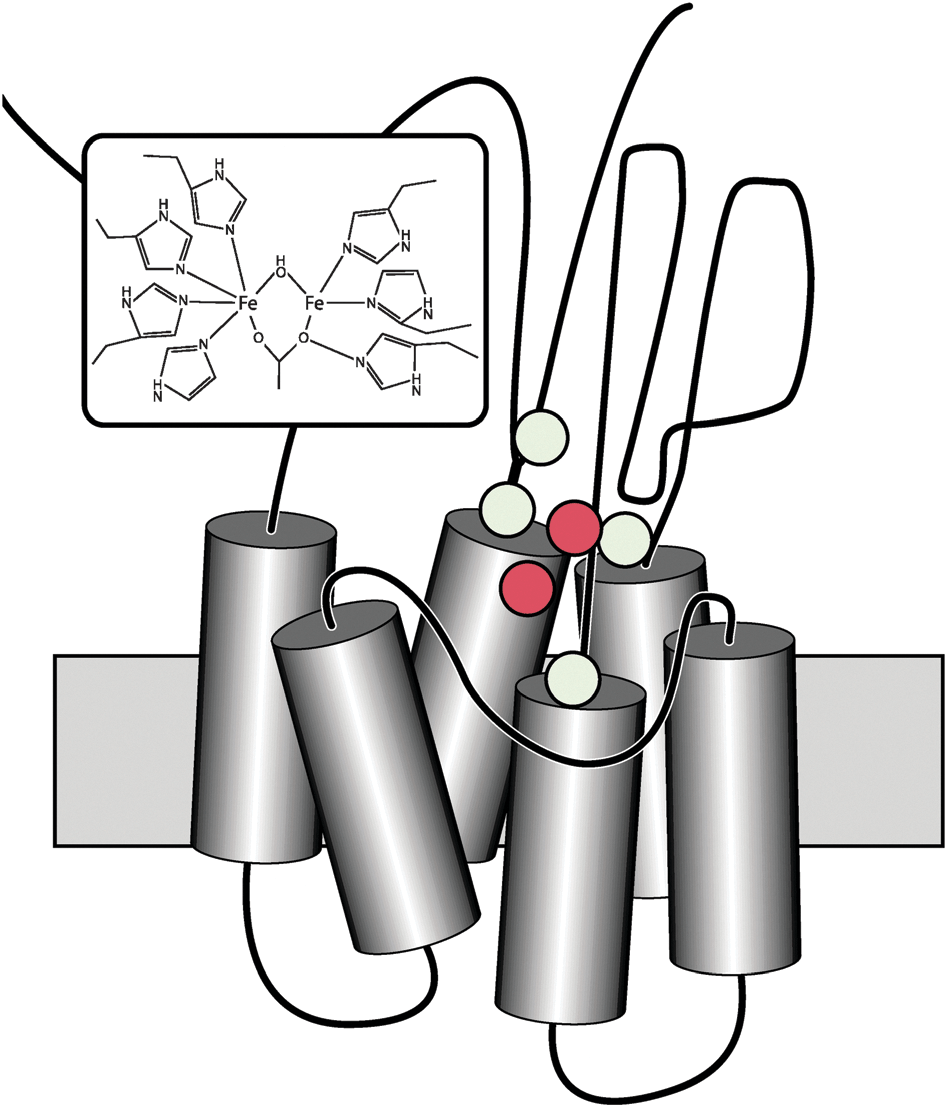
AlkB состоит из шести гидрофобных альфа-спиралей, пронизывающих мембрану, и двух гидрофильных альфа-спиралей, расположенных в цитоплазме (рис. 1). В активный центр входят 8 остатков гистидина и глутамат, которые необходимы для стабилизации двух ионов железа [7].
Донором электронов служит восстановленный NAD(P)H. Однако они поступают в активный центр не напрямую, а через небольшую электрон-транспортную цепь. Сначала фермент рубредоксинредуктаза использует NAD(P)H для восстановления окисленного белка рубредоксина, затем рубредоксин передает электроны в активный центр AlkB.
Рубредоксин — небольшой белок, в состав которого входит ион железа, стабилизированный четырьмя остатками цистеина. Железо может иметь степень окисления +2 или +3, благодаря чему рубредоксин и может выполнять функцию переносчика электронов. В состав рубредоксинредуктазы также входит железо. Еще одним ее кофактором является FAD [6].
Рубредоксин и рубредоксинредуктаза очень важны для работы AlkB и связаны с ней неразрывно. У бактерии Pseudomonas putida (именно на ней лучше всего изучена деградация алканов) есть специальная плазмида OCT, ответственная за метаболизм алканов. В нее входят гены всех трех белков: AlkB, ген рубредоксинредуктазы AlkT и ген рубредоксина AlkG. Кроме того, имеются и гены и других белков: AlkJ — алкогольдегидрогеназа, окисляющая спирты до альдегидов; AlkH — альдегиддегидрогеназа, окисляющая альдегиды до жирных кислот; AlkK — ацил-КоА-синтетаза, активирующая жирные кислоты, чтобы они могли вступить в β-окисление; AlkL — переносчик во внешней мембране; и AlkS — регулятор экспрессии AlkB. Полный набор для питания алканами в одной плазмиде!
О плазмидах и других мобильных генетических элементах читайте в статье «Мобильные генетические элементы прокариот: стратификация “общества” бродяжек и домоседов» [8].
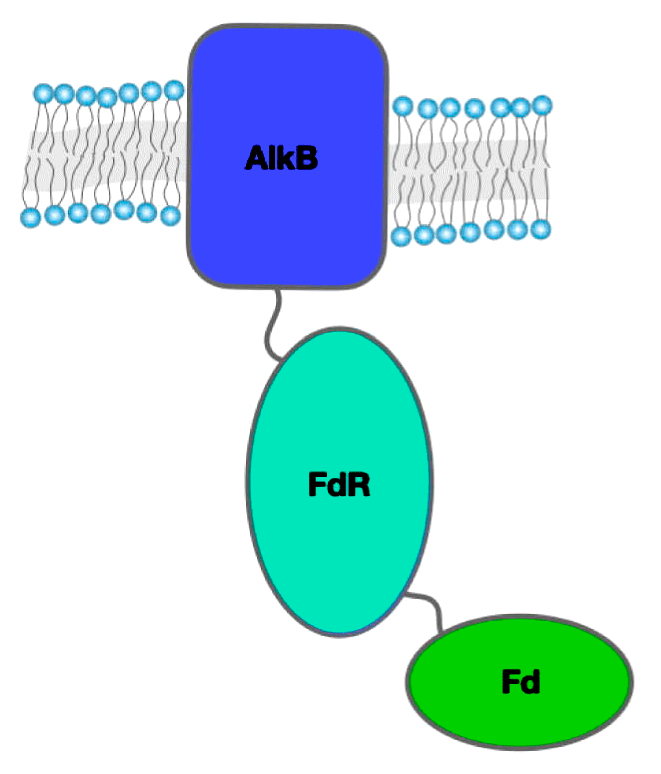
Рисунок 3. Алканмонооксигеназа из трех доменов
Многие бактерии пошли еще дальше по пути объединения AlkB и ее помощников. Довольно часто встречаются ферменты, представляющие собой алканмонооксигеназу (рис. 3), слитую с рубредоксином. Такое слияние увеличивает способность ферментов окислять длинноцепочечные алканы. Этому есть два объяснения: во-первых, ускоряется транспорт электронов от фермента к ферменту, во-вторых, длинные алканы могут лучше связываться с ферментом, так как не мешают рубредоксину соединяться с AlkB. Недавно даже были найдены белки, состоящие из слитых монооксигеназы, рубредоксина и рубредоксинредуктазы [6].
Помимо AlkB есть и другие алканмонооксигеназы, для которых пока неизвестна способность окислять полимеры, но которые, теоретически, вполне могут это делать. Например, из термофильной бактерии Geobacillus thermodentrificans NG80-2 была выделена монооксигеназа длинноцепочечных алканов (long-chain monooxygenase) LadA, которая, как ни странно, относится к семейству бактериальных люцифераз. Этот фермент может окислять алканы с длиной цепи от 15 до 36 атомов углерода, больше, чем в норме предпочитают AlkB. Может быть, полиэтилен им тоже подойдет?
Помимо этого есть еще разнообразные цитохром-Р540-алканмонооксигеназы. Они очень широко распространены в природе, есть не только у прокариот, но и у некоторых дрожжей. Эти ферменты обладают довольно низкой субстратной специфичностью. Помимо алканов они разлагают жирные кислоты, стероиды, простагландины и различные ксенобиотики, например, пестициды, лекарства, органические растворители. Почему бы им также не разлагать какой-нибудь пластик [6]?
Полиэтилен и древесина
Две другие группы ферментов, способных разлагать полиэтилен — марганцевые пероксидазы и лакказы, — нужны микроорганизмам для того, чтобы окислять растительный полимер лигнин — основной (вместе с целлюлозой) компонент древесины.
Лигнин крайне устойчив к биодеградации, так как имеет сложное и нерегулярное строение (рис. 4). В ходе биосинтеза лигнина его предшественники — ароматические спирты — окисляются с образованием радикалов, которые потом соединяются друг с другом случайным образом. Образуются простые эфирные и углерод-углеродные связи между различными атомами мономеров. Именно поэтому ферменты, участвующие в разложении лигнина, имеют очень низкую субстратную специфичность и могут окислять также и полиэтилен [9].

Рисунок 4. Лигнин и его основные предшественники
Лакказы — ферменты из семейства оксидаз с несколькими катионами меди (multicopper oxidases, MCOs). Они окисляют различные фенольные соединения и восстанавливают кислород до воды. Активный центр лакказы включает в себя 4 катиона меди, образующие сайты трех разных типов (рис. 5) [10]. Первый тип (Т1) отвечает за окисление субстрата. В его координации задействованы 2 остатка гистидина и 1 остаток цистеина, а в некоторых ферментах еще и метионин. Катион второго типа (Т2) и два катиона третьего типа (Т3α и Т3β) участвуют в восстановлении кислорода до воды. Электроны из Т1 передаются им по специальному цистеин-гистидиновому мосту. Катион Т2 координирует два остатка гистидина и гидроксолиганд. Каждый из катионов Т3 координирует 3 гистидина, кроме того, они связаны между собой гидроксидным мостиком. Помимо этого, важную роль в катализе играют два остатка аспарагиновой кислоты, расположенные недалеко от активного центра. Они нужны для того, чтобы передавать восстановленному кислороду протоны и делать из него воду [11].

Рисунок 5. Лакказа и ее активный центр
Такое сложное строение позволяет лакказе эффективно окислять фенольные соединения, однако полиэтилен не имеет с ними ничего общего. Низкая специфичность фермента обеспечивается использованием медиаторов. В роли медиаторов могут выступать различные фенольные или похожие на них соединения, которые лакказа может окислить и превратить в относительно стабильные фенольные радикалы. Эти радикалы сами являются сильными окислителями и могут разрушать самые разные соединения, включая полиэтилен. Роль медиаторов в биодеградации лигнина очень высока. Не только потому, что связи в лигнине очень разные, но и потому, что структура древесины очень плотная, и крупные ферменты не могут протиснуться вглубь нее. Поэтому на начальных этапах деградации ведущую роль играют низкомолекулярные соединения.
Лакказы имеются у самых разных живых организмов, причем в зависимости от условий они могут выполнять диаметрально противоположные функции. Грибы и бактерии используют лакказы для того, чтобы разлагать лигнин, а растениям они нужны, чтобы лигнин синтезировать. Лакказы окисляют ароматические спирты — предшественники лигнина, после чего те соединяются случайным образом.
Лакказы имеют много практических применений. Они используются в бумажной промышленности для очистки целлюлозы от лигнина, для обезвреживания отходов производств, очистки продуктов питания, в качестве биосенсоров на загрязнение и для синтеза некоторых лекарств [12].
Так как лакказы имеют важное практическое значение, проводятся многочисленные исследования, направленные на улучшение их характеристик. Например, недавно была получена модифицированная лакказа, способная более активно окислять лигнин. Аналогичным образом можно получить ферменты, лучше разлагающие пластик [13].
Еще одна группа ферментов, способных разлагать и лигнин, и полиэтилен — марганцевые пероксидазы (MnP). Причем некоторые исследования показали, что MnP окисляют пластик эффективнее, чем лакказы. Марганцевые пероксидазы окисляют Mn2+ до Mn3+ и восстанавливают пероксид водорода (или органический пероксид) до воды. Эта способность обусловливается наличием гемовой группы в качестве кофактора.
Реакция начинается с того, что к железу в гемовой группе присоединяется пероксид водорода (рис. 6). Затем 2 электрона из гема передаются пероксиду водорода, и связь между атомами кислорода в перекиси разрывается. Формируется комплекс Fe4+-оксопорфирин-радикал (MnP Compound I). Этот комплекс по очереди окисляет два иона Mn3+. Первый катион восстанавливает комплекс до Fe4+-оксопорфирина (MnP Compound II), второй возвращает его в исходное состояние [14].

Рисунок 6. Механизм реакции, которую катализирует марганцевая пероксидаза
Катионы Mn3+ в водном растворе неустойчивы, поэтому образуются хелатные комплексы катионов марганца и карбоновых кислот, таких как оксалат, малонат, малат и лактат. Эти комплексы могут окислять разнообразные соединения (рис. 7), которые после этого сами становятся сильными окислителями. Благодаря своей особенности марганцевые пероксидазы обладают очень низкой специфичностью, что позволяет им окислять полиэтилен и, возможно, другие синтетические полимеры.

Рисунок 7. Окисление хелатами Mn3+ различных соединений
Однако наибольший вклад в разложение лигнина вносят не марганцевые пероксидазы или лакказы, а лигнинпероксидазы (LiP). Это родственные марганцевым пероксидазам ферменты, также имеющие гем в качестве кофактора. Они могут окислять различные субстраты, используя в качестве акцептора электронов пероксид водорода. Окислительно-восстановительный потенциал LiP очень высокий, это самые сильные окислители среди ферментов, разлагающих лигнин. Они могут разрушать разнообразные компоненты лигнина, включая самые прочные и недоступные для других ферментов. Но из-за довольно большого размера они не могут протиснуться между древесными волокнами и вступают в дело уже после того, как часть связей разрушена низкомолекулярными окислителями [15].
Хотя для лигнинпероксидаз и не была продемонстрирована способность окислять полиэтилен, их точно не стоит сбрасывать со счетов, так как они очень близки к марганцевым пероксидазам и имеют аналогичный механизм катализа, но при этом являются более сильными и мало специфичными окислителями. К тому же они имеются у некоторых микроорганизмов, для которых была показана способность разлагать пластик [2].
Заключение
Таким образом, хотя ферменты, способные разлагать полиэтилен, изучены довольно хорошо, механизм окисления именно пластика понятен далеко не до конца. Также неясно, могут ли некоторые другие ферменты окислять полиэтилен и, если не могут, то почему. Кроме того, неизвестно, какие ферменты участвуют в деградации других синтетических полимеров, таких как полистирол, полипропилен и ПВХ. Конечно, мы пока очень далеки от использования микроорганизмов для промышленной переработки пластиковых отходов, но учитывая низкую специфичность ферментов, вполне возможно как-то модифицировать один из них, чтобы он мог хорошо окислять все основные синтетические полимеры. Новые исследования в этой области позволят нам приблизиться к решению пластиковой проблемы.
Литература
- А ты такой холодный, как... пластик в океане;
- Victor Gambarini, Olga Pantos, Joanne M. Kingsbury, Louise Weaver, Kim M. Handley, Gavin Lear. (2021). Phylogenetic Distribution of Plastic-Degrading Microorganisms. mSystems. 6;
- «Пластик, сэр!», или Бактериальная диета в стиле хай-тек;
- Пластисфера: невидимый мир;
- Ванильные мечты о пластике;
- Yurui Ji, Guannan Mao, Yingying Wang, Mark Bartlam. (2013). Structural insights into diversity and n-alkane biodegradation mechanisms of alkane hydroxylases. Front. Microbiol.. 4;
- Rachel Narehood Austin, John T. Groves. (2011). Alkane-oxidizing metalloenzymes in the carbon cycle. Metallomics. 3, 775;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Ian D. Reid. (1995). Biodegradation of lignin. Can. J. Bot.. 73, 1011-1018;
- Claudia M. Rivera-Hoyos, Edwin David Morales-Álvarez, Raúl A. Poutou-Piñales, Aura Marina Pedroza-Rodríguez, Refugio RodrÍguez-Vázquez, Julio M. Delgado-Boada. (2013). Fungal laccases. Fungal Biology Reviews. 27, 67-82;
- Stephen M. Jones, Edward I. Solomon. (2015). Electron transfer and reaction mechanism of laccases. Cell. Mol. Life Sci.. 72, 869-883;
- Karla Mayolo-Deloisa, Mirna González-González, Marco Rito-Palomares. (2020). Laccases in Food Industry: Bioprocessing, Potential Industrial and Biotechnological Applications. Front. Bioeng. Biotechnol.. 8;
- Julian Ihssen, Dagmara Jankowska, Thomas Ramsauer, Renate Reiss, Ronny Luchsinger, et. al.. (2017). Engineered Bacillus pumilus laccase-like multi-copper oxidase for enhanced oxidation of the lignin model compound guaiacol. Protein Engineering, Design and Selection. 30, 449-453;
- Martin Hofrichter. (2002). Review: lignin conversion by manganese peroxidase (MnP). Enzyme and Microbial Technology. 30, 454-466;
- Ahmed M. Abdel-Hamid, Jose O. Solbiati, Isaac K.O. Cann. (2013). Insights into Lignin Degradation and its Potential Industrial Applications. Advances in Applied Microbiology. 1-28;
- Shoshana C. Williams, Dahlia Luongo, Marina Orman, Christina L. Vizcarra, Rachel N. Austin. (2022). An alkane monooxygenase (AlkB) family in which all electron transfer partners are covalently bound to the oxygen-activating hydroxylase. Journal of Inorganic Biochemistry. 228, 111707.