
Отступают, но не сдаются: что помогает опухолевым клеткам противостоять лекарственной терапии
22 ноября 2022
Отступают, но не сдаются: что помогает опухолевым клеткам противостоять лекарственной терапии
- 1452
- 0
- 8
Опухолевые клетки в начале лечения не выносят лекарственного воздействия. У них есть два пути — остаться чувствительными к терапии (и умереть) или стать резистентными.
flickr, с изменениями автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Считается, что лекарственная устойчивость опухолевых клеток возникает благодаря новым мутациям. Например, мутации, тем или иным образом изменяющие рецепторный белок на поверхности клетки, могут сделать его «невидимым», так как лекарственный препарат не сможет более взаимодействовать со своей мишенью. В других случаях клетки опухоли в результате мутаций находят обходной путь для важных сигнальных путей, которые были выключены предшествующей терапией. Варианты могут быть разные. Обычно в таких случаях пациенту изменяют схему лечения — в ход идут другие лекарства, которые будут эффективными с учетом новой мутации. Однако есть еще одна стратегия, с помощью которой можно противостоять лекарственному воздействию, и стратегия эта связана не с мутациями, а с удивительной способностью опухолевых клеток приспосабливаться к изменяющимся условиям окружающей среды. При этом изменений в ДНК не происходит, меняется лишь активность генов — какие-то начинают работать сильнее, какие-то слабее. Удивительным образом это приводит к появлению устойчивых к лекарственному воздействию клонов — которые в дальнейшем, даже после успешного на первый взгляд лечения, будут обеспечивать возникновение рецидивов и метастазирование опухоли. В итоге противоопухолевая терапия начинает напоминать изматывающую битву с Лернейской гидрой — пока одну голову отрубишь, отрастает другая и уже от нее приходится уворачиваться. Чтобы победить в схватке с таким серьезным противником, нужно досконально изучить механизмы устойчивости к противоопухолевому воздействию. Именно этим и занимается сегодня множество исследовательских групп по всему миру.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла второе место в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
За последний год в России выявлено более 500 тысяч новых случаев злокачественных новообразований [1]. Для лечения большей части из них недостаточно только хирургической операции (либо ее невозможно провести) и тогда встает вопрос о лекарственной терапии. К сожалению, рано или поздно большинство опухолей становятся резистентными к используемым препаратам: возникает рецидив, появляются метастазы, иными словами, болезнь прогрессирует.
Как возникает резистентность?
При первом контакте опухоли с лекарственным веществом начинается активная гибель клеток. При химиотерапевтическом воздействии гибнут в первую очередь активно делящиеся клетки. Если применяются таргетные препараты, гибнут те клетки, которые несут соответствующее данному препарату генетическое нарушение. Очевидно, что чем больше опухолевых клеток погибнет, тем лучше будет клинический эффект противоопухолевого препарата. Возобновление же роста опухоли на фоне проводимого лечения или появление новых очагов в других органах принято трактовать в клинической практике как проявление резистентности (устойчивости) .
Подробно о механизмах развития резистентности «Биомолекула» рассказывала в статье: «Соревнуясь с раком» [4].
Различают первичную и вторичную (приобретенную) резистентности.
Первичная резистентность имеет место в случаях, когда некоторые изначально присущие опухолевым клеткам характеристики обеспечивают ее устойчивость к какому-либо лекарственному препарату. Так, некоторые редко встречающиеся мутации EGFR ассоциируются с первичной резистентностью к ингибиторам тирозинкиназ (ИТК) при немелкоклеточном раке легкого (НМРЛ) [2].
Вторичная, или приобретенная, резистентность возникает в случаях, когда изначально чувствительные к лекарственному воздействию опухолевые клетки становятся устойчивыми к терапии уже во время лечения. Несмотря на отличия первичной резистентности от приобретенной, биологические механизмы их во многом похожи и обусловлены клональным разнообразием, существующим в опухоли. Все опухоли, помимо немногочисленных драйверных мутаций, несут и множество других — пассажирских. В любом случае часть опухолевых клеток переживает летальное для всех прочих клеток воздействие. Только при первичной резистентности такие устойчивые клетки существуют в опухоли изначально, а при приобретенной возникают путем селекции из всего спектра мутаций в процессе отбора тех, что обеспечивают неоспоримое конкурентное преимущество в существующих на данный момент условиях. Так, например, изначальное присутствие в небольшом проценте опухолевой популяции мутации в 20 экзоне гена EGFR, обозначаемой как Т790М (что означает замену треонина (Т) на метионин (М) в положении 790 белка), вероятно, не дающей никакого преимущества относительно прочих клеток в отсутствие терапии, при воздействии ИТК EGFR 1 и 2 поколений (гефитиниб, эрлотиниб, афатиниб) обеспечивает клеткам селективное преимущество просто за счет того, что мишень для противоопухолевого препарата в данном случае отсутствует [3]. Селекция такого предсуществующего клона приводит к быстрому замещению всех прочих клонов опухоли на резистентный к лекарственному воздействию клон клеток с мутацией Т790М.
Таким образом, при условии клонального разнообразия опухоли таргетная терапия выступает направляющим фактором эволюции, приводя к появлению резистентности. Клинически для таких опухолей характерен короткий по длительности ответ на проводимое лечение, сменяющийся неуклонным ростом и прогрессией заболевания. Существует препарат третьего поколения — осимертиниб — который применяется при лечении больных НМРЛ с наличием мутации Т790М, но и к нему рано или поздно возникает устойчивость [5]. Можно предположить, что в опухоли появляются другие мутации, которые приводят к активации альтернативных сигнальных путей (к примеру, амплификации Her2/neu и MET). Однако в последнее время появляется всё больше данных о том, что механизмы устойчивости могут быть не только генетическими, но и негенетическими — то есть клетки ухитряются выжить без мутаций, без изменений в генетическом тексте (рис. 1) [6].
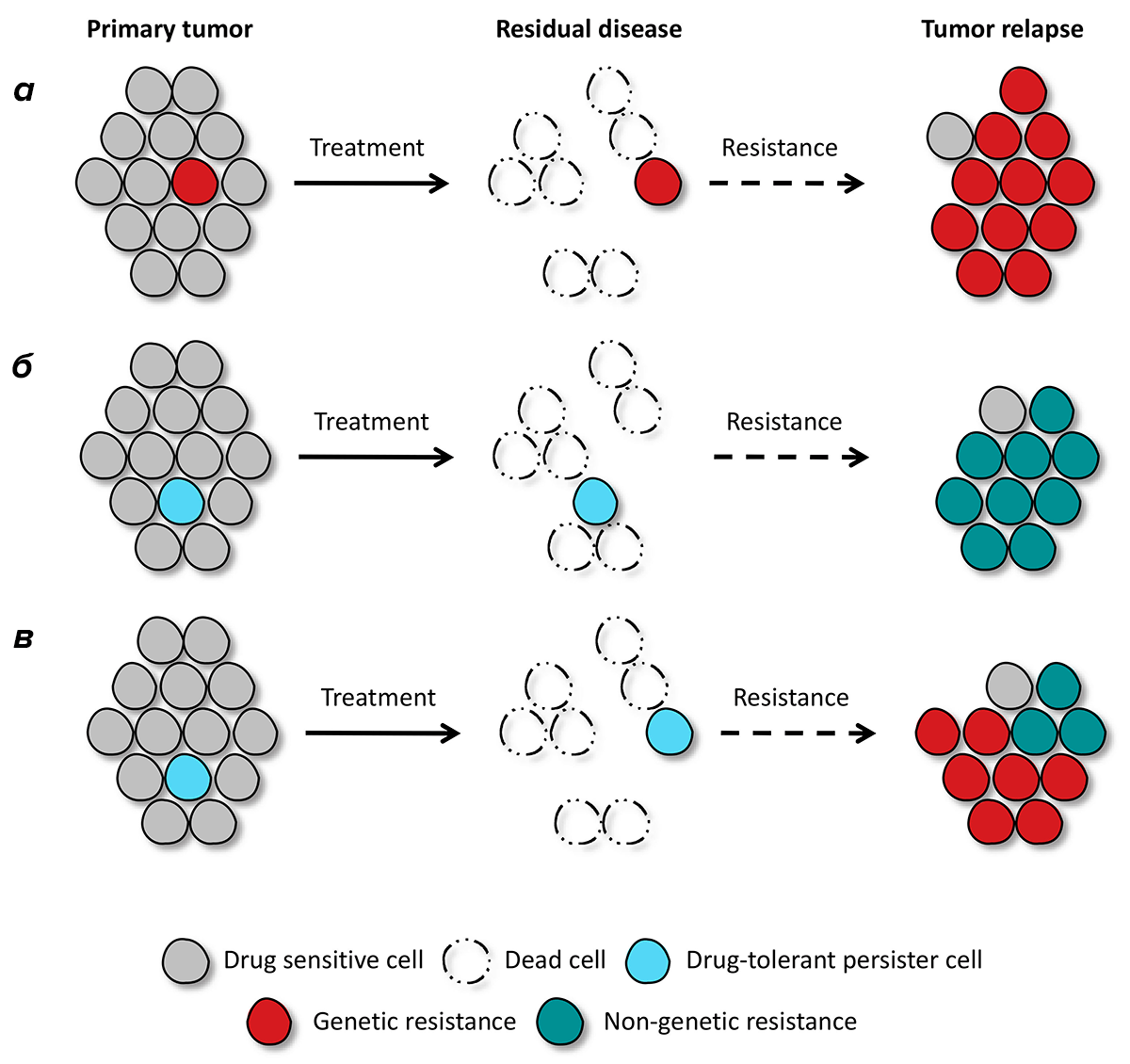
Рисунок 1. Генетические и негенетические механизмы формирования лекарственной устойчивости. а — В опухоли исходно существует клон с той или иной специфической мутацией. Терапия приводит к элиминации большинства опухолевых клеток, но резистентный клон остается и дает начало новой опухоли. б — В отсутствие специфических мутаций, подавляющее большинство чувствительных к лекарственному препарату опухолевых клеток элиминируется, но некоторое количество клеток, находящихся в состоянии персистенции и названных поэтому drug-tolerant persisters (DTP), остается. С течением времени, начав пролиферировать, эти клетки дают начало новой опухоли, точно так же не имеющей специфических мутаций. в — Специфические мутации могут возникнуть в клетках-потомках тех DTP, которые выжили после лечения, и тогда во вторичной опухоли будут обнаруживаться клетки как с генетической (необратимой), так и негенетической (обратимой) резистентностью.
Ученым и раньше было известно: что не убивает рак, то делает его сильнее. И далеко не всегда это происходит за счет мутаций. Хорошо известны примеры изменений фенотипа опухолевых клеток как механизма развития устойчивости к лекарственному воздействию. Так, описан феномен трансформации НМРЛ в мелкоклеточный рак при лечении препаратом осимертиниба [5], [7]. Это прогностически неблагоприятная форма заболевания, для которой к тому же отсутствуют эффективные схемы лечения. Аналогично клетки рака предстательной железы (РПЖ) могут претерпевать трансдифференцировку (превращение клеток одного типа в другой) в крайне агрессивный нейроэндокринный фенотип при назначении андрогендепривационной (от лат. deprivatio — потеря, лишение; направленной на снижение уровня андрогенов) терапии [7]. Клетки РПЖ приобретают фенотипические признаки нейронов, форма их становится более вытянутой, в цитоплазме появляются секреторные гранулы, что сопровождается увеличением экспрессии нейроэндокринных маркеров хромогранина А и синаптофизина [8]. При этом количество нейроэндокринных клеток возрастает по мере увеличения продолжительности лечения. Особенностью нейроэндокринного фенотипа является то, что андрогеновых рецепторов такие клетки не содержат. Как и в случае с НМРЛ, фенотипическая трансформация клеток РПЖ не затрагивает генотип, но является тем адаптивным механизмом, который позволяет опухолевым клеткам сохранить жизнеспособность в неблагоприятных условиях терапевтического воздействия [9].
Существует еще один феномен, который заставляет ученых рассматривать фенотипические изменения в качестве серьезного игрока в развитии резистентности опухолей. Речь идет об обратимости резистентности, неоднократно описанной в различных клинических исследованиях. Так, было замечено, что в некоторых случаях НМРЛ перерыв в лечении «возвращал» ставшие резистентными к действию ИТК клетки опухоли обратно в изначальное чувствительное к действию лекарственного препарата состояние [10]. Обратимость лекарственной устойчивости также описана на модели меланомы человека, пересаженной мышам. На таких ксенотрансплантатах было показано, что «терапевтические каникулы» при экспозиции с вемурафенибом предотвращали развитие резистентности у иммунокомпетентных животных [11]. Эти данные свидетельствуют о том, что приобретенная резистентность к лекарственным препаратам может включать обратимую фазу. Поскольку генетические изменения, как правило, не являются обратимыми, под подозрением опять оказывается фенотип. Отсюда следует вывод, что механизм устойчивости к терапии не всегда связан с изменениями в последовательности ДНК, а может определяться и более пластичными паттернами активности (или, как говорят биологи, экспрессии) отдельных генов.
Возникновение новых фенотипических состояний клеток помогает опухоли противостоять внезапно изменяющимся условиям внешней среды и наряду с генетической гетерогенностью играет важную роль в прогрессии опухоли, формировании резистентности к разнообразным противоопухолевым терапевтическим воздействиям. Каждая опухолевая клетка в организме уникальна по потенциальной возможности претерпеть различные изменения, но даже одна из многих, избежавшая, путем изменения фенотипа, действия терапии, может потенциально вызвать прогрессирование болезни и стать основой формирования лекарственной резистентности.
Преступник вооружен и очень опасен, или Что скрывается за аббревиатурой DTP
Русская аббревиатура ДТП, конечно, не имеет ничего общего с принятым в научном сообществе термином DTP (Drug-Tolerant Persister) — персистирующим состоянием клеток, которое индуцируется воздействием лекарственного средства при условии возникновения толерантности к нему. Ввиду трудности перевода здесь и далее мы будем называть это состояние клеток его английской аббревиатурой. Отметим также, что толерантность следует отличать от резистентности. Под резистентностью подразумевается способность противостоять воздействию того или иного лекарственного препарата. Развитие резистентности — процесс многоступенчатый и одной из его «ступеней» является толерантность. Толерантность — это снижение реакции на неоднократное введение того или иного лекарственного препарата, ввиду чего требуется всё бóльшая и бóльшая доза для достижения эффекта. Толерантные клетки переходят в состояние с пониженным или выключенным метаболизмом и таким образом становятся персистирующими.
От латинского глагола persisto — оставаться, постоянно пребывать.
Давайте вспомним кинозлодея из фильма «Молчание ягнят» доктора Лектера, который, будучи закован в наручники, смог освободиться благодаря кусочку ручки, спрятанному между пальцев рук. Клетки, перешедшие в состояние DTP, можно сравнить с таким кусочком ручки: маленькая незаметная деталь, способная стать ключом к успешному существованию опухоли и, что немаловажно, помочь ей противостоять внезапно изменяющимся условиям внешней среды, образно говоря, «развязать руки».
Впервые термин DTP использовал профессор Сринат Шарма с соавторами в 2010 году, когда описал трансформацию небольшой части опухолевых клеток в состояние, при котором ранее чувствительные к лекарственному препарату эрлотиниб клеточные линии НМРЛ становились резистентными к нему [12]. При дозе эрлотиниба, соответствующей той, что используется в стандартных режимах терапии, через 9 дней непрерывного воздействия препарата в исследованных клеточных линиях оставалось 0,03% клеток, которые находились преимущественно в G1-фазе клеточного цикла и были охарактеризованы как drug-tolerant persisters (DTP). Через некоторое время около 20% из них переходили в медленно пролиферирующее состояние и формировали растущую популяцию толерантных к лекарственному воздействию клеток (drug-tolerant expanded population, DTEP). Оба фенотипических варианта обладали выраженной резистентностью к ИТК — даже очень высокая концентрация лекарственного препарата не приводила к возникновению апоптоза. Любопытно, что в этих клетках не было выявлено мутации Т790М или амплификации МЕТ как стандартных механизмов приобретенной резистентности. Полученные клетки были малочувствительны ко многим классам таргетных препаратов, но, кроме этого, значительно менее устойчивы к химиотерапевтическому препарату цисплатину, что предполагает неспецифический характер резистентности.
Со времени выхода этой ключевой публикации данные Шармы и соавторов неоднократно подтверждали многие другие исследователи. Существование популяции DTP-клеток подтверждили при глиобластоме (злокачественной опухоли головного мозга), меланоме (злокачественной опухоли, возникающей из меланоцитов), колоректальном раке, раке молочной железы и многих других опухолях (рис. 2).
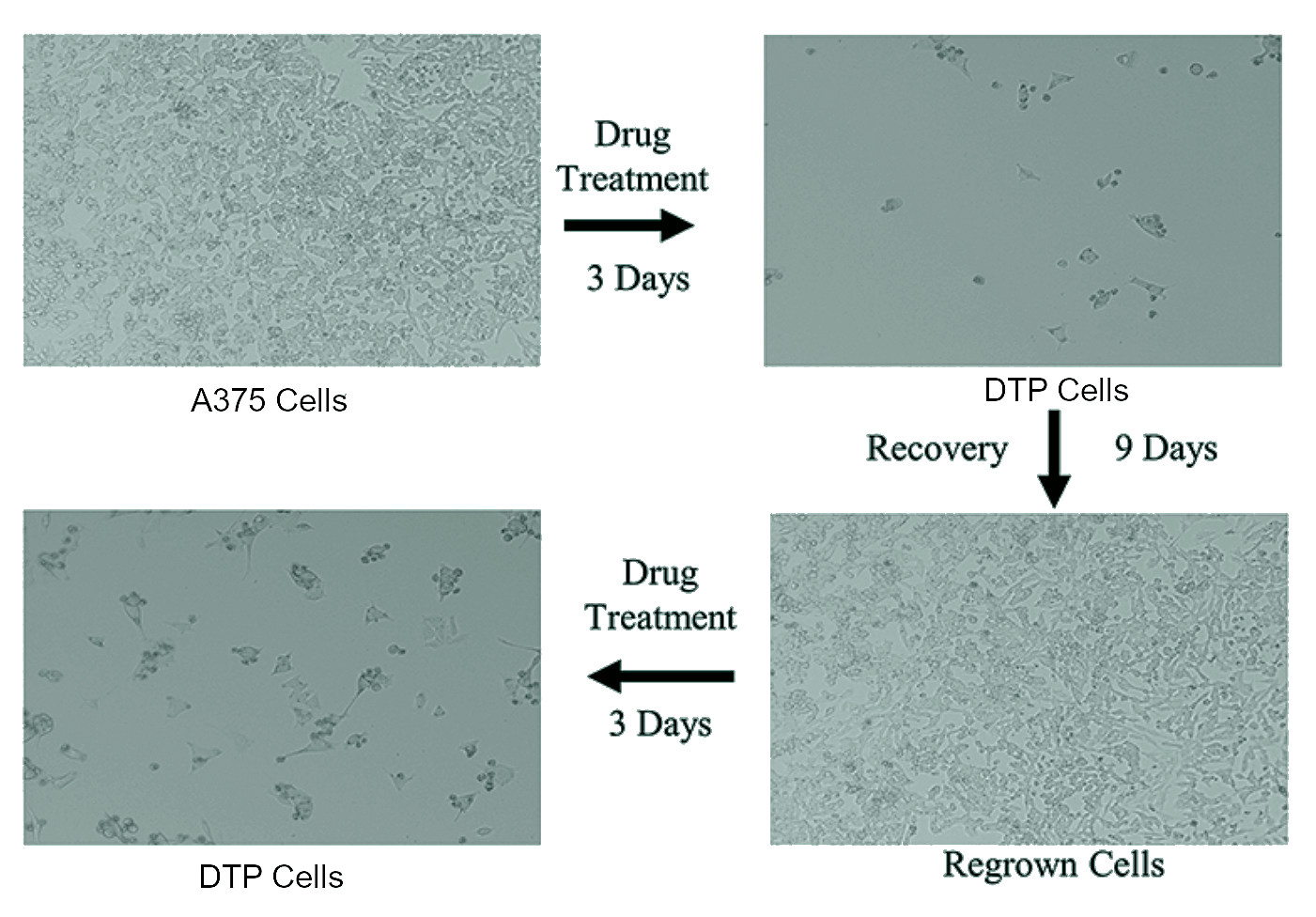
Рисунок 2. Клеточная линия меланомы А375. Микроскопическое изображение опухолевых клеток до лечения, выживших DTP после трехдневной экспозиции с лекарственным препаратом, восстановление популяции после отмены терапии и повторение цикла при новом лекарственном воздействии (ввиду сохраняющейся чувствительности опухоли к терапии).
Как можно заметить из рисунка 2, популяция DTP очень немногочисленна. Но именно присутствие этих клеток защищает опухоль от полной гибели при лекарственном воздействии. Держа в резерве DTP, опухоль имеет все возможности начать новое наступление на организм, и только вопрос времени, когда это случится.
Внимание, розыск!
Если бы мы составляли ориентировку на DTP-клетки как на опасных преступников, какие их особенности нужно было бы упомянуть в первую очередь? Оказывается, это очень сложная задача, поскольку такие особенности сложно отыскать. Дело в том, что не существует какого-то единого стабильного фенотипического маркера, характеризующего клетки опухоли в состоянии DTP. Именно поэтому их сложно изучать. Предполагают, что отсутствие единого биомаркера DTP вызвано существованием множества нозологических форм (разновидностей) опухолей, а также различиями в механизмах действия используемых лекарственных препаратов.
В клетках DTP происходит множество различных метаболических изменений. Исследователи из Университета Хьюстона, Прашант Карки с соавторами, оценили 689 различных метаболитов в DTP-клетках меланомы линии А375 после их трехдневной инкубации с гемцитабином. Авторы установили, что уровень 342 из них — аминокислот, фосфолипидов, интермедиатов цикла Кребса, пентозофосфатного пути и т.д. — тем или иным образом изменялся [13]. Помимо метаболического, в клетках DTP происходит и транскрипционное перепрограммирование. Так, секвенирование РНК единичных клеток глиобластомы при инкубации их с темозоломидом, химиотерапевтическим препаратом, использующимся для лечения этой опухоли, продемонстрировало, что состояние DTP характеризуется повышенной экспрессией четырех генов, которые кодируют белки-регуляторы активности компонентов межклеточного матрикса, отвечающие в том числе за тканевое ремоделирование (KLK5, FAT2, HB-EGF, CHI3L1) [14]. Два из них — HB-EGF и CHI3L1 — присутствуют во всех DTP-клетках, а синтез двух остальных варьирует от клетки к клетке. Вероятно, это создает необходимую фенотипическую гетерогенность, качественные и количественные параметры которой могут динамично изменяться в процессе прогрессии опухоли, обеспечивая более агрессивное ее поведение.
Интересен тот факт, что активность регуляторных участков генома и белков-транскрипционных факторов, которые с этими участками взаимодействуют, в покоящихся и пролиферирующих клетках DTP тоже изменяется по-разному. Так, группа исследователей под руководством Яары Орен установила, что в пролиферирующих DTP наблюдается усиление антиоксидантной защиты клеток [15]. Известно, что одним из главных антиоксидантных белков является транскрипционный фактор NRF2. В нормальных условиях NRF2 находится в основном в цитоплазме — в комплексе с белком-репрессором Keap1. В условиях окислительного стресса , индуцированного лекарственным воздействием, NRF2 высвобождается и аккумулируется в ядре, а затем связывается с сайтами ARE (элемента антиоксидантного ответа) и активирует многие гены, включая гены антиоксидантной защиты. Кроме того, NRF2 «переключает» метаболизм на окисление жирных кислот. Логично предположить, что лекарства, подавляющие активность NRF2 или препятствующие окислению жирных кислот, могут справиться с пролиферирующими DTP-клетками. Поскольку повышение транскрипционной активности NRF2 и степени окисления жирных кислот было описано авторами в различных клеточных культурах — меланомы, рака молочной железы и рака легкого, — это гипотетическое лекарство способно стать универсальным.
Окислительным стрессом называют процесс накопления в клетке значительных количеств токсичных активных форм кислорода (АФК), например, пероксидов и свободных радикалов.
Разработка новых лекарственных препаратов в области онкологии — это сложный и дорогостоящий процесс, к тому же, занимающий очень много времени. Поэтому препарат, воздействующий непосредственно на NRF2, в ближайшем будущем вряд ли появится. Можно пойти другим путем и попытаться воздействовать на компоненты NRF2-зависимых сигнальных путей уже существующими соединениями. Например, недавно было показано, что NRF2 вовлечен в транскрипционную регуляцию гена NPC1L1 (Niemann-Pick C1-Like1) [16]. Этот ген кодирует белок, участвующий во внутриклеточном транспорте холестерина. Существуют лекарственные препараты, являющиеся ингибиторами NPC1L1 — их давно и успешно применяют в качестве гиполипидемических средств. Возможно, в скором времени ингибиторы NPC1L1 найдут свое применение и в онкологии. При этом надо понимать, что панацеей такие препараты не станут, так как пролиферирующих DTP-клеток в опухолях мало и основной их пул находится в неактивном, «спящем» состоянии (рис. 3).
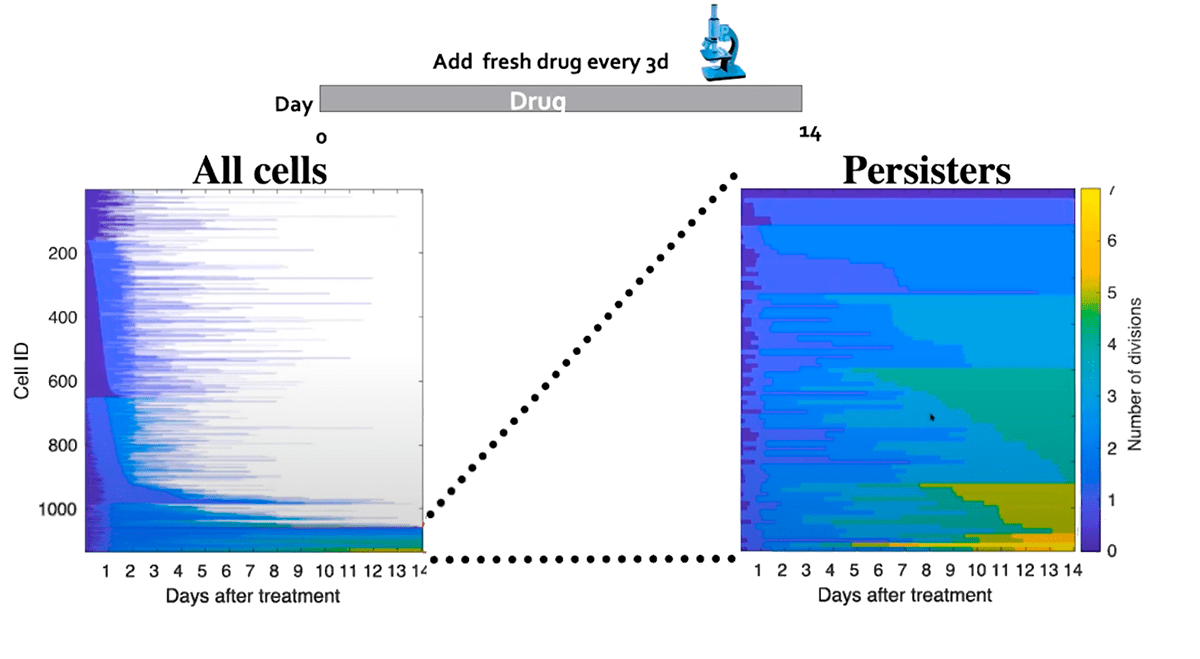
Рисунок 3. Схематичное изображение отношения пролиферирующих DTP-клеток (выделены желтым цветом) к их общему количеству (справа). На графике слева можно оценить, насколько немногочисленной является популяция DTP-клеток по сравнению со всей массой опухолевых клеток.
Все новое — это хорошо забытое старое, или Как микробиологи онкологов опередили
Интересно, что процесс образования небольшой по численности генерации клеток, способных сохранять жизнеспособность в присутствии лекарственных препаратов (в концентрациях, многократно превышающих терапевтические) был описан еще в 40-х годах ХХ века. Сделали это, правда, вовсе не молекулярные биологи, а микробиологи, которые заметили, что в культуре бактериальных клеток Staphylococcus aureus при воздействии на нее пенициллином эффект полной стерилизации отсутствует [17]. Небольшая выжившая субпопуляция бактерий сохраняла жизнеспособность, а после прекращения воздействия антибиотика давала начало новой микробной популяции — к слову, также чувствительной к нему. Это наблюдение стало убедительным доказательством того, что новая популяция бактерий сохраняет биологические свойства материнской культуры и не представляет собой генетически модифицированный пенициллин-резистентный штамм, а выжившие клетки являются фенотипическим вариантом первоначальной популяции. Сохраняющие жизнеспособность в присутствии антибиотика бактериальные клетки назвали персистирующими. Они находятся в состоянии метаболического и репродуктивного покоя, что и было подтверждено через два года, в 1944 году, в экспериментах Джозефа Биггера [18].
С самого момента открытия феномен персистенции бактерий активно изучался . В частности, обнаружилось, что клетки-персистеры обычно составляют лишь малую часть бактериальной популяции. В штаммах Escherichia coli дикого типа их частота — не более одной на миллион клеток. Но в некоторых условиях — например, в биопленках, — частота таких персистеров может значительно, более чем в сто раз, возрастать.
«Биомолекула» освещала эту тему в статье «Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью» [19].
Биологическая целесообразность существования таких клеточных генераций микроорганизмов связана с необходимостью сохранения популяции в условиях изменения условий внешней среды. Отличаясь сниженной метаболической активностью и находясь в фазе покоя, клетки-персистеры при наступлении оптимальных условий приобретают способность к быстрому восстановлению своих исходных патогенных характеристик. С этих позиций можно рассматривать популяцию бактериальных клеток, в которых присутствуют персистеры, как обладающую определенным адаптационным потенциалом, направленным на сохранение вида.
Сейчас нам понятно, что наличие в организме этой генерации бактерий снижает эффективность лечения антибиотиками, но вызвано это не генетической лекарственной устойчивостью микроорганизмов, а временной и обратимой фенотипической толерантностью персистирующих клеток. Такие клеточные формы патогенных бактерий способствуют возникновению персистирующих инфекций, очень трудно поддающихся лечению. Персистенция — феномен, присущий не только бактериям. Обнаружена она и у вирусов (к персистенции способны, например, вирусы ветряной оспы и кори), а теперь еще и у опухолевых клеток. Похоже, не сговариваясь, все они используют стратегию бет-хэджинга (защиты от рисков). Бет-хэджинг — это финансовый термин, который плавно перекочевал в эволюционную биологию и используется для обозначения стратегии, позволяющей избежать необратимых потерь при стрессовых или любых необычных воздействиях, пусть и за счет чуть меньшего успеха в нормальных условиях.
С момента появления первой публикации о DTP интерес к феномену сохраняющих жизнеспособность на фоне лечения опухолевых клеток, способных менять свой фенотип при наличии стрессорного фактора в окружающей среде, возрос многократно. Персистирующие опухолевые клетки являются объектом изучения научных лабораторий во всем мире. По запросу drug-tolerant persister cells в базе данных PubMed можно найти почти 1500 различных работ. Феномену DTP посвящены сессии на различных конференциях. Это неудивительно, ведь, как известно, врага нужно знать в лицо.
К сожалению, клетки DTP способны умело маскироваться. С одной стороны, популяция персистеров обогащена клетками, синтезирующими маркеры стволовых клеток — CD133 и СD44 [20]. Клетки с таким иммунофенотипом характеризуются профилем генной экспрессии, во многом сходным с таковым у стволовых клеток нормальных тканей. С другой стороны, клетки в состоянии DTP приобретают черты стареющих клеток, то есть клеток, которые перестали выполнять свои функции, но при этом еще не умерли. Возможно, клетки опухоли только «притворяются» стареющими, чтобы переждать стресс, вызванный лекарственной терапией. А затем они вновь «молодеют» и начинают размножаться, что неизбежно приводит к резистентности и прогрессии опухоли [21].
Однако такое обратимое старение — явление достаточно редкое. Гораздо чаще встречается другой — паракринный — механизм влияния стареющих клеток на развитие резистентности к терапии [22]. Помимо того, что стареющие клетки хуже справляются со своими функциями, они еще и обретают особый секреторный фенотип SASP (от англ. Senescence associated secretory phenotype) и выделяют во внеклеточную среду множество растворимых факторов, таких как цитокины, хемокины, протеазы и ростовые факторы. С одной стороны, профиль секретируемых стареющими клетками продуктов SASP привлекает клетки иммунной системы, что лежит в основе опухолевой супрессии. С другой стороны, компоненты SASP стимулируют пролиферацию клеток микроокружения, в том числе и находящихся рядом DTP [6]. Что в конечном итоге перевесит — положительные или негативные эффекты SASP, — будет зависеть от баланса между временем присутствия стареющих клеток в популяции и скоростью их элиминации клетками иммунной системы. В связи с этим перспективной может оказаться разработка стратегий, направленных на модуляцию состава факторов, секретируемых стареющими клетками.
И, наконец, некоторые исследователи сравнивают транскрипционный профиль и функциональное состояние DTP с диапаузой, феноменом остановки эмбрионального развития на стадии бластоцисты при воздействии неблагоприятных факторов внешней среды. Диапауза описана для многих представителей животного мира (хорьки, медведи) и используется ими как стратегия выживания вида в нестабильных условиях окружающей среды. Удивительно, но опухоли способны брать на вооружение похожие механизмы. Так, ключевую роль в процессе входа и выхода из диапаузы играет протеиновый комплекс mTOR, и он же регулирует образование DTP-клеток под воздействием химиотерапевтического препарата СPT-11 в клеточных линиях колоректального рака [23].
Еще одна связь между DTP и эмбриональной диапаузой — использование аутофагии , хорошо известного биологического механизма клеточной смерти, при котором клеточные органеллы и белки фактически съедают сами себя.
«Биомолекула» ранее уже писала об аутофагии: «Нобелевская премия по медицине и физиологии 2016: за самоедство» [24] «Аутофагия, протофагия и остальные» [25].
Центральную роль в запуске процесса аутофагии, как и в случае с диапаузой, играет mTOR, а именно уменьшение активности mTOR-сигнального пути в условиях энергетического дефицита или гипоксии, что вызывает образование аутофаголизосом. Индуктором процессов аутофагии в клетках является не только дефицит питательных веществ, но и метаболический стресс, вызванный влиянием противоопухолевой терапии. Поскольку лекарственно-индуцированная аутофагия способствует прогрессии опухоли, можно предположить, что использование ингибиторов аутофагии (таких как хлорохин и гидроксихлорохин — хорошо всем известных первых предложенных лекарств против SARS-CoV-2) будет потенцировать действие химиотерапевтических препаратов, а также поможет преодолеть резистентность опухолей к терапии.
Таким образом, популяция DTP, хоть и является немногочисленной, гетерогенна по своему составу и может варьировать в зависимости от типа опухоли, а также меняться на разных стадиях ее развития и в зависимости от схемы применяемой терапии. Эти злокачественные клетки демонстрируют высокий потенциал пластичности, устойчивость к стрессовым факторам, например, к действию противоопухолевых препаратов, и характеризуются обратимым состоянием покоя как общего ответа на стрессорное воздействие. В определенный момент времени в клетках-потомках тех, что пережили лекарственное воздействие и перешли в состояние толерантности к нему, возникают новые мутации, причем в количестве существенно большем, чем в «родительских» клетках. Это было продемонстрировано в экспериментах на клеточных линиях колоректального рака DiFi и WiDr (рис. 4) [26].
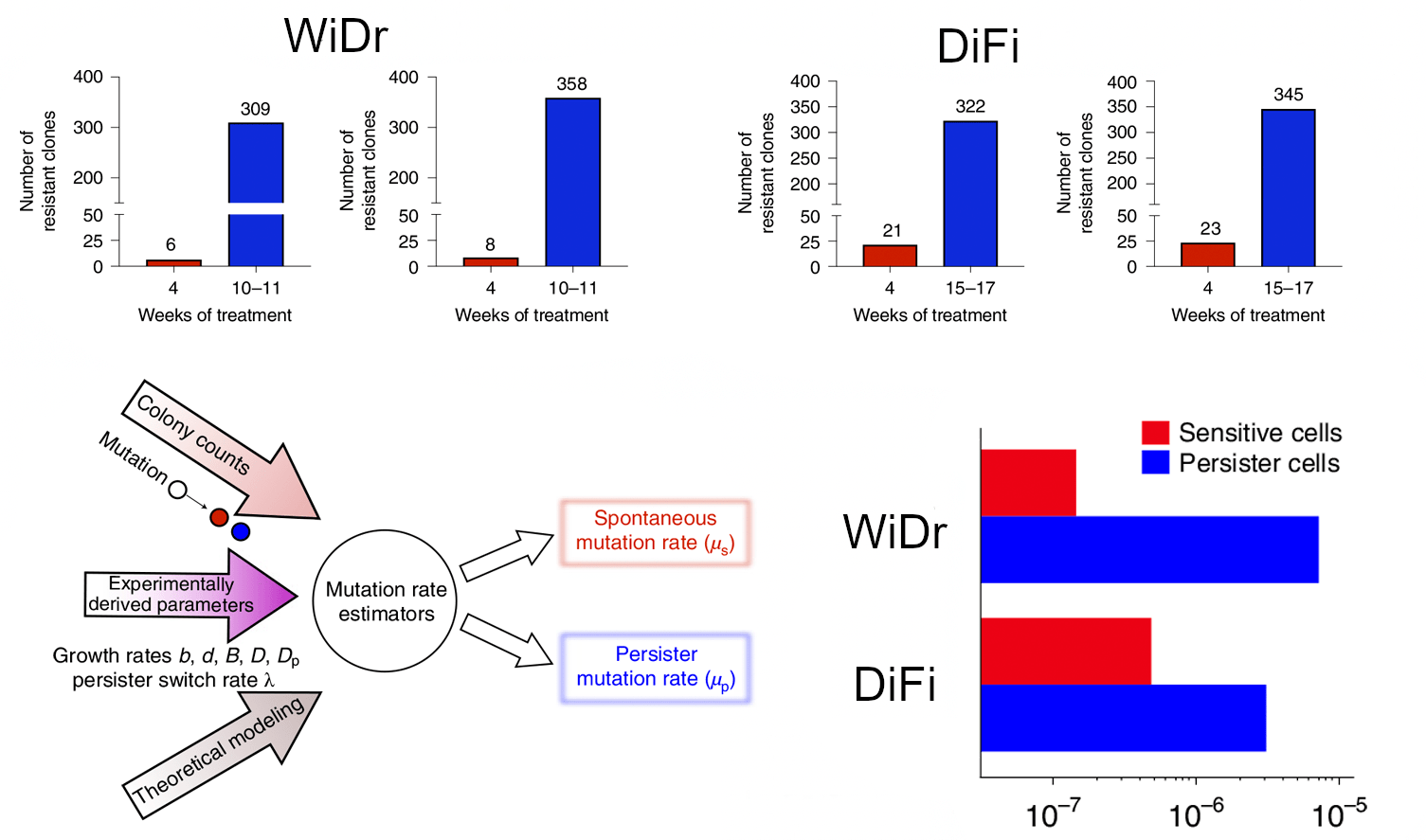
Рисунок 4. Общая схема эксперимента и выявленный уровень мутаций в клеточных линиях колоректального рака DiFi и WiDr. Красным цветом обозначен уровень мутаций в чувствительных к лекарственным препаратам цетуксимабу и дабрафенибу клетках. Синим — уровень мутаций в DTP. Для каждой клеточной линии приведены два графика (вверху), поскольку измерения выполнялись в двух повторах.
Возможный механизм возникновения таких мутаций связан, скорее всего, с ошибками в процессе репликации, так как на фоне подавления генов репарации в DTP-клетках активизируются подверженные ошибкам ДНК-полимеразы, что приводит к нецелевому мутагенезу [26]. В конечном итоге, именно благодаря DTP, опухоль способна выжить при лекарственном воздействии, постепенно возобновить рост, приобрести новые генетические аберрации и стать резистентной, причем эта резистентность будет иметь необратимый характер. Теперь, после открытия DTP, прогрессирование злокачественных новообразований представляется еще более сложным процессом, а противоопухолевая терапия — еще более проблематичной.
И все же, стратегии борьбы с DTP-клетками существуют. Например, можно попытаться «разбудить» их, увеличив количество пролиферирующих клеток, а затем использовать, к примеру, цитостатическую терапию. Минус здесь заключается в том, что «выпустив джина из бутылки», мы можем недостаточно эффективно контролировать его, что чревато быстрым рецидивированием или метастазированием опухоли. Другой подход заключается в том, чтобы поддерживать DTP-клетки в состоянии постоянной спячки и не давать им «проснуться». Однако это требует постоянного воздействия терапевтических препаратов на опухоль и организм в целом, что в реальной жизни невозможно, в первую очередь, из-за риска развития нежелательных явлений. В любом случае, нам понятно, что не существует простых способов лечения злокачественных заболеваний — у раковых клеток слишком много уловок, помогающих выжить. Выстраивание оптимальной схемы лечения — чтобы не допустить формирования резистентного клона опухоли — требует разработки сложной комбинированной терапии, которая должна быть направлена в том числе и на клетки в состоянии DTP.
Заключение
К развитию приобретенной резистентности приводит не только генетическая нестабильность, но и фенотипическая гетерогенность опухолевых клеток. В этом заложен глубокий биологический смысл, так как чем более неоднородна популяция клеток опухоли, тем быстрее она эволюционирует, чтобы достичь максимума приспособляемости. Таким максимумом в условиях лекарственного воздействия на опухоль является резистентность к проводимой терапии.
Преодоление опухолевой резистентности — серьезный вызов, который стоит перед современной медицинской наукой. Открытие клеток DTP, выявление механизмов их функционирования, а также первые положительные результаты в разработке стратегий борьбы с ними позволяют смотреть в будущее с некоторой долей оптимизма.
Литература
- Состояние онкологической помощи населению России в 2021 году / А.Д. Каприн, В.В. Старинский, А.О. Шахзадова. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. — 239 с.;
- M. Beau-Faller, N. Prim, A.-M. Ruppert, I. Nanni-Metéllus, R. Lacave, et. al.. (2014). Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Annals of Oncology. 25, 126-131;
- Celia Delahaye, Sarah Figarol, Anne Pradines, Gilles Favre, Julien Mazieres, Olivier Calvayrac. (2022). Early Steps of Resistance to Targeted Therapies in Non-Small-Cell Lung Cancer. Cancers. 14, 2613;
- Соревнуясь с раком;
- Jingyi He, Zhengrong Huang, Linzhi Han, Yan Gong, Conghua Xie. (2021). Mechanisms and management of 3rd‑generation EGFR‑TKI resistance in advanced non‑small cell lung cancer (Review). Int J Oncol. 59;
- Giulia De Conti, Matheus Henrique Dias, René Bernards. (2021). Fighting Drug Resistance through the Targeting of Drug-Tolerant Persister Cells. Cancers. 13, 1118;
- Mark A. Rubin, Robert G. Bristow, Phillip D. Thienger, Caroline Dive, Marcin Imielinski. (2020). Impact of Lineage Plasticity to and from a Neuroendocrine Phenotype on Progression and Response in Prostate and Lung Cancers. Molecular Cell. 80, 562-577;
- Grigoriy A. Chizh, Yuliya A. Tyutrina, Svetlana A. Protsenko, Ernest S. Dzhelialov, Dilorom H. Latipova. (2022). Current concepts of neuroendocrine cancer of the prostate: a clinical case and review of the literature. J. Mod. Onco.. 24, 242-249;
- Shensi Shen, Stéphan Vagner, Caroline Robert. (2020). Persistent Cancer Cells: The Deadly Survivors. Cell. 183, 860-874;
- Heidie Frisco Cabanos, Aaron N. Hata. (2021). Emerging Insights into Targeted Therapy-Tolerant Persister Cells in Cancer. Cancers. 13, 2666;
- Elizabeth A. Kuczynski, Daniel J. Sargent, Axel Grothey, Robert S. Kerbel. (2013). Drug rechallenge and treatment beyond progression—implications for drug resistance. Nat Rev Clin Oncol. 10, 571-587;
- Sreenath V. Sharma, Diana Y. Lee, Bihua Li, Margaret P. Quinlan, Fumiyuki Takahashi, et. al.. (2010). A Chromatin-Mediated Reversible Drug-Tolerant State in Cancer Cell Subpopulations. Cell. 141, 69-80;
- Prashant Karki, Vahideh Angardi, Juan C. Mier, Mehmet A. Orman. (2022). A Transient Metabolic State in Melanoma Persister Cells Mediated by Chemotherapeutic Treatments. Front. Mol. Biosci.. 8;
- Marion Rabé, Lucie Fonteneau, Lisa Oliver, Alvaro Morales-Molina, Camille Jubelin, et. al.. (2022). Cellular Heterogeneity and Cooperativity in Glioma Persister Cells Under Temozolomide Treatment. Front. Cell Dev. Biol.. 10;
- Yaara Oren, Michael Tsabar, Michael S. Cuoco, Liat Amir-Zilberstein, Heidie F. Cabanos, et. al.. (2021). Cycling cancer persister cells arise from lineages with distinct programs. Nature. 596, 576-582;
- Zhe Zhang, Siyuan Qin, Yan Chen, Li Zhou, Mei Yang, et. al.. (2022). Inhibition of NPC1L1 disrupts adaptive responses of drug‐tolerant persister cells to chemotherapy. EMBO Mol Med. 14;
- G. L. Hobby, K. Meyer, E. Chaffee. (1942). Observations on the Mechanism of Action of Penicillin.. Experimental Biology and Medicine. 50, 281-285;
- JosephW. Bigger. (1944). TREATMENT OF STAPHYLOCOCCAL INFECTIONS WITH PENICILLIN BY INTERMITTENT STERILISATION. The Lancet. 244, 497-500;
- Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью;
- Changlin Yang, Guimei Tian, Mariana Dajac, Andria Doty, Shu Wang, et. al.. (2022). Slow-Cycling Cells in Glioblastoma: A Specific Population in the Cellular Mosaic of Cancer Stem Cells. Cancers. 14, 1126;
- Maja Milanovic, Dorothy N. Y. Fan, Dimitri Belenki, J. Henry M. Däbritz, Zhen Zhao, et. al.. (2018). Senescence-associated reprogramming promotes cancer stemness. Nature. 553, 96-100;
- Karla Santos-de-Frutos, Nabil Djouder. (2021). When dormancy fuels tumour relapse. Commun Biol. 4;
- Sumaiyah K. Rehman, Jennifer Haynes, Evelyne Collignon, Kevin R. Brown, Yadong Wang, et. al.. (2021). Colorectal Cancer Cells Enter a Diapause-like DTP State to Survive Chemotherapy. Cell. 184, 226-242.e21;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Аутофагия, протофагия и остальные;
- Mariangela Russo, Simone Pompei, Alberto Sogari, Mattia Corigliano, Giovanni Crisafulli, et. al.. (2022). A modified fluctuation-test framework characterizes the population dynamics and mutation rate of colorectal cancer persister cells. Nat Genet. 54, 976-984.







