
От поцелуя до лимфомы один вирус
23 ноября 2015
От поцелуя до лимфомы один вирус
- 11937
- 1
- 3
Будьте осторожны с поцелуями!
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: За последние три десятилетия становится все очевиднее, что некоторые вирусы играют ключевую роль в развитии человеческих злокачественных новообразований. В последние годы наблюдается рост числа больных, страдающих хроническими рецидивирующими герпесвирусными инфекциями. По данным различных авторов, в настоящее время до 80–90% населения земного шара инфицировано вирусом Эпштейна — Барр (ВЭБ). С этим вирусом связывают возникновение африканской лимфомы Беркитта (ЛБ), недифференцированного рака носоглотки (нРНГ), В-клеточных лимфом у больных с иммунодефицитами различного происхождения. Эпидемиологическое значение ВЭБ определяется широкой циркуляцией вируса среди населения. Актуальность проблемы обусловлена высокой степенью поражения людей во всем мире, часто латентным течением болезни и пожизненной персистенцией вируса. По данным ВОЗ, заболевания, обусловленные герпесвирусной инфекцией, занимают второе место после гриппа среди всех инфекционных патологий.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Исследования в области происхождения злокачественных опухолей, ежегодно уносящих миллионы человеческих жизней, ведутся с XIX века. Работая в области молекулярной вирусологии, Вармус совместно с Дж. М. Бишопом в исследованиях 1970-х гг. сделали открытие, которое по-новому осветило долго остававшуюся дискуссионной проблему этиологии опухолей у человека и животных. Согласно полученным результатам, неконтролируемый рост клеток, образующих опухоль, вызывается не только проникающим в клетку извне онковирусом, но и внутренними процессами в самой клетке. Вармус доказал, что нормальные гены роста клетки вследствие случайных спонтанных мутаций под воздействием химических канцерогенов или, порой, процесса старения могут изменять свою молекулярную структуру и таким образом превращаться в протовирусы онкогенной природы. За открытие клеточного происхождения онкогенных протовирусов Вармус совместно с Дж. М. Бишопом в 1989 г. были удостоены Нобелевской премии по физиологии и медицине [1].
Также в начале 1970-х годов немецкий исследователь Харальд цур Хаузен [2] успешно использовал для идентификации вирусов новую в то время технику гибридизации in situ. Ученые давно предполагали, что рак шейки матки и другие генитальные разновидности рака вызываются каким-то вирусом, передающимся половым путем, — например, вирусом герпеса. Однако с герпесом у Хаузена ничего не получилось: ДНК вируса герпеса в образце опухоли шейки матки обнаружить не удалось. Поэтому он предположил, что рак шейки матки обусловлен не вирусом герпеса, а другим агентом — вирусом папилломы человека. Предположение неожиданное, поскольку вирус папилломы считался в то время довольно безобидным. Цур Хаузен также высказал соображение, что ДНК вируса папилломы встраивается в геном клетки «хозяина», то есть опухолевые клетки хранят генетическую информацию вируса. Причем вирус папилломы не воспроизводит в клетке свои копии, как это обычно происходит при вирусной инфекции, а как бы «спит» внутри инфицированных клеток. Впоследствии Цур Хаузену и его коллегам в 1983 году удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль. В 2008 году Харальд цур Хаузен признан лауреатом Нобелевской премии по физиологии и медицине «за открытие вируса папилломы человека как причины рака шейки матки» [3]. Он также занимался изучением ВЭБ и пытался найти взаимосвязь вируса с другими заболеваниями. В итоге ему это удалось: он доказал, что ВЭБ способствует возникновению лимфомы Беркитта [4], [5].
Один из самых распространенных вирусов в человеческой популяции — вирус Эпштейна — Барр (рис. 1) — был открыт и описан в 1964 году двумя английскими вирусологами: Майклом Эпштейном и Ивонной Барр. Вирус Эпштейна — Барр (ВЭБ) — член семейства герпесвирусов [6], [7]. В инфицированных клетках вирусная ДНК, как правило, не встроена в клеточный геном, а находится в ядре в виде замкнутого кольца (эписомы). Биологическое значение интеграции ВЭБ в геном клетки остается неясным. Высказываются предположения, что эписомная ДНК необходима для реализации полноценной репликации ВЭБ, завершающейся формированием вирусных частиц [8].
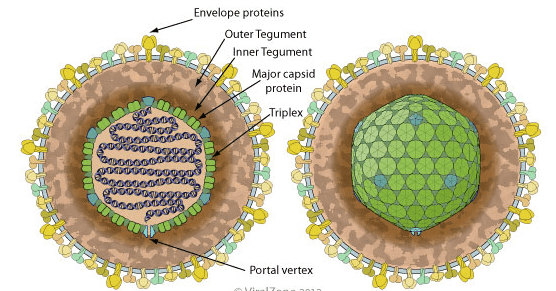
Рисунок 1. Структура вириона вируса Эпштейна — Барр. Вирион ВЭБ построен таким образом, что вирусная нуклеиновая кислота окружена белковой оболочкой (капсидом), образуя вместе с ней структуру, получившую название нуклеокапсид. Капсид имеет 25 граней и состоит из 162 субъединиц (так называемых капсомеров). Средние размеры вириона — около 150 нанометров. Снаружи вирусная частица покрыта двухслойной мембраноподобной оболочкой, именуемой суперкапсидом, или пеплосом. При этом между внешней мембраноподобной структурой и нуклеокапсидом располагается так называемая волокнистая оболочка, имеющая белковую природу и получившая название тегумент [8].
В отличие от многих других герпесвирусов, вирус Эпштейна — Барр поражает в первую очередь эпителиальные клетки ротовой полости, глотки, миндалин. Здесь он размножается наиболее активно, и поэтому главным путем заражения вирусом являются поцелуи (вот и приехали). Наибольшее количество вирусных частиц находится в клетках эпителия около слюнных желез, и со слюной выделяется большое количество их. Не удивительно, что инфекционный мононуклеоз — самое распространенное заболевание, вызываемое вирусом Эпштейна — Барр, — называют еще болезнью поцелуев [9].
Входными воротами инфекции являются клетки ротовой полости и носоглотки [10]. ВЭБ проникает в В-лимфоидную ткань ротоглотки, а затем происходит его распространение по всей лимфатической системе организма. ДНК вируса попадает в ядро клеток, при этом белки ВЭБ предоставляют инфицированным В-лимфоцитам способность непрерывно размножаться в культуре. Вирус может делать клетки бессмертными [11].
После первой встречи человека с ВЭБ вирус в незначительном количестве сохраняется в организме хозяина в течение всей жизни. Однако если любой элемент иммунного ответа нарушен, даже незначительное количество ВЭБ-инфицированных клеток может преумножиться колоссально [12].
Инфицированные В-клетки могут значительное время находиться в миндалинах, что позволяет вирусу выделяться во внешнюю среду со слюной. С зараженными клетками ВЭБ распространяется по другим органам. В пораженных вирусом клетках возможно два вида развития: литический, приводящий к разрушению клетки-хозяина, и латентный (клетка заражена, но ничего не выдает о месте нахождения вируса), когда число вирусных копий небольшое и клетка не разрушается. ВЭБ может длительно находиться в В-лимфоцитах, эпителии носоглотки и слюнных железах. Кроме того, он способен проникать и в другие клетки: Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эпителиоциты сосудов (рис. 2а, 2б) [13].
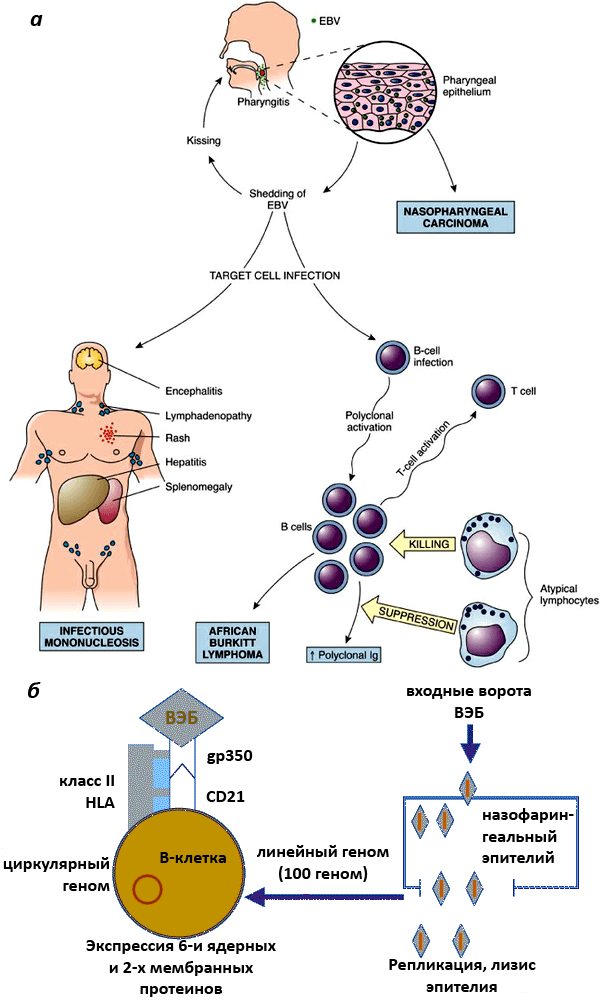
Рисунок 2. Проникновение ВЭБ в организм. а — Механизм проникновения ВЭБ в организм хозяина. При первичном заражении после активного увеличения количества вирионов в эпителиальной ткани они попадают в кровь и разносятся по всему организму. Большое количество их помимо слюнных желез обнаруживается также в клетках шейки матки, печени и селезенки. Главной мишенью их становятся В-лимфоциты, клетки иммунной системы. б — Схема проникновения ВЭБ в B-лимфоциты. Проникновение ВЭБ в В-лимфоциты осуществляется через рецептор этих клеток CD21. Роль корецептора выполняют молекулы класса II HLA.
Злокачественные лимфомы (например, увеличение лимфоузлов), согласно данным Международного агентства по изучению рака, составляют 3–4% среди всех регистрируемых в мире злокачественных новообразований [14]. Лимфомы делят на две основные группы: лимфома Ходжкина (20–30 % всех лимфом) и неходжкинские лимфомы (около 70%) [14], [15].
Лимфома Ходжкина (ЛХ) — самостоятельное заболевание, при котором характерные измененные (раковые) клетки, известные как клетки Ходжкина и Рид — Штернберга, рассеяны среди окружающих воспалительных клеток и составляют лишь около 2% объема опухолевой массы [16]. После первичного заражения вирус долгое время находится в В-клетках памяти в «покойном» состоянии на протяжении всей жизни хозяина. У здоровых лиц, зараженных ВЭБ, ингибирующее воздействие на размножение вируса оказывает врожденный (доставшийся от папы с мамой) иммунитет хозяина [17]. Следовательно, повышенный риск заболеть ЛХ у больных с иммунодефицитом может быть объяснен потерей иммунного контроля над вирусной инфекцией.
Неходжкинские лимфомы — это совокупность новообразований, в возникновении которых принимают участие различные агенты [18]. Первая группа — это вирусы, трансформирующие лимфоциты и другие клетки (ВЭБ, HHV-8). Вторая группа представлена факторами различной природы, вызывающими иммунодефицитные состояния. К таким факторам в первую очередь относится ВИЧ (вирус иммунодефицита человека), вызывающий у инфицированного лица подавление иммунитета в результате истощения пула Т-лимфоцитов CD4+ и возникновение СПИДа. В третью группу входят некоторые инфекции, (например, H. pylori), которые увеличивают риск возникновения лимфом на фоне вызываемой ими хронической стимуляции иммунной системы и постоянной активации лимфоцитов [17].
Исследования последних лет свидетельствуют о том, что в патогенезе ВЭБ-ассоциированных патологий чрезвычайно важную роль играет вредный LMP1 — латентный мембранный белок 1, кодируемый одноименным геном (LMP1). Он обладает свойствами онкобелка и функционирует как постоянно активный псевдорецептор. Он способен изменять В-лимфоциты человека [19].
Существует гипотеза о том, что этот ген вирус «украл» у клеток человека в процессе эволюции. Кроме того, высказывается предположение о возможной роли этого белка в развитии аутоиммунных заболеваний [20].
Есть предположение, что аминокислотные замены, накапливающиеся в LMP1, по-видимому, также вносят свой вклад в возникновение опухолей. Механизм этого процесса окончательно не установлен, но предполагается, что усиленный трансформирующий эффект мутированных LMP1 может представлять важную составляющую этого процесса. При этом показано, что различия в последовательности гена LMP1 могут определять агрессивный географически локализованный генотип ВЭБ [21].
Из известных механизмов действия LMP-2 (второй из братьев семейства LMP), расположенного на противоположном конце линейного генома, упоминается лишь способность этих белков совместно повышать сигнальную трансдукцию в ВЭБ (+) клетках [19].
По данным Харальда цур Хаузена, связь между вирусом и раковым заболеванием считается установленной при определении следующих критериев:
- эпидемиологические доказательства того, что вирусная инфекция является фактором риска для развития специфической опухоли;
- присутствие и сохранение генома вируса в клетках опухоли;
- стимуляция пролиферации клеток после введения генома (или его части) вируса в ткани культуры клеток;
- демонстрация того, что геном возбудителя индуцирует пролиферацию и злокачественный фенотип опухоли [19].
Несмотря на более чем 45-летний период изучения биологических свойств этого вируса, ВЭБ до сих пор остается вирусом-загадкой. С одной стороны, это убиквитарный вирус, практически тотально инфицирующий население Земли. С другой — он доказанный или предполагаемый этиологический агент для целого ряда доброкачественных и злокачественных новообразований лимфоидного, эпителиального и мезенхимального происхождения. Наиболее убедительным аргументом в пользу канцерогенности ВЭБ является обнаружение в злокачественных клетках вызываемых им опухолей генетической информации вируса в виде клональных экстрахромосомных эписом. Клональность вируса предполагает развитие событий, согласно которым опухоль возникает из единственной инфицированной ВЭБ клетки, чья успешная дальнейшая селекция может быть стимулирована экспрессией одного или нескольких вирусных генов. Высказанное предположение поддерживается способностью ВЭБ «обессмертить» («иммортализовать») В-лимфоциты человека in vitro и легкостью спонтанного установления ВЭБ-содержащих лимфобластоидных клеточных линий (ЛКЛ) из образцов крови и лимфоидной ткани лиц, инфицированных вирусом, особенно в случаях иммуносупрессии хозяина.
Однако канцерогенность ВЭБ далеко не однозначна. Несмотря на то, что кодируемые вирусом продукты способны вызывать пролиферацию инфицированных клеток, ведущую к возникновению лимфом у больных с иммунодефицитом, эти клинически агрессивные опухоли довольно часто поликлональны и подвергаются регрессии при восстановлении иммунного ответа на ВЭБ. Такие опухоли как лимфома Беркитта (ЛБ) и лимфома Ходжкина (ЛХ) встречаются не только в ВЭБ-ассоциированных, но и в ВЭБ-неассоциированных вариантах, что говорит о том, что патогенез этих новообразований связан не только с ВЭБ. Кроме того, злокачественные клетки больных ЛБ и ЛХ отличаются фенотипически от клеток ЛКЛ, полученных под воздействием ВЭБ in vitro, и не экспрессируют ряд белков, необходимых для трансформирующего роста. Эти находки позволяют предположить, что опухолевые клетки могут возникать и под воздействием факторов невирусного происхождения, а также зависеть от различных усиливающих рост клеток стимулов [17].
Лабораторная диагностика ВЭБ-инфекции базируется на цитологическом исследовании крови или костного мозга, серологических исследованиях и ПЦР. С помощью метода ПЦР можно определить ДНК вируса в плазме до клинических проявлений болезни, а репликация вируса в организме является показанием к противовирусной терапии и критерием эффективности проведенного лечения. Материалом для исследования служат слюна или рото- и носоглоточная слизь, соскоб эпителиальных клеток урогенитального тракта, кровь, спинномозговая жидкость, ткани опухоли и костный мозг. Как у больных ВЭБ, так и у носителей может быть получен положительный результат в ПЦР. Поэтому для их дифференцировки проводится количественный ПЦР-анализ для определения количества копий вирусного генома. У маленьких детей (до 1–3-х лет) по причине недостаточно сформированного иммунитета диагностика по антителам затруднительна, поэтому в данной группе пациентов в помощь приходит именно ПЦР. Однако в силу того, что ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов (до 30%), связанный именно с отсутствием репликации в момент исследования. При этом важно сопоставление результатов клинических, серологических и молекулярных обследований в определении ВЭБ-инфекции, как причины имеющегося заболевания [1].
Специфическая профилактика (вакцинация) против ВЭБ не разработана, но проводятся клинические испытания. Основной проблемой при разработке вакцины является большое отличие в белковом составе вируса на разных фазах его существования. Впрочем, в настоящее время разрабатывается вакцина, которая содержит рекомбинантный поверхностный антиген gp350. После вакцинации первичная инфекция протекает субклинически, но собственно инфицирование человека не предупреждается. Кроме того, вырабатывающиеся нейтрализующие антитела не влияют на течение различных форм латентной инфекции, в том числе опухолей. Профилактические меры сводятся к укреплению иммунитета, закаливанию детей, мерам предосторожности при появлении больного в окружении, соблюдению правил личной гигиены.
Заключение
Широкое распространение ВЭБ с выраженным трансформирующим потенциалом среди населения планеты и редкого возникновения в инфицированной популяции связанных с этим вирусом опухолей с преимущественной их локализацией в определенных географических регионах позволяет сделать важный вывод. Подобно большинству опухолей иной вирусной природы, в патогенезе ВЭБ-ассоциированных новообразований важную роль играют дополнительные факторы, и одного ВЭБ недостаточно для возникновения опухоли. ВЭБ лишь инициирует пролиферацию инфицированных им клеток, а последующие события влияют на гистопатологический спектр возникающих неоплазий. Одним из важнейших факторов, в значительной степени определяющих возникновение ВЭБ-ассоциированных опухолей, служит выраженная иммуносупрессия (врожденная, ятрогенная или индуцированная любой вирусной инфекцией, и в первую очередь ВИЧ), приводящая к утрате функции иммунного распознавания клеток, инфицированных ВЭБ.
Таким образом, несмотря на многолетнее изучение связи ВЭБ с опухолями человека, вопрос о роли вируса в их возникновении до конца не изучен. Раскрытие механизма злокачественной трансформации вирусом, персистирующим в латентном состоянии более чем у 90% населения планеты, — задача чрезвычайно сложная. Однако технические достижения последних лет, существенно повысившие специфичность исследований, позволяют надеяться, что детали ВЭБ-ассоциированного канцерогенеза будут выяснены.
Литература
- Лауреаты Нобелевской премии в области генетики. (2012). Электронная библиотека студента «Библиофонд»;
- Увидевший вирусы в раке. Харальд цур Хаузен;
- Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования;
- Белоконева О. (2008). Нобелевская премия по физиологии и медицине 2008 года. Наука и жизнь;
- Alison Abbott. (2008). Virus discoveries secure Nobel prize in medicine. Nature;
- Lawrence S Young, Paul G Murray. (2003). Epstein–Barr virus and oncogenesis: from latent genes to tumours. Oncogene. 22, 5108-5121;
- Margaret L. Gulley. (2001). Molecular Diagnosis of Epstein-Barr Virus-Related Diseases. The Journal of Molecular Diagnostics. 3, 1-10;
- Smith T.F. Herpesviruses. In: Clinical and pathogenic microbiology (2-th edition) /ed. by Howard B.J. St.Louis: Mosby, 1994. P. 785–800;
- Чем грозит Вирус Эпштейна-Барр? (2012). Herpes911;
- Никольский И.С. (2006). Инфекция, вызываемая вирусом Эпштейна—Барр: иммунопатогенез, клиника и лечение. Медицинские новости. 9, 24–30;
- Glenda C Faulkner, Andrew S Krajewski, Dorothy H Crawford. (2000). The ins and outs of EBV infection. Trends in Microbiology. 8, 185-189;
- Gemma L. Kelly, Heather M. Long, Julianna Stylianou, Wendy A. Thomas, Alison Leese, et. al.. (2009). An Epstein-Barr Virus Anti-Apoptotic Protein Constitutively Expressed in Transformed Cells and Implicated in Burkitt Lymphomagenesis: The Wp/BHRF1 Link. PLoS Pathog. 5, e1000341;
- Кудин А.П. (2006). Эта «безобидная» вирус Эпштейна-Барра инфекция. Часть 1. Характеристика возбудителя. Реакция иммунной системы на вирус. Медицинские новости. 7, 14–22;
- Boyle P. and Levin B. World Cancer Report 2008. Lyon: IARC-press, 2008. — 512 p.;
- Jaffe E.S., Harris N.L., Stein H, Campo E., Pileri S.A., Swerdlow S.H. Introduction and overview of the classification of the lymphoid neoplasms. In: WHO Classification of Tumors of Haematopoietic ans Lymphoid Tissues / ed. by Swerdlow S.H., Campo E. et al. Lyon: IARC-press, 2008. P. 158–166;
- Stein H. Hodgkin lymphoma — introduction. In: WHO Classification of Tumors of Haematopoietic ans Lymphoid Tissues / ed. by Swerdlow S.H., Campo E. et al. Lyon: IARC-press, 2008. P. 322;
- Гурцевич В.Э. (2010). Роль вируса Эпштейна—Барр в онкогематологических заболеваниях человека. Клиническая онкогематология. 3, 222–234;
- H. Hjalgrim, E. A. Engels. (2008). Infectious aetiology of Hodgkin and non-Hodgkin lymphomas: a review of the epidemiological evidence. Journal of Internal Medicine. 264, 537-548;
- Blossom Damania. (2007). DNA tumor viruses and human cancer. Trends in Microbiology. 15, 38-44;
- Dimitris Panagopoulos, Panayiotis Victoratos, Maria Alexiou, George Kollias, George Mosialos. (2004). Comparative Analysis of Signal Transduction by CD40 and the Epstein-Barr Virus Oncoprotein LMP1 In Vivo. J Virol. 78, 13253-13261;
- Смирнова К.В., Дидук С.В., Джаббаров С.М., Яковлева Л.С., Гончарова Е.В., Щербак Л.Н. и др. (2010). Вирус Эпштейна — Барр: генетические варианты гена LMP1 у больных опухолями лимфоидного и эпителиального происхождения в России. Молекулярная медицина. 1, 46–53.







