
Осьминожий геном
26 ноября 2015
Осьминожий геном
- 817
- 0
- 3
Калифорнийский двупятнистый осьминог.
фотография Judit Pungor (журнал Nature)
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Осьминоги, обладающие многообразием отличительных черт и инновационных структур и способные посоревноваться в сложности организации и поведения с позвоночными, несомненно, являются интересным объектом для изучения. Полногеномное секвенирование и анализ транскриптома Octopus bimaculoides позволили ответить на ряд интригующих вопросов об этих необычных животных, больше узнать об эволюции нервной системы беспозвоночных и даже опровергнуть некоторые гипотезы.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Осьминоги — поистине удивительные животные. Совсем непохожие на других моллюсков, они могут похвастаться не только ловкими щупальцами с присосками, замысловато устроенными глазами и способностью к маскировке, но и сложным поведением. Каролин Альбертéн (Caroline B. Albertin, Чикагский университет) и ее коллеги, вооружившись секвенаторами Illumina HiSeq 2000, провели полногеномное секвенирование и секвенирование транскриптома (RNA-Seq) двенадцати тканей калифорнийского двупятнистого осьминога Octopus bimaculoides (рис. 1) и впервые получили ответы на множество вопросов о молекулярных основах осьминожьих инноваций [1]. Так, высказанные ранее [2], [3] предположения о роли полногеномных дупликаций в эволюции головоногих моллюсков не нашли поддержки. Однако удалось выявить экспансию некоторых семейств генов в геноме O. bimaculoides.

Рисунок 1. Схематичное изображение анатомии Octopus bimaculoides. Разными цветами обозначены ткани, использованные для анализа транскриптома. Справа вверху — схематичное изображение эмбриона осьминога.
В частности, это гены протокадгеринов — белков клеточной адгезии, принадлежащих к семейству кадгеринов. В геноме осьминога обнаружено 168 генов этих белков (почти в два раза больше, чем у человека), в то время как у Drosophila melanogaster и Caenorhabditis elegans генов протокадгеринов нет вовсе — они их утратили. Протокадгерины млекопитающих необходимы для развития нервной системы и формирования синаптических связей [4], [5]. Похоже, что для нервной системы осьминога эти гены, демонстрирующие высокие уровни экспрессии именно в нервной ткани (рис. 2), тоже очень важны.
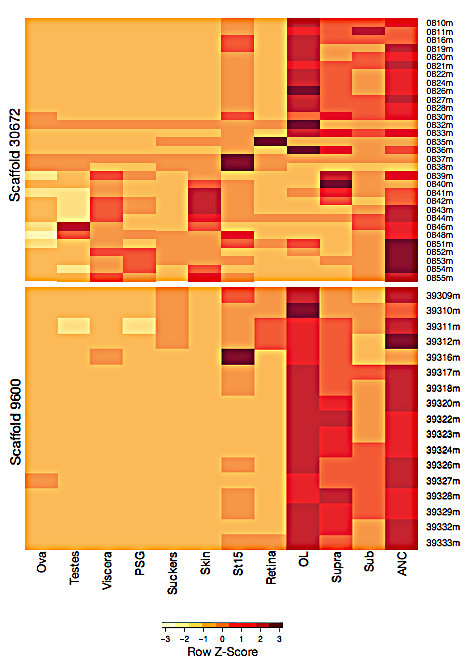
Рисунок 2. Профиль экспрессии генов протокадгеринов, расположенных на скаффолде 30672 (31 ген в кластере) и скаффолде 9600 (17 генов), в 12 образцах тканей: гонадах (ova, testes), внутренних органах (viscera), слюнной железе (PSG), присосках (suckers), коже (skin), эмбрионе (St15), сетчатке (retina), оптических долях мозга (OL), подпищеводном мозге (Sub) и осевом нерве (ACN).
Нервная система осьминога отличается своей распределенной организацией: каждое из восьми щупалец может действовать в определенной степени автономно. По оценкам ученых, осьминог может похвастаться 500 миллионами нейронов — это в 6 раз больше, чем у мыши, и в 200 раз меньше, чем у человека. При этом в отсутствие миелиновой оболочки функционирование нервной системы O. bimaculoides основано на местной нервной регуляции, что, как предполагают ученые, объясняет наблюдаемое многообразие протокадгеринов. Примечательно, что увеличение набора генов протокадгеринов у осьминогов и позвоночных происходило, по-видимому, независимо, являя тем самым красивый пример конвергентной эволюции на молекулярном уровне.
Другое семейство генов, имеющих характерный тканеспецифичный профиль экспрессии, кодирует цинковые пальцы типа C2H2. Ранее было показано, что гены этого семейства транскрипционных факторов у позвоночных участвуют в клеточной дифференцировке и развитии [6]. Высокий уровень экспрессии C2H2-ZNF-генов в нервной ткани, а также тканях эмбриона осьминога согласуется с описанными для позвоночных функциями этих генов. Любопытно, что в геноме O. bimaculoides удалось идентифицировать 1790 генов этого семейства, при том что у человека их несколько меньше — 764 (рис. 3).
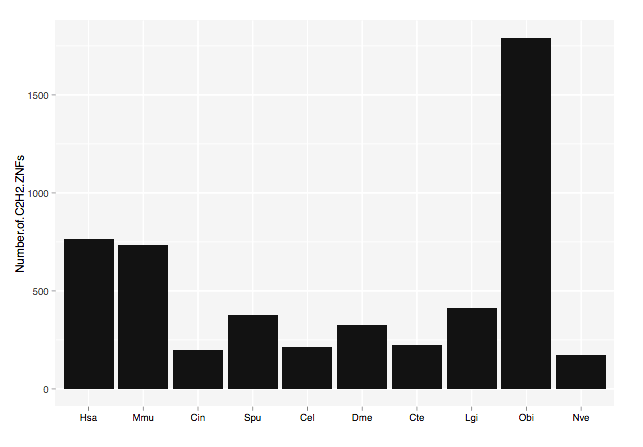
Рисунок 3. Число генов C2H2 у разных видов. Слева направо: человек (Homo sapiens, Hsa), мышь (Mus musculus, Mmu), оболочник (Ciona intestinalis, Cin), морской еж (Strongylocentrotus purpuratus, Spu), круглый червь (Caenorhabditis elegans, Cel), плодовая мушка (Drosophila melanogaster, Dme), многощетинковый червь (Capitella teleta, Cte), брюхоногий моллюск (Lottia gigantea, Lgi), осьминог (Octopus bimaculoides, Obi), актиния (Nematostella vectensis, Nve).
Гены белков DLG-семейства (discs large) необходимы для правильного функционирования постсинаптических терминалей [7]. Если прежде у беспозвоночных (D. melanogaster) были описаны лишь два гена dlg (один из которых похож на гены кластера dlg1–4 позвоночных, а другой — на dlg5), то в геноме осьминога удалось обнаружить три dlg1–4-подобных и два dlg5-подобных гена. Высокие уровни экспресcии генов dlg характерны для нервной ткани и присосок O. bimaculoides (рис. 4). В присосках щупалец также выражена экспрессия генов белков, похожих на никотиновые ацетилхолиновые рецепторы. Субъединицы рецепторов осьминога, однако, лишены аминокислотных остатков, которые считаются необходимыми для связывания ацетилхолина . Возможно, эти рецепторы выполняют сенсорную функцию.
Зачем нам нужен ацетилхолин и какими бывают его рецепторы, рассказано в статье «Молекула здравого ума» [8]. — Ред.
В целом, анализ генома и транскриптома O. bimaculoides позволил обнаружить несколько сотен осьминог-специфичных генов. Многие из них экспрессируются в тканях, связанных с инновационными структурами осьминога: коже, присосках и нервной системе. Так, если речь заходит о маскировке, осьминоги, без всякого сомнения, являются настоящими профессионалами. Этим умением они обязаны иридофорам — особым структурам, состоящим из белков семейства рефлектинов [9]. В геноме O. bimaculoides ученые нашли 6 генов рефлектинов. При этом экспрессируются они тканеспецифично, демонстрируя высокий уровень активности в коже.
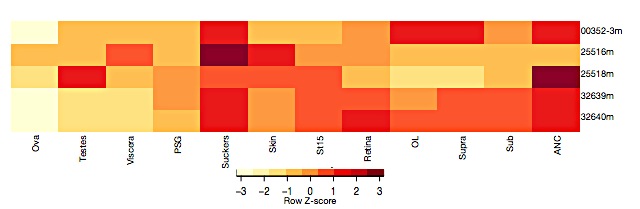
Рисунок 4. Профиль экспрессии пяти генов dlg в 12 образцах тканей. Обозначения те же, что на рисунке 2.
Размер генома O. bimaculoides оценен в 2,7 Гб (2,7 × 109 оснований), что в несколько раз больше геномов других моллюсков [10]. И хотя осьминожий геном меньше человеческого, в нем было предсказано 33 638 белок-кодирующих генов — примерно в полтора раза больше, чем у человека.
Определение последовательности ДНК O. bimaculoides является лишь первым и, безусловно, необходимым шагом для дальнейшего предметного изучения осьминога и его биологических инноваций. Работать с геномом можно уже сейчас — например, с помощью геномного браузера. Кстати, авторы статьи [1] разместили в разделе дополнительной информации интересные видеозаписи. Первая из них демонстрирует способности калифорнийского двупятнистого осьминога к изменению окраски, а просмотр второй развеет любые сомнения в ловкости цепких щупалец Octopus bimaculoides.
Литература
- Albertin C.B., Simakov O., Mitros T., Wang Z.Y., Pungor J.R., Edsinger-Gonzales E. et al. (2015). The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524, 220-224;
- Yoshida M.A., Ishikura Y., Moritaki T., Shoguchi E., Shimizu K.K., Sese J. et al. (2011). Genome structure analysis of molluscs revealed whole genome duplication and lineage specific repeat variation. Gene. 483, 63-71;
- Hallinan N.M. and Lindberg D.R. (2011). Comparative analysis of chromosome counts infers three paleopolyploidies in the mollusca. Genome. Biol. Evol. 3, 1150-1163;
- Zipursky S.L. and Sanes J.R. (2010). Chemoaffinity revisited: dscams, protocadherins, and neural circuit assembly. Cell. 143, 343-353;
- Frank M. and Kemler R. (2002). Protocadherins. Curr. Opin. Cell Biol. 14, 557-562;
- Liu H., Chang L.H., Sun Y., Lu X., Stubbs L. (2014). Deep vertebrate roots for mammalian zinc finger transcription factor subfamilies. Genome. Biol. Evol. 6, 510-525;
- Nithianantharajah J., Komiyama N.H., McKechanie A., Johnstone M., Blackwood D.H., St Clair D. et al. (2013). Synaptic scaffold evolution generated components of vertebrate cognitive complexity. Nat. Neurosci. 16, 16-24;
- Молекула здравого ума;
- Crookes W.J., Ding L.L., Huang Q.L., Kimbell J.R., Horwitz J., McFall-Ngai M.J. (2004). Reflectins: the unusual proteins of squid reflective tissues. Science. 303, 235-238;
- Simakov O., Marletaz F., Cho S.J., Edsinger-Gonzales E., Havlak P., Hellsten U. et al. (2013). Insights into bilaterian evolution from three spiralian genomes. Nature. 493, 526-531..







