
Немного о железе. Теория
24 марта 2022
Немного о железе. Теория
- 3190
- 1
- 8
Пародийный комикс на тему нелегкой старости Железного Человека.
Alarmingly Bad, адаптировано автором
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все знают, что CHON крайне важны для всего живого на Земле. Но задумывались ли вы о том, какую роль в работе нашего тела играют другие элементы? Для интеграции в организм каждого из них требуется свой полноценный путь метаболизма, который включает уникальные системы потребления, транспорта, хранения и т.д. Об одном таком элементе — о железе — сейчас и пойдет речь.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Школьная» конкурса «Био/Мол/Текст»-2021/2022.
Эта работа заняла первое место в номинации «Школьная» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — некоммерческая школа-пансион «Летово».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Неверная диагностика заболевания обычно заканчивается неправильно выбранным лечением, а значит и лекарствами, которые не только не лечат пациента, но и могут ухудшить его состояние. Пока вы пьете таблетки от болезни на бумажке, настоящая продолжает развиваться. Звучит не очень классно. Да и последствия от такой ситуации не самые приятные, так как вы не выздоравливаете и вдобавок отравляетесь медикаментами. Это бич медицины во все времена. Однако дело не только в некомпетентности некоторых врачей, как может показаться на первый взгляд. К сожалению, это не единственная и часто не главная причина. Дело в том, что существуют группы заболеваний со схожим патогенезом, поиск различий между которыми требует проводить целую плеяду измерений, нередко уникальных и дорогостоящих и потому недоступных для большого числа людей.
Одной из таких трудных тем в современной медицине можно назвать физиологию железа. Заболевания, основанные на его метаболизме, зачастую имеют схожую симптоматику при кардинально разной этиологии и поэтому становятся предметом ложной диагностики. Болезни требуют проведения нестандартных анализов вплоть до генетического обследования пациента. В условиях ограниченного набора методов обследования очень легко построить ошибочные причинно-следственные связи и назначить неверное лечение.
Например, в одном исследовании, проведенном в США, 325 врачей общей практики обследовали медицинские показатели пациента с железодефицитной анемией (ЖДА), самым распространенным железосвязанным заболеванием. В итоге 26,5% из них неверно определили тип анемии. Эти ошибки можно связать с неверной интерпретацией результатов лабораторных тестов и отсутствием проведения дополнительного обследования. При глубоком понимании физиологических основ применяемых методов и многочисленных нюансов измерений процент ложной диагностики бы сократился.
Именно поэтому эта статья посвящена обзору необходимой для таких заболеваний теоретической базы и прикладных аспектов их диагностирования. Сначала мы подробно разберем физиологию железа в организме человека, чтобы потом обсудить все самое важное в работе с железосвязанными патологиями.
В силу большого объема текста и информации данная статья разделена на две части. Сейчас вы читаете первую, в которой описывается роль железа в организме со всем его метаболизмом и нормами потребления. Ознакомившись с ней, вам будет легко воспринять следующую часть, посвященную заболеваниям и методам их диагностики, а также способам измерения концентрации железа в теле человека [1].
Железо
В человеческом теле около 3,72 × 1013 клеток [2], сколько в нас молекул — сложно представить, а о количестве атомов даже и говорить не стоит. Удивительно, но это невообразимое число при классификации можно свести всего к паре десятков химических элементов. О некоторых, например: углероде, водороде и кислороде, и так все известно любому человеку, когда-то окончившему школу. Они присутствуют почти во всех органических веществах. А есть элементы, о которых ты вроде слышал, но даже до конца и не уверен, что они есть в твоем организме. Ну да, железо, что-то про кровь, про перенос кислорода. Но наше тело — очень сложный механизм, поэтому даже с таким «непопулярным» микроэлементом, которого в каждом из нас всего по несколько грамм, обращается очень замысловато. Давайте разбираться.
Пару слов
В среднем в организме человека содержится от 2 до 4 граммов железа [3]. Казалось бы, немного, но и этого небольшого количества хватает для осуществления всего огромного спектра его функций. Но для их понимания сначала стоит объяснить немного химии:
Железо — это d-элемент восьмой группы четвертого периода, поэтому оно может наблюдаться в разных степенях окисления. В теле млекопитающего железо представлено в виде двух ионов: Fe2+ (железо двухвалентное) и Fe3+ (железо трехвалентное). При получении электрона Fe3+ переходит в Fe2+, обратный переход тоже возможен.
Отдельные молекулы железа потенциально токсичны, поскольку в аэробных условиях они катализируют распространение активных форм кислорода и генерацию высокореактивных радикалов, таких как OH–. Так что в теле человека они не встречаются в свободном виде и спрятаны в различные структуры для использования, транспорта и хранения.
Для чего вообще нужно железо?
Двумя словами — функционал огромен. В первую очередь, железо входит во всем известные соединения, связывающие кислород: гемоглобин в эритроцитах и миоглобин в мышцах, на синтез которых и уходит основная часть запасов микроэлемента. Кроме того, железо является компонентом большого числа жизненно необходимых ферментов, например каталаз и пероксидаз, и разнообразных по функциям белков-цитохромов. Железо проявляет 2 степени окисления, следовательно, оно может участвовать в окислительно-восстановительных реакциях, что собственно и делает практически во всех указанных соединениях. Именно поэтому железо почти всегда встречается в реакционных центрах белков и в составе, так называемых, гемов, о которых мы поговорим чуть позже.
Потребление и выделение
Две трети железа в организме человека содержится в уже упомянутом гемоглобине [4], железопротеине, который используется для переноса кислорода красными кровяными тельцами — эритроцитами. Эритроцит, к сожалению или счастью, как и любая другая клетка человеческого тела, не живет вечно и имеет ограниченный срок жизни (Life Span), составляющий примерно 111 дней [5], [6]. После смерти клетка поглощается специальными макрофагами в селезенке или печени, а содержащийся в нем гемоглобин «переваривается» и железо вновь ступает на свой метаболический путь: накапливается в теле или сразу идет в красный костный мозг к предшественникам эритроцитов.
На этом моменте возникает логичный вопрос: если метаболизм железа в человеческом теле зациклен, зачем нужно поступление нового железа?
Дело в том, что кровотечения и отшелушивания слизистых и кожных покровов, которые являются частью и нормальной жизнедеятельности организма, все же приводят к потерям микроэлемента. Именно поэтому небольшое количество железа должно ежедневно поступать в организм вместе с пищей. По статистике, для человека с «европейским образом питания» это количество равно 15 мг, из которых усваивается только 10–15%, то есть 1,5–2,5 мг [7], [8]. Число действительно крошечное по сравнению с целыми граммами железа в здоровом организме. Интересно, что у взрослых людей оно может быть намного меньше. Для нормального функционирования и профилактики заболеваний, хватит и 6,7 мг железа для мужчин и 11,4 мг для женщин [8].
Если человек ежедневно потребляет пищу с повышенным содержанием железа, почему у него тогда не развивается какая-нибудь болезнь? Или как развивается дефицит железа в организме, если его так много в пище? Эти и другие вопросы мы обсудим чуть позже при обсуждении регуляции метаболизма.
Продукты
Негемовое железо составляет большинство потребляемого за день железа и преимущественно содержится в растительной пище, такой как бобы, злаки и темные зеленые части листовых овощей [9]. Например, листья известной восточной приправы пажитника имеют огромную концентрацию железа: 2,4 миллиграмма на 100 грамм продукта (для сравнения яблоко содержит только ~ 0,9 мг/100 г). Большим содержанием негемового железа также отличаются орехи — около 1,3 мг/100 г [10].
Этот тип железа содержится и в животной пище. В теле животного железо аккумулируется в составе запасающего белка печени — ферритина, о котором мы еще будем говорить позже, поэтому печень — богатый источник негемового железа (2,7–8,3 мг/100 г) [11], [12].
Гемовое железо легче усваивается организмом: в норме абсорбируется 20–30% [13]. В основном оно представлено в виде составной части гемоглобина и миоглобина, поэтому содержится в продуктах животного происхождения [14], в особенности с высоким содержанием крови [13]. Больше всего такого железа содержится в мышечной ткани (1–3,5 мг/100 г) и почках животных (5–18 мг/100 г) [11].
Как мы можем видеть, железо присутствует в большом количестве повседневных продуктов питания, а специальных систем его вывода из человеческого тела не существует. Следовательно, для поддержания постоянной концентрации железа организму нужно уметь грамотно контролировать его поступление. Чтобы понять, как это происходит, нужно разобраться с тем, как железо вообще попадает в организм.
Метаболизм железа
Абсорбция
В силу своей химической природы свободный ион железа может быть в двух степенях окисления. Однако так эволюционно сложилось, что для организма не выгодно делать два аналогичных пути метаболизма, поэтому уже при поглощении железо унифицируется и поступает только в виде Fe2+. Как это происходит? Довольно банально. Сначала все свободное железо просто окисляется до степени окисления 3+, а затем восстанавливается при поглощении до 2+. Гемовое железо уже находится в нужной форме (см. рис. 2). Теперь чуть подробней.
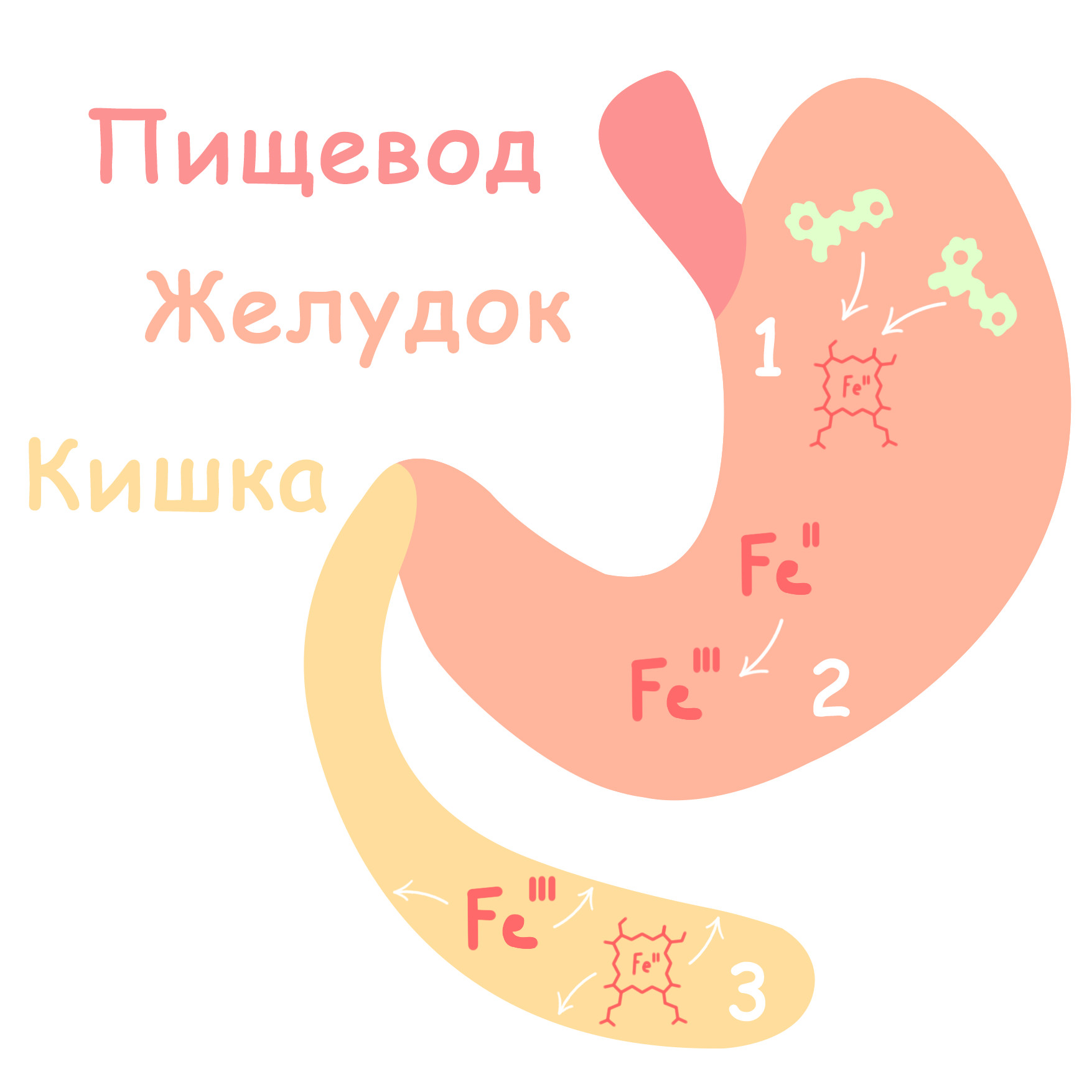
Рисунок 2. Абсорбция железа.
Измельченная в ротовой полости пища попадает в желудок через пищевод. Кислая среда желудка высвобождает гемы из гемопротеинов (1), а негемовое железо окисляется до Fe3+ (2). Наиболее активно поглощение проходит в первых отделах тонкого кишечника, а точнее, в двенадцатиперстной и тощей кишке (3).
рисунок автора
Процессы происходящие далее требуют объяснений на молекулярном уровне, поэтому будьте готовы к куче новых названий и аббревиатур белковых комплексов. Я вас предупредил.
Первое такое соединение на пути свободного иона железа — редуктаза Dcytb (ферриредуктаза дуоденального цитохрома B). Дословный перевод термина «ферриредуктаза» — восстановитель железа, прямо говорит о функциях этого белка: он восстанавливает ион до формы Fe2+. В связи с его функциями комплекс располагается на открытой в просвет кишечника части энтероцита, то есть на его апикальной мембране. Кроме ферриредуктазы восстановлением железа может заниматься и аскорбиновая кислота, которая попадает в кишечник в составе пищи [7]. Об аскорбиновой кислоте и других стимуляторах абсорбции речь пойдет чуть позже.
Восстановление железа нужно для его прохождения внутрь клетки кишечника через белковый комплекс DMT1 (транспортер двухвалентных металлов; транспортирует и другие ионы металлов [15]) (см. рис. 3). Такая активная закачка железа происходит за счет параллельно происходящего транспорта протонов водорода, которые стремятся пройти через мембрану из-за накопленного на ней градиента, но сделать это они не могут в силу некоторых физиологических особенностей. Итак, DMT1 позволяет протонам делать то, что они хотят, а взамен использует энергию их перехода и вкачивает в энтероцит катионы железа — это явление получило название котранспорта.
Что касается гемов, то они, попав в кишечник, тоже проникают в энтероцит , но уже через другой трансмембранный белок —HCP-1 (белковый переносчик гема-1). В клетке гем разлагается на железо и протопорфирин с помощью специального фермента HO-1 (гем оксигеназа-1) [16]. Восстанавливать железо до двухвалентной формы не нужно, так как оно уже находится в ней.
Существует еще один путь поглощения гемового железа. Дело в том, что в селезенке содержатся специальные клетки-макрофаги, ответственные за перевариваривание старых и поврежденных эритроцитов. В макрофагах двухвалентное железо высвобождается из гемов гемоглобина и проходит тот же метаболический путь, что и в энтероцитах.
На этом этап абсорбции заканчивается. Ион железа полноценно поступил в организм и теперь у него есть три пути:
- Пойти в расход на нужды энтероцита, то есть вступить во внутриклеточный синтез.
- Если первый вариант не актуален и у клетки нет нужды в синтезе железосодержащих соединений, то запастись там же в составе белка ферритина, о котором мы еще поговорим.
- Когда клеточных запасов будет достаточно, уйти в открытое плавание в кровоток для использования другими клетками организма.
Если ион железа решает пойти по третьему пути, то сначала он окисляется и транспортируется в кровь белком ферропортином и связывается там с апотрансферрином. Но об этом речь пойдет уже при обсуждении следующего этапа метаболизма — транспорта.
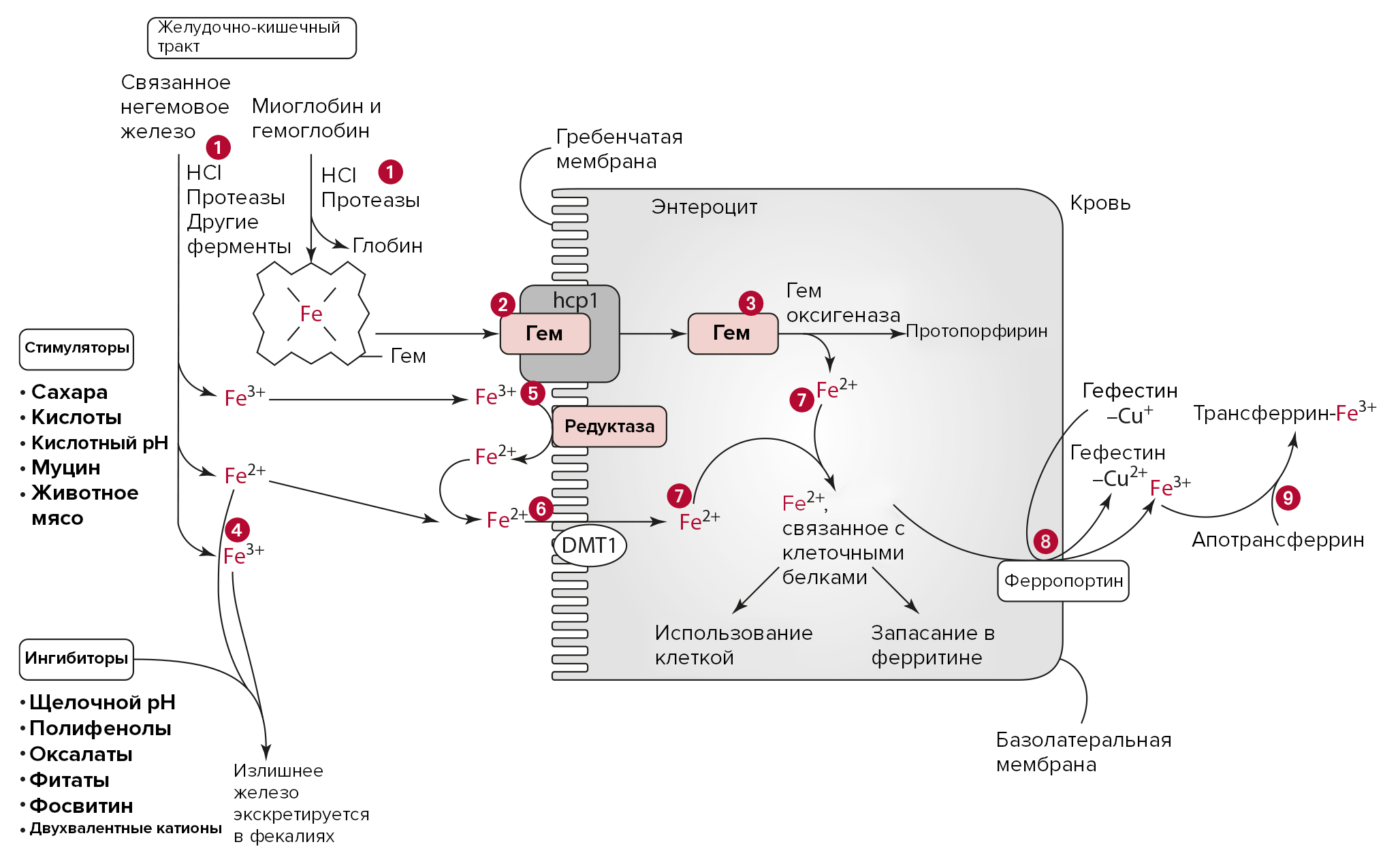
Рисунок 3. Абсорбция и транспорт железа в энтероците.
- Железо высвобождается из соединений в пище с помощью протеаз и соляной кислоты. Соляная кислота желудочного сока может восстанавливать железо до Fe2+.
- Свободные гемы попадают в клетку с помощью белкового переносчика гемов — 1 (HCP-1), расположенного в энтероцитах тощей кишки.
- Внутри клетки гем диссоциирует на протопорфирин и двухвалентное железо благодаря гем оксигеназе.
- Негемовое железо может реагировать с ингибиторами ее всасывания в тонкой кишке, такими как полифенолы или щелочной pH, которые стимулируют фекальный вывод железа.
- Редуктаза (например цитохром B) восстанавливает свободное трехвалентное железо до двухвалентной формы.
- DMT1 переносит свободное двухвалентное железо внутрь энтероцита.
- Fe2+ из свободного и гемового железа связывается с белками-переносчиками в цитозоле клетки кишки и либо используется клеткой, либо направляется в кровоток, либо на хранение в составе ферритина.
- Ферропортин транспортирует двухвалентное железо сквозь базолатеральную мембрану энтероцита, после чего оно окисляется гефестином до трехвалентного состояния.
- Две молекулы Fe3+ связываются с апотрансферрином с образованием трансферрина, который направляется к тканям организма через кровоток.
адаптировано из [3]
Регуляция абсорбции
Как вы поняли, абсорбция железа — это сложный многоступенчатый процесс, поэтому она может контролироваться на разных этапах и разными факторами.
Во-первых, активность абсорбции напрямую зависит от концентрации железа в межклеточном веществе вокруг энтероцитов, поэтому после приема пищи, богатой железом, ее интенсивность может резко упасть даже при дефиците микроэлемента в организме [15].
Во-вторых, абсорбция, как и другие этапы метаболизма железа, может регулироваться организмом совершенно на разных уровнях. На поступление нового железа из кишечника влияют внутренние органы, которые могут стимулировать абсорбцию железа при недостатке микроэлемента с помощью гормона гепсидина, о котором речь пойдет позже. В частности, этим занимается печень: в ней железо запасается в виде составной части ферритина.
В-третьих, существуют отдельные уникальные регуляторные вещества, воздействующие на процесс поглощения либо гемового, либо негемового железа. Их делят на стимуляторы и ингибиторы в зависимости от своей функции.
Транспорт
После поступления железа в энтероцит оно должно стать доступным каждой клетке тела, и в организме подобный транспорт осуществляется по кровотоку. Для реализации этой несложной махинации клетке кишечника нужно просто выбросить железо в кровь. На базолатеральной стороне энтероцита находится транспортер двухвалентного железа, называемый ферропортином, который и поставляет ионы в кровоток. Сразу после выхода из клетки мембраносвязанная ферроксидаза гефестин окисляет Fe2+ до Fe3+ [3]. Одной из возможных причин этого преобразования может быть разграничение пулов транспортируемого (3+) и используемого в клетке (2+) железа.
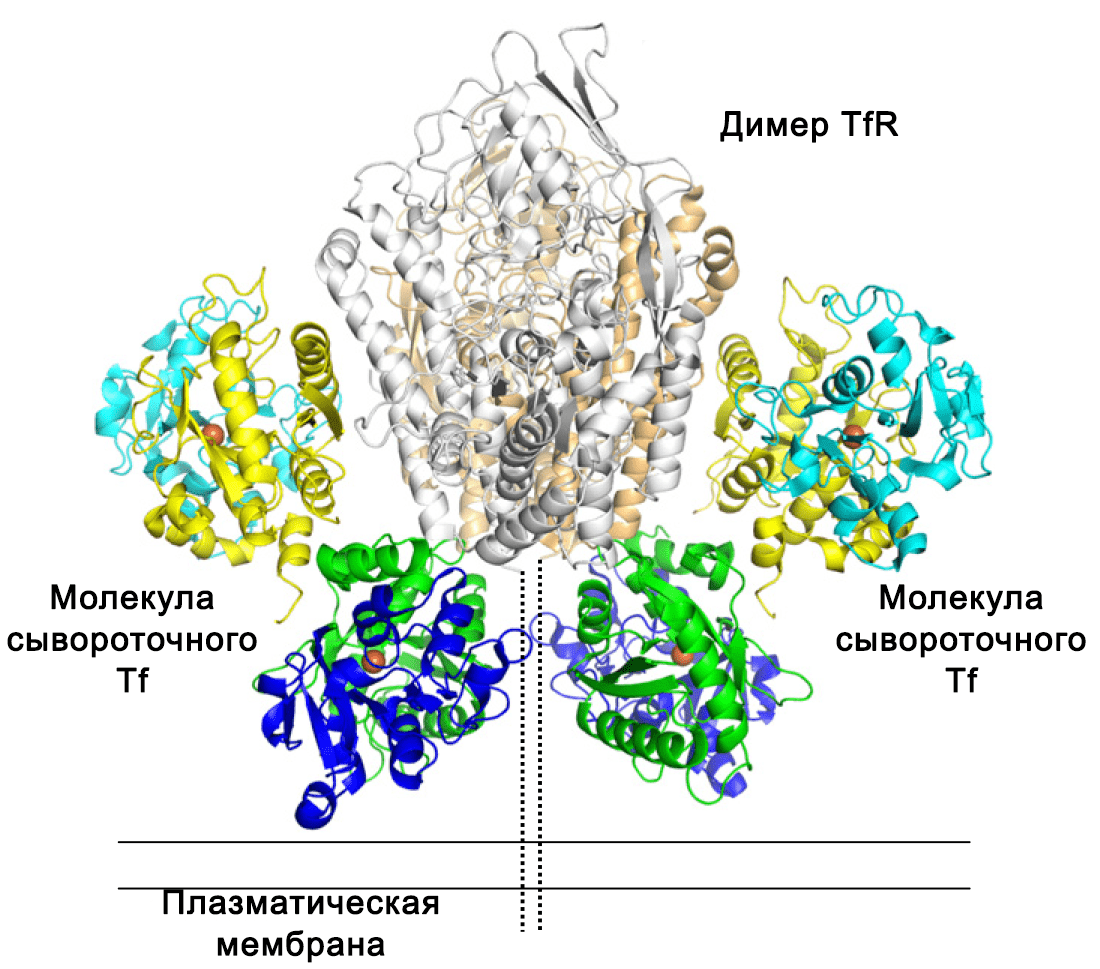
Рисунок 4. Строение связанного с рецептором трансферрина на мембране клетки.
Светло-оранжевые и серые спирали — димер рецептора.
Желтый, циановый, зеленый, синий — 2 молекулы трансферрина.
Оранжевые сферы обозначают связанное железо.
Пунктирной линией отмечен стержень рецептора, а сплошными — мембрана клетки.
адаптировано из [28]
Затем железо попадает в плазму и следует до пункта назначения вместе со специальным кровяным транспортером — трансферрином (Tf). Белок связывает молекулы железа на двух сайтах и поддерживает их в нужной степени окисления (см. рис. 4) [16]. Доля железа, связанного с Tf, невелика — около 0,1%, но интенсивность его перемещения настолько высока, что каждый день подвергается более чем десятикратному обороту [16].
В свою очередь в процентном соотношении Tf тоже нечасто связывается с железом — только 10% от всех молекул. Такая форма трансферрина называется холотрансферрином (холоTf), остальной же несвязанный белок именуется апотрансферрином (апоTf) (см. рис. 5). Такое высокое относительное содержание апоTf позволяет создавать кровеносный буфер для железа. Это значит, что ион, только что попавший в кровоток, сразу же связывается с трансферрином. Таким образом, железо проводит в свободном виде минимальное количество времени, не накапливается в одном месте и не повреждает близлежащие ткани.
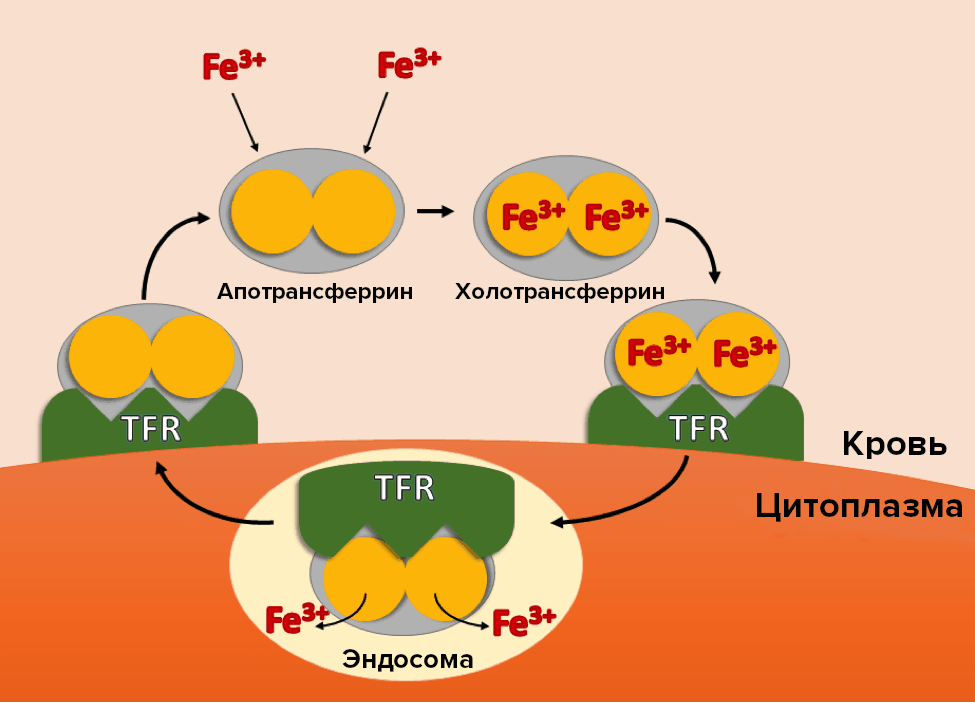
Рисунок 5. Взаимопереход двух форм трансферрина.
После связывания молекул железа из крови с апотрансферрином он превращается в холотрансферрин, который, в свою очередь, связавшись с мембранным рецептором к трансферрину (TFR), попадает в эндосому клетки, где высвобождает железо и переходит в свой несвязанный вид. После выхода трансферрина из клетки круг завершается и повторяется.
адаптировано из [29]
Что происходит дальше? Есть два пути:
- Большинство железа идет на эритропоэз в красном костном мозге, который использует исключительно Tf-железо [16]. Другие органы и ткани также используют Tf-железо в своих целях.
- Оставшаяся четверть железа запасается в организме, из которого почти 17% отправляется на хранение в печень [30].
Второй путь мы рассмотрим чуть подробнее.
Хранение в печени
Трансферрин путешествует по кровотоку в компании двух молекул трехвалентного железа. Его распознавание клетками печени, гепатоцитами, происходит с помощью мембранных белков — трансферриновых рецепторов (TfR) (см. рис. 4). На месте связывания Тf образуется везикула, и белок-рецепторный комплекс попадает внутрь клетки.
Протонный насос подкисляет ионами H+ среду эндосомы до pH 5,5, и молекулы железа отходят от трансферрина, который в свою очередь остается связанным с рецептором. Fe3+ восстанавливается до Fe2+ с помощью металлоредуктазы STEAP3 (Six Transmembrane Epithelial Antigen of the Prostate proteins 3) и в таком виде выходит из везикулы с помощью уже известного нам транспортера двухвалентных металлов DMT-1 [3], [31].
Трансферрин же в своей апо-форме отсоединяется от TfR и экзоцитируется из гепатоцита в кровоток, а рецептор возвращается на мембрану клетки.
Трехвалентное железо запасается в белковом комплексе — ферритине. При недостатке микроэлемента в крови гепатоциты начинают разрушать этот белок в лизосомах, высвобождают железо и секретируют его в кровь по схожему с энтероцитами механизму.
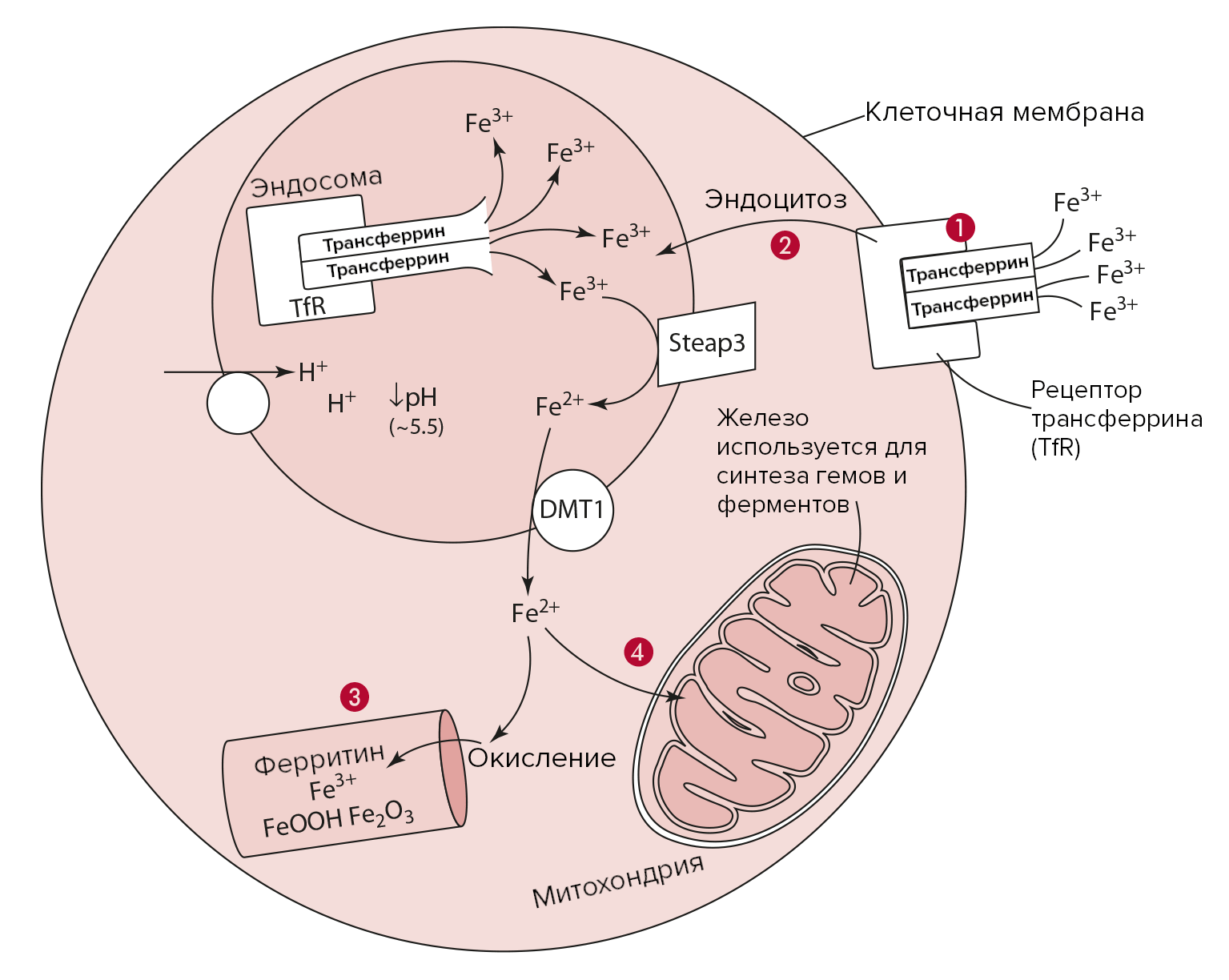
Рисунок 6. Запасание железа.
- Трансферрин со связанными молекулами железа активирует трансферриновые рецепторы (TfR) на мембране клетки. Комплекс рецептор-трансферрин поглощается клеткой с образованием эндосомы.
- Изменение pH внутри эндосомы приводит к отщеплению молекул Fe3+ с их последующим восстановлением STEAP3 и поглощением DMT1.
- Полученное двухвалентное железо либо может быть окислено и храниться в качестве составной части ферритина.
- Либо может быть функционально использовано клеткой.
адаптировано из [3]
Регуляция метаболизма
Весь человеческий организм работает в синергии. Его структурные части общаются друг с другом совершенно на разных уровнях: органы говорят с органами, клетки — с клетками. И для этого есть инструменты. Первое что приходит в голову — сигнальные молекулы, которые и правда являются основным способом коммуникации в организме. Самым популярным видом таких молекул в организме человека можно назвать гормоны, через них организм контролирует огромное количество физиологических процессов, и метаболизм железа в том числе. Делает он это с помощью пептида гепсидина, секретируемого печенью.
Ферропортин — единственный экспортер неорганического железа в теле млекопитающих. Гепсидин вызывает его инактивацию или даже уничтожение на макрофагах, энтероцитах, гепатоцитах и других клетках тела [16]. Поэтому гепсидин является главным регулятором содержания железа в крови, с помощью которого организм изменяет доступность железа для тканей и регулирует скорость эритропоэза [7]. Заболевания с малым содержание гемоглобина в крови, например, анемия и гипоксия, ингибируют синтез гепсидина еще на уровне мРНК в гепатоцитах. Результатом становится повышение общего уровня железа в организме, что в свою очередь стимулирует синтез гемоглобина [32].
Многие органы поддерживают постоянный уровень железа в крови через стимуляцию выброса железа печенью и его поглощения в тонкой кишке. Например, так делает красный костный мозг, так как ему необходимы ресурсы для самого затратного по железу процесса в организме — эритропоэза [15].
Послесловие
Итак, теперь вы знаете почти все об этом сложном микроэлементе. Надеюсь, вся та теоретическая информация о метаболизме железа, его регуляции в организме, разных нормах и рекомендациях, которая была преподнесена в этой статье, поможет вам легко воспринять следующую часть. В ней речь пойдет о практике. Мы разберем все необходимые аспекты прикладной медицины, с которыми врач сталкивается при диагностике железосвязанных заболеваний. Если говорить конкретнее, то предметами обсуждения станут методы измерения содержания железа в организме человека, нормы концентрации разных белков и, что самое главное, физиология таких болезней и способы их диагностики.
Литература
- Немного о железе. Практика;
- Eva Bianconi, Allison Piovesan, Federica Facchin, Alina Beraudi, Raffaella Casadei, et. al.. (2013). An estimation of the number of cells in the human body. Annals of Human Biology. 40, 463-471;
- Gropper S. S. and Smith J. L. Advanced Nutrition and Human Metabolism (6th Edition). Mass: Cengage Learning, 2012. — 608 p.;
- Abbaspour N., Hurrell R. and Kelishadi R. (2014). Review on iron and its importance for human health. J. Res. Med. Sci.. 19, 164–174;
- Gao Q. Y., Zhu Y. M., Hu J., Guo J., Bao B. L., Zhao X. et al. (2019). [Red blood cell lifespan detected by endogenous carbon monoxide breath test in patients with polycythemia vera]. Zhonghua Nei Ke Za Zhi. 58, 777–781;
- Ye L., Guo J., Jing L. P., Peng G. X., Zhou K., Li Y. et al. (2018). [The life span of red blood cell in patients with severe/very severe aplastic anemia]. Zhonghua Xueyexue Zazhi. 39, 137–142;
- Sophie Waldvogel-Abramowski, Gérard Waeber, Christoph Gassner, Andreas Buser, Beat M. Frey, et. al.. (2014). Physiology of Iron Metabolism. Transfus Med Hemother. 41, 213-221;
- Catherine Geissler, Mamta Singh. (2011). Iron, Meat and Health. Nutrients. 3, 283-316;
- Sean Lynch, Christine M Pfeiffer, Michael K Georgieff, Gary Brittenham, Susan Fairweather-Tait, et. al.. (2018). Biomarkers of Nutrition for Development (BOND)—Iron Review. The Journal of Nutrition. 148, 1001S-1067S;
- Bhuvaneswari S., Joshi M. and D’Souza A. (2015). Quantitative Analysis of Iron and Ascorbic acid contents in locally consumed Fruits and Vegetables. International Research Journal of Biological Sciences. 4, 42–47;
- J. Falandysz. (1991). Manganese, copper, zinc, iron, cadmium, mercury and lead in muscle meat, liver and kidneys of poultry, rabbit and sheep slaughtered in the northern part of Poland, 1987. Food Additives and Contaminants. 8, 71-83;
- J D Cook, E R Monsen. (1976). Food iron absorption in human subjects. III. Comparison of the effect of animal proteins on nonheme iron absorption. The American Journal of Clinical Nutrition. 29, 859-867;
- DeMaeyer E.M. (1989). Nutrition,Preventing and controlling Iron Deficiency Anemia. WHO;
- Mateusz Buzała, Bogdan Janicki, Mateusz Buzała, Artur Słomka. (2015). Heme iron in meat as the main source of iron in the human diet. J. Elem.;
- Nancy C. Andrews. (1999). Disorders of Iron Metabolism. N Engl J Med. 341, 1986-1995;
- Jian Wang, Kostas Pantopoulos. (2011). Regulation of cellular iron metabolism. Biochemical Journal. 434, 365-381;
- Teucher, Olivares, Cori. (2004). Enhancers of Iron Absorption: Ascorbic Acid and other Organic Acids. International Journal for Vitamin and Nutrition Research. 74, 403-419;
- Yum Hashim, Bioprocess and Molecular Engineering Research Unit (BPMERU), Department of Biotechnology Engineering, Kulliyyah of Engineering, International Islamic University Malaysia, P.O. BOX 10, Kuala Lumpur, 50728, Malaysia, Nur Ismail, Parveen Jamal, Rashidi Othman, Hamzah Salleh. (2014). Production of Cysteine: Approaches, Challenges and Potential Solution. Int. J. Biotech. Well. Indus.. 3, 95-101;
- Miguel Layrisse, Carlos Martínez-Torres, Irene Leets, Peter Taylor, José Ramírez. (1984). Effect of Histidine, Cysteine, Glutathione or Beef on Iron Absorption in Humans. The Journal of Nutrition. 114, 217-223;
- Michael D. Kalaras, John P. Richie, Ana Calcagnotto, Robert B. Beelman. (2017). Mushrooms: A rich source of the antioxidants ergothioneine and glutathione. Food Chemistry. 233, 429-433;
- J D Cook, E R Monsen. (1975). Food iron absorption. I. Use of semisynthetic diet to study absorption of nonheme iron. The American Journal of Clinical Nutrition. 28, 1289-1295;
- Itske M. Zijp, Onno Korver, Lilian B. M. Tijburg. (2000). Effect of Tea and Other Dietary Factors on Iron Absorption. Critical Reviews in Food Science and Nutrition. 40, 371-398;
- T A Morck, S R Lynch, J D Cook. (1983). Inhibition of food iron absorption by coffee. The American Journal of Clinical Nutrition. 37, 416-420;
- P B Disler, S R Lynch, R W Charlton, J D Torrance, T H Bothwell, et. al.. (1975). The effect of tea on iron absorption.. Gut. 16, 193-200;
- L Hallberg, L Rossander, A B Skånberg. (1987). Phytates and the inhibitory effect of bran on iron absorption in man. The American Journal of Clinical Nutrition. 45, 988-996;
- R F Hurrell, M A Juillerat, M B Reddy, S R Lynch, S A Dassenko, J D Cook. (1992). Soy protein, phytate, and iron absorption in humans. The American Journal of Clinical Nutrition. 56, 573-578;
- Sean R Lynch. (2000). The effect of calcium on iron absorption. Nutr. Res. Rev.. 13, 141-158;
- Kimihiko Mizutani, Mayuko Toyoda, Bunzo Mikami. (2012). X-ray structures of transferrins and related proteins. Biochimica et Biophysica Acta (BBA) - General Subjects. 1820, 203-211;
- Sargent B. (2016). Pumping Iron – But Not in the gym: The Critical Roles of Transferrin in Cell Culture Media. Cell Culture Dish;
- Ferritin. (2010). Ilex Medical;
- Kostas Pantopoulos, Suheel Kumar Porwal, Alan Tartakoff, L. Devireddy. (2012). Mechanisms of Mammalian Iron Homeostasis. Biochemistry. 51, 5705-5724;
- Tomas Ganz. (2003). Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood. 102, 783-788.







