
Настоящий сад на дрожжах!
15 декабря 2022
Настоящий сад на дрожжах!
- 696
- 0
- 4
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сегодня мы поговорим с вами о дрожжах — маленьких организмах, которые плотно осели в жизни человека. В настоящее время их используют не только хозяйки на кухне и виноделы, но и ученые. Эта статья посвящена биотехнологическому методу применения дрожжей, который носит название «дрожжевой дисплей». В основе этой технологии лежит создание генетической конструкции, которая потом загружается в дрожжевую клетку и вовлекается в транскрипцию и последующие процессы. Во многих мокрых лабораториях молекулярные биологи с радостью применяют дисплей для наработки белков и изучения механизмов сложных химических реакций.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Сравнительно недавно молекулярные биологи поняли, что маленькие организмы, такие, как фаги, дрожжи или бактерии, могут сослужить человечеству добрую службу, ведь они умеют быстро и достаточно эффективно продуцировать белки и пептиды. Эти важные вещества широко используются учеными в биомедицине и биотехнологиях, а также фармкомпаниями и другими представителями индустрии. Пептиды входят в состав вакцин и лекарств, в основу аналитических методов и являются ключевым продуктом фуд-технологий.
С 1980 года в качестве платформы по производству белков ученые начали использовать фаги, вирусы бактерий, встраивая нуклеотидную последовательность интересующего белка (protein of interest) в ген капсида вируса. Это делается с помощью различных методов генной инженерии, например, путем сборки плазмиды. Так на поверхности бактериофага появляется нужный исследователю белок, который в процессе трансляции собирается вместе с белком оболочки фага [1]. Такой составной белок называется химерным, потому что является искусственно составленным. Он закрепляется в белковой оболочке вируса, поэтому его можно легко вовлекать в эксперименты по изучению белок-белковых взаимодействий, катализируемых реакций, а также заниматься его наработкой. Чаще всего для проделывания всех этих манипуляций используют такие бактериофаги [2], как Т4, М13, λ-фаг [3], и другие. А сам вышеописанный метод получил название фагового дисплея [4].
Но, подобно кухне лучших ресторанов мира, ученые совершенствовали свои навыки, оттачивая мастерство. Фаговый дисплей оказался не столь универсальным методом, как хотелось бы — его возможности охватывают не всё разнообразие белков.
Дело в том, что вирусы сами по себе очень маленького размера, поэтому некоторым белкам-великанам просто не хватает места на их поверхности. Тогда ученые решили использовать вместо фагов бактерии, ведь их размеры куда больше. Но и этот подход не полностью решал все проблемы. Ведь у бактерий, как и у вирусов, нет ядра и многих других конструкций, благодаря которым, например, осуществляется посттрансляционная модификация и фолдинг сложных белковых молекул. Именно эти особенности позволяют нашим клеткам собирать пептидные конструкции, которые состоят из нескольких отдельных кусочков (субъединиц) и свернуты в такие сложные формы, как глобулы. К сожалению, «бедные» фаги и бактерии не получили такого апгрейда от природы, поэтому их нельзя использовать для производства многих белков эукариот.
Тогда ученые решили преодолеть и эту трудность: они изобрели дрожжевой дисплей. Суть метода остается такой же, как в фаговом дисплее: экспрессируется ген химерного белка, который состоит из нескольких частей — белка клеточной стенки и целевого белка. Но отличие в том, что основу платформы составляют клетки дрожжей — одноклеточных грибов, относящихся к домену эукариот. Несмотря на то, что сравнение ученых с поварами ресторана — всего лишь сравнение, первый объект для исследования дрожжевого дисплея нашли всё-таки на кухне. Saccharomyces cerevisiae, или пекарские дрожжи, давно используются для производства алкогольной и хлебной продукции, и к настоящему моменту также активно применяются в научных исследованиях. Этот эукариотический модельный организм очень интенсивно изучается в молекулярной и клеточной биологии — по своей значимости он похож на Escherichia coli в бактериальном мире. Многие белки, значимые для жизни человека, были впервые обнаружены путем изучения их гомологов в дрожжах, например, некоторые белки клеточного цикла, сигнальные белки и ферменты-протеазы.
А теперь давайте более подробно разберемся с тем, каким образом исследователи заставляют дрожжей вырабатывать на своей поверхности интересующие их белки.
Что учитывают исследователи
Для создания эффективных систем дрожжевого дисплея биотехнологи учитывают сразу несколько факторов. Проработка каждого из них помогает правильно подобрать:
- генетическую конструкцию белка, которая будет экспрессироваться в дрожжевой клетке;
- вид дрожжей для синтеза выбранного белка;
- условия культивирования, от которых зависит количество и качество белка.
В данной статье мы рассмотрим вопрос о том, каким именно образом происходит закрепление всего сложного белка на поверхности дрожжей. И начнем мы с того, как выглядит самая стандартная белковая конструкция, которую мы захотели закрепить в мембране.
Строение конструкции
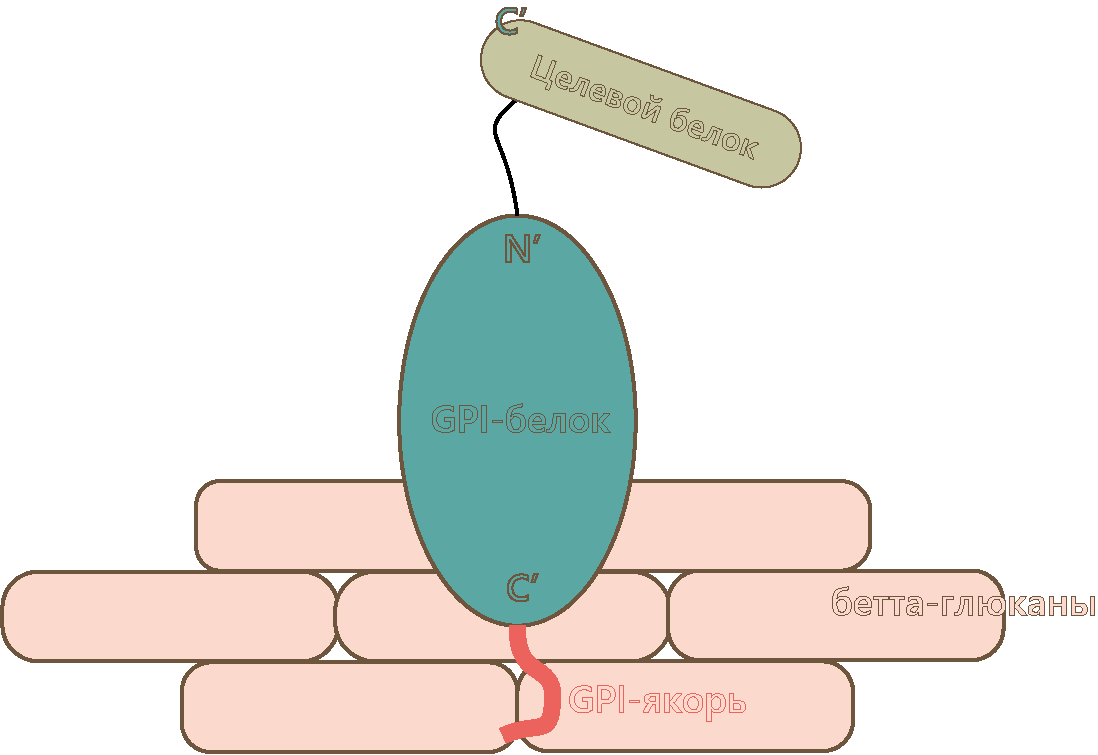
Рисунок 1. Схематичное изображение всей заякоренной конструкции (типа GPI), расположенной в клеточной стенке дрожжей.
рисунок автора статьи
Якорная конструкция, которая уже находится в стенке клетки дрожжей, состоит из (рис. 1) [5]:
- GPI-якоря (или якоря другого типа) — гликолипида, который присоединяется к якорному белку в процессе посттрансляционной модификации и отвечает за его закрепление в клеточной стенке.
- Якорного белка — белка-посредника, который одним своим концом через якорь связан со стенкой дрожжей, а другим — с нашим целевым белком. Эти белки специфичны и исходно синтезируются дрожжевыми клетками для своих целей, а именно для закрепления собственных белков, например, отвечающих за половое распознавание.
- Целевого белка — то, ради чего мы, собственно, затеяли всю эту шумиху.
Якорная конструкция, которая содержит в себе наш целевой белок, кодируется соответствующей генетической конструкцией. Из чего же она состоит?
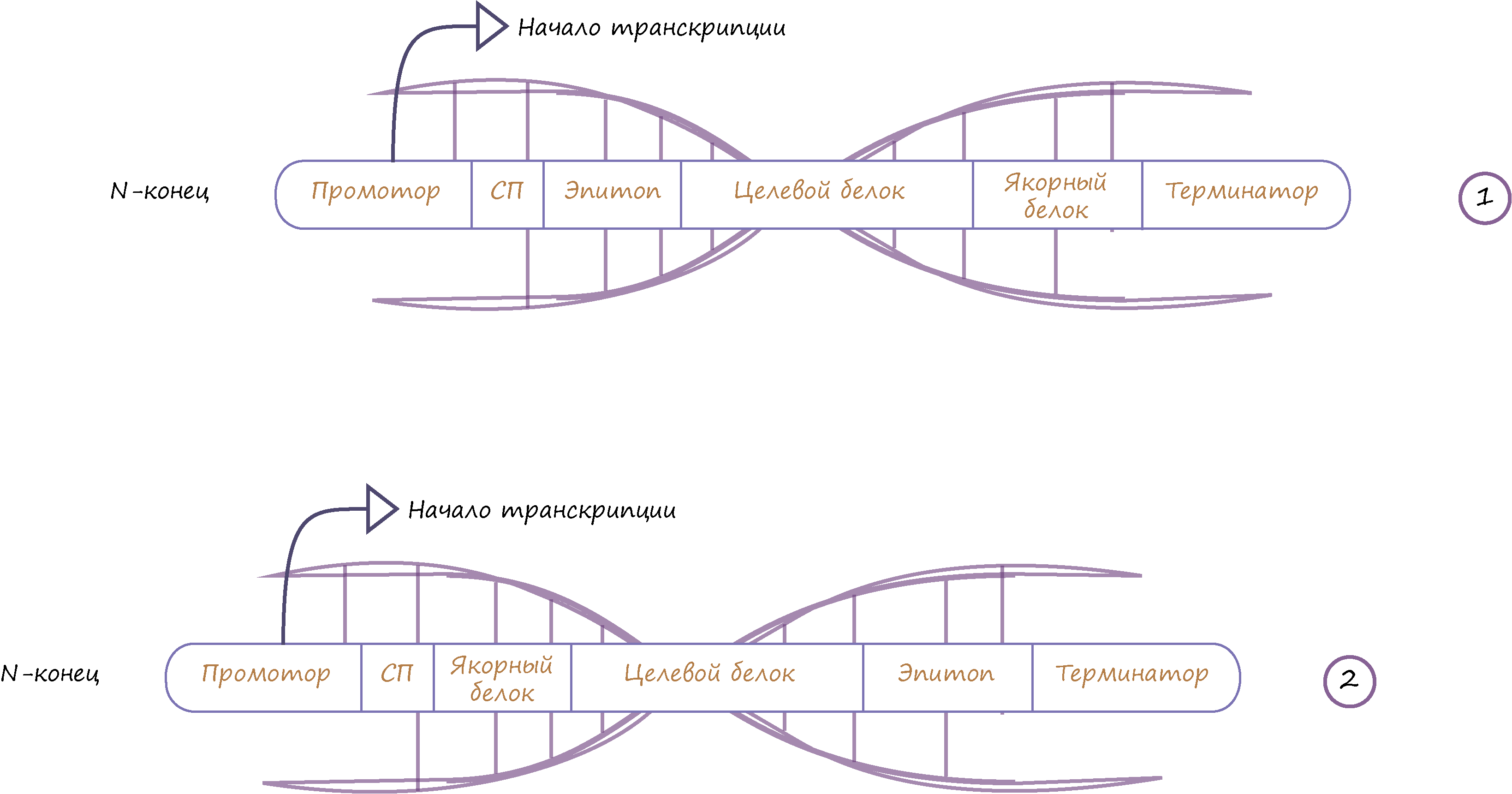
Рисунок 2. Типичные генетические конструкции, используемые в дрожжевом дисплее. Указано расположение целевого белка по отношению к якорному белку. Первая схема — это ДНК-последовательность для белка, который прикрепляется за N-конец, вторая схема — аналогично, но за С-конец.
рисунок автора статьи
Генетическая конструкция (рис. 2) включает в себя:
- Промотор — это последовательность ДНК, с которой начинается транскрипция гена.
- СП — сигнальный пептид (отвечает за перенос собранного белка на поверхность мембраны клетки из цитоплазмы). После того, как белок доставлен на мембрану, СП отщепляется специальным ферментом.
- Целевой белок — нуклеотидная последовательность белка, который мы хотим синтезировать.
- Последовательность якорного белка — он соединяется с protein of interest на поверхности клетки, то есть выполняет роль клея для нашего белка.
- Терминатор — последовательность ДНК, на которой завершается транскрипция гена.
Генетическая конструкция, кодирующая наш белок, должна быть встроена в сам геном дрожжевой клетки или помещена в состав плазмиды.
Допустим, с промотором всё более-менее известно и понятно: экспериментальным путем молекулярные биологи подбирают самый лучший вариант нуклеотидной последовательности для синтеза именно в этом виде дрожжей. Кроме того, ученые могут найти эту информацию в статьях и патентах, для которых уже прописаны стандартные протоколы по проведению эксперимента.
В методе дрожжевого дисплея особенными составляющими являются якоря и якорные белки, поэтому разберем их подробнее [6].
Якорные белки: какие бывают белки клеточной стенки в дрожжевом дисплее?
Для ответа на этот вопрос сперва разберемся с устройством клеточной стенки дрожжей, так как именно она играет ключевую роль в закреплении нашей конструкции и делает метод дрожжевого дисплея таким удобным в применении (рис. 3).
Стенка дрожжей имеет толщину ~200 нм и выполняет функции поддержания формы организма и осмотического давления [6]. Она состоит из двух слоев:
- Внутренний слой отвечает за механическую прочность и состоит из β-1,3-глюканов, β-1,6-глюканов и хитина (1–2%). Глюканы вместе составляют 50% веса всей клеточной стенки.
- Внешний слой участвует в межклеточном взаимодействии и состоит из сильно гликозированных манопротеинов (Cell Wall Proteins, CWPs), которые в основном связаны с сетью глюканов.
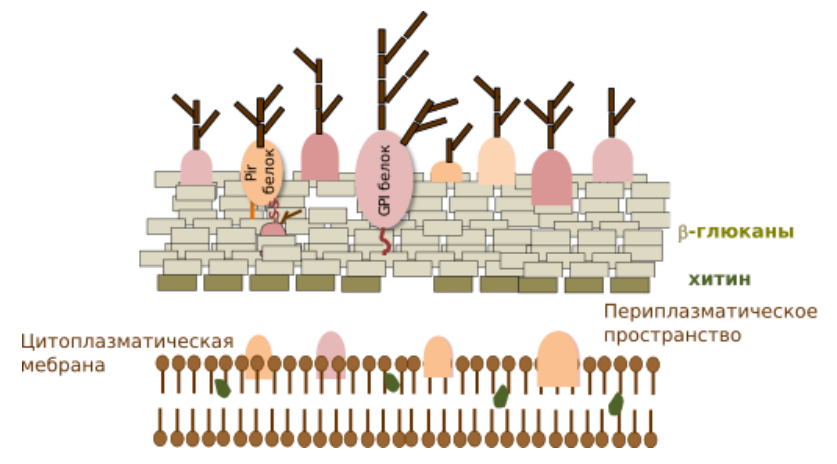
Рисунок 3. Схематическое представление клеточной стенки дрожжей. Также на картинке изображены различные якорные белки и их способы закрепления в клеточной стенке дрожжей. Видно, что вся заякоренная конструкция в конечном счете располагается среди молекул β-глюканов.
В закреплении целевого белка на поверхности дрожжевой клетки участвуют белки клеточной стенки, а иногда — их фрагменты. Они отличаются друг от друга по ряду факторов: по свободному концу, к которому может прицепиться целевой белок, по механизму взаимодействия с клеточной стенкой и равномерности распределения на ней, а также по уровню синтеза в различные периоды клеточного цикла.
После ряда исследований стало известно [7], что часть белков клеточной стенки дрожжей закрепляется в ней при помощи GPI-якоря (гликозилфосфатидилинозитолового якоря) — гликолипида, который присоединяется к С-концу белка в эндоплазматическом ретикулуме (ЭПР) в процессе посттрансляционной модификации. Это происходит за счет гидрофобных взаимодействий: участки якоря и белка как бы слипаются друг с другом. GPI-якорные белки закреплены на клеточной стенке при помощи ковалентных связей с β-1,6-глюканами, то есть они достаточно прочно врастают в поверхность дрожжей.
Есть и другие классы белков, например, Pir-белки (Protein with inverted repeats), которые ковалентно связываются с клеточной стенкой за счет цистеина и глутамина, образующих связи с β-1,3-глюканами, и не используют якоря для закрепления [8].
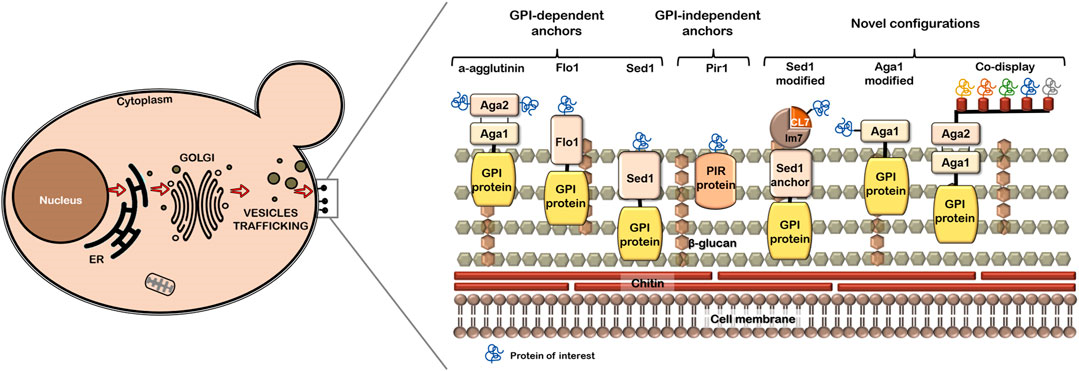
Рисунок 4. Обычные и модифицированные якоря. Некоторые якоря, такие как Aga1-Aga2 (из группы GPI-якорных), позволяют закреплять целевые белки как за их N-конец, так и за C-конец. Pir-белки (Protein with inverted repeats) не используют якоря и ковалентно связываются с клеточной стенкой за счет цистеина и глутамина, образующие связи с β-1,3-глюканами. Целевой белок обозначен на картинке синей завитушкой.
Соответственно, все якорные белки делятся на три группы по механизму закрепления в клеточной стенке (рис. 4):
- GPI-якорные,
- FS/FL,
- Pir-белки.
Еще раз отметим, что только первое из перечисленных семейств (GPI-якорные) использует для связи с клеточной стенкой якорь. Оно является самым популярным в применении на практике. Остальные две группы иным способом взаимодействуют с дрожжевой стенкой.
Разберем подробности на первом и третьем подтипах, так как они наиболее часто используются на практике.
GPI-якорные белки
Якорные белки, закрепленные на поверхности клетки при помощи GPI-якоря, имеют сигнальный пептид (СП), с помощью которого направляются на поверхность мембраны. Далее связь якорного белка с липидами мембраны (его гидрофобная часть сидит внутри нее) разрушается фосфолипазой С. Белок попадает в клеточную стенку и закрепляется в ней за счет ковалентной связи между остатком GPI-якоря и β-1,6-глюканом. С-конец якорного белка участвует в его закреплении в клеточной стенке (связь с GPI-якорем), а вот его N-конец может связаться с целевым белком. Эта «однобокость» является главным недостатком данного типа закрепления.
В случае GPI-якоря, наиболее часто используют белки Sag1(AGa1), Aga1-Aga2, Fig2 и Flo1. Все эти белки были выделены из клеточной стенки дрожжей при обработке специальными ферментами. Эти белки выполняют различные функции в клетках дрожжей (например, Sag1 отвечает за половое размножение) и по-разному присоединяют наш целевой белок.
Pir-белки
Белки семейства Pir — это консервативное семейство белков клеточной стенки, общим свойством которых является наличие внутренних аминокислотных повторов — SQIGDGQIQAT. Помимо этих повторов, Pir-белки также содержат:
- N-концевой сигнальный пептид, который отщепляется сериновой протеазой Луч 2 в аппарате Гольджи;
- консервативный регион с четырьмя остатками цистеина на С-конце.
Данное семейство белков обнаружено у разных видов дрожжей, а внутри одного вида белки отличаются по количеству аминокислотных повторов.
Обнаружено два механизма взаимодействия Pir-белков с клеточной стенкой:
- Первый заключается в образовании сложных эфирных связей между β-1,3-глюканами и γ-карбоксильными группами второго глутаминового остатка внутренних повторов SQIGDGQIQAT.
- Второй же — в образовании дисульфидных мостиков между остатками цистеина на С-конце и белками — компонентами клеточной стенки.
Семейство этих белков стало настоящей сказкой для молекулярных биологов: с ними стратегии создания заякоренных конструкций стали очень и очень разнообразны. Как хлеб всему голова, так и Pir-белки способны на многое!
Например, можно присоединить целевой белок с N-конца, тогда в этом случае остатки цистеина на С-конце отвечают за заякоривание белка посредством дисульфидных мостиков.
А можно присоединить целевой белок с С-конца. В данном случае заякоривание происходит за счет образования сложных эфирных связей между клеточной стенкой и внутренними повторами.
Но самый изысканный «рецепт» — это встраивание protein of interest между N- и С- концами Pir-белка. Такой механизм используется, когда для прочного заякоривания недостаточно одного из концов ввиду маленького количества повторов SQIGDGQIQAT. При помощи Pir-белков заякориваются такие ферменты, как ксиланазы и гликозилтрансферазы, у которых активные центры располагаются близко к их С-концу.
О применении
Мы разобрали идею дрожжевого дисплея на популярных примерах, применяющихся повсеместно в мире биотехнологий. И, конечно, наука ради науки — это романтично, но что же касается конкретного приложения (рис. 5)?
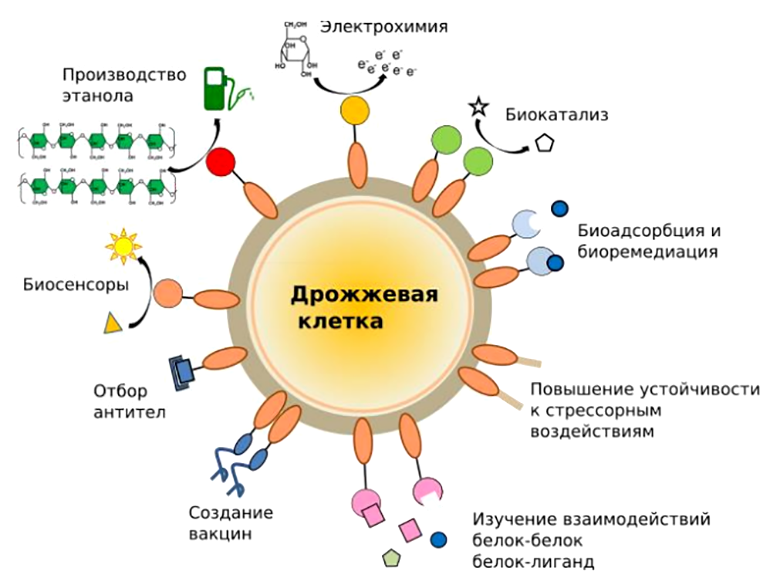
Рисунок 5. Области применения дрожжевого дисплея.
Метод дрожжевого дисплея нашел приложение в переработке таких промышленных отходов, как целлюлоза и крахмал; используется в катализе реакций на крупных субстратах, которые просто не могут попасть в клетку, или при неоптимальных для фермента условиях [6]. Кроме того, дрожжевой дисплей позволяет повысить устойчивость целевого белка к изменениям pH, температуры, к наличию протеаз и органических растворителей. Также стало возможным более эффективное изучение белок-белковых взаимодействий, ведь закрепление белка в клеточной стенке позитивно влияет на его кинетические свойства.
Конечно, данный метод имеет свои недостатки: в частности, это касается скрининга антител. При трансформации дрожжей количество клонов с различными антителами получается на порядки меньше, чем при использовании фагов (о фаговом дисплее подробно написано в статье «12 методов в картинках: иммунологические технологии» [4]). Большое количество заякоренных на поверхности дрожжей антител ведет к тому, что отбор происходит не по аффинности взаимодействия антиген—антитело, а по авидности. По этим причинам ученые решили использовать фаговый и дрожжевой дисплеи в комбинации для ряда задач.
Дрожжевой дисплей часто применяется для исследовательских задач, например, для изучения кинетики ферментативных гетерофазных реакций, когда нам нужно закрепить белок и при контролируемых внешних условиях зафиксировать протекание процесса.
За последние десятилетия огромное количество тяжелых металлов попало в окружающую среду, что представляет собой глобальную экологическую проблему. Ценные редкие металлы (Pd, Mo, Ni и Pt) и токсичные тяжелые металлы (Zn, Cu, Cd и также Ni) часто обнаруживаются в сточных водах. Их эффективное извлечение — важная задача с точки зрения повторного использования ресурсов и очистки окружающей среды. Биоадсорбция — экстраклеточное связывание ионов металлов микроорганизмами за счет олигосахаридов и пептидов — позволяет решить обе эти проблемы [9]. Например, для связывания диоксида урана (UO2) — одного из наиболее востребованных металлов, можно использовать мутантный Ni2+-зависимый транскрипционный фактор (NikRm). Экспонированный на поверхности клеток S. cerevisiae, он привел к эффективной сорбции ионов диоксида урана [10].
Помимо металлов, важно избавляться и от других типов загрязнений. Так, иммобилизация рецептора эстрогена крысы (ERLBD) на поверхности клеток S. cerevisiae позволила им эффективно связывать эстрогеноподобные молекулы со сродством, близким к нативному рецептору [11]. Бисфенолы, фталаты и перфторированные органические соединения, очень распространенные в биосфере, являются такими соединениями. Их молекулы напоминают женские половые гормоны, поэтому их наличие в организме беременной нарушает обычное развитие плода и отражается на умственном развитии ребенка в дальнейшем.
На самом деле, технология дрожжевого дисплея только начинает набирать обороты: достаточно углубиться чуть больше в детали, как становится понятно, что поле еще не пахано и огромное количество белков клеточной стенки ждут своих исследователей.
Литература
- Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?;
- Огромный и загадочный мир бактериофагов;
- Модельные организмы: фаг лямбда;
- 12 методов в картинках: иммунологические технологии;
- Гапизов С.Ш. Гибридные белки на основе 10-го домена фибронектина для молекулярной диагностики и терапии: дис. — Москва, 2019. — 142 с.;
- Слепченков А.В. Разработка платформы для экспонирования гетерологичных белков на поверхности клеток дрожжей: дис. — СПб, 2018. — 81 с.;
- Frans M. Klis, Pieternella Mol, Klaas Hellingwerf, Stanley Brul. (2002). Dynamics of cell wall structure inSaccharomyces cerevisiae. FEMS Microbiol Rev. 26, 239-256;
- Karla V. Teymennet-Ramírez, Fernando Martínez-Morales, María R. Trejo-Hernández. (2022). Yeast Surface Display System: Strategies for Improvement and Biotechnological Applications. Front. Bioeng. Biotechnol.. 9;
- Kouichi Kuroda, Mitsuyoshi Ueda. (2011). Cell surface engineering of yeast for applications in white biotechnology. Biotechnol Lett. 33, 1-9;
- Kouichi Kuroda, Kazuki Ebisutani, Katsuya Iida, Takashi Nishitani, Mitsuyoshi Ueda. (2014). Enhanced Adsorption and Recovery of Uranyl Ions by NikR Mutant-Displaying Yeast. Biomolecules. 4, 390-401;
- Yasui M., Shibasaki S., Kuroda K., Ueda M., Kawada N., et. al.. (2002). An arming yeast with the ability to entrap fluorescent 17β-estradiol on the cell surface. Applied Microbiology and Biotechnology. 59, 329-331.







