Мышиные миобласты против дистрофии Дюшенна
25 мая 2020
Мышиные миобласты против дистрофии Дюшенна
- 563
- 0
- 1
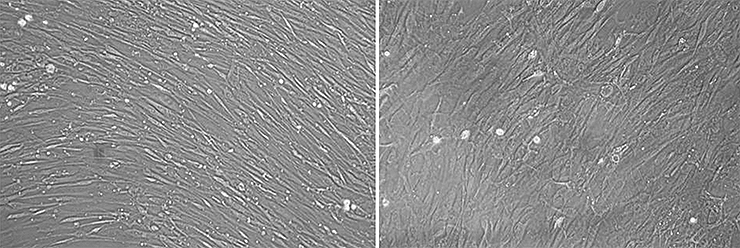
Миоциты здоровых мышей (слева) и мышей, лишенных функционального дистрофина (справа)
-
Автор
-
Редактор
Мышечная дистрофия Дюшенна, поражающая одного из трех-пяти тысяч мальчиков, связана с мутациями в гене DMD, кодирующем белок дистрофин. В норме дистрофин связывает актиновый цитоскелет миоцитов с внеклеточным матриксом, а в отсутствие функционального белка сокращения мышцы приводят к разрушению целостности мембран миоцитов. Российские исследователи предложили новую модель для изучения дистрофии Дюшенна на основе первичных миобластов мышей с мутантным дистрофином. Помогут ли мышиные миобласты в борьбе против дистрофии Дюшенна? Давайте разбираться.
Миодистрофия Дюшенна является классическим примером X-сцепленного наследственного заболевания, которое поражает почти исключительно мальчиков. Манифестация заболевания происходит в раннем детстве, и человек погибает еще в юном возрасте из-за прогрессирующего разрушения мышц. Причина дистрофии Дюшенна кроется в мутациях гена DMD, которые делают его продукт — белок дистрофин — нефункциональным. В нормальных мышцах дистрофин локализуется недалеко от сарколеммы (мембраны мышечных клеток) и посредством особых трансмембранных дистрофин-ассоциированных гликопротеиновых комплексов (ДАГК, DGC) обеспечивает связь актинового цитоскелета миоцитов с внеклеточным матриксом [1]. Когда функционального дистрофина нет, сокращения становятся для мышц поистине фатальными: повреждается сакролемма, повышается уровень кальция внутри миоцитов, из-за чего нарушается работа митохондрий, возникает окислительный стресс и в конечном счете развивается воспаление и некроз мышечной ткани. Смерть наступает из-за отказа дыхательных мышц или миокарда.
На данный момент лечение болезни носит скорее симптоматический характер и направлено на подавление чрезмерного воспалительного процесса в мышцах. Предлагается также восстанавливать мышечную ткань, стимулируя пролиферативную активность сателлитных клеток. Однако одно из самых многообещающих направлений лечения дистрофии Дюшенна — генная терапия . Активно разрабатывается возможность доставки нормального гена дистрофина или его укороченной (но функциональной копии) в мышцы посредством специальных векторов, в частности, аденоассоциированных вирусов.
О терапии миодистрофии Дюшенна укороченными версиями дистрофина, доставляемыми в клетки с помощью аденоассоциированных вирусов, подробно рассказано в статье «Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик» [1], а материал «Фетальная генная терапия: от теории — к практике» раскрывает возможности генной терапии плода [2].
Аденоассоциированные вирусы хороши тем, что обладают низкой иммунногенностью, и получить конструкт с нужной вставкой на их основе с технической точки зрения не представляет больших сложностей. Впрочем, у аденоассоциированных вирусов есть и свои существенные недостатки: в частности, из-за маленького размера капсида в их ДНК нельзя внедрить длинную вставку. Однако использование синтетической урезанной копии гена дистрофина, остающейся функциональной, может решить проблему применения аденоассоциированных вирусов для лечения дистрофии Дюшенна.
Чтобы детально разобраться с молекулярными механизмами болезни и иметь возможность проверять возможные стратегии лечения, необходимо иметь под рукой адекватную модель заболевания, причем, желательно, дешевую и относительно просто получаемую. Российские исследователи из компании «Марлин Биотех», Сколтеха и Института биологии гена РАН предложили использовать для изучения дистрофии Дюшенна принципиально новую модель — первичные миобласты мышей линии mdx с мутантным дистрофином [3]. Используя специальные среды для культивирования, исследователи вызвали дифференцировку миобластов в зрелые мышечные трубочки. Сокращения мышечных трубочек, растущих в культуре на шестилуночных планшетах, вызывали с помощью электрической пульсовой стимуляции. В отсутствие функционального дистрофина электрическая стимуляция приводила к нарушению целостности мембраны, которое ученые детектировали с помощью специального красителя TO-PRO-3, не способного проникать через интактную клеточную мембрану. Повреждения в мембране, возникающие в результате электростимуляции, позволяют красителю пройти внутрь миоцита, что можно обнаружить и количественно оценить с помощью флуоресцентной микроскопии (рис. 1).
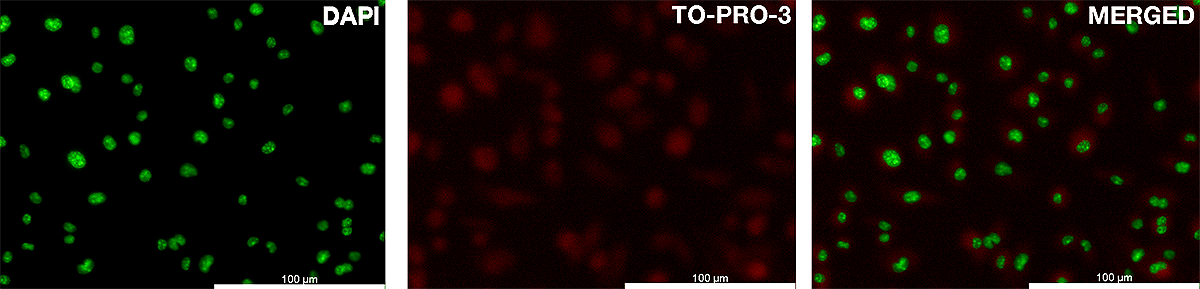
Рисунок 1. Анализ целостности мембраны с помощью красителя TO-PRO-3. После стимуляции я́дра миоцитов выявляли с помощью красителя DAPI, окрашивающего ДНК. Интенсивность свечения TO-PRO-3 была нормирована на размер ядра, определенный с помощью DAPI.
Как появление в миоцитах функционального дистрофина скажется на их реакции на электрическую стимуляцию? Чтобы ответить на этот вопрос, ученые создали вектор на основе аденоассоциированного вируса, в который включили вставку гена микродистрофина — укороченной формы дистрофина, сохраняющей функциональность. После трансдукции вектором провели эксперимент с электростимуляцией и оценкой целостности мембраны с помощью красителя TO-PRO-3. Оказалось, что после введения конструкта, кодирующего микродистрофин, повреждений сарколеммы в результате стимуляции, характерных для лишенных дистрофина мышечных трубочек, не появилось. Экспрессию микродистрофина в измененных миоцитах доказали с помощью окрашивания антителами (рис. 2).
О разнообразии векторов и их использовании в молекулярной биологии можно прочитать в статье «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [4].
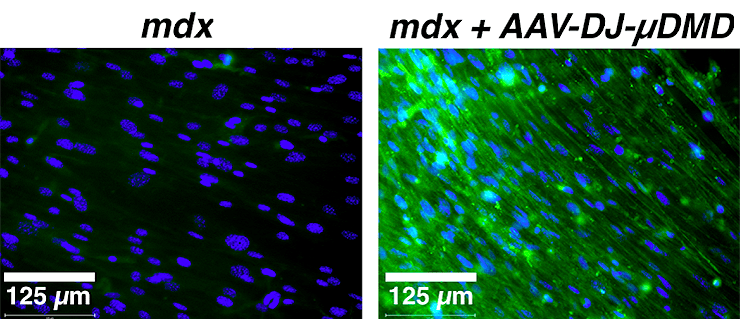
Рисунок 2. Окрашивание антителами к микродистрофину клеток, выделенных из мышей линии mdx и лишенных дистрофина (слева), и измененных клеток mdx (справа). Антитела светятся зеленым, синий цвет — краситель DAPI, окрашивающий ДНК.
Таким образом, ученые создали новую модель, позволяющую оценивать эффективность векторов на основе аденоассоциированных вирусов для восстановления нормального фенотипа у мышечных трубочек с нефункциональным дистрофином. В качестве фактора, аналогичного физической активности и механическому стрессу скелетных мышц, выбрали электрическую пульсовую стимуляцию. Ученые предложили оценивать восстановление нормального фенотипа, измеряя повреждения мембраны с помощью интенсивности флуоресценции красителя, который в норме через мембраны не проходит. Авторы работы отмечают, что с помощью предложенной модели можно будет одновременно проверять большое количество новых генетических конструкций для оценки их эффективности в потенциальной терапии дистрофии Дюшенна. Наконец, модель будет полезна и для фундаментального изучения механизмов поддержания целостности и восстановления сарколеммы.
Литература
- Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик;
- Фетальная генная терапия: от теории — к практике;
- Kirill A. Danilov, Svetlana G. Vassilieva, Anna V. Polikarpova, Anna V. Starikova, Anna A. Shmidt, et. al.. (2020). In vitro assay for the efficacy assessment of AAV vectors expressing microdystrophin. Experimental Cell Research. 112033;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники.