
Молекулярные тайны осенних листьев
28 января 2021
Молекулярные тайны осенних листьев
- 3776
- 2
- 6
фото автора статьи
-
Автор
-
Редактор
-
Рецензент
Статья на конкурс «Био/Мол/Текст»: Иосиф Бродский писал: «Осень — хорошее время, если вы не ботаник». Однако многие ботаники и физиологи растений с этим не согласятся, ведь, говоря словами Николая Заболоцкого, «осенний мир осмысленно устроен». В природе ни одна смена года не проходит без удивительного каскада молекулярных реакций и биохимических процессов, и осень — не исключение. Погрузимся в тайные механизмы фотосинтеза и тонкую гормональную перестройку, чтобы проследить за всеми процессами, ответственными за яркие краски осени.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как известно, за цвет листьев отвечают пигменты. Это очень важные (в чем мы неоднократно убедимся) вещества различной природы, которые имеются не только у растений, но и у других организмов (в том числе у нас). Что-то красивое и разноцветное (рис. 1 и 2) не может закрепиться в процессе эволюции просто так, так что и пигменты нужны не для придания цвета, а для обеспечения особых физиологических функций. Именно поэтому их синтез и распад строго регулируются в зависимости от условий и потребностей организма. Разберемся в этом подробнее!
А что там, внутри листьев?
Для того чтобы ответить на этот вопрос, нужно понять, какие красящие вещества (пигменты) в них обычно содержатся. Попробуем провести эксперимент, выделив, а затем разделив пигменты зеленого листа (рис. 3).
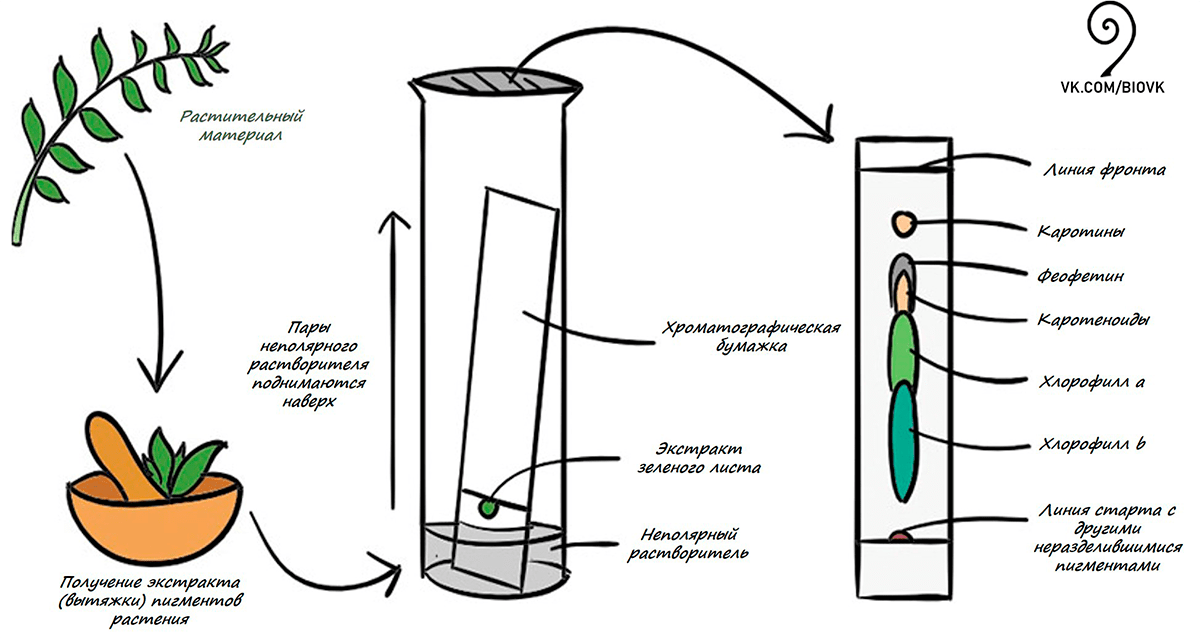
Рисунок 3. Хроматографическое разделение пигментов листа
Principles of chromatography, перевод автора статьи для сообщества «Биология»
Для начала разотрем листья в ступке, добавив 96%-ный спирт, который поможет разрушить остальные, не интересующие нас компоненты клетки. Эти ненужные компоненты мы обязательно отфильтруем (видео 1), чтобы получить чистую вытяжку (экстракт) пигментов.
Видео 1. Фильтрация экстракта листа
Пигменты — это химические вещества, поэтому для понимания эксперимента нам потребуются некоторые знания по химии. Вспомним одно важное правило из уроков химии: подобное растворяется в подобном. Так, в спирте как в полярном растворителе хорошо растворяются полярные вещества (например, хлорофиллы и некоторые каротиноиды), хотя на данном этапе работы там содержатся все пигменты, присутствующие в живом листе, в том числе и неполярные. Эти неполярные соединения можно легко отделить, используя неполярный растворитель (например бензин). Отделить можно и в пробирке, но для большей наглядности эксперимента мы возьмем фильтровальную бумажку (в лабораториях для более качественного разделения используют специальную хроматографическую бумагу или пластинки с нанесенным на них селикогелем). Капнув совсем немного полученной спиртовой вытяжки листа на бумажку (неподвижная фаза) (рис. 4), поставим ее в стакан, куда заранее мы налили неполярный растворитель (например, бензин или уайт-спирит) и где теперь содержатся пары неполярного растворителя.

Рисунок 4. Нанесение экстракта листа на хроматографическую бумажку

Рисунок 5. Хроматографическая бумажка в стакане с бензином. Видны разделившиеся пигменты.
Со временем пары бензина будут как бы «тянуть» то, что хочет раствориться в нем (неполярные соединения, например, каротины), вверх по бумажке (рис. 5). Адсорбирующие свойства бумажки также помогут физически разделить растительные пигменты, схожие по физико-химическим свойствам, но отличающиеся структурно.
Впервые подобный метод разделения пигментов зеленого листа применил русский ботаник-физиолог и биохимик растений Михаил Семенович Цвет в 1900 году. Этот метод спустя несколько лет был назван хроматографией. Хроматография позволяла разделить самые разные вещества: витамины, гормоны и многое другое, что в значительной степени расширило возможности их изучения. Именно благодаря этому методу ученому впервые удалось выделить в чистом виде ряд важнейших пигментов растения! Каких? Чтобы ответить на этот вопрос, посмотрим на результаты нашего эксперимента.
На хроматографической бумажке можно увидеть набор разноцветных полос (рис. 6), каждая из которых (в идеале) содержит один тип пигментов.
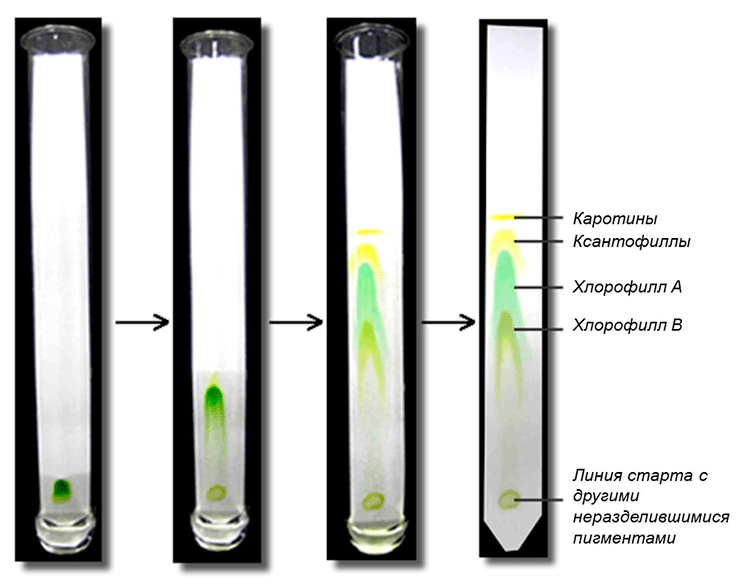
Рисунок 6. Результат хроматографического разделения пигментов листа (с использованием в качестве подвижной фазы уайт-спирита)
Column chromatography vs paper chromatography, рисунок адаптирован
Наверняка вам сразу бросаются в глаза две зеленые полоски — они содержат хлорофиллы. Хлорофилл а по химической структуре отличается от хлорофилла b наличием метильной группы вместо альдегидной (рис. 7).
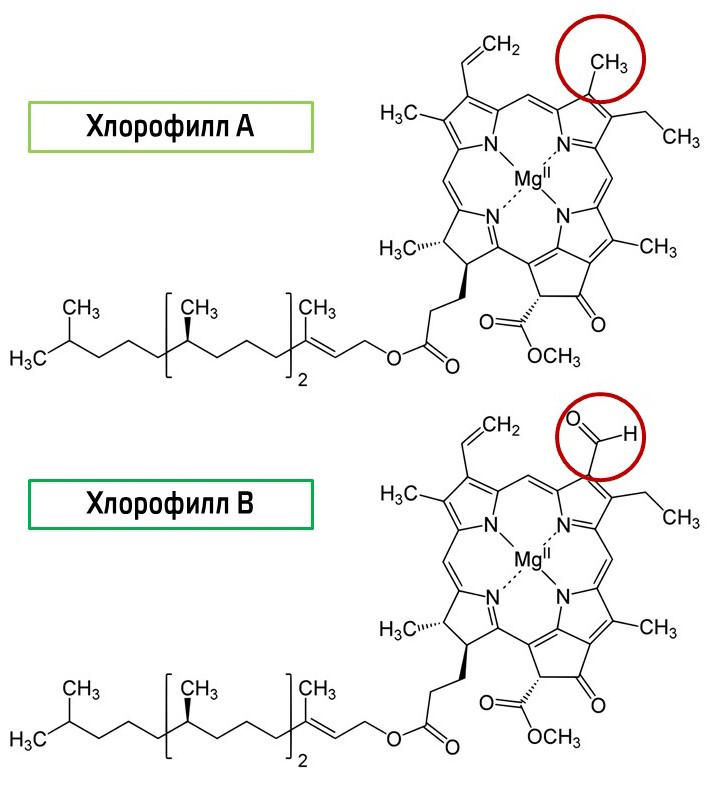
Рисунок 7. Структурная формула хлорофиллов а и b
схема автора статьи с использованием формул из «Википедии»
Это делает хлорофилл a менее полярным, поэтому он поднимается по нашей бумажке выше.
Есть и желтые линии разного оттенка — это каротиноиды. Существует две группы каротиноидов: ксантофиллы и каротины (рис. 8). Ксантофиллы в своем составе содержат кислород, поэтому являются полярными, а каротины кислорода не содержат, и поэтому неполярны.
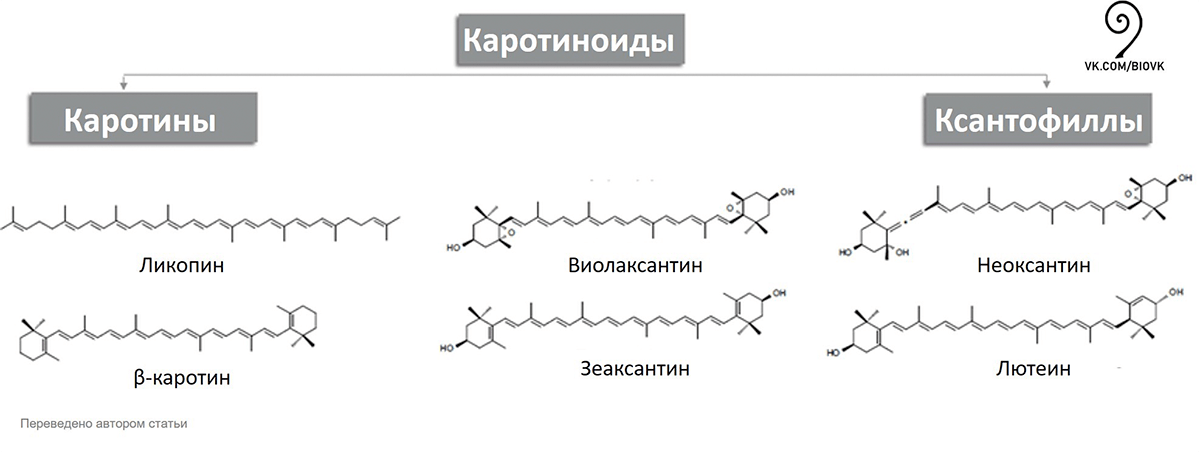
Рисунок 8. Разнообразие каротиноидов
[1], рисунок адаптирован
Все эти пигменты необходимы для важнейшего процесса в жизни растений — фотосинтеза. Фотосинтез — это мощнейший механизм в биосфере, позволяющий преобразовать солнечную энергию в энергию химических связей. Напомню, что фотосинтез можно разделить на световую и темновую (светонезависимую) фазы, причем обе из них идут только на свету! Световая фаза фотосинтеза включает в себя разнообразные процессы, главная цель которых — преобразование солнечной энергии в энергию химических связей (прежде всего АТФ и НАДФН+Н+). Для того чтобы получить АТФ, нужно запустить работу фермента АТФ-синтазы, а для того чтобы получить НАДФН, необходимо восстановить НАДФ+ (то есть дать ему электроны). В осуществлении всех этих процессов на мембранах тилакоидов внутри хлоропластов помогает электрон-транспортная цепь.
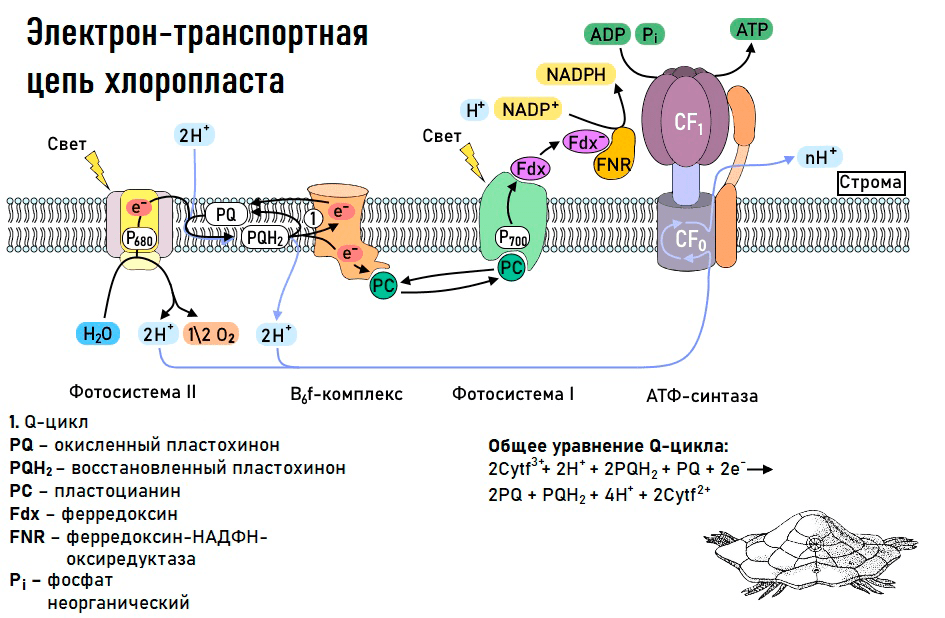
Рисунок 9. Электрон-транспортная цепь хлоропласта
схема нарисована Владом Начатым для сообщества «Биологи-всероссники»
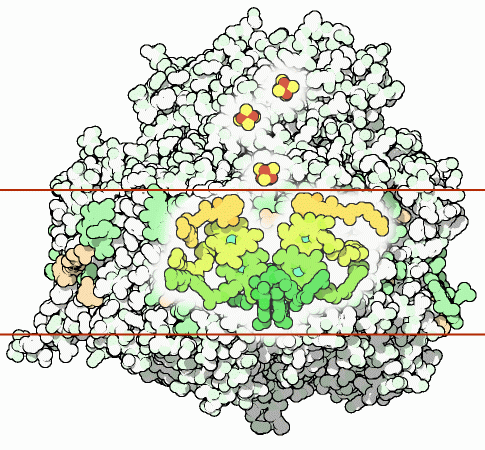
Рисунок 10. Структурная организация фотосистемы I. Отмечен реакционный центр и цепь кофакторов, участвующих в переносе электрона внутри фотосистемы I. Зеленым показаны хлорофиллы; оранжевым — филлохиноны; желто-красным — три железосернистых кластера.
Перенос электрона начинается с того, что особые белки — фотосистемы (их в цепи переноса электрона две: фотосистема I и фотосистема II) — улавливают квант света. Именно тут перед любым фотосинтетическим организмом (а это может быть не только растение) встает нелегкая задача: уловить как можно больше света и использовать его энергию для переноса электрона. Для этого рядом с фотосистемами и внутри них существуют специальные антенные комплексы, которые содержат хлорофиллы и каротиноиды. Особую роль в фотосистемах играют так называемые реакционные центры, представленные димерами хлорофиллов (рис. 10). Именно от них и будет отделяться электрон, который побежит по переносчикам цепи и попадет на НАДФ+ (существуют, однако и другие варианты транспорта электронов, но о них мы говорить не будем).
Хлорофиллы а и b, а также дополнительные пигменты каротиноиды выступают в качестве антенн (рис. 11), собирающих как можно большее количество энергии света.
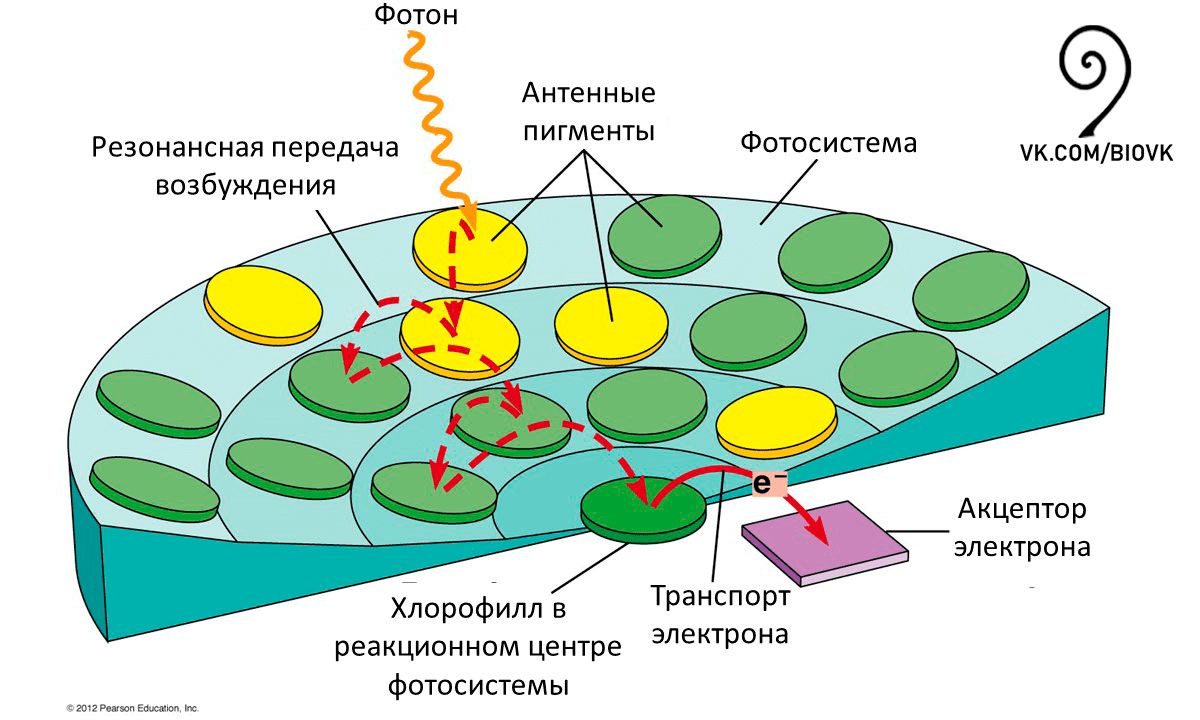
Рисунок 11. Схематическая структура антенного комплекса фотосистем. Попадающие на молекулы пигментов фотоны переводят их в возбужденное состояние, и это возбуждение передается путем экситонного механизма и в конечном итоге достигает реакционного центра. В реакционном центре происходит разделение зарядов, и электрон начинает двигаться по ряду переносчиков.
Light Harvesting Complexes, рисунок адаптирован для сообщества «Биология»
Как нетрудно догадаться, зеленые хлорофиллы в осенних листьях разрушаются, и в этот момент листья приобретают цвет каротиноидов (рис. 12).

Рисунок 12. Лист клена платановидного (Acer platanoides)
фото автора статьи
Бывают, однако, и красные листья (тогда как красных пигментов в нашей хроматограмме мы не нашли). Красный цвет (рис. 13) обусловлен антоцианами, присутствие которых описанным методом обнаружить не получится потому, что антоцианы водорастворимы и, следовательно, не экстрагируются этанолом. К тому же их синтез у растений нередко связан с защитной функцией, но к этому мы еще вернемся.
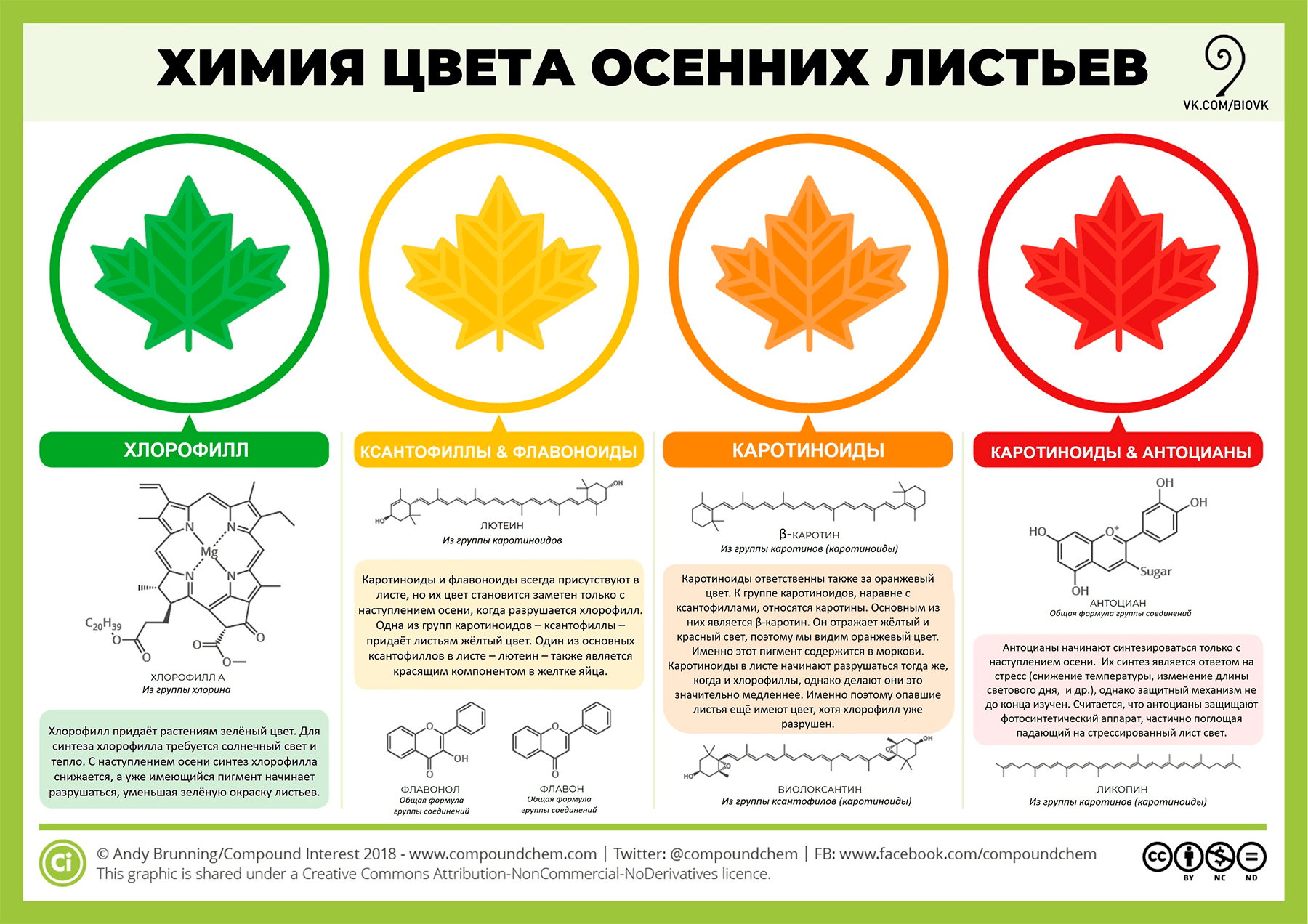
Рисунок 13. Химия осенних листьев
The Chemicals Behind the Colours of Autumn Leaves, рисунок адаптирован для сообщества «Биология»
Что заставляет листву менять цвет?
Для того чтобы ответить на этот вопрос, необходимо разобраться в том, благодаря каким сигналам и механизмам поддерживается работа хлоропластов и синтез фотосинтетических пигментов.
Как ни странно, в этом нам могут помочь грибы и бактерии, которые знают физиологию растений нередко гораздо лучше людей. Более того, некоторые фитогормоны были открыты благодаря исследованию патогенов растений. Об этом можно подробнее прочитать в моей статье для сообщества «Биология» во «ВКонтакте». Попробуем подглядеть за тем, что творят эти маленькие паразиты растений.
Гуляя в парке или по лесу, можно встретить листья, которые большей частью пожелтели, но на них остались зеленые пятна (рис. 14).

Рисунок 14. Лист клена платановидного (Acer platanoides), пораженного грибом ритисма кленовая (Rhytisma acerinum), выделяющим цитокинины
фото автора статьи
Подобные зеленые круги создают патогенные грибы, заражающие ослабленные и стареющие листья. Эти грибы умеют синтезировать и выделять небезызвестные растительные гормоны — цитокинины, которые заставляют растения фотосинтезировать «до последнего», тем самым позволяя грибам еще долгое время питаться углеводами растения.
Чтобы понять, как синтезированные грибами цитокинины действуют на хлоропласты (ведь именно они придают растению их зеленый цвет), попробуем проследить за жизнью пластид в лаборатории.
Все пластиды растений, в том числе виновники исследований — хлоропласты, берут свое начало из недифференцированных пропластид. Когда растение только начинает прорастать из семени и находится под землей, пропластиды начинают дифференцироваться в особые пластиды — этиопласты. В этиопластах накапливаются липиды, чтобы, как только на такой этиопласт попадет свет, оперативно сделать тилакоиды и ламеллы. Накопленные липиды хорошо различимы под электронным микроскопом и называются проламеллярными телами (рис. 15).
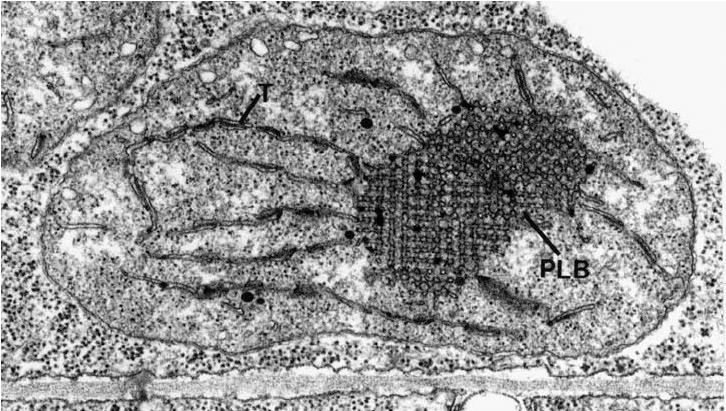
Рисунок 15. Электронная микрофотография этиопласта гороха на ранней стадии светоиндуцированного превращения в хлоропласт. T — тилакоид; PLB — проламеллярное тело.
Когда маленький проросток показывается из земли, падающий на него свет запускает целый каскад физиологических процессов (все их объединяют словом «деэтиоляция»), в частности превращение этиопластов в хлоропласты.
Какова роль цитокинина в этом превращении? Чтобы узнать это, возьмем трехдневные проростки излюбленного модельного организма физиологов растений Arabidopsis thaliana (подробнее о нем вы можете узнать, прочитав статью Елены Лабунской «Модельные организмы: арабидопсис», написанную в рамках спецпроекта «Модельные организмы» для портала «Биомолекула»), выращенные в темноте. Одни из них мы вырастим без каких-либо добавок (контроль), а другим добавим тот самый гормон, который производили патогенные грибы, — цитокинин, — а точнее возьмем его искусственный аналог — 6-бензиламинопурин (БАП). Чтобы увидеть изменения в структуре интересующих пластид, посмотрим на них под электронным микроскопом до освещения, через 6 часов после начала освещения и через 12 часов после освещения (рис. 16).
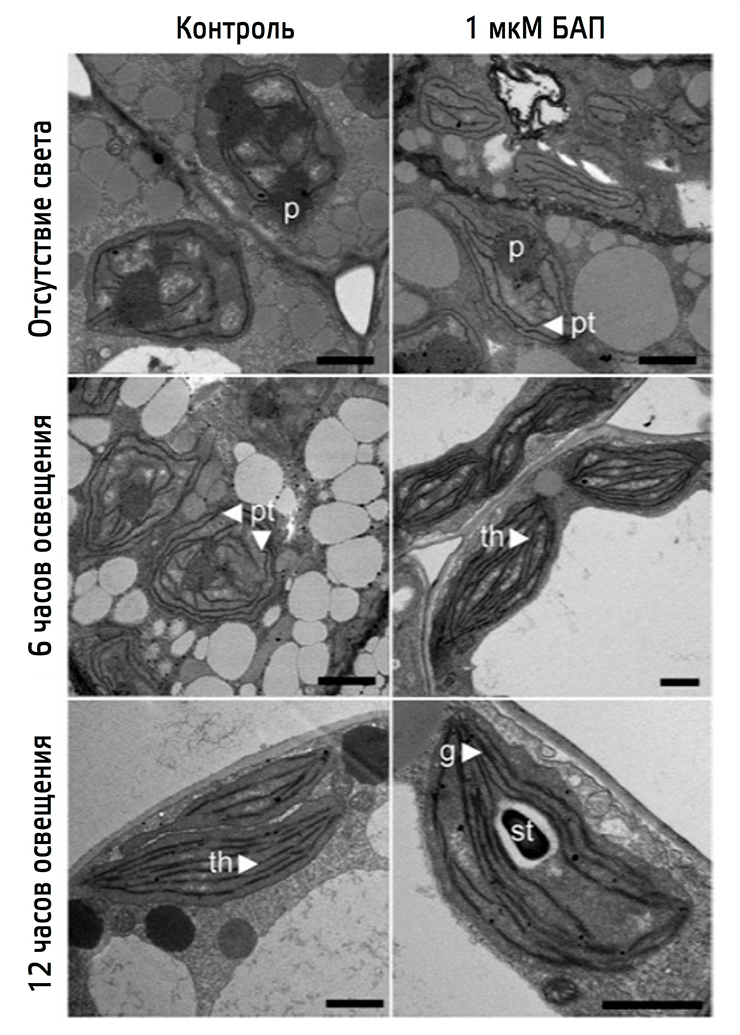
Рисунок 16. Влияние цитокинина на ультраструктуру хлоропластов при деэтиоляции. Условные обозначения: Р — проламеллярные тела; pt — претилакоиды; th — тилакоидные мембраны; g — грана; st — крахмал. После трехдневного роста в темноте этиопласты и в контрольных растениях, и в растениях, к которым был добавлен БАП, содержат крупные проламеллярные тела (Р). На этой стадии у растений, к которым добавляли БАП, присутствуют также претилакоиды (pt). После шестичасового освещения в контроле проламеллярные тела начинают распадаться и образуются претилакоидные мембраны (pt), тогда как у растений, выращенных в присутствии БАП, к этому моменту уже не видно проламеллярного тела, а тилакоидные (th) мембраны полностью развиты. Спустя 12 часов освещения у этих растений образуется полностью функциональный хлоропласт с тилакоидными мембранами и укладкой грана (g), кроме того, начинают формироваться гранулы крахмала (st). У контрольных растений после двенадцатичасового освещения есть хорошо развитые тилакоиды, но нет явно выраженных гран и отсутствуют крахмальные гранулы.
[4], рисунок адаптирован
Нетрудно заметить, как цитокинины позволяет хлоропластам добиться первенства в скорости их развития по сравнению с хлоропластами тех растений, которым цитокинин не добавляли! У растений под действием искусственного цитокинина тилакоиды начинают формироваться уже через 6 часов освещения, тогда как без них такую же картину можно увидеть только через 12 часов освещения.
Наверняка подобный эффект убедил читателей, что цитокинины участвуют в дифференцировке хлоропластов, и, сказать по правде, этот процесс гораздо сложнее, чем кажется. Так, цитокинины инициируют синтез белков, входящих в состав уже упомянутой фотосистемы II, запускают сплайсинг хлоропластной РНК, а также влияют на синтез хлорофилла (рис. 17).
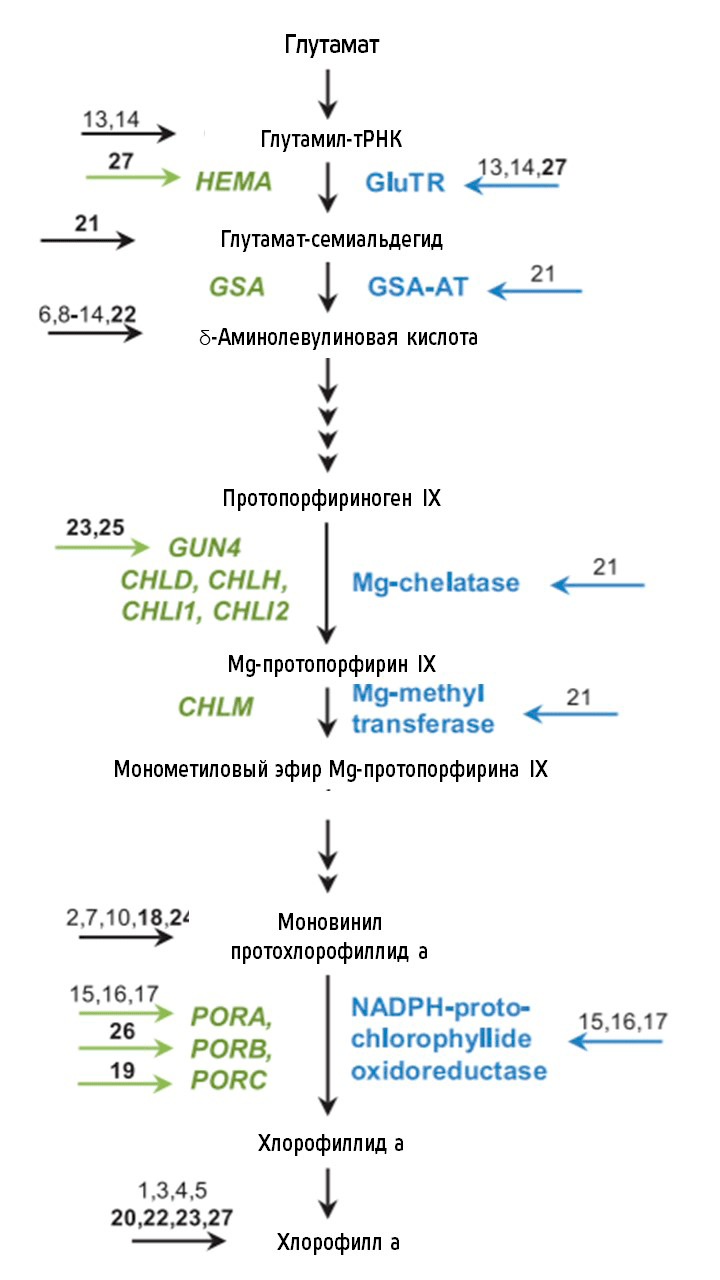
Рисунок 17. Роль цитокинина в биосинтезе хлорофилла. Показана упрощенная схема биосинтеза хлорофилла. Он начинается с превращения глутамата в 5-аминолевулиновую кислоту и сопровождается образованием порфириновой структуры, в результате чего образуется протопорфириноген IX. Биосинтез хлорофилла продолжается с включением Mg в протопорфириноген IX, что в конечном итоге приводит к синтезу хлорофилла. Зеленым (слева) показаны гены, а синим (справа) — ферменты, катализирующие различные реакции синтеза хлорофилла. Стрелки указывают на соединения и ферментативные стадии пути биосинтеза хлорофилла, которые, как известно, находятся под влиянием цитокинина.
[4], рисунок адаптирован
Кроме того, цитокинины индуцируют экспрессию генов апопластной инвертазы и гексозного транспортера. Зачем? Все предельно просто. Основной транспортной формой углеводов в растении является сахароза. Когда сахароза выходит из клетки (в апопласт), ее может разрушить имеющийся там фермент инвертаза. На что «развалится» сахароза? На фруктозу и глюкозу, а это — шестиуглеродные сахара, иными словами — гексозы. Их-то и хватает гексозный траспортер и заносит обратно в клетку. Получается, что такая система не дает продуктам фотосинтеза выходить из фотосинтезирующего органа. Подобный эффект называется аттрагирующим и препятствуют старению листа (рис. 18).
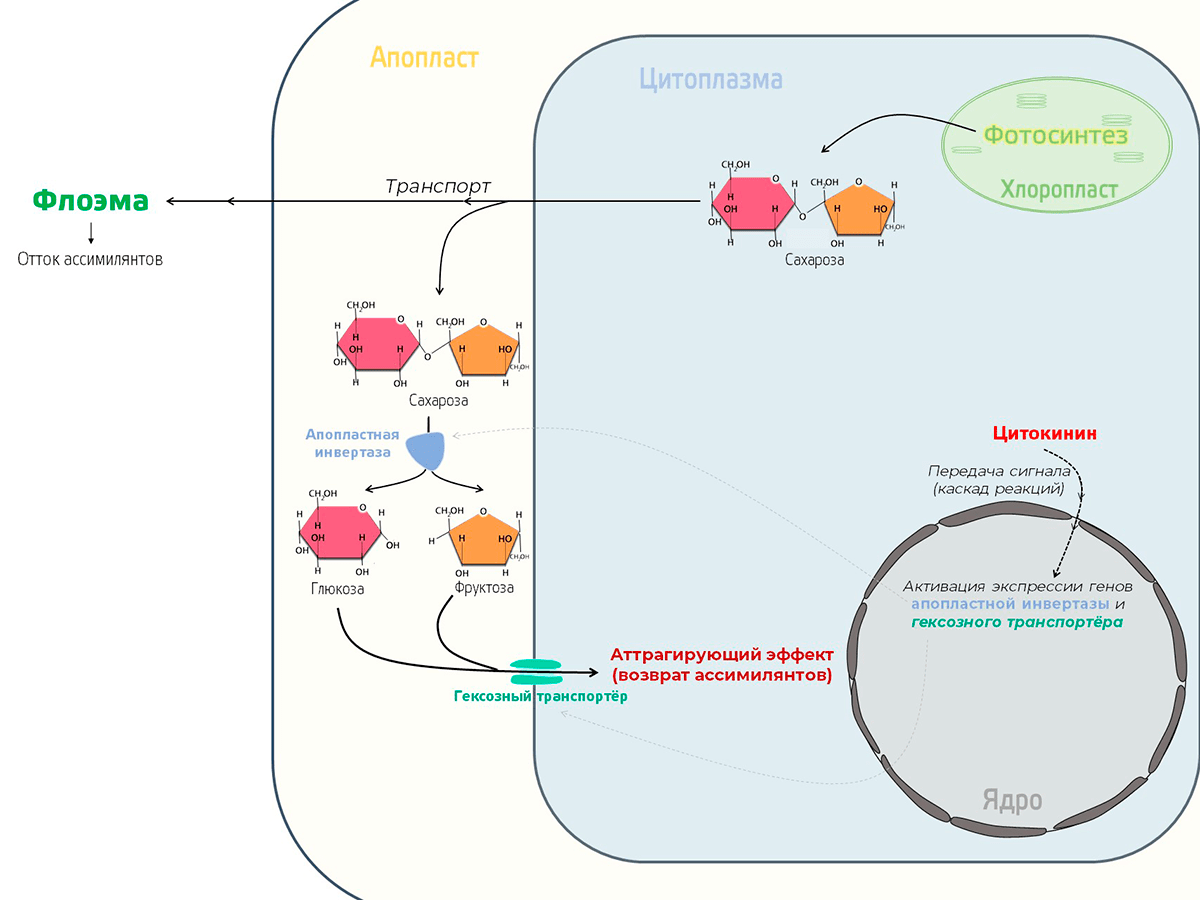
Рисунок 18. Модель регуляции старения за счет действия цитокинина и аттрагирующего эффекта
иллюстрация автора статьи по [5]
Из этого становится понятен смысл выделения цитокининов патогенами. Мало того, что они заставляют растения поддерживать хлоропласты, они еще и не дают углеводам, полученным в ходе фотосинтеза, уходить от того места, где поселились грибы.
Как показывают исследования, осенью уровень этого гормона снижается, и его рецепция начинает падать, а значит, и количество заново синтезированных фотосинтетических пигментов, и аттрагирующий эффект постепенно сходят на нет.
Стоит отметить, что помимо цитокининов для синтеза хлорофиллов также необходим свет (для работы фермента протохлорофиллидоксидоредуктазы), а значит, с уменьшением длины светового дня хлорофилла будет синтезироваться все меньше и меньше.
Осень — это стресс
Вообще подобная смена времен года воспринимается растением как стресс. Снижение длины светового дня, понижение температуры, изменение водного обмена — все это так или иначе приводит к тому, что в листе запускаются механизмы старения и опадения (рис. 19).

Рисунок 19. Стареющие листья боярышника кроваво-красного (Crataegus sanguinea)
фото автора статьи
Стрессовый сигнал SOS! опять-таки связан с гормонами, прежде всего с повышением уровня абсцизовой кислоты (АБК) и этилена. Повышение уровня этих гормонов зависит в том числе от сигналов с фоторецепторов, участвующих в работе циркадных ритмов растений. Через ряд посредников (рис. 20) активируется биосинтез этих гормонов, а также повышается экспрессия генов белков, участвующих в передаче сигнала этилена (EIN3) и АБК (ABI5).
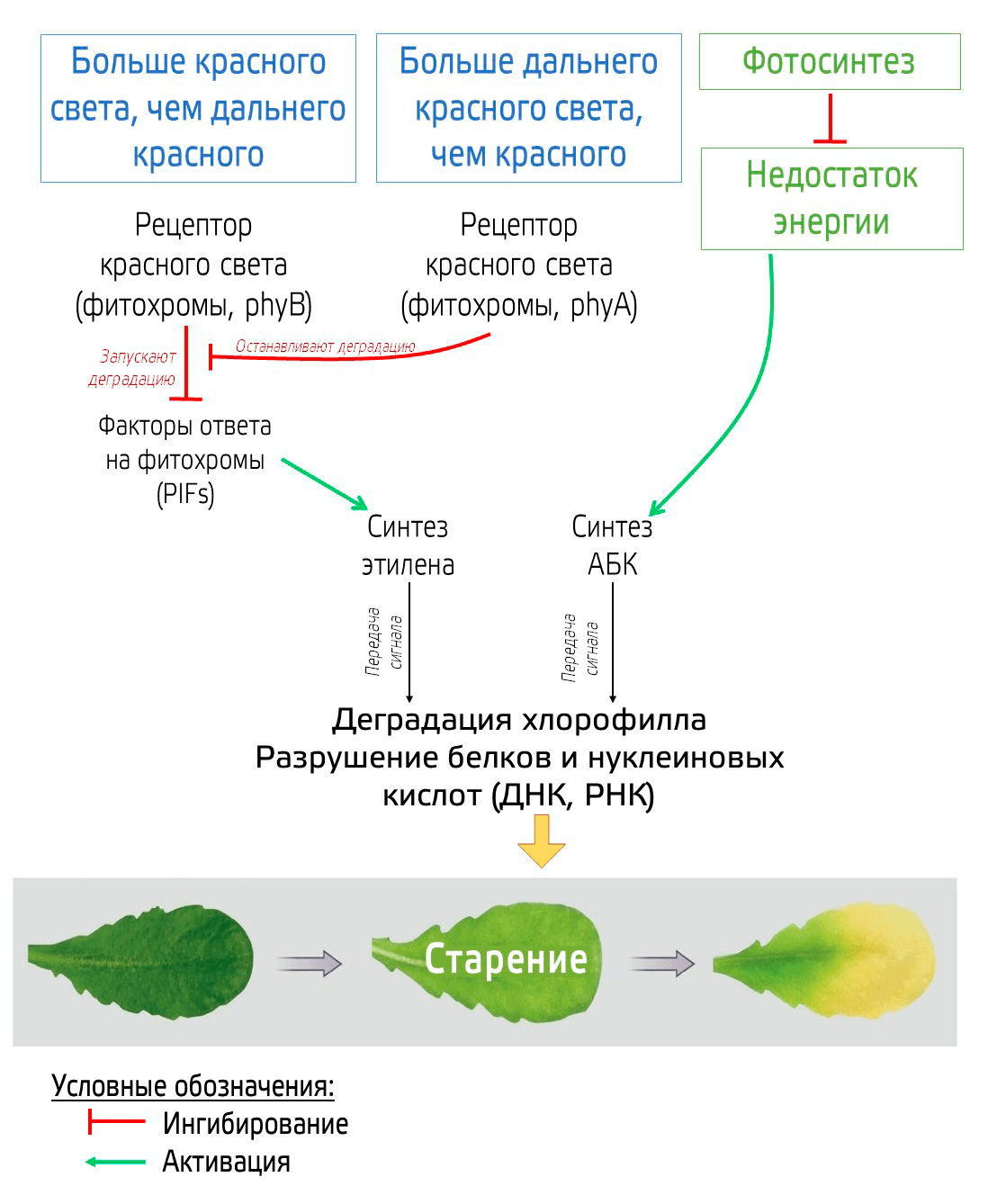
Рисунок 20. Молекулярная регуляторная сеть старения листьев, вызванного лишением света и уменьшением фотосинтетических функций. Соотношение красного и дальне красного света улавливается фитохромами (phy A и phy B).
иллюстрация автора статьи по [6]
Рисунок 21. Хлоропласты осенью превращаются в геронтопласты
Взаимодействие гормонов с рецептором приводит к каскаду реакций, запускающих распад хлорофилла, разрушение белков фотосинтеза и превращение хлоропластов в геронтопласты (рис. 21).
При этом разрушение всех пигментов зеленого листа начинается одновременно, но скорость их разрушения разная. Хлорофиллы разрушаются одними из первых, тогда как каротиноиды, придающие кроне ее золотой облик, делают это медленнее.
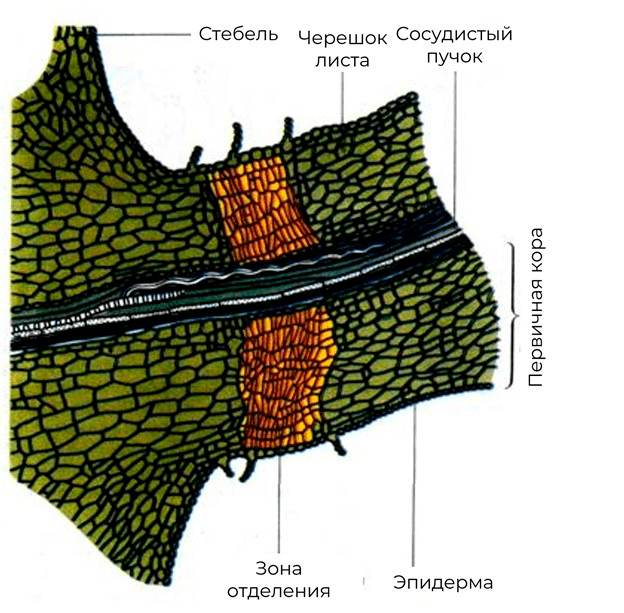
Рисунок 22. Формирования зоны отделения в черешке листа перед его опадением
учебник В.В. Полевого «Физиология растений»
Стоит отметить, что эти стрессовые гормоны также участвуют и в запуске опадения листьев. Интересно, что АБК был впервые обнаружен в качестве агента, который вызывает падение коробочек хлопчатника. Однако подобный эффект АБК чаще всего обусловлен недостатком воды. Основную роль в осеннем листопаде все же присваивают именно этилену. Для того чтобы листья опали, необходимо заложение отделительного слоя у основания черешка листа (рис. 22).
Этилен вызывает изменения в составе клеточной стенки, из-за чего происходит постепенное размягчение тканей в зоне отделения. Однако процесс закладки отделительного слоя зависит от баланса этилена с другим растительным гормоном — ауксином (рис. 23). Они в данном случае являются антагонистами.
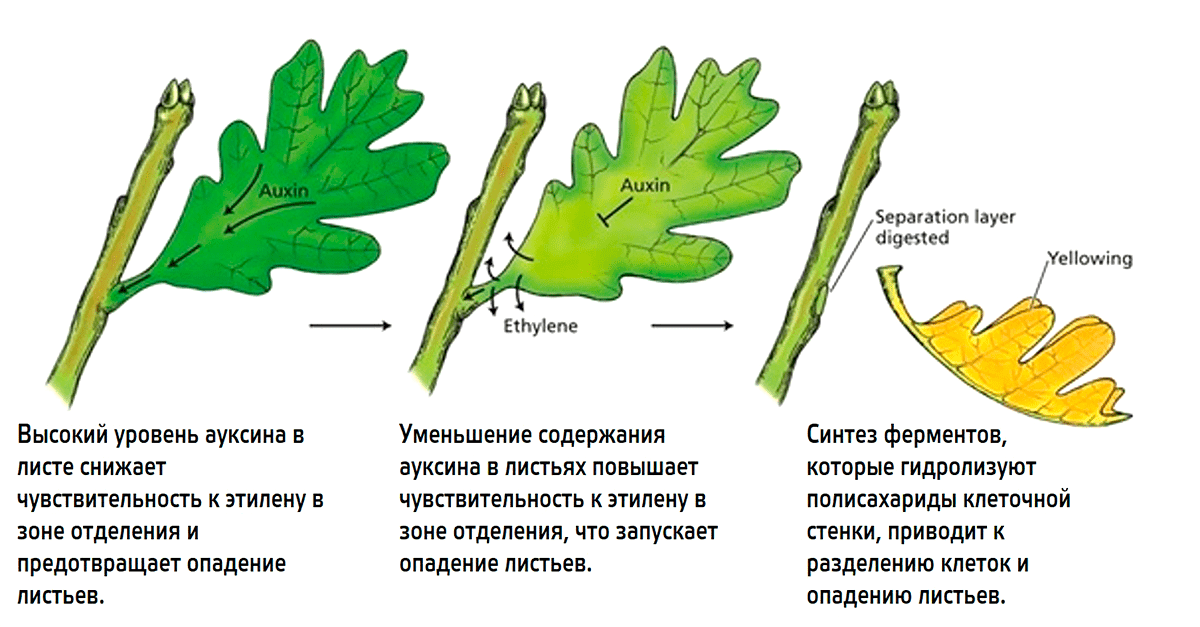
Рисунок 23. Роль ауксина и этилена в опадении листьев
Plant Physiology (5th Edition), figure 22.20; рисунок адаптирован
Но в конце концов при высокой концентрации этилена черешок листа в этом месте становится настолько непрочным, что любое дуновение ветра срывает лист с дерева (рис. 24).

Рисунок 24. Листопад
В ответ на наступление осеннего периода синтезируются не только гормоны стресса (этилен и АБК), но и протекторные соединения — антоцианы. И наверняка большинство из вас видели красные литься клена (рис. 25) или боярышника.

Рисунок 25. Лист клена платановидного (Acer platanoides), содержащий антоцианы
фото автора статьи
Синтез ферментов синтеза антоцианов зависит от целого ряда транскрипционных факторов (из классов MYB, bHLH и WD40) [8], [9], которые в свою очередь регулируются самыми разнообразными сигналами, в том числе гормональными. Так, антоцианы могут вырабатываться в ответ на различные факторы внешней среды: недостаток воды, избыточное освещение, недостаток минеральных веществ (например фосфора), но при этом антоцианы порой синтезируются и без участия сигналов из окружающей среды. Этими веществами могут быть окрашены цветы, плоды и даже листья некоторых растений (вспомнить хотя бы красный лук) в отсутствие стрессовых факторов.
Считается, что антоцианы участвуют в тушении активных форм кислорода (АФК) (рис. 26), фотозащите, в проведении сигнала о стрессе и в других физиологических реакциях.
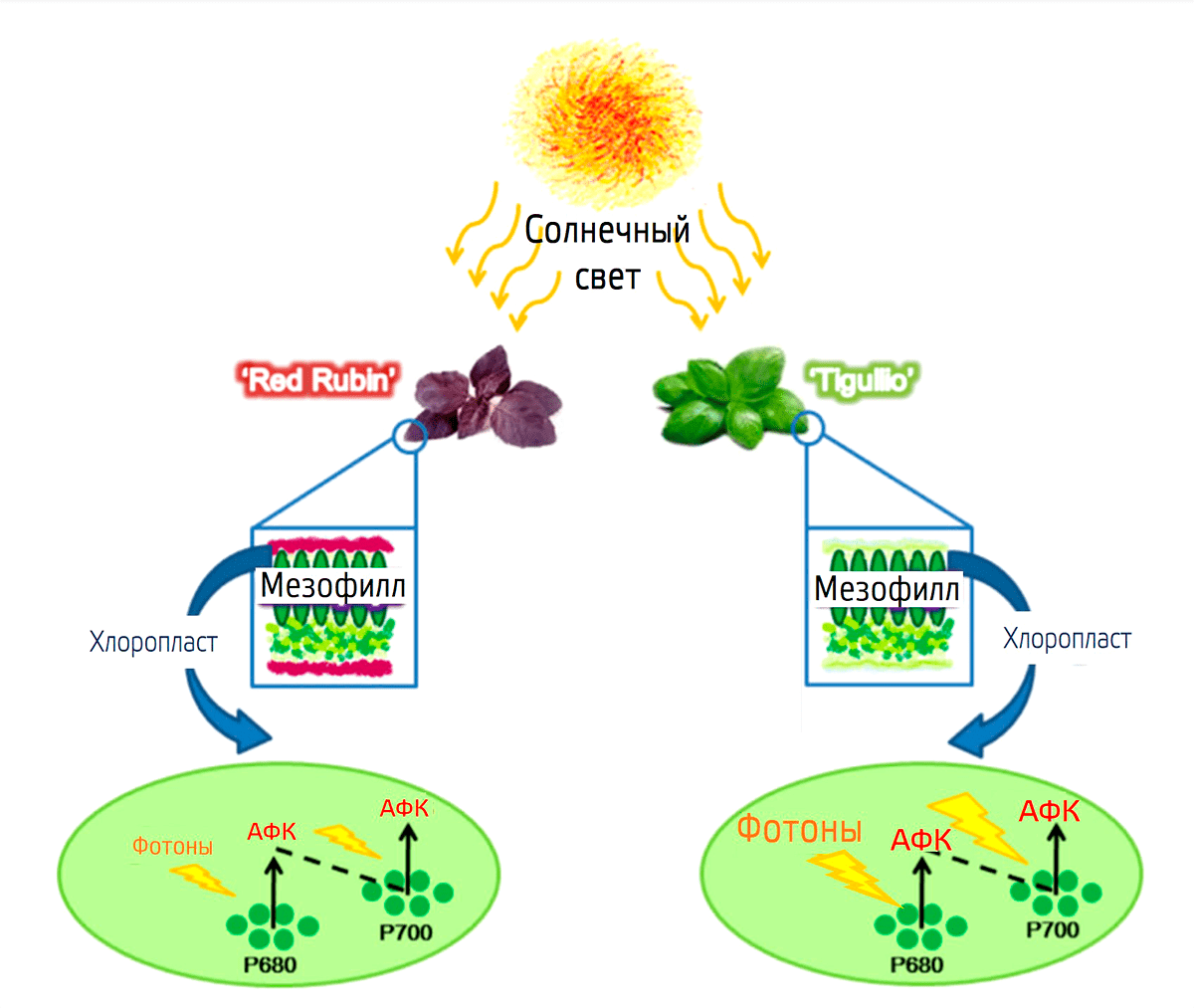
Рисунок 26. Предположительный механизм ослабления потока солнечной энергии (фотонов) и образования активных форм кислорода (АФК) благодаря антоцианам в красных пигментированных листьях базилика (Ocimum basilicum) сорта Red Rubin по сравнению с базиликом (Ocimum basilicum) сорта Tigullio, имеющим зеленые листья. Красный цвет антоцианов поглощает больше света, из-за чего на электрон-транспортную цепь хлоропласта (условно отмечены пигменты P680 и P700 в составе фотосистем II и I соответственно) падает меньше фотонов и вероятность образования АФК снижается.
[10], рисунок адаптирован
Действительно, если присмотреться к деревьям, которые имеют красные листья (рис. 27 и 28), то можно заметить, что большинство таких листьев находится на верхушке кроны. А ведь именно там на листья падает самое большое количество света.
Из-за того что синтез хлорофилла нарушен, фотосинтетический аппарат не может работать в достаточном режиме, поэтому в большом количестве образуются активные формы кислорода (АФК). Антоцианы же выступают в роли антиоксидантов, снижая количество активных форм кислорода, и поглощают часть поступающего на лист света, как бы экранируя хлорофилл от него.
А вспомните ли вы, какого еще цвета бывают осенние листья? Наверняка многие в детстве собирали желуди и знают, как выглядит дуб. Осенью под этим деревом вы не найдете красных или желтых листьев, как, например, у клена: опавшие листья дуба коричневые (рис. 29).

Рисунок 29. Опавшие листья дуба черешчатого (Quercus robur)
фото автора статьи
Подняв голову вверх и посмотрев на крону, вы заметите, что листья у дуба не желтеют, а скорее коричневеют (рис. 30).

Рисунок 30. Осенняя крона дуба черешчатого (Quercus robur)
фото автора статьи
Подобная окраска листьев связана с накоплением в них совершенно других веществ — хинонов. Они образуются в листьях растения из веществ, известных многим как дубильные вещества, — танинов. Раньше дубильные вещества использовались при обработке шкур животных: дубильные вещества обладают способностью взаимодействовать с белком коллагеном в коже, что и делало изделия мягкими и долговечными.
Реакцию превращения танинов, имеющих фенольную природу, в хиноны, окрашивающие листья в коричневый цвет, катализирует фермент полифенолоксидаза (ПФО) (рис. 31).
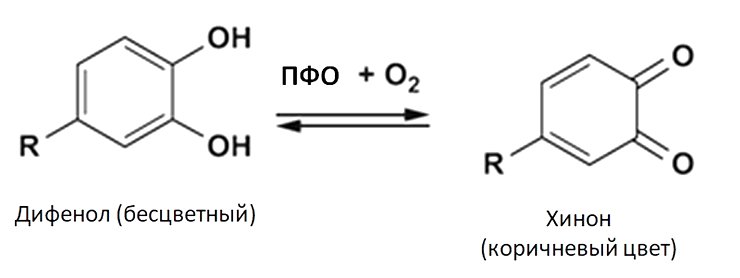
Рисунок 31. Реакция, катализируемая ПФО
[11], с дополнениями автора статьи
ПФО имеется у многих растений, хотя ее физиологическая роль остается не до конца понятной. Она принимает участие в образовании некоторых вторичных метаболитов, снижении уровня АФК и защитных механизмах растений от патогенов.
Современная физиология растений лишь приоткрывает занавесу тайны игры молекул внутри разноцветных осенних листьев. Красота их, не раз вдохновившая поэтов, еще хранит много загадок, молекулярные механизмы и смыслы которых пока не раскрыты учеными. Но известное науке сейчас говорит о том, что самые привычные процессы могут быть весьма замысловаты и еще более красивы.
Литература
- Andrêssa Silva Fernandes, Tatiele Casagrande do Nascimento, Eduardo Jacob-Lopes, Veridiana Vera De Rosso, Leila Queiroz Zepka. (2018). Introductory Chapter: Carotenoids - A Brief Overview on Its Structure, Biosynthesis, Synthesis, and Applications. Progress in Carotenoid Research;
- D.S. Goodsell. (2001). Photosystem I. RCSB PDB;
- L. Andrew Staehelin. (2003). . Photosynthesis Research. 76, 185-196;
- Anne Cortleven, Thomas Schmülling. (2015). Regulation of chloroplast development and function by cytokinin. EXBOTJ. 66, 4999-5013;
- Paul J. Zwack, Aaron M. Rashotte. (2013). Cytokinin inhibition of leaf senescence. Plant Signaling & Behavior. 8, e24737;
- Daniela Liebsch, Olivier Keech. (2016). Dark-induced leaf senescence: new insights into a complex light-dependent regulatory pathway. New Phytol. 212, 563-570;
- Camilla Knudsen, Nethaji Janeshawari Gallage, Cecilie Cetti Hansen, Birger Lindberg Møller, Tomas Laursen. (2018). Dynamic metabolic solutions to the sessile life style of plants. Nat. Prod. Rep.. 35, 1140-1155;
- Gayatri Goswami, Ujjal Kumar Nath, Jong-In Park, Mohammad Rashed Hossain, Manosh Kumar Biswas, et. al.. (2018). Transcriptional regulation of anthocyanin biosynthesis in a high-anthocyanin resynthesized Brassica napus cultivar. J of Biol Res-Thessaloniki. 25;
- Ying Liu, Yury Tikunov, Rob E. Schouten, Leo F. M. Marcelis, Richard G. F. Visser, Arnaud Bovy. (2018). Anthocyanin Biosynthesis and Degradation Mechanisms in Solanaceous Vegetables: A Review. Front. Chem.. 6;
- M. Landi, M. Tattini, Kevin S. Gould. (2015). Multiple functional roles of anthocyanins in plant-environment interactions. Environmental and Experimental Botany. 119, 4-17;
- Aravind Jukanti Polyphenol Oxidases (PPOs) in Plants — Springer Singapore, 2017;
- Erik Edlund, Ondrej Novak, Michal Karady, Karin Ljung, Stefan Jansson. (2017). Contrasting patterns of cytokinins between years in senescing aspen leaves. Plant, Cell & Environment. 40, 622-634;
- Muhammad Asad, Shamsu Zakari, Qian Zhao, Lujian Zhou, Yu Ye, Fangmin Cheng. (2019). Abiotic Stresses Intervene with ABA Signaling to Induce Destructive Metabolic Pathways Leading to Death: Premature Leaf Senescence in Plants. IJMS. 20, 256;
- Tomotsugu Koyama. (2018). A hidden link between leaf development and senescence. Plant Science. 276, 105-110;
- Page W. Morgan, James I. Durham. (1973). Leaf Age and Ethylene-induced Abscission. Plant Physiol.. 52, 667-670.











