
Молекулярные машины — новые герои антибиотикотерапии
23 июня 2022
Молекулярные машины — новые герои антибиотикотерапии
- 1083
- 2
- 5
Антибиотики, к которым у бактерий развилась резистентность, нуждаются в помощи. Молекулярная машина «просверливает» дыру в клеточной мембране патогена, облегчая попадание лекарства вовнутрь.
рисунок автора
-
Автор
-
Редакторы
Резистентность бактерий — глобальная проблема, которая становится причиной смерти людей по всему миру и ежегодно уносит жизни порядка 700 000 человек. Более того, есть опасения, что к 2050 году около 10 млн человек будут ежегодно подвергаться риску умереть от микробной инфекции [1]. Проблема обостряется тем, что многие разрабатываемые препараты, хоть и относятся к новым классам лекарственных средств, проблему резистентности не решают. Подробнее о нависшей угрозе можно прочитать в спецпроекте «Биомолекулы»: «Антибиотики и антибиотикорезистентность».
Задача — найти средство, способное нейтрализовать защиту бактерий, чтобы вернуть антибиотикам былую славу. Возможно, решение найдено.
Неутомимые двигатели жизни
Молекулярными машинами (ММ) называют структуры, которые могут манипулировать объектами на молекулярном уровне: передвигать, состыковывать, собирать, разбирать. При этом молекулярным машинам нужен стимул или топливо — химическое, фото- или электрохимическое.
Как правило, молекулярные машины подразделяют на биологические и искусственно синтезированные. К первым, например, относится кинезин (перемещает груз от ядра по микротрубочкам; рис. 1), АТФ-синтаза (за счет энергии протонных градиентов, подобно турбине, синтезирует АТФ), ДНК-полимераза (участвует в репликации ДНК) и многие другие.

Рисунок 1. Классическая молекулярная машина. Белок кинезин транспортирует груз, «шагая» по микротрубочке.
К бою готов
Молекулярная нанотехнология позволила создать искусственные молекулярные машины — модифицированные молекулы. Аналог со сборкой автомобиля здесь неуместен: молекулярные машины названы так потому, что способны двигаться, а не потому что человек может сконструировать молекулярного киборга и отправить его на борьбу с патогеном. В перспективе они станут мощнейшим инструментом наномедицины — например, для обнаружения и уничтожения раковых клеток [4], [5]. В борьбе с микробными патогенами ММ имеют весомое преимущество — бактерии не готовы к встрече с ними. Человек способен контролировать пространственное расположение и активность молекулярной машины, что позволяет смягчить негативный эффект на клетки хозяина (то есть человека).
Ученые из Университета Райса исследовали, могут ли молекулярные машины помочь антибиотикам [6]? Созданные ими ММ способны проникать внутрь клетки, подчиняясь управлению извне. Чтобы они заработали, необходим стимул — свет: его удобно регулировать, он не инвазивен и не оказывает побочных эффектов (в отличие от химических стимулов).
При разработке исследователи опирались на работу коллег, опубликованную в Nature в 2017 году [7]. Именно в ней ученые показали, что молекулярные машины при нанесении на липидный бислой и последующей активации светом, способны «сверлить» отверстия. Составные части ММ назвали ротором и статором, проводя аналогию с частями электродвигателя, хотя обе части в молекуле остаются подвижными. Роторная часть получила такое название из-за добавления функциональных групп, которые позволяют управлять ММ и направлять ее.
Активация светом стала возможна благодаря добавлению амино- или алкокси-группы, которые стали электронодонорными заместителями в сопряженном ядре ММ и повысили электронную плотность. Одна из двух частей машины (статорная или роторная) была дополнительно модифицирована аминами для лучшего связывания с отрицательно заряженной мембраной бактерий (химическая структура ММ представлена на рис. 2). Кстати, принцип использования положительно заряженных молекул в борьбе с микробными патогенами далеко не нов: он используется как в антибиотикотерапии, так и в разработке антимикробных пептидов [8].

Рисунок 2. Химическая структура шести ММ, усиливающих эффект антибиотиков.
Добавленные функциональные группы выделены красным и синим цветом.
MW — молекулярная масса.
Роторная часть ММ после облучения начинает однонаправленно вращаться с частотой около 0,003 ГГц. Такая скорость вращения позволяет разрушать клеточную стенку и мембрану, а не просто проникать сквозь нее (рис. 3). Механическое нарушение целостности клеточной стенки и мембраны, приводящее к потере мембранного потенциала, инициирует действие антибиотиков, которые больше не сталкиваются с защитой бактерий, проникают внутрь и успешно оказывают клинический эффект. (Впрочем, это наиболее актуально для антибиотиков, разрушающих рибосомальные субчастицы, а не клеточную стенку.) В перспективе подобные ММ можно использовать для доставки и других лекарств в клетку.
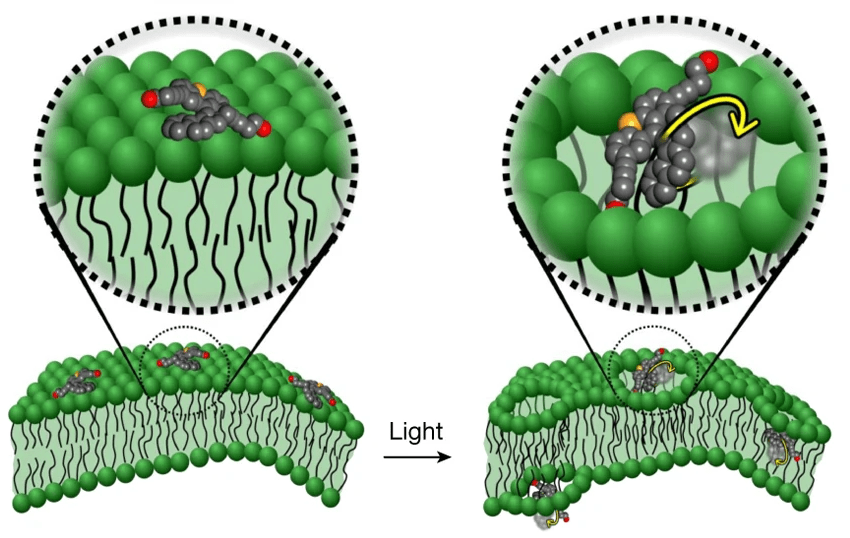
Рисунок 3. Молекулярная машина после активации светом проникает сквозь билипидный слой.
В борьбе с резистентностью бактерий
Ученые из Университета Райса, после первой серии экспериментов на Escherichia coli, обнаружили, что незначительная разница в скорости вращения ММ не сказывалась на антибактериальном эффекте. При помощи моделирования молекулярной динамики выявлены различия в отношениях углов оси ММ и мембраны бактерии у разных машин. Так, ось ММ1 почти параллельна мембране (угол составляет около 15°), а для оси ММ2 угол около 60°. Угол вхождения в мембрану, который различался у разных ММ, оказывал влияние на степень деформации мембраны бактерии и итоговый антибактериальный эффект. Деформацию мембраны изучали при помощи обработки клеток флуоресцентным красителем — йодистым пропидием, и последующим измерением уровня флуоресценции.
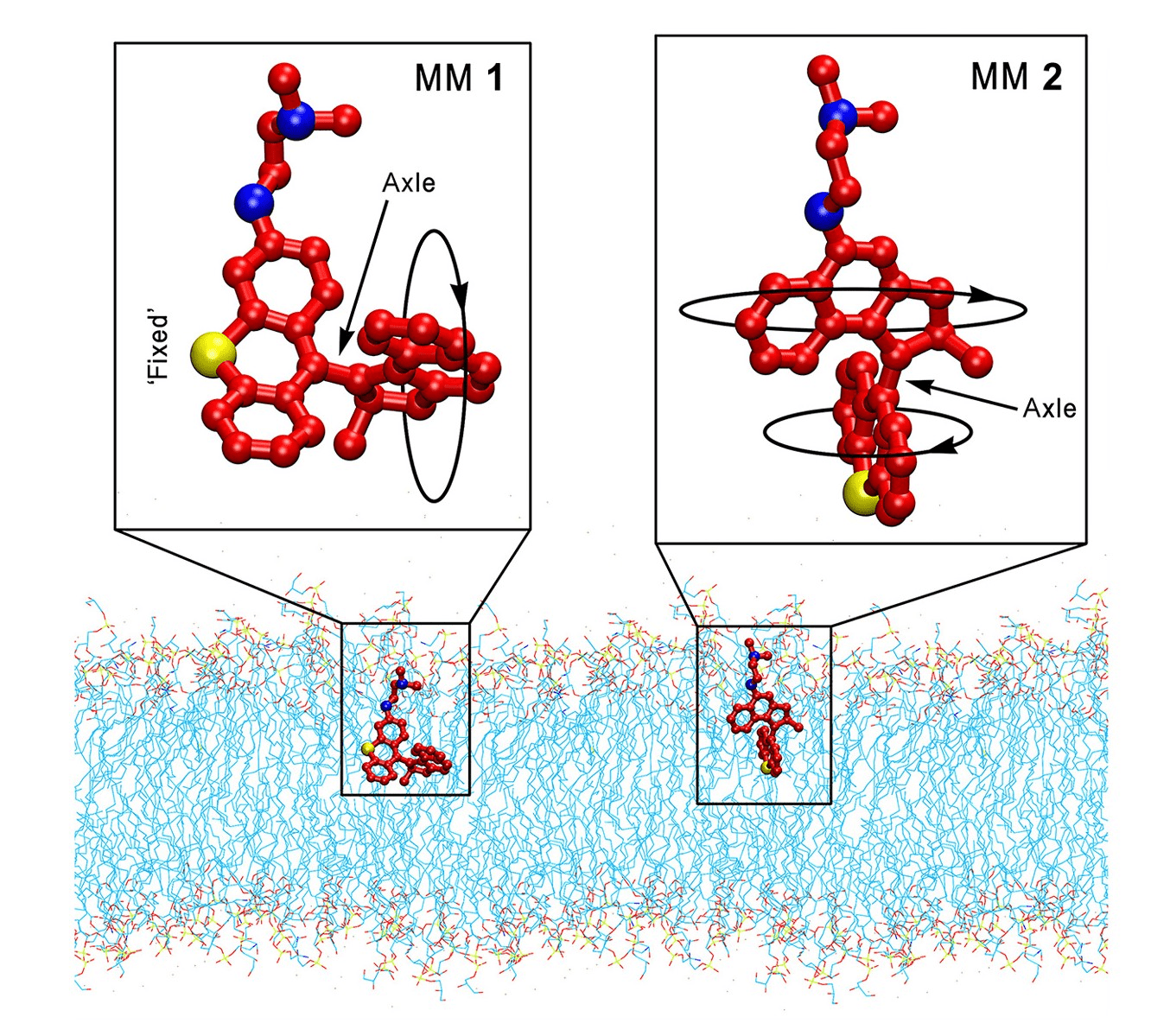
Рисунок 4. Схематичное изображение расположения разных ММ во время движения в мембране.
Угол вхождения зависит от функциональных групп молекулы — так говорят данные молекулярной динамики.
Шесть самых эффективно действующих ММ задействовали в экспериментах на других грамположительных и грамотрицательных бактериях, в том числе золотистом стафилококке (Staphylococcus aureus). Рекордсменом в скорости его уничтожения стала ММ4 — снижение количества клеток в биопленке до нижнего предела обнаружения при помощи АТФ-метрии составило всего две минуты от момента активации. При добавлении к биопленкам с синегнойной палочкой (Pseudomonas aeruginosa) и S. aureus таких антибиотиков как рифампин и тобрамицин количество бактериальных клеток снижалось до 43 и 64%, соответственно. При этом, одновременное с антибиотиками добавление ММ снижало общее количество клеток до 78%. Антибиотики и молекулярные машины сообща действовали эффективнее, нежели по отдельности. Дальнейший анализ подтвердил, что повышение уровня воздействия антибиотиков на бактерий достигнуто благодаря возникновению пор в клеточных стенках, что облегчало лекарственному средству доступ вовнутрь.
Отмечено, что повторное использование ММ не приводило к развитию резистентности к ним. После 20 циклов развилась резистентность к антибиотикам, но устойчивость к молекулярным машинам так и не возникла, в связи с особенностями механизма действия — ММ не ингибируют белки, а напрямую повреждают мембрану. Впрочем, это утверждение стоит проверить на большем количестве циклов и разнообразии патогенов.
При воздействии молекулярных машин наблюдались существенные изменения в морфологии клеток: внутренняя мембрана отделялась от клеточной стенки, в слое пептидогликана возникали бреши, в результате мембранного и периплазматического стресса на наружной мембране образовывались везикулы. На рисунке 5 представлены клетки, целостность которых нарушена при помощи ММ.

Рисунок 5. Изображение клеток E. coli, полученные при помощи просвечивающей электронной микроскопии.
Крайняя слева клетка (контроль) обработана 1%-раствором диметилсульфоксида, который повышает проницаемость клеточной стенки бактерий в присутствии антибиотиков.
На следующих трех снимках представлены клетки после воздействия трех разных ММ в минимальной ингибирующей концентрации.
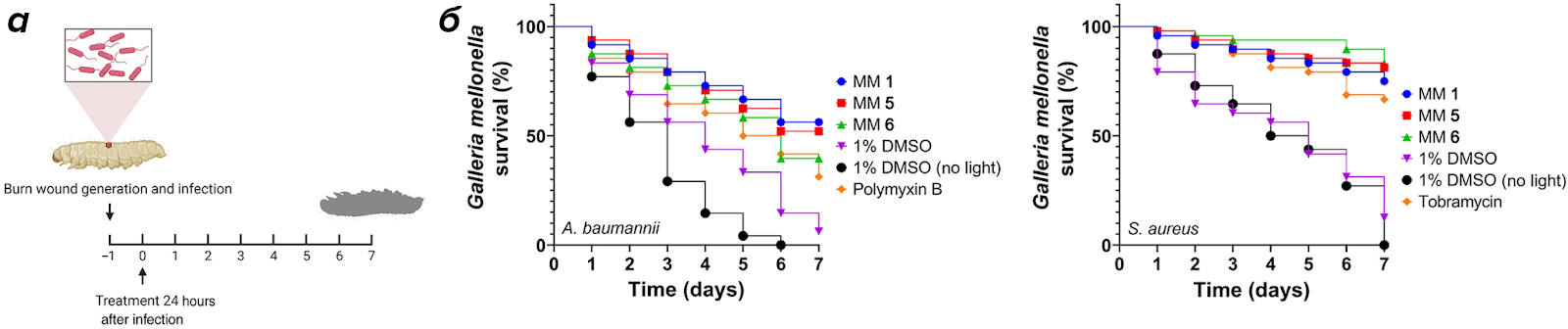
Рисунок 6. ММ снижает смертность зараженных бактериями личинок большой восковой моли.
У одной группы личинок Galleria mellonella ожоговую рану инфицировали грамположительным S. aureus, а у другой группы грамотрицательным — A. baumannii. Раны обрабатывали смесью антибиотиков без и с добавлением разных ММ. Выживаемость отслеживали в течение 7 дней.
На графиках отмечена выживаемость разных групп личинок в течении недели: тех, чьи раны были обработаны только антибиотиком, 1% раствором DMSO или раствором с ММ.
Добавление молекулярных машин оказало самый сильный эффект.
Исследователи обратили внимание, что ММ уничтожали также и клетки-персистеры — бактериальные популяции, которые находятся в состоянии покоя . Обычно из-за «сна» такие фракции крайне устойчивы к антибиотикам, но не в случае использования ММ! Неожиданно молекулярные машины могут справиться и с этой затаенной угрозой.
Эта способность великолепна для бактерий, однако может стать роковой для людей — подробнее читайте в статье «Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью».
Заключение
Молекулярные машины механически нарушают целостность клеточной стенки, тем самым способствуя гибели бактерии. Появление пор в клеточной стенке позволяет антибиотику преодолеть резистентность бактерий и проникнуть внутрь. Исследователям предстоит продолжить эксперименты, задействуя модельные организмы, чтобы подойти к подтверждению терапевтического эффекта на людях. Но есть надежда, что молекулярные машины, свободные от угрозы резистентности, станут ключевыми героями в борьбе с бактериальной угрозой.
Литература
- O’Neill J. (2016). Tackling drug-resistant infections globally: final report and recommendations. Review on antimicrobial resistance;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Kinesin Motor Protein With Vesicle. (2022). Xvivo;
- Маленькое будущее;
- «Врачи-нанороботы» — миф или реальность?;
- Ana L. Santos, Dongdong Liu, Anna K. Reed, Aaron M. Wyderka, Alexis van Venrooy, et. al.. (2022). Light-activated molecular machines are fast-acting broad-spectrum antibacterials that target the membrane. Sci. Adv.. 8;
- Víctor García-López, Fang Chen, Lizanne G. Nilewski, Guillaume Duret, Amir Aliyan, et. al.. (2017). Molecular machines open cell membranes. Nature. 548, 567-572;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью.






