
Молекулярные маркеры самоубийства
30 января 2015
Молекулярные маркеры самоубийства
- 6169
- 0
- 14
Каков он, маркер суицида?
Рисунок в полном размере.
-
Автор
-
Редактор
Патологический процесс в организме вызывает серьезные перестройки метаболизма. Уровень одних веществ в клетках и биологических жидкостях падает, других — повышается. Четкую корреляцию изменений уровня некоторых веществ с конкретными патологическими процессами можно использовать в диагностике заболеваний. Такие «диагностические» вещества, называемые маркерами, известны для аутоиммунных заболеваний, инфекций, рака, инфаркта и т.д. А есть ли маркеры таких «неуловимых», вроде бы не связанных с физиологией, состояний, как депрессия и склонность к суициду?
Анализ на самоубийство
Проблема суицида актуальна для многих стран, включая самые развитые. По данным ВОЗ ежегодно в мире более 800 тысяч человек лишает себя жизни. Жертвами суицидов в большинстве случаев становятся молодые люди до 30 лет, а их смерть приводит к тяжелым экономическим и социальным последствиям как на уровне отдельной семьи, так и целого государства. Важным результатом исследований в области суицидологии стало то, что самоубийства можно предотвращать, используя программы психологической поддержки. Серьезную роль играет также своевременность диагностики и лечения психических расстройств, приводящих к суициду, — депрессии и шизофрении [1].
Для определения риска самоубийства чаще всего используется структурированный опрос для выявления суицидальных мыслей. Иногда это не работает, поэтому необходимо простое исследование, которое будет объективно указывать на риск суицида. Проведение скрининга на самоубийство у всего населения — слишком затратная процедура с низкой эффективностью. Эффективность диагностики возрастет, если сосредоточиться на пациентах из группы риска — например, больных депрессией, попавших под наблюдение врачей. Для предотвращения самоубийств у таких пациентов необходимо найти биомаркер, доступный для забора и анализа. Биопсию мозга и функциональную МРТ всем и каждому проводят только в медицинских сериалах, нужен же более «земной» способ диагностики. На эту роль подходит анализ крови или мочи: в этих жидкостях содержится большое количество веществ, характеризующих метаболизм в разных органах и тканях. Если по анализу крови можно диагностировать инфекцию или инфаркт, то что может помешать определить склонность к суициду тем же способом?
На первый взгляд, идея ставить диагноз психического расстройства по анализу крови кажется странной. Причина этого в том, что мы не привыкли видеть биологический субстрат при психических заболеваниях: душевные переживания, по глубокому убеждению многих людей, совершенно не связаны с какими-то реальными процессами в организме человека. На самом деле, принципиальных ограничений в биологических методах диагностики психических расстройств нет, но нужны достоверные корреляции между концентрацией вещества и риском суицида.
При депрессии снижается уровень моноаминов (серотонина и норадреналина) в центральной нервной системе: нейромедиаторы перестают в достаточном количестве поступать в синаптическую щель. Это приводит к тревоге, страху и бессоннице (в случае дефицита серотонина) или снижению концентрации внимания и вялости (при недостатке норадреналина). Антидепрессанты увеличивают концентрацию нейромедиаторов двумя путями [2]. Например, ингибиторы моноаминоксидазы (моклобемид) уменьшают разрушение моноаминов. В свою очередь, известный препарат флуоксетин (в миру «Прозак») подавляет обратный захват серотонина из синаптического пространства. Чтобы узнать состояние моноаминовых систем в мозге у живого человека, можно использовать позитронно-эмиссионную томографию (ПЭТ). Но ПЭТ — слишком дорогой метод для этой цели, имеющий ряд технических сложностей и ограничений из-за радиоактивности. Если мы хотим узнать что-то о работе нейромедиаторов и при этом не потратить миллионы рублей, то придется искать способ попроще.
Тромбоциты и мозг
Данные об особенностях метаболизма самоубийц стали накапливаться с конца
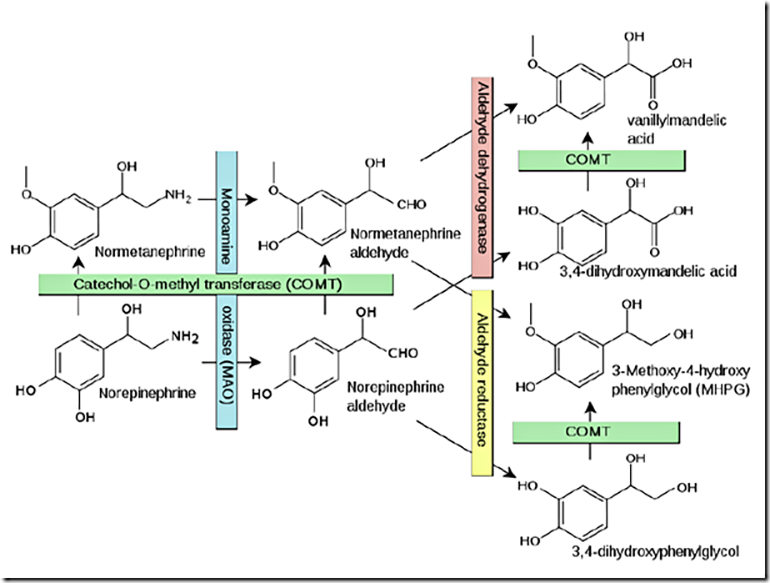
Рисунок 1. Схема метаболизма норадреналина.
Затем исследователи обратили внимание на серотонин
Параллельно с изучением метаболизма серотонина ученые исследовали рецепторы к этому нейромедиатору, встречающиеся не только в центральной нервной системе, но и в желудочно-кишечном тракте, стенках кровеносных сосудов и других стуктурах. Существует 15 видов 5-HT-рецепторов, составляющих 7 семейств [8], но в тромбоцитах представлены только 5-HT2А (рис. 2). Количество рецепторов можно определить методом радиолигандного анализа. Особым веществом с радиоактивной меткой обрабатывают клетки, где предполагается наличие интересующих рецепторов. Меченое вещество «залипает» на них, а его излишек удаляется. Затем измеряется радиоактивное излучение от закрепившихся на рецепторах молекул. Чем выше его интенсивность, тем больше вещества с меткой осталось на клетках, а значит, и больше рецепторов, которые мы ищем.
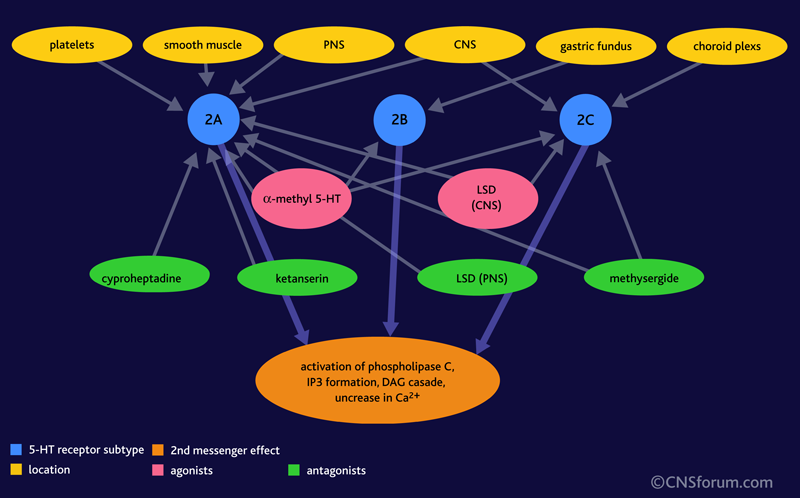
Рисунок 2. Распределение подтипов серотониновых рецепторов по тканям. 5-HT2А-рецепторы представлены в тромбоцитах, гладкой мускулатуре, центральной и периферической нервной системе.
Было выяснено, что экспрессия 5-HT2А-рецепторов в мозге и тромбоцитах схожа, по метаболическим показателям они тоже совпадали [9]. По этой причине исследование рецепторов на периферии, в клетках крови, могло дать достоверную информацию о количестве рецепторов в ЦНС. Оказалось, что в среднем у самоубийц количество тромбоцитарных 5-HT2А-рецепторов выше, чем у тех, кто не совершал суицид, причем независимо от заболевания, которое привело к этому поступку [10]. Позже обнаружили связь между суицидальным поведением и высоким уровнем экспрессии 5-HT2А-рецепторов в префронтальной коре и гиппокампе [11].
Количество 5-HT2А-рецепторов на тромбоцитах стало одним из первых реальных биологических маркеров риска самоубийства. Связь между клетками крови, лишенными ядра, и сложными по строению и функции нейронами удивляет... и напоминает о высочайшей степени интеграции всех процессов в нашем организме.
Проблемы с пластичностью
Более специфичным веществом, которое может определяться в «анализе на самоубийство», является белок по имени «нейротрофический фактор мозга» (Brain-Derived Neurotrophic Factor, BDNF). BDNF — вещество, регулирующее структурную и синаптическую пластичность: регенерацию нерва, структурную интеграцию нейронов и синтез нейромедиаторов.
Как говорилось выше, часто самоубийства совершают люди, страдающие депрессией. При депрессии снижается уровень BDNF и падает нейропластичность, теряются полноценные связи между фронтальной корой, которая регулирует социальное поведение человека, и другими отделами. То есть мозг теряет способность полноценно реагировать на сигналы, поступающие извне. При использовании антидепрессантов уровень BDNF повышается, и функционирование головного мозга возвращается к более или менее нормальному режиму. В ходе исследований ткани мозга людей, совершивших суицид, было обнаружено, что концентрация BDNF снижена в префронтальной коре и гиппокампе (рис. 3) [12]. Это те самые отделы мозга, в которых у самоубийц обнаруживается повышенное количество 5-HT2А-рецепторов. Снижение уровня BDNF в мозге приводило к уменьшению его концентрации и в крови [13].
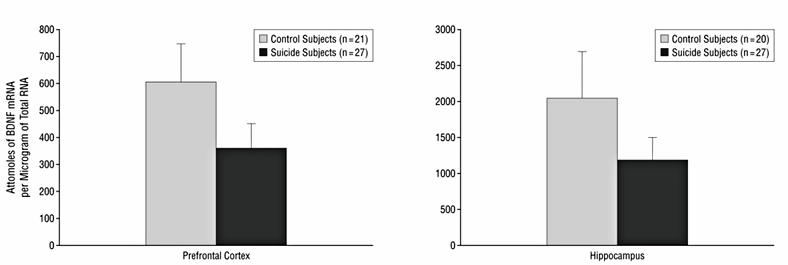
Рисунок 3. Содержание BDNF в префронтальной коре и гиппокампе самоубийц. В образцах мозговой ткани самоубийц (черные столбцы) уровень BDNF заметно ниже.
Исследование 2013 года, опубликованное в Journal of Affective Disorders [14], выявило еще один потенциальный маркер для определения суицидального риска. Авторы работы учли клинические и демографические особенности более 100 пациентов с депрессией. Все участники исследования тестировались на протяжении 12 недель с целью выявления суицидальных тенденций. Кроме этого, у каждого пациента определялся уровень метилирования промоторной области гена BDNF. (Метилирование обычно блокирует экспрессию гена). Оказалось, что у пациентов, совершавших попытки самоубийства и выражавших суицидальные идеи в ходе лечения, уровень метилирования был повышен.
Самоубийственный стресс
До этого момента речь шла о специфических молекулярных изменениях, связанных с функционированием мозга. В случае суицидального поведения показатели активности серотониновой системы и синтез BDNF демонстрируют изменения в деятельности гиппокампа и префронтальных отделов коры. Возможно, нарушения в биохимическом статусе отражают распад функциональной связи между этими частями мозга. Гиппокамп формирует негативное переживание; оно служит фоном для депрессии и поддерживает ее. Эмоциональная проблема требует решения, а префронтальная кора, в чьи функции входит прогнозирование и планирование, не может найти его. То, что для мозга проявляется в виде нарушенных связей, человеком ощущается как невозможность найти выход из сложной жизненной ситуации. Именно эта безысходность и в нейробиологическом, и в психологическом смысле, приводит людей к самоубийству. Аргументом в пользу данного утверждения является то, что дисфункция префронтальной коры, выражающаяся в нарушенном планировании действий и сниженном их контроле, была обнаружена у больных шизофренией с высоким суицидальным риском [15].
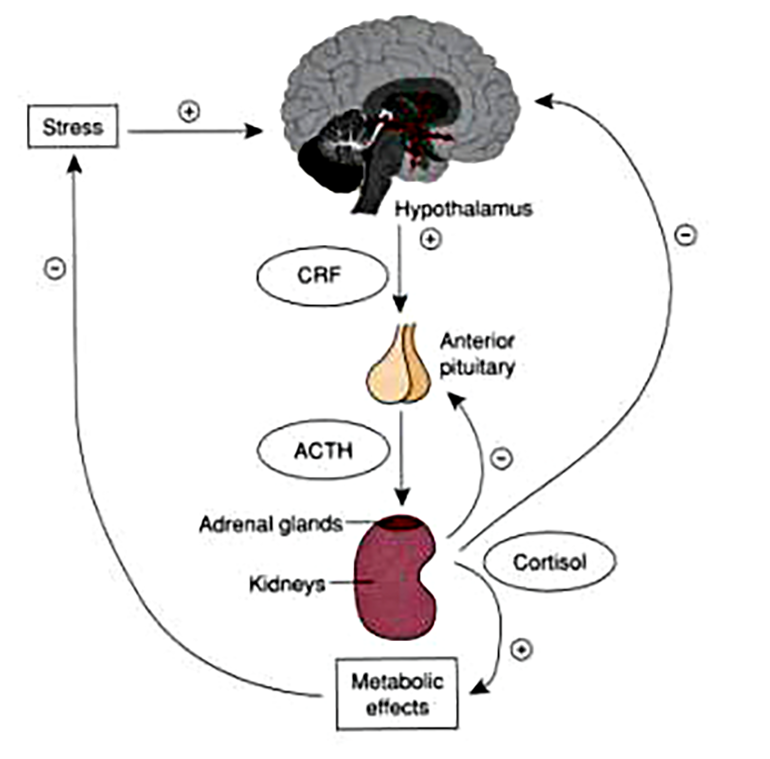
Рисунок 4. Гипоталамо-гипофизарно-надпочечниковая ось. Cверху вниз: стресс вызывает выделение гипоталамусом кортиколиберина (CRF); происходит подъем содержания адренокортикотропного гормона (ACTH); ACTH заставляет надпочечники производить кортизол. Восходящие красные стрелки: отрицательная обратная связь — повышение концентрации кортизола в крови тормозит выделение CRF и ACTH.
Кроме узких, «мозговых», биомаркеров при оценке суицидального риска можно определять показатели, которые свидетельствуют о всеобщей мобилизационной реакции организма — стрессе. Во второй половине XX века ученые обратили внимание на активацию гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) при психических расстройствах. Органы, входящие в ГГНС, тесно связаны между собой. Гипоталамус выделяет пептидный гормон кортиколиберин, что приводит к увеличению секреции адренокортикотропного гормона (АКТГ). Рост количества АКТГ повышает секрецию кортизола — гормона стресса. Кроме описанных прямых связей в этой системе существуют и обратные, своеобразная тормозная система стресса — повышение концентрации одного гормона снижает секрецию предшествующего (рис. 4).
На вскрытиях у жертв суицида обнаруживалось увеличение коры надпочечников [16], а в спинномозговой жидкости определялась повышенная концентрация кортиколиберина [17]. Похоже, что этот гормон напрямую связан с тревожными расстройствами, поэтому сейчас тестируются лекарственные средства, модулирующие активность рецепторов к кортиколиберину.
Также для оценки суицидального риска применялся дексаметазоновый тест. Пациент принимал на ночь 1 мг глюкокортикоида дексаметазона, а затем в течение нескольких часов у человека определяли уровень собственного кортизола. При приеме дексаметазона запускаются механизмы обратной связи: из-за повышения концентрации глюкокортикоидов снижается уровень секреции кортиколиберина и АКТГ. В результате должна упасть концентрация и кортизола. В этой ситуации организм не очень разборчив — кортизол и дексаметазон для него «на одно лицо». В эксперименте проба считалась отрицательной, если концентрация кортизола снижалась, в обратном случае делали вывод о повышенной активности ГГНС. У пациентов с повышенным суицидальным риском дексаметазоновый тест чаще всего оказывался положительным [18]. Это говорит о том, что при депрессии ГГНС активирована и организм находится в стрессовом состоянии. К сожалению, метод обладает низкой диагностической ценностью. Врачам требовалось что-то более специфичное, и они обратились к генам.
Ученые предположили, что длительная активация ГГНС у самоубийц может быть связана с нечувствительностью рецепторов к глюкокортикоидам, подобно тому, как инсулинорезистентность тканей организма приводит к сахарному диабету второго типа. Усилия были сосредоточены на изучении белка FKBP5 (рис. 5), который входит в структуру глюкокортикоидного рецептора [19]. Оказалось, что сочетание одного из вариантов строения FKBP5 с психической травмой в детстве значительно повышало вероятность самоубийства в будущем. К сожалению, эта информация мало приблизила ученых к биомаркеру суицида. Биомаркер должен быть простым, а в данном случае приходилось учитывать прошлое человека, которое могло быть искажено им самим в беседе с врачом.
Рисунок 5. Строение FKBP5.
С глюкокортикоидными рецепторами связан и специфический белок SKA2 (spindle and kinetochore associated complex subunit 2). Он задействован в модулировании активности этих рецепторов внутри клетки, и его недостаток приводит к пролонгированной и чрезмерной реакции мозга на стресс. Для исследования связи определенного варианта SKA2 с суицидом ученые из университета Джонса Хопкинса провели генотипирование образцов мозговой ткани уже умерших людей, а также изучили ДНК участников нескольких проектов по психическому здоровью [20]. У лиц, покончивших с собой, определялся высокий уровень метилирования гена белка SKA2 и понижение его экспрессии в головном мозге. Для работы использовались замороженные, не подвергшиеся трупному распаду образцы. У живых участников исследования было обнаружено, что низкий уровень SKA2 достоверно связан с повышенным уровнем кортизола и с переходом от суицидальных мыслей к активным действиям. Результаты исследований во всех группах представлены на рис. 6.
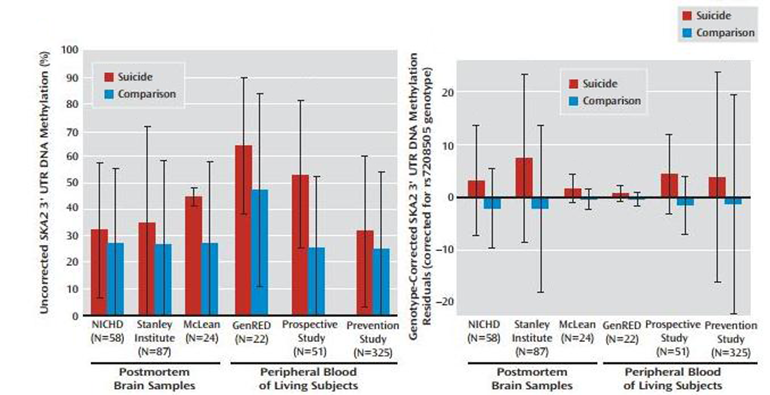
Рисунок 6. Уровень метилирования гена белка SKA2 в постмортальных образцах мозга и периферической крови живых людей. В случаях суицидального поведения (красные столбцы) уровень метилирования ДНК серьезно повышен.
У белка SKA2 есть функциональная связь с белком SAT1 (spermidine/spermine N1-acetyltransferase 1). Последний вовлечен в регуляцию внутриклеточной концентрации полиаминов и их транспорта во внеклеточную среду. Высокий уровень SAT1 был связан с попыткой самоубийства в прошлом и с будущими суицидальными действиями у пациентов с диагностированным биполярным аффективным расстройством [21]. Прогностическая ценность SAT1 была подтверждена выявлением повышенной концентрации этого белка в крови людей, совершивших самоубийство, но не страдавщих психическими расстройствами.
Заключение
Общая картина зарождения суицидальных тенденций выглядит так. При развитии негативной стрессовой ситуации в мозге начинают происходить определенные функциональные перестройки; вероятно, они осуществляются под действием кортизола. При ряде генетических вариантов не формируется система нейронных связей для реагирования на эту ситуацию. В частности, это проявляется в функциональном разобщении префронтальной коры и гиппокампа, что может приводить к потере контроля над импульсивными действиями. Данная особенность считается характерной для поведения самоубийц [22]. У перечисленных процессов есть свои признаки, которые с некоторой натяжкой можно расценивать как маркеры склонности к суициду:
- повышенное количество серотониновых рецепторов;
- высокий уровень белка SAT1;
- низкий уровень BDNF и SKA2 (повышенное метилирование их генов).
Проблема в том, что нельзя однозначно привязать риск самоубийства к какому-то гену или белку — их нужно оценивать в комплексе, да еще и с учетом жизненных коллизий каждого человека.
Литература
- Предотвращение самоубийств. Глобальный императив. (2014). Женева: ВОЗ. 102;
- Краткая история антидепрессантов;
- STEVEN K. SECUNDA, CHRISTINE K. CROSS, STEPHEN KOSLOW, MARTIN M. KATZ, JAMES H. KOCSIS, JAMES W. MAAS. (1986). Relationship to Suicidal Behavior. Annals of the New York Academy of Sciences. 487, 231-241;
- Gerald L. Brown, Frederick K. Goodwin, James C. Ballenger, Peter F. Goyer, Leslie F. Major. (1979). Aggression in humans correlates with cerebrospinal fluid amine metabolites. Psychiatry Research. 1, 131-139;
- Almeida-Montes L.G., Valles-Sanchez V., Moreno-Aguilar J., Chavez-Balderas R.A., Garcia-Marin J.A., Cortes Sotres J.F., Hheinze-Martin G. (2000). Relation of serum cholesterol, lipid, serotonin and tryptophan levels to severity of depression and to suicide attempts. J. Psychiatry Neurosci. 25,
371–377; ; - Micha Ragolsky, Hady Shimon, Hadar Shalev, Abraham Weizman, Eitan Rubin. (2013). Suicidal Thoughts Are Associated with Platelet Counts in Adolescent Inpatients. Journal of Child and Adolescent Psychopharmacology. 23, 49-53;
- Owens M.J., Nemeroff C.B. (1994). Role of serotonin in the pathophysiology of depression: Focus on the serotonin transporter. Clin. Chem. 40, 288–295;
- Рецептор медиатора настроения;
- Scott D Mendelson. (2000). The current status of the platelet 5-HT2A receptor in depression. Journal of Affective Disorders. 57, 13-24;
- . (1995). Platelet serotonin-2A receptors: a potential biological marker for suicidal behavior. AJP. 152, 850-855;
- Ghanshyam N. Pandey, Yogesh Dwivedi, Hooriyah S. Rizavi, Xinguo Ren, Subhash C. Pandey, et. al.. (2002). Higher Expression of Serotonin 5-HT2A Receptors in the Postmortem Brains of Teenage Suicide Victims. AJP. 159, 419-429;
- Yogesh Dwivedi, Hooriyah S. Rizavi, Robert R. Conley, Rosalinda C. Roberts, Carol A. Tamminga, Ghanshyam N. Pandey. (2003). Altered Gene Expression of Brain-Derived Neurotrophic Factor and Receptor Tyrosine Kinase B in Postmortem Brain of Suicide Subjects. Arch Gen Psychiatry. 60, 804;
- Félicien Karege, Michèle Schwald, Mbaye Cisse. (2002). Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets. Neuroscience Letters. 328, 261-264;
- Hee-Ju Kang, Jae-Min Kim, Ju-Yeon Lee, Seon-Young Kim, Kyung-Yeol Bae, et. al.. (2013). BDNF promoter methylation and suicidal behavior in depressive patients. Journal of Affective Disorders. 151, 679-685;
- Michael J. Minzenberg, Tyler A. Lesh, Tara A. Niendam, Jong H. Yoon, Remy N. Rhoades, Cameron S. Carter. (2014). Frontal cortex control dysfunction related to long-term suicide risk in recent-onset schizophrenia. Schizophrenia Research. 157, 19-25;
- H. S. Willenberg, S. R. Bornstein, T. Dumser, M. Ehrhart-bornstein, A. Barocka, et. al.. (1998). Morphological changes in adrenals from victims of suicide in relation to altered apoptosis. Endocrine Research. 24, 963-967;
- Mihály Arató, Csaba M. Bánki, Garth Bissette, Charles B. Nemeroff. (1989). Elevated CSF CRF in suicide victims. Biological Psychiatry. 25, 355-359;
- Jussi Jokinen, Andreas Carlborg, Björn Mårtensson, Kaj Forslund, Anna-Lena Nordström, Peter Nordström. (2007). DST non-suppression predicts suicide after attempted suicide. Psychiatry Research. 150, 297-303;
- Elisabeth B. Binder. (2008). Association of <emph type="ital">FKBP5</emph> Polymorphisms and Childhood Abuse With Risk of Posttraumatic Stress Disorder Symptoms in Adults. JAMA. 299, 1291;
- Jerry Guintivano, Tori Brown, Alison Newcomer, Marcus Jones, Olivia Cox, et. al.. (2014). Identification and Replication of a Combined Epigenetic and Genetic Biomarker Predicting Suicide and Suicidal Behaviors. AJP. 171, 1287-1296;
- H Le-Niculescu, D F Levey, M Ayalew, L Palmer, L M Gavrin, et. al.. (2013). Discovery and validation of blood biomarkers for suicidality. Mol Psychiatry. 18, 1249-1264;
- Matthew K. Nock, Irving Hwang, Nancy Sampson, Ronald C. Kessler, Matthias Angermeyer, et. al.. (2009). Cross-National Analysis of the Associations among Mental Disorders and Suicidal Behavior: Findings from the WHO World Mental Health Surveys. PLoS Med. 6, e1000123.






