
Молекулярное двурушничество: гены человека работают на вирус гриппа
16 февраля 2010
Молекулярное двурушничество: гены человека работают на вирус гриппа
- 2179
- 0
- 3
Крайне простое устройство вирусной частицы — по сравнению с клеткой инфицируемого организма — с лихвой компенсируется умением вируса эксплуатировать клеточные механизмы в своих целях. При этом многие «хозяйские» белки невольно оказываются пособниками распространения вирусной инфекции. На картинке: вирус свиного гриппа и флуоресцентно окрашенные клетки.
-
Автор
-
Редакторы
Геном вируса гриппа A (в том числе, свиного происхождения) кодирует не более 11 белков, вследствие чего вирус активно использует клеточные механизмы заражённого организма в своих целях. В результате полногеномного сканирования с помощью РНК-интерференции установлен список из почти 300 человеческих генов, которые нужны вирусу для ранних стадий жизненного цикла. Среди белков-«предателей» — вакуолярная АТФаза, коатомеры комплекса Гольджи, рецептор фактора роста фибробластов, кальмодулин-зависимая протеинкиназа и многие другие. Эта информация будет использована для создания новых поколений антивирусных препаратов — ингибиторов определённых человеческих белков.
Вирусы гриппа (рис. 1) ежегодно вызывают волны заболеваемости, а в отдельных случаях становятся причиной пандемий с высоким уровнем смертности. Среди таких происшествий можно назвать пандемии 1918-го, 1957-го и 1968-го годов, а также находящуюся на слуху вспышку свиного гриппа 2009 года. Геном вируса гриппа кодирует не более чем одиннадцать (!) белков, из которых только два являются мишенями современных противовирусных средств, утверждённых американским управлением FDA, — нейраминидаза и ионный канал M2. Основные из этих лекарств — озельтамивир (тамифлю), занамивир (реленза), амантадин и римантадин, причём к каждому из них современные штаммы вируса уже успели выработать устойчивость.
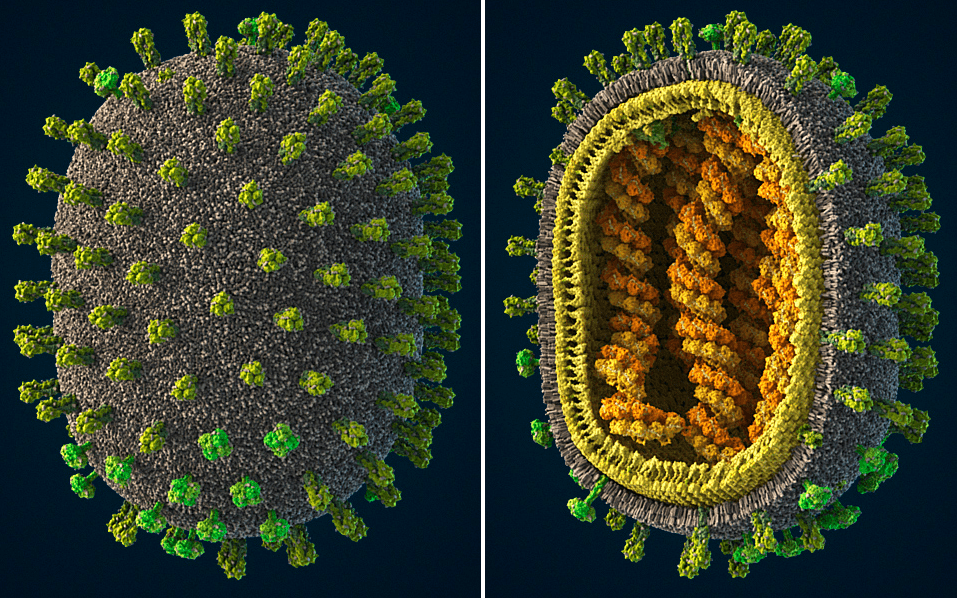
Рисунок 1. Вирусы гриппа относятся к семейству Orthomyxoviridae. Они патогенны для человека, некоторых млекопитающих и многих птиц. У человека и млекопитающих вирус поражает верхние дыхательные пути, а у птиц инфекция затрагивает преимущественно кишечник. Эти вирусы характеризуются высокой изменчивостью и широким кругом хозяев. Заболевание гриппом периодически распространяется в виде эпидемий и пандемий. Тяжесть и характер течения заболевания варьирует в зависимости от штамма вируса. Другие иллюстрации капсида вируса, 3D-модель, интерактивную схему и более полное описание смотри на сайте visualscience.ru.
Учитывая принципиально малое число возможных вирусных белков-мишеней, феноменальную изменчивость вирусов (а, следовательно, способность вырабатывать устойчивость) и их глубокое внедрение во множество клеточных процессов во время инфекции, всё большую привлекательность получает идея противовирусных средств, направленных не напрямую на белки вируса, а на клеточные механизмы «хозяина», участвующие в жизненном цикле агрессора. Однако этот путь требует досконального изучения молекулярных механизмов размножения вируса внутри клетки носителя, а также составления полного перечня «хозяйских» белков, которые участвуют в процессе инфекции и репликации вируса.
Некоторые такие белки известны уже давно: например, сиалогликорецепторы клеточной мембраны, узнаваемые вирусным гемагглютинином перед «взломом» клетки. (Кстати, именно изменчивость и разнообразие форм гемагглютинина различных штаммов вируса определяет круг потенциальных «хозяев» (человек, другие млекопитающие, птицы) и возможность перескакивать с одного носителя на другого — см., например, «Объяснена различная вирулентность вирусов гриппа — возбудителей „испанки“» [1].)
Но это — отдельный, наиболее хорошо изученный путь. А сколько их всего? Ответ на этот вопрос начал вырисовываться около двух лет назад (в 2008 году), когда в систематическом полногеномном сканировании с последовательным «выключением» почти каждого гена в культуре человеческих клеток был составлен список генов-«предателей», работающих на вирус СПИДа («Подножка для вируса СПИДа» [2]). Ошеломляющий размер этого списка — более 250 генов! — почти на порядок превзошёл предположения, показав, насколько глубоко вирусы внедряются в биохимию носителя, в нашем случае — человека.
Эта работа положила начало целому ряду подобных проектов — кроме ВИЧа, аналогичным образом изучены вирусы гепатита C, тропической лихорадки денге и западно-нильского энцефалита. Теперь этот перечень пополнил и вирус гриппа A, причём масштабное сканирование на основе РНК-интерференции выполнили сразу два коллектива учёных, опубликовавших свои отчёты в одном номере Nature [3], [4].
Задачи, постановка эксперимента и, следовательно, результаты у немецких [4] и американских [3] исследователей несколько отличались, но главный принцип был тот же: на основе библиотеки из нескольких десятков тысяч коротких интерференционных РНК (киРНК) проводили изучение развития вируса гриппа в культуре эпителиальных клеток человека с «выключенным» геном — в каждом случае одним из примерно 20000. (РНК-интерференция — явление, с помощью которого можно селективно и обратимо подавлять активность генов.) В случае если вирус в таких клетках не развивался или развивался замедленно (но сами клетки при этом чувствовали себя нормально), считали, что ген связан с репликацией вируса. Кстати, учитывая огромное число исследуемых генов и, значит, необходимых экспериментов, нужно отметить, что такое сканирование проводилось в формате высокоплотных микроматриц (рис. 2б). Число идентифицированных генов — потенциальных «предателей» — в обоих случаях приближается к 300, что практически совпадает с аналогичной цифрой для ВИЧа [2].
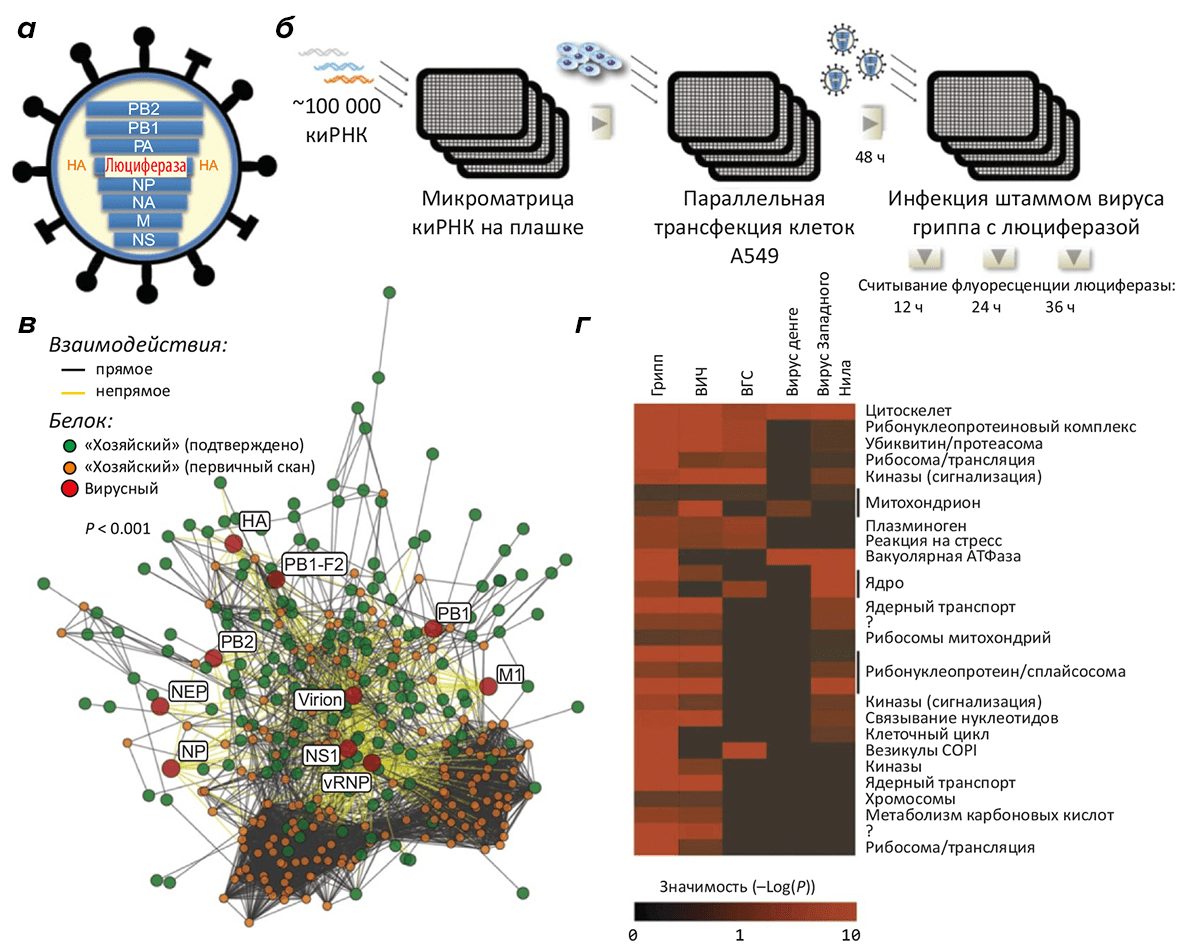
Рисунок 2. Масштабное сканирование генов, «пособничающих» размножению вируса гриппа. а — Схема рекомбинантного вируса, основанного на штамме A/WSN/33, у которого ген гемагглютинина заменён геном люциферазы для облегчения «считывания» данных об инфекции по флуоресцентному сигналу. б — Библиотека киРНК, подготовленная в формате микроматрицы лунок, используется для «выключения» в клетках лёгочного эпителия A549 одного из генов по принципу РНК-интерференции. (Исследована инактивация ~19000 генов.) Трансфицированные клетки в лунках заражали вирусом и по интенсивности флуоресценции контролировали развитие инфекционного процесса. в — Сеть взаимодействий десяти вирусных белков и клеточных факторов. г — Предсказанные взаимодействия с белкáми человека вирусов гриппа, СПИДа, гепатита C, лихорадки денге и лихорадки Западного Нила (данные для всех вирусов, кроме первого, взяты из литературы). Интенсивность красного цвета показывает значимость предсказания.
Остановимся подробнее на работе американцев из Университета Калифорнии, калифорнийского института Солка и нескольких других научных учреждений [3]. В их эксперименте библиотека киРНК была предварительно нанесена на матрицу лунок лабораторной плашки, в которых предстояло развиваться культуре клеток легочного эпителия человека А549, заражённой модифицированным вирусом гриппа штамма A/WSN/33. Фактически, в каждой лунке находились клетки, в которых по принципу РНК-интерференции был «выключен» тот или иной ген (всего около 19000 — практически каждый ген в геноме человека). Для удобного наблюдения за процессом инфекции в формате микроматрицы ген гемагглютинина был заменён на ген люциферазы, что обеспечивает удобство считывания информации о прогрессе инфекции по флуоресцентному сигналу (рис. 2). Однако такой рекомбинантный вирус неспособен полностью пройти весь свой клеточный цикл, — так что основное внимание уделялось проникновению частиц в клетку, высвобождению вирусного генома и генетическим процессам, но не сборке или выходу частиц вируса из клетки.
Анализ скорости развития вируса в клетках с тем или иным «выключенным» геном позволил идентифицировать 295 генов человека, участвующих в развитии вируса: каждый из них, будучи инактивированным, замедлял процесс на 35% и более, или вообще останавливал инфекцию. Многие из этих генов являются «старыми знакомыми» в истории с вирусом гриппа, но большинство «ранее в порочащих их связях замечены не были».
Среди этих генов особенно богато представлены группы сигнальных молекул (участников пути PI3K/AKT), регуляторов динамики цитоскелета, белки, участвующие в фосфорилировании и убиквитилировании [5] других белковых молекул, белки-коатомеры везикул комплекса Гольджи (COPI) и другие (рис. 2г). 53 гена из этого списка «двурушничают» и в пользу других РНК-содержащих вирусов, что говорит об определённой общности механизмов их жизненного цикла. Найденные гены проверили и на вирусе дикого типа, с нормальным гемагглютинином: 219 генов из списка подтвердили то, что они «не чисты на руку». Дополнительная проверка показала, что пособничество 23 генов человека требуются вирусу ещё на стадии проникновения в клетку. Не остался без внимания и вирус свиного гриппа (A/Netherlands/602/2009 H1N1), для которого составили список из 12 генов, ингибирование активности которых подавляло развитие инфекции.
Учёные выдвинули гипотезу, что для борьбы с вирусом гриппа — в том числе, вирусом свиного происхождения, — могут быть полезны ингибиторы некоторых белков человека, например рецептора фактора роста фибробластов FGFR4, вакуолярной АТФазы, киназы гликогенсинтазы GSK3β и некоторых других.
Картирование взаимодействия вирусов с человеческими клетками открывает картину потрясающей сложности там, где ещё несколько лет назад никто и не предполагал ничего подобного. С одной стороны, это осложняет понимание всего процесса, но с другой — указывает новые возможности для того, чтобы сделать вирусу — названому гостю в наших организмах — «подножку». Ведь чтобы «увернуться» от сегодняшних противовирусных лекарств, ему достаточно лишь случайно измениться самому (точнее, изменить всего один или два белка), но антивирусные стратегии завтрашнего дня могут «перекрыть кислород» гораздо более основательно, сделав невозможным взаимодействие с внутриклеточными «предателями», без которого захватчик станет совершенно беспомощным.
Литература
- Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки»;
- Подножка для вируса СПИДа;
- Renate König, Silke Stertz, Yingyao Zhou, Atsushi Inoue, H. -Heinrich Hoffmann, et. al.. (2010). Human host factors required for influenza virus replication. Nature. 463, 813-817;
- Alexander Karlas, Nikolaus Machuy, Yujin Shin, Klaus-Peter Pleissner, Anita Artarini, et. al.. (2010). Genome-wide RNAi screen identifies human host factors crucial for influenza virus replication. Nature. 463, 818-822;
- «Вездесущий убиквитин» возвращается.






