Модельные организмы: бонус — раковые клетки
25 декабря 2020
Модельные организмы: бонус — раковые клетки
- 1777
- 0
- 11
Бывшие убийцы на службе биомедицине
иллюстрация Ксении Сайфулиной
-
Автор
-
Редакторы
-
Иллюстратор
Бессмертные, вечно делящиеся клетки злокачественной опухоли человека и других организмов служат наиболее распространенной биологической моделью современных молекулярных исследований. Если говорить об изучении многоклеточных организмов, то эксперименты в клеточных системах представляют собой промежуточную стадию между работой в пробирке, на разрушенных клетках и тканях — in vitro, — и анализом явлений в целых живых организмах — in vivo. Для исследований, проводимых на искусственно выращиваемых клеточных культурах, даже специально придумали название — in cello. Хотя организм, из которого происходит большинство стандартных клеточных культур — человек, эти клетки представляют собой совершенно особенную модель. Мне показалось, что нашу сагу о модельных организмах надо закончить своего рода бонусом — рассказом о раковых клетках.
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Что такое злокачественная опухоль? — Колония дрожжей посреди многоклеточного организма — Геномная болезнь — Бессмертная жизнь Генриетты Лакс — Клеточные фабрики — Культуры клеток плюс голые мыши
Что такое злокачественная опухоль?
В русскоязычной традиции термин «рак» более узок, нежели английский cancer, который объединяет все злокачественные опухоли. Под раковыми в нашей литературе понимают опухоли эпителиального происхождения, исключая, например, лейкозы (англ. leukemia) — опухоли белых кровяных клеток, саркомы — опухоли мезенхимального происхождения, глиомы — опухоли глиального происхождения, и т.д. В этом эссе для удобства понимания я буду употреблять такие выражения как «раковые клетки» и «злокачественные клетки» взаимозаменяемо.
С возникновением многоклеточности, а точнее, дифференцировки — образования двух или более клеточных типов — у организмов появилась серьезная проблема. Теперь стало нужно контролировать, чтобы в усложненном дифференцировкой многоклеточном теле клеток каждого типа было столько, сколько необходимо для функционирования. Представим двухслойный организм: наружный слой клеток будет, грубо говоря, кожей, а другой — кишечником. Если клетки кожи, положим, более прочные и, например, стрекающие, станут делиться и попадут внутрь этого организма, он не справится с перевариванием пищи. Наоборот, если более уязвимые, но способные к секреции с целью пристеночного пищеварения клетки кишки окажутся снаружи, внешние условия могут их разрушить. И так, и так плохо — слои разной функциональности должны находиться в равновесии.
К чему это я? К тому, что многоклеточные организмы, в особенности, животные, — более хрупкие, подвижные, в основном, живущие быстрее, чем растения и грибы, — вынуждены очень строго контролировать деление и дифференцировку своих клеток, тратя большие ресурсы на контроль этого самого деления. Клетки должны размножаться по команде (например, в период эмбрионального развития). А во взрослом организме — где надо, то есть в обновляющихся тканях, например, различных эпителиях, красном костном мозге, соединительной ткани. Напротив, существуют покоящиеся клеточные типы, деление в которых — событие экстраординарное. Например, у человека многие нейроны живут вместе с ним всю жизнь, не делясь. Совокупность связей с другими клетками нервной системы формируется на всю жизнь, и поделиться для нейронов — означает поставить под угрозу четкое функционирование этой клетки со всеми отростками и связями.
И вот когда клетки начинают делиться когда и где не надо, возникает опухоль. Разрастание клеток опухоли утрачивает смысл на уровне всего организма, но имеет смысл для каждой клетки в отдельности. В некотором роде, происходит возврат к одноклеточности. Поведение клеток опухоли напоминает разрастание колонии конкурирующих эукариотических клеток (например дрожжей). Пока рост идет медленно, опухоль не вредит или мало вредит организму, она расположена локально. Такую опухоль в контексте биологии человека и высших позвоночных называют доброкачественной. Когда рост ускоряется, опухоль повреждает окружающие ткани и органы. Ее клетки даже способны передвигаться по организму и образовывать новые, отдаленные колонии — метастазы [1]. Колония делится сама по себе, ни для чего, и действует самоубийственно. Она убивает свой субстрат — организм — и погибает сама (рис. 1).
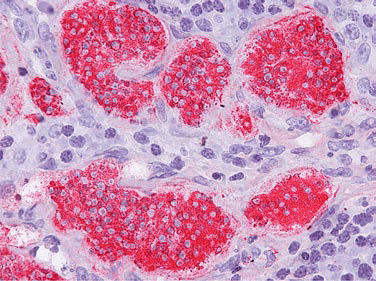
Рисунок 1. Удивительный пример из биологии злокачественных опухолей. Раковые клетки, происходящие из кишечного паразита — ленточного червя Hymenolepis nana, — в лимфатических узлах иммунодефицитного пациента. Клинический случай развития фатальной опухоли из клеток паразита-беспозвоночного в тканях человека описан в журнале New England Journal of Medicine в 2015 году [2]. Клетки червя окрашены методом гибридизации in situ ДНК-зондом из гена 18S рибосомной РНК ленточных червей.
Картина так себе. Но почему возникает опухоль? Что происходит такого, что начинается вот это бесконтрольное деление? Вопрос не праздный. Он волновал исследователей с самого зарождения современного естественнонаучного подхода. Выдвигались разные теории канцерогенеза (то есть зарождения злокачественных опухолей). В качестве факторов канцерогенеза рассматривали химические вещества, физические воздействия (например, облучение), вирусы, воспаление. И действительно, эксперименты убедительно подтверждают, что все эти факторы способны вызвать у человека и животных опухоли различных органов и тканей. Теории канцерогенеза существовали независимо друг от друга. В конце 1970-х годов возникла еще одна — мутационная. Оказалось, что имеется связь между канцерогенностью веществ и их мутагенностью, что было показано в работах под руководством американского биохимика Брюса Эймса [3]. Чуть позже группе Роберта Вайнберга из Массачусетского технологического университета удалось вызвать опухоли у мышей, вводя в их клетки мутантную ДНК [4]. Так была заложена основа современного взгляда на происхождение опухолей.
Дело в том, что, как постепенно выяснилось, химические, физические и вирусные канцерогены в итоге вызывают мутации в геномах клеток. Это и есть механизм их действия. Где же должны произойти такие мутации, чтобы клетки стали злокачественными?
Есть две больших группы таких генов. Более представленная из них кодирует белки онкосупрессоры . Обычно они занимаются тем, что разными способами препятствуют бесконтрольному клеточному делению или повреждению генома мутациями. Первые еще называют «привратниками», потому что они, как будто стражи у ворот клеточного деления, не дают им не вовремя открыться. Классический пример такого привратника — узловой регулятор каскада программируемой клеточной гибели (апоптоза [5]) — знаменитый белок p53. Вторая группа онкосупрессоров — белки репарации ДНК, которые прозвали «смотрителями», заботящимися о том, чтобы геном был в порядке. Опять же, тут есть знаменитый прототип — ген белка BRCA1 (breast cancer 1), «ген Анджелины Джоли» [6]. Потеря функциональности продуктов онкосупрессоров из-за инактивирующих мутаций способствует приобретению клетками злокачественности. Из-за поломки привратников клетка не впадает в апоптоз в случае тревожных сигналов, а утрата функции смотрителей нарушает своевременный ремонт ДНК. Всё это способствует размножению клеток, в которых умножаются мутации.
В основном, «раковые» гены кодируют белки, хотя в последнее время показано, что «раковыми» молекулами могут служить и некодирующие РНК.
Вторая группа опасных в плане развития рака генов — это протоонкогены. «Прото» — потому что в нормальном состоянии они не опасны, а вот после мутации становятся самыми настоящими онкогенами. Какую функцию они выполняют в своем безопасном состоянии? Очевидно, что нормальным клеткам тоже нужно делиться. Они это делают под воздействием специальных сигналов, собирательно называемых факторами роста. Большинство онкогенов принимают сигнал от факторов роста и далее распространяют его, запуская процесс деления клеток. Онкогенные мутации делают так, чтобы эти белки всегда находились в активированном состоянии, независимо от присутствия сигналов к росту. Получается, что у этих регуляторов ломается выключатель — они всегда в состоянии «вкл».
Широко распространенная — и понятная — аллегория сравнивает нарушение работы протоонкогенов и онкосупрессоров с поломками в автомобиле (рис. 2). Движение машины — это клеточное деление. Ситуация, когда машина необузданно несется вперед, символизирует неконтролируемое деление клеток. Протоонкоген — это педаль газа. Ростовый стимул — это нажатие на нее. Если педаль залипла и не отпускается, не отвечает на отсутствие стимула, машина несется вперед. При этом тормоза пытаются работать, но они не рассчитаны на такой режим и постепенно просто сгорают. Тормоза — это как раз онкосупрессоры. Если они сломаны, машина не останавливается даже при нормально работающей педали газа.
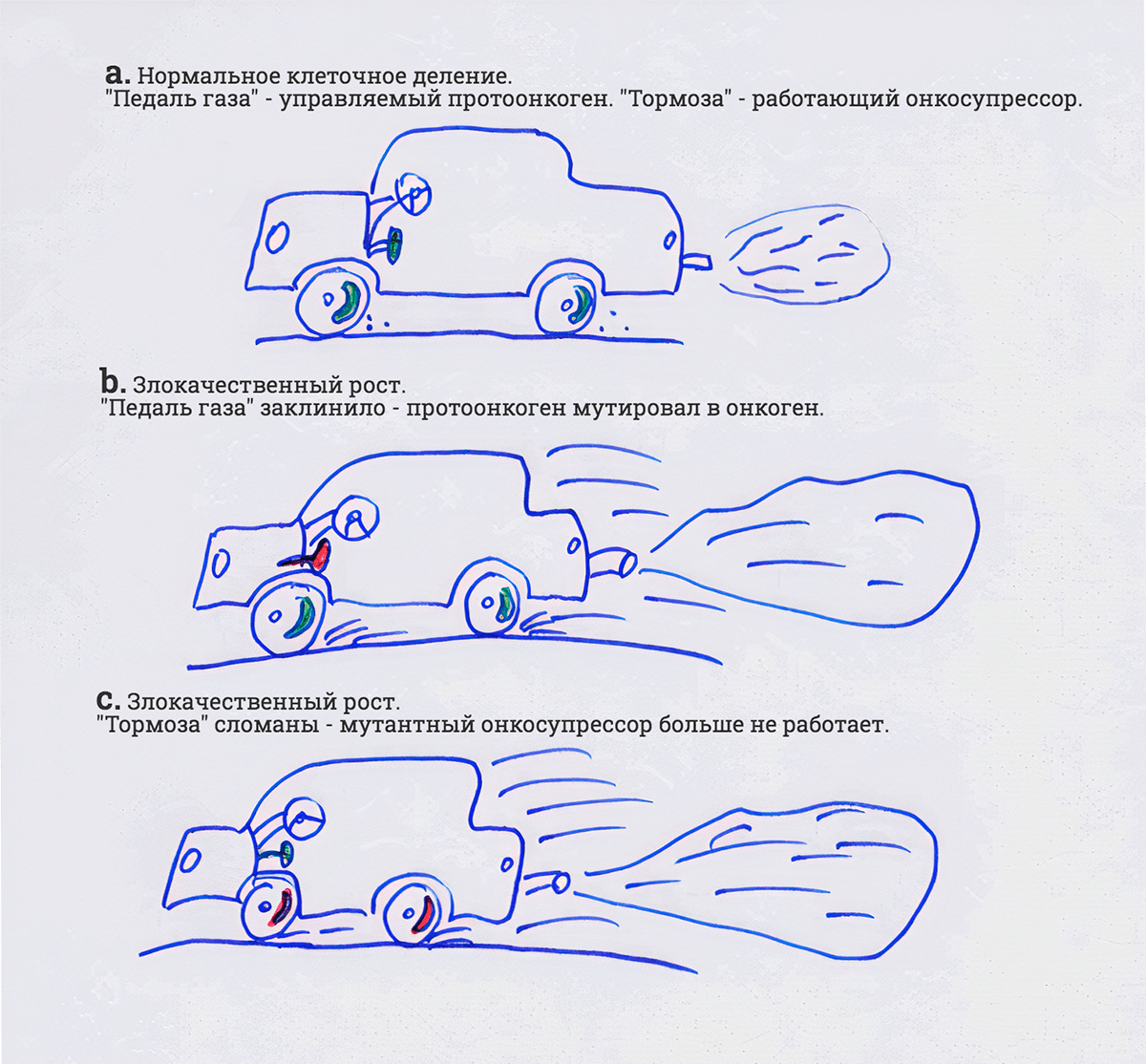
Рисунок 2. Раковая клетка как взбесившийся автомобиль. а. Всё хорошо. Протоонкоген («педаль газа») при наличии ростового сигнала («нажатие педали») стимулирует клеточное деление. Онкосупрессоры («тормоза») занимаются починкой ДНК или в случае накопления мутаций запускают клеточную гибель. b. Мутация превращает протоонкоген в онкоген. Он больше не реагирует на «нажатие», а заклинивает, как педаль газа, вдавленная в пол. Клеточное деление начинает «ехать» бесконтрольно и не может остановиться, даже «тормоза» не помогают. Пример — мутация в генах онкогенных киназ, например в kras или braf. с. Мутации ломают «тормоза»-онкосупрессоры. При малейшем нажатии педали газа клетка начинает «ехать» — бесконтрольно делиться. Пример — мутации в гене онкосупрессора-привратника p53 или в гене онкосупрессора-смотрителя BRCA1. В реальности ситуации b и с часто сочетаются, ведь для клинического проявления опухолевому клону, как правило, нужно более пяти значимых мутаций в протоонкогенах и(или) в онкосупрессорах (в поддержку сравнения с авто, по-английски они называются driver mutations).
иллюстрация автора статьи
Набор мутированных протоонкогенов и онкосупрессоров в индивидуальных опухолях разный. Как правило, для разворачивания клинически значимой опухоли, нужно несколько значимых мутаций. Процесс развития опухоли как целого анатомического образования сопровождается борьбой конкурирующих клонов по принципам дарвиновской эволюции. По биологии злокачественных опухолей на молекулярном и клеточном уровне существует обширная научная и популярная литература. Здесь я хочу остановиться, приступив к непосредственному предмету этой заметки. Напоследок скажу, что сегодня в разных опухолях человека уже выявлено около двух тысяч генов, кодирующих протоонкогены и онкосупрессоры. Информацию о таких генах аккуратно собирают в специальном реестре — Cancer Сensus.
Попытки культивирования клеток многоклеточных организмов за пределами мест их естественного пребывания предпринимались с начала XX века. Оказалось, что клетки, например, фибробласты, способны несколько раз поделиться при помещении их в сыворотку крови. Возникла идея создания стандартных сред для культивирования эукариотических клеток. В итоге, к 1940-м годам такие среды поступили в производство. Они были уравновешены по кислотности и ионному составу, содержали необходимые питательные вещества и значительное количество сыворотки крови (обычно 5–10%). Оптимальной сывороткой для культивирования стала специально производимая сыворотка плода крупного рогатого скота. Она обладает высоким содержанием ростовых факторов. Клетки стали культивировать в плоских флаконах, поскольку было замечено, что многие из них лучше себя чувствуют, прикрепляясь к стеклу. Если клетки, делясь, образовывали сплошной слой на поверхности флакона, их жизнеспособность падала. Колония требовала пересева — так называемого пассажа. Количество пересевов, которые претерпевает клеточная культура — ее важная техническая характеристика.
Ранние опыты по культивированию клеток показали, что далеко не все клетки, которые можно выделить в живом виде из тканей (для этого ткани подвергают мягкому разрушению, например, обрабатывая ферментами) вообще способны долго поддерживаться в культуре . Свежесозданную из ткани культуру клеток стали называть первичной. На ней, если она не хотела расти дальше, конечно, можно быстро выполнить какие-то эксперименты. Однако мечтой биологов была долгосрочно поддерживаемая культура, способная в неизменном виде переживать множество пересевов. Прообразом такой культуры стала знаменита клеточная линия рака шейки матки HeLa.
И это понятно, поскольку в большинстве дифференцированных клеток имеются механизмы противодействия длительному делению даже в случае стимуляции ростовыми факторами.
В 1951 году культура клеток из биопсии рака шейки матки была получена от афроамериканки Генриетты Лакс, которая на развернутой стадии болезни поступила в известный госпиталь Джонса Хопкинса в Балтиморе [7]. Культуру создали под руководством клеточного биолога Джорджа Отто Гея, который обнаружил, что она делится значительно быстрее, чем другие известные злокачественные клетки, имевшиеся в его распоряжении. Линия HeLa, как ее назвали по первым буквам имени донора, стала первой клеточной линией человеческого происхождения, которая могла в течение длительного времени поддерживаться в культуре для различных экспериментов.
Получение культуры HeLa сопровождалось этическими противоречиями, которые повлияли на индустрию спустя многие годы использования этой линии. Дело в том, что в 1950-е годы никто и не думал спросить согласия донора этой линии на ее использования, тем более что пациентка скончалась вскоре после получения клеток. Драматическое разбирательство наследников Генриетты Лакс с университетами и клиниками широко освещалось в медиа. История конфликта легла в основу книги Ребекки Склут и одноименного художественного фильма (рис. 3).
Несмотря на то, что в организме конкурирующие клоны раковых клеток разрастаются и в итоге приводят к гибели пациента, не все они, будучи выделенными и помещенными в первичную культуру, способны без проблем переживать множественные пересевы, как HeLa. Это, вероятно, зависит от индивидуальных особенностей мутантного опухолевого генома и, как следствие, потребностей опухолевых клеток в микроокружении . Тем не менее развитие клеточной биологии привело к выделению сотен долгоживущих в культуре клеточных линий, представляющих различные опухоли. Классикой стали человеческие линии рака молочной железы MCF7, злокачественной меланомы A375, печеночноклеточной карциномы HepG2, эмбриональной почки (а как позже оказалось, надпочечника) HEK293 и многие другие. Клеточные линии депонированы в хранилища, где их можно купить. Старейшая из таких коллекций принадлежит некоммерческой компании American Type Culture Collection (ATCC). Созданная еще в 1920-е для депонирования важных штаммов микроорганизмов, ATCC также стала собирать и хранить живые линии злокачественных опухолей. Аналогичные собрания существуют и в других странах. Панели из клеточных линий стали стандартами для различных экспериментов. Например, в американском Национальном институте рака (NCI) разработали набор из 60 клеточных линий, так называемый NCI-60.
Стволовые клетки, так же как и раковые, обладают высоким пролиферативным потенциалом. Чем ближе к главной стволовой клетке организма, тем дольше они живут и в культуре. Например, эмбриональные стволовые клетки, а также индуцированные можно пересевать десятки и более раз. Правда, в экспериментах избегают большого количества пассажей, чтобы в клетках не накапливались мутации: в результате они могут утратить свои исходные черты. При этом более дифференцированные мезенхимальные стволовые клетки в пригодном для исследования жизнеспособном состоянии выдерживают не более десяти пассажей, после чего стареют и погибают.
Ведение раковых клеточных линий в лаборатории к нашему времени существенно усовершенствовалось технически и во многом стандартизовалось. В широкой продаже различные типы ростовых сред, среди которых предлагаются бессывороточные среды, которые, тем не менее, поддерживают жизнеспособное состояние некоторых линий клеток. Стандартом для поддержания стабильной кислотности среды культивирования считается гидрокарбонатный буфер. Чтобы углекислота из среды не испарялась, меняя кислотность, культивирование проводят в атмосфере с содержанием углекислого газа. Для этого разработаны специальные CO2-инкубаторы [8].
Немаловажный момент в управлении клеточными культурами — как хранить клетки, чтобы не поддерживать культуру все время. Для этого разработаны системы замораживания. В отличие от целого человеческого организма, который консервировать в живом состоянии мы пока не научились, хотя давно мечтаем об этом, клетки несложно заморозить, а потом достать из холодильника или сосуда Дьюара с парами жидкого азота и снова культивировать. Для этого обычную среду меняют на жидкость с криопротектором (обычно используют диметилсульфоксид). Затем культуру в специальной морозоустойчивой таре надо как можно скорее заморозить, но сделать это постепенно. Изобретен специальный замораживающий контейнер для клеток с низкой теплопроводностью. Систему помещают в морозилку на −80 °C, а там контейнер обеспечивает медленное охлаждение среды, примерно, по 1 °C в минуту. Долгосрочное хранение культур в жизнеспособном состоянии проходит в парах жидкого азота, при температуре −196 °C.
Примерно то же, что бытовой термос, только больше. Сосуд изобрел в 1892 году шотландский естествоиспытатель сэр Джеймс Дьюар. Так как патент на изобретение он оформлять не стал, с 1904 года такие сосуды для различных нужд стала независимо от него производить немецкая фирма «Термос», от которой и пошло известное сегодня название.
Клеточные культуры — великолепный инструмент для выяснения молекулярных механизмов работы клеток. Несмотря на существенные геномные и, как следствие, биохимические изменения, раковые клетки сохраняют бóльшую часть молекулярного инструментария, присущего организму, из которого они когда-то произошли. На клеточных линиях делается много работы, связанной с поиском фундаментальных механизмов действия живых систем, когда патологическая сущность модели становится неважной. В этом небольшом рассказе нельзя перечислить всю пользу, которую клеточные модели принесли современной биотехнологии. Стоит упомянуть гибридомы, где злокачественные клетки используются как фабрики производства моноклональных антител [9–11], да и другие решения по производству полезных белков, которое нельзя произвести в рекомбинантных бактериях.
Геномика и другие омиксные технологии поддали жару в использовании клеточных моделей — ведь теперь их можно исчерпывающе охарактеризовать прямо сейчас, не уповая на предшествующие описания. Так можно убедиться, например, насколько имеющаяся у вас линия, полученная от друзей, совпадает с ее заявленным прототипом, хранящимся в ATCC.
Конечно, накопленный опыт применения клеточных линий для моделирования настоящих злокачественных опухолей выявил существенные недостатки этих моделей, которые нужно принимать во внимание [12]. Во-первых, с момента их культивирования эти линии претерпевают множество пересевов — пассажей, — причем условия их роста немного меняются. Это ведет к тому, что такие клетки накапливают генетические изменения, которые происходят уже in vitro. Последние, разумеется, вызывают изменения по сравнению с исходным вариантом и на уровне генной экспрессии. Во-вторых, клеточные линии становятся однородными за счет адаптации к условиям культуры одного клона. Исходные опухоли, как правило, содержат несколько конкурирующих клонов. Очевидно также, что клетки в культуре не содержат тканевого микроокружения, настолько важного в жизни настоящих опухолей.
Чтобы частично преодолеть эти ограничения, сочетают подходы клеточной культуры и работы с модельными животными, преимущественно, грызунами (о работе с ними читайте ноябрьскую статью из этого цикла [13]). Если трансплантировать, ввести в какую-то часть тела, первичные или иммортализованные культуры злокачественных клеток здоровой мыши, эти клетки уничтожит иммунная система. Рак не разовьется. Но если создать мышь с ослабленным клеточным иммунитетом, у нее вырастет опухоль, похожая по свойствам на ту, из которой взяли клетки. Поскольку эксперименты на мышах с ксенотрансплантатами оказались очень ценны для онкологии, были выведены специальные мутантные бестимусные мыши, от рождения лишенные клеточного иммунитета (и, по совпадению, шерсти).
Трансплантаты клеток или тканей из другого вида животного, например те, что вводят мыши от человека. Используя кальку с английского, их еще иногда называют ксенографтами.
Бессмертные или долгоживущие линии раковых клеток в культуре стали, не побоюсь сказать, самым распространенным живым модельным объектом для экспериментов. Действительно, вырастить их намного проще и дешевле, чем держать модельных животных. Преимущества клеточных моделей плавно перетекают в их недостатки. Их простота и воспроизводимость по свойствам далеко уклоняются от образа жизни ансамблей из сотен клеточных типов, существующих в реальных тканях человека. Тем не менее когда-то погубив организмы, из которых они происходят, раковые клетки теперь помогают в спасении жизней, участвуя в огромном количестве доклинических исследований медицинских продуктов, проводимых, как говорится, in cello.
Литература
- Метастазирование опухолей;
- Atis Muehlenbachs, Julu Bhatnagar, Carlos A. Agudelo, Alicia Hidron, Mark L. Eberhard, et. al.. (2015). Malignant Transformation ofHymenolepis nanain a Human Host. N Engl J Med. 373, 1845-1852;
- B. N. Ames, H. O. Kammen, E. Yamasaki. (1975). Hair dyes are mutagenic: identification of a variety of mutagenic ingredients.. Proceedings of the National Academy of Sciences. 72, 2423-2427;
- Chiaho Shih, Robert A. Weinberg. (1982). Isolation of a transforming sequence from a human bladder carcinoma cell line. Cell. 29, 161-169;
- Апоптоз, или Путь самурая;
- Рак молочной железы с семейной историей;
- Бессмертные клетки Генриетты Лакс;
- 12 методов в картинках: клеточные технологии;
- 12 методов в картинках: иммунологические технологии;
- Краткая история открытия и применения антител;
- Открытие моноклональных антител;
- Mirabelli, Coppola, Salvatore. (2019). Cancer Cell Lines Are Useful Model Systems for Medical Research. Cancers. 11, 1098;
- Модельные организмы: грызуны.