
Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии
29 ноября 2007
Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии
- 8679
- 2
- 2
Знаменитый магический блеск золота (как, впрочем, и других металлов) обусловлен отражением света от поверхностных плазмонов — квазичастиц, возникающих за счёт квантования коллективных колебаний свободных электронов в металле. Наночастицы золота (несоизмеримо меньшие этих слитков) имеют частоту плазмонного резонанса, сравнимую с пиком оптической плотности многих металлопротеинов.
-
Автор
-
Редакторы
Спектроскопия оптического поглощения — один из старейших методов физико-химического анализа биомолекул. Однако невысокие его чувствительность и пространственное разрешение не позволяют изучать процессы с участием низких концентраций белка. Учёным из Беркли удалось «продлить век» оптическому методу за счёт сопряжения его с другим принципом, применяемым в биофизических и биохимических исследованиях, — плазмонным резонансом. Оказалось, что в спектре упругого рассеяния на наночастицах золота, введённых в клетку, могут появляться специфические «провалы», соответствующие частотам, на которых поглощают некоторые биологические молекулы (например, металлопротеины). Исследователи называют этот эффект миграцией энергии плазмонного резонанса и объясняют его непосредственным взаимодействием частиц золота с адсорбирующимися на них молекулами белка. Предложенный метод обладает невиданной ранее чувствительностью: с его помощью можно определять если и не единичные молекулы белка, то, по крайней мере, их десятки.
Оптическая спектрометрия позволяет изучать белки, обладающие оптической плотностью в видимом диапазоне электромагнитного излучения (хромопротеины) с помощью измерения поглощения света на определённых («характеристических» для конкретных молекул) длинах волн. Однако для таких измерений требуются довольно высокие концентрации белкá, да и пространственное разрешение этого метода весьма низкое (обычно изучают растворы молекул, находящиеся в спектрометрических кюветах, и речи о том, где именно в клетке расположены изучаемые молекулы, просто не идёт). Гораздо большей чувствительностью обладают методы, основанные на измерении флуоресценции (вместе с конфокальной микроскопией они позволяют определять месторасположение молекул внутри живой клетки), но тут необходимо модифицировать изучаемые молекулы специальными молекулами-метками, что не всегда желательно и возможно. Другой часто используемый в биологии метод — спектроскопия ядерного магнитного резонанса — также требует довольно больших концентраций белка и часто — изотопного мечения объекта, сложного в условиях живых систем.
Предлагаемая учёными из Беркли методика (статья опубликована в журнале Nature Methods [1]) основана на введении в живые клетки наноскопических частиц золота контролируемого размера (20–30 нм). Электроны на поверхности частиц из таких металлов как золото или серебро коллективно осциллируют в ответ на облучение светом определённой длины волны — это явление известно как плазмонный резонанс (см. врезку). Резонансные частоты этих наночастиц зарегистрировать намного легче, чем слабый (из-за очень низких концентраций) оптический сигнал от биологических молекул, что и позволяет проводить измерения.
Измерения основаны на явлении, называемом миграцией энергии плазмонного резонанса (введём аббревиатуру МЭПР), которое заключается в том, что молекулы белка, адсорбирующиеся на поверхности золотых частиц, как бы «оттягивают» на себя часть энергии плазмонного резонанса, что достаточно легко зарегистрировать по специфическим «провалам» в спектрах рассеяния, «снимаемых» с этих частиц. Главным условием этого эффекта является перекрывание частоты плазмонного резонанса и частот оптического поглощения белка, — требование, аналогичное тому, которое накладывается и в более широко известном методе резонансного переноса энергии флуоресценции (Fluorescence Resonance Energy Transfer, FRET). Именно этим условием и определяется то, что частицы состоят из золота, и их размер (частицы этого размера имеют пик плазмонного резонанса в области 530–580 нм, перекрывая диапазон поглощения цитохрома c, который был выбран для исследования). Предполагается, что механизм миграции энергии аналогичен таковому при миграции энергии флуоресценции (так называемое Фёрстеровское диполь-дипольное взаимодействие).
В установке, созданной учёными, наночастицы золота освещаются под определённым углом через фазово-контрастный конденсор. Изучаемым параметром является светорассеяние (на величину которого как раз и влияет плазмонный резонанс), регистрируемое цветной камерой и анализируемое с помощью спектрофотометра (рис. 1).

Рисунок 1. «Тушение» плазмонного резонанса вследствие миграции энергии на биомолекулы. а — Схема установки. б — Типичный спектр рэлеевского (упругого) рассеяния наночастиц золота. Для частиц размером 30 нм характерен пик на 530–580 нм. в — Типичный спектр оптического поглощения белка (цитохрома c). Характерные пики — 530 нм для окисленной формы (Fe III) и 525 нм и 550 нм для восстановленной (Fe II). г — «Провалы» на спектре плазмонного резонанса (рассеяния), вызванные миграцией энергии на биомолекулу в диапазонах длин волн, соответствующих пикам оптического поглощения белкá.
«Тушение» плазмонно-резонансного спектра, обусловленное миграцией энергии на адсорбирующиеся на поверхности наночастиц биомолекулы, проявляется в виде специфических «провалов» на спектрах рассеяния в диапазонах длин волн, совпадающих с пиками оптического поглощения молекул белка (рис. 1г). (Как уже говорилось, для эффективного переноса энергии необходимо, чтобы спектры рассеяния и поглощения перекрывались.) Поскольку такая резонансная миграция является прямым переносом, и, следовательно, происходит быстрее и эффективнее, чем оптическое поглощение, спектры МЭПР могут быть зарегистрированы обыкновенной оптической системой, что было бы невозможно при использовании «обычной» оптической спектроскопии.
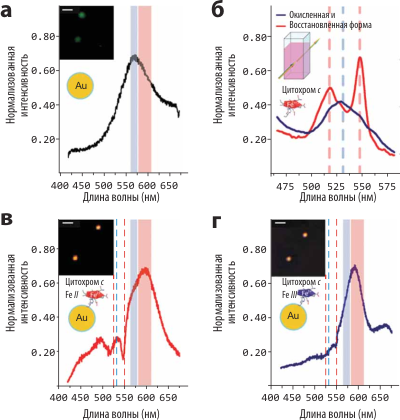
Рисунок 2. Результаты экспериментов по измерению миграции энергии плазмонного резонанса с индивидуальной 30-нм наночастицы золота на молекулы цитохрома c. а — Спектр рэлеевского рассеяния наночастицы, модифицированной молекулами линкера (используется для ковалентной пришивки молекул цитохрома). б — Спектры оптического поглощения окисленной и восстановленной форм цитохрома c (8 μМ). в и г — Спектры рассеяния наночастицы, модифицированной (посредством линкера) окисленной и восстановленной формами цитохрома c. Пунктиром показаны характеристические частоты поглощения этих форм. На врезках: цветные микрофотографии рассеивающих наночастиц (длина нормировочного отрезка: 2 μм). (Дополнительный анализ, посвящённый точной идентификации спектральных «провалов», тут приводить не будем.)
Для проверки возможностей нового метода учёными был выбран цитохром c — металлопротеин, ассоциированный с внутренней митохондриальной мембраной. Основные его биохимические функции — перенос заряда как элемент дыхательной цепи и в некоторых случаях инициация апоптоза. Как переносчик заряда, цитохром c может находиться в двух формах: окисленной и восстановленной, отличающихся спектроскопически (рис. 2б). Будучи ковалентно присоединён к наночастицам золота, цитохром c модифицирует спектры рассеяния этих частиц: в зависимости от того, какая форма молекулы изучалась, на пике плазмонного резонанса наблюдались характерные «провалы» на частотах, соответствующих частотам поглощения цитохрома (рис. 2в,г). Молекулы линкера, с помощью которых цитохром присоединялся к частицам, не изменяли форму спектра рассеяния (рис. 2а).
То, что «провалы» на спектре обусловлены именно присутствием цитохрома c, было подтверждено электрохимическими методами, а то, что механизмом, ответственным образование спектральных «провалов», является именно резонансный перенос энергии, подтвердили:
- ставя эксперимент на неметаллических частицах (тоже рассеивающих свет) — в их спектре рассеяния не наблюдается никаких провалов;
- значительно увеличивая диаметр золотых частиц, смещая тем самым максимум спектра рассеяния в область 650 нм (уже не перекрывающуюся с диапазоном поглощения цитохрома) — делая «провалы» на левом «крыле» спектра практически незаметными;
- модифицируя частицы золота не цитохромом, а синтетическими пептидами, не поглощающими свет в видимой области — и опять же, форма спектра рассеяния оставалась неизменённой.
Кстати, для исследований не обязательно брать именно золото: аналогичные эксперименты были проведены на серебряных наночастицах, взаимодействующих с гемоглобином (частота плазмонного резонанса серебряных частиц и полоса Соре гемоглобина (~407 нм) находятся в одной спектральной области). Если же использовать другие металлы, то можно изучать аналогичный эффект в ультрафиолетовой или ближней инфракрасной областях спектра — например, чтобы идентифицировать взаимодействие с нуклеиновыми кислотами или большинством белков, не поглощающих свет в видимой области.
Руководитель исследования — Люк Ли (Luke P. Lee), занимающий должности в двух калифорнийских университетах, — так отзывается о разработанной ими технологии: «До настоящего времени ещё не было придумано ни одной неразрушающей методики, способной дать информацию о биомолекулах на наноскопических масштабах в одной-единственной живой клетке. Существует надежда, что стволовые клетки помогут однажды против многих болезней, однако самое сложное в этой области — это понять, как именно дифференцируется клетка. Что происходит внутри неё, когда она развивается в клетку сердечной мышцы, а не в зубную эмаль или волос? Чтобы понять это, нам нужно повнимательнее „приглядеться“ к химическим сигналам, сопровождающим работу белков и генов в клетке».
Исследователи считают, что наиболее перспективная область использования нового метода (учитывая его беспрецедентную чувствительность и возможность применения в живой клетке) — это генетический анализ низко-копийных молекул РНК и продуктов экспрессии генов, редко включающихся в «нормальных» условиях и про работу которых почти ничего не известно. Кроме того, можно будет определять белки-спутники различных форм рака, токсины и вирусные частицы. «Наша работа „убивает сразу двух зайцев“, — говорит Ли. — Мы одновременно на порядки уменьшили пространственное разрешение, необходимое для идентификации отдельных молекул, и смогли получить физико-химическую информацию об изучаемых молекулах — и всё это в живой клетке! В общем, использованные нами частицы золота похожи на „нано-звёзды“, потому что они освещают внутреннюю вселенную живой клетки» [2].
Литература
- Gang Logan Liu, Yi-Tao Long, Yeonho Choi, Taewook Kang, Luke P Lee. (2007). Quantized plasmon quenching dips nanospectroscopy via plasmon resonance energy transfer. Nat Methods. 4, 1015-1017;
- New nanoparticle technique captures chemical reactions in single living cell with amazing clarity. (2007). ScienceDaily.






