
Метроном: как руководить разрядами?
16 апреля 2015
Метроном: как руководить разрядами?
- 3556
- 1
- 3
-
Автор
-
Редактор
Как много механизмов и чудес техники придумано человеком. А как много позаимствовано им у природы!.. Иной раз невольно диву даешься, что вещи из разных и, казалось бы, не связанных между собой областей подчиняются общим законам. В этой статье мы проведем параллель между прибором, задающим ритм в музыке — метрономом, — и нашим сердцем, обладающим физиологическим свойством генерировать и регулировать ритмическую активность.
Метроном... Что же это за штука такая? А это тот самый прибор, который используют музыканты для установки ритма. Метроном равномерно отстукивает удары, позволяя точно придерживаться необходимой продолжительности каждого такта при исполнении всего музыкального произведения. Так же и природа: и «музыка», и «метрономы» у нее давным-давно есть. Первое, что приходит на ум при попытке вспомнить, что же в организме может быть похожим на метроном, — это сердце. Настоящий метроном, не правда ли? Так же равномерно отстукивает удары, хоть бери да музыку играй! Но в нашем сердечном метрономе важна не столько высокая точность интервалов между ударами, сколько возможность постоянно, не останавливаясь, поддерживать ритм. Именно это свойство и будет главной нашей темой сегодня.
Так где же в нашем «метрономе» спрятана отвечающая за всё пружина?
И день и ночь без остановок...
Все мы знаем (даже больше — можем почувствовать), что наше сердце работает постоянно и самостоятельно. Ведь мы совершенно не задумываемся над тем, чтобы контролировать работу сердечной мышцы. Более того, даже полностью изолированное от организма сердце будет ритмически сокращаться, если обеспечить поступление к нему питательных веществ (см. видео). Как же это происходит? Это невероятное свойство — сердечный автоматизм — обеспечивается проводящей системой, которая генерирует регулярные импульсы, распространяющиеся по всему сердцу и управляющие процессом. Именно поэтому элементы этой системы называют водителями ритма, или пейсмейкерами (от англ. рacemaker — задающий ритм). В норме сердечным оркестром дирижирует главный пейсмейкер — синоатриальный узел. Но вопрос всё равно остается: как это у них получается? Давайте разбираться.
Сокращение сердца кролика без внешних стимулов.
Импульсы — это электричество. Откуда в нас берется электричество, мы знаем — это мембранный потенциал покоя (МПП)*, являющийся непременным атрибутом любой живой клетки на Земле [1]. Различие ионного состава по разные стороны избирательно проницаемой мембраны клетки (называемое электрохимическим градиентом) определяет возможность генерировать импульсы. При определенных условиях в мембране открываются каналы (представляющие собой молекулы белка с отверстием изменяемого радиуса), через которые проходят ионы, стремящиеся выровнять концентрацию с обеих сторон мембраны. Возникает потенциал действия (ПД) — тот самый электрический импульс, распространяющийся по нервным волокнам и в конечном итоге приводящий к сокращению мышц [2]. После прохождения волны потенциала действия градиенты концентраций ионов возвращаются на свои исходные позиции, и мембранный потенциал покоя восстанавливается, что позволяет генерировать импульсы снова и снова. Однако генерация этих импульсов требует внешнего стимула. Как же тогда так получается, что пейсмейкеры самостоятельно генерируют ритм?
* — Образно и очень понятно о путешествиях ионов сквозь мембрану «релаксирующего» нейрона, внутриклеточном аресте отрицательных общественных элементов ионов, сиротской доле натрия, гордой независимости калия от натрия и безответной любви клетки к калию, стремящемуся тихонько утечь, — см. в статье «Формирование мембранного потенциала покоя» [3]. — Ред.
Наберитесь терпения. Прежде чем ответить на этот вопрос, придется вспомнить подробности механизма генерации потенциала действия.
Потенциал — откуда берутся возможности?
Мы уже отметили, что между внутренней и внешней сторонами мембраны клетки существует разница зарядов, то есть мембрана поляризирована (рис. 1). Собственно, эта разница и есть мембранный потенциал, обычное значение которого около −70 мВ (знак «минус» означает, что внутри клетки отрицательного заряда больше). Проникновение заряженных частиц через мембрану само собой не происходит, для этого в ней содержится внушительный ассортимент особых белков — ионных каналов. Классификация их основана на типе пропускаемых ионов: выделяют натриевые [4], калиевые [5], кальциевые, хлорные и другие каналы. Каналы способны открываться и закрываться, но делают они это только под действием определенного стимула. После завершения стимуляции каналы, как дверь на пружине, автоматически закрываются.
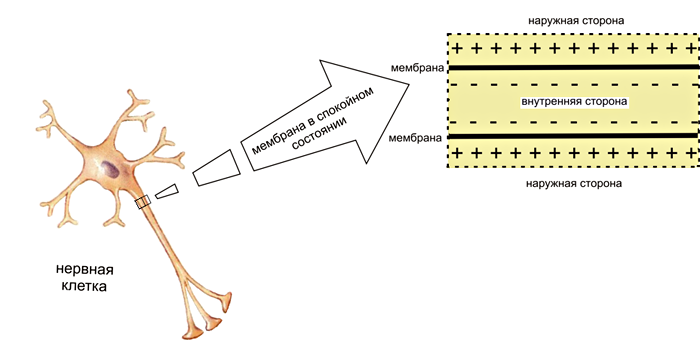
Рисунок 1. Поляризация мембраны. Внутренняя поверхность мембраны нервных клеток заряжена отрицательно, а наружная — положительно. Изображение схематическое, детали строения мембраны и ионные каналы не показаны. Рисунок с сайта dic.academic.ru.
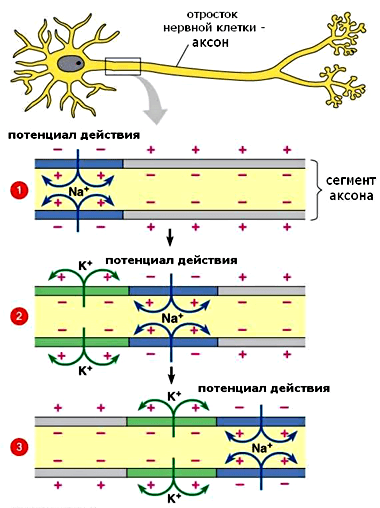
Рисунок 2. Распространение потенциала действия по нервному волокну. Синим цветом обозначена фаза деполяризации, зеленым — реполяризации. Стрелками показано направление движения ионов Na+ и К+. Рисунок с сайта cogsci.stackexchange.com.
Стимул — как звонок желанного гостя в дверь: он звонит, дверь открывается и гость заходит. Стимулом может быть и механическое воздействие, и химическое вещество, и электрический ток (посредством изменения мембранного потенциала). Соответственно, и каналы есть механо-, хемо- и потенциал-чувствительные. Как двери с кнопкой, нажать которую могут только избранные.
Итак, под действием изменения мембранного потенциала определенные каналы открываются и пропускают ионы. Это изменение может быть разнообразным в зависимости от заряда и направления движения ионов. В случае, когда положительно заряженные ионы поступают в цитоплазму, происходит деполяризация — кратковременная смена знака зарядов по разные стороны мембраны (на внешней стороне устанавливается отрицательный заряд, а на внутренней — положительный) (рис. 2). Приставка «де-» означает «движение вниз», «снижение», то есть поляризация мембраны уменьшается, и числовое выражение отрицательности потенциала по модулю снижается (например, с изначального −70 мВ до −60 мВ). Когда же в клетку входят отрицательные ионы или выходят наружу положительные, происходит гиперполяризация [6]. Приставка «гипер-» означает «чрезмерность», и поляризация, наоборот, становится более выраженной, а МПП становится еще более отрицательным (с −70 мВ до −80 мВ, например).
Но небольших сдвигов МП недостаточно для генерации импульса, который будет распространяться вдоль по нервному волокну. Ведь, по определению, потенциал действия — это волна возбуждения, распространяющаяся по мембране живой клетки в виде кратковременой смены знака потенциала на небольшом участке (рис. 2). По сути это та же деполяризация, но в бóльших масштабах и волнообразно распространяющаяся вдоль нервного волокна. Для достижения этого эффекта служат потенциал-чувствительные ионные каналы, которые очень широко представлены в мембранах возбудимых клеток — нейронов и кардиомиоцитов. Первыми при запуске потенциала действия открываются натриевые (Na+) каналы, что приводит к входу в клетку этих ионов по градиенту концентрации: ведь снаружи их было существенно больше, чем внутри. Те значения мембранного потенциала, при которых открываются деполяризирующие каналы, называются порогом и действуют как спусковой крючок (рис. 3) [6].
Точно так же потенциал и распространяется: при достижении пороговых значений соседние потенциал-чувствительные каналы открываются, порождая быструю деполяризацию, которая распространяется всё дальше и дальше по мембране. В случае, если деполяризация не была достаточно сильной и порог не был достигнут, массового открывания каналов не происходит, и сдвиг мембранного потенциала остается локальным событием (рис. 3, обозначение 4).
Потенциал действия, как и любая волна, имеет и нисходящую фазу (рис. 3, обозначение 2), которая называется реполяризацией («ре-» означает «восстановление») и заключается в восстановлении исходного распределения ионов по разные стороны клеточной мембраны. Первое событие в этом процессе — открывание калиевых (K+) каналов. Хотя ионы калия тоже заряжены положительно, их движение направлено наружу (рис. 2, зеленый участок), поскольку равновесное распределение этих ионов противоположно Na+ — калия много внутри клетки, а в межклеточном пространстве мало*. Таким образом, отток положительных зарядов из клетки уравновешивает количество положительных зарядов, поступивших в клетку. Но чтобы полностью вернуть возбудимую клетку в начальное состояние, должен активироваться натрий-калиевый насос, транспортирующий натрий наружу, а калий внутрь.
* — Справедливости ради стоит уточнить, что натрий и калий — главные, но не единственные ионы, принимающие участие в формировании потенциала действия. В процессе также задействован поток отрицательно заряженных хлоридных (Cl−) ионов, которых, так же как и натрия, больше вне клетки. Кстати, у растений и грибов потенциал действия и вовсе в значительной степени основан на хлоре, а не на катионах. — Ред.
Каналы, каналы и еще раз каналы
Утомительное объяснение деталей закончилось, так что вернемся к теме! Итак, мы выяснили главное — импульс действительно не возникает просто так. Он генерируется путем открывания ионных каналов в ответ на стимул в форме деполяризации. Причем деполяризация должна быть такой величины, чтобы открыть достаточное количество каналов для смещения мембранного потенциала до пороговых значений — таких, которые запустят открывание соседних каналов и генерацию настоящего потенциала действия. Но ведь водители ритма в сердце обходятся без каких-либо внешних стимулов (посмотрите видео в начале статьи!). Как им это удается?
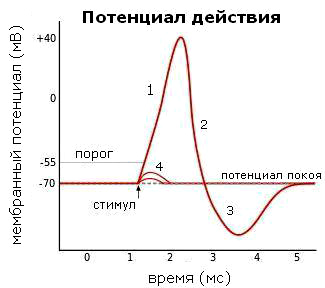
Рисунок 3. Изменения мембранного потенциала при различных фазах потенциала действия. МПП равен −70 мВ. Пороговое значение потенциала равно −55 мВ. 1 — восходящая фаза (деполяризация); 2 — нисходящая фаза (реполяризация); 3 — следовая гиперполяризация; 4 — допороговые смещения потенциала, которые не привели к генерации полноценного импульса. Рисунок из «Википедии».
Помните, мы говорили, что существует впечатляющее многообразие каналов? Их и правда не счесть: это как иметь в доме отдельные двери для каждого гостя, да еще управлять входом и выходом визитеров в зависимости от погоды и дня недели. Так вот, существуют такие «двери», которые называются низкопороговыми каналами. Продолжая аналогию со входом гостя в дом, можно представить, что кнопка звонка расположена довольно высоко, и чтобы позвонить, нужно сначала встать на порожек. Чем выше находится эта кнопка, тем выше должен быть порог. Порогом выступает величина мембранного потенциала, и для каждого типа ионных каналов этот порог имеет свое значение (например, для натриевых каналов это −55 мВ; см. рис. 3).
Так вот, низкопороговые каналы (например, кальциевые) открываются при совсем небольших смещениях значения мембранного потенциала покоя. Чтобы достать до кнопки этих «дверей», достаточно встать просто на коврик перед дверью. Еще одно интересное свойство низкопороговых каналов: после акта открывания/закрывания они не могут открыться вновь сразу же, но лишь после некоторой гиперполяризации, которая выводит их из неактивного состояния. А гиперполяризация, кроме тех случаев, о которых мы говорили выше, возникает еще и в конце потенциала действия, как его последняя фаза (рис. 3, обозначение 3), вследствие чрезмерного выхода ионов K+ из клетки.
Итак, что мы имеем? При наличии низкопороговых кальциевых (Ca2+) каналов (НКК) генерировать импульс (или потенциал действия) становится проще после прохождения предыдущего импульса. Незначительное изменение потенциала — и каналы уже открыты, пропускают катионы Ca2+ внутрь и деполяризируют мембрану до такого уровня, чтобы сработали каналы с более высоким порогом и запустили масштабное развитие волны ПД. В конце этой волны гиперполяризация вновь переводит инактивированные низкопороговые каналы в состояние готовности [7].
А если бы не было этих низкопороговых каналов? Гиперполяризация после каждой волны ПД снижала бы возбудимость клетки и ее способность генерировать импульсы, ведь при таких условиях для достижения порогового потенциала нужно было бы впустить в цитоплазму намного больше положительных ионов. А в присутствии НКК достаточно лишь небольшого смещения мембранного потенциала, чтобы запустить всю последовательность событий. Благодаря деятельности низкопороговых каналов повышается возбудимость клеток и быстрее восстанавливается состояние «боевой готовности», необходимое для генерации энергичного ритма.
Но и это еще не всё. Порог у НКК хотя и маленький, но есть. Так что же смещает МПП даже до такого низенького порога? Мы же выяснили, что пейсмейкеры ни в каких внешних стимулах не нуждаются?! Так вот у сердца для этого есть смешные каналы. Нет, правда. Они так и называются — funny channels (от англ. funny — «смешной», «забавный» и channels — каналы). Почему смешные? Да потому что большинство потенциал-чувствительных каналов открывается при деполяризации, а эти — чудаки — при гиперполяризации (при де-, наоборот, закрываются). Относятся эти каналы к семейству белков, пронизывающих мембраны клеток сердца и ЦНС и носящих совсем уж серьезное название — управляемые циклическими нуклеотидами гиперполяризационно-активируемые каналы (HCN — hyperpolarization-activated cyclic nucleotide-gated), поскольку открытие этих каналов облегчается при взаимодействии с цАМФ (циклическим аденозинмонофосфатом). Вот и нашелся недостающий фрагмент в этом пазле. HCN-каналы, открытые при значениях потенциала, близких к МПП, и пропускающие внутрь Na+ и K+, сдвигают этот потенциал до значений низкого порога. Продолжая нашу аналогию — стелят недостающий коврик. Так весь каскад открываний/закрываний каналов повторяется, зацикливается и ритмически самоподдерживается (рис. 4) [8].
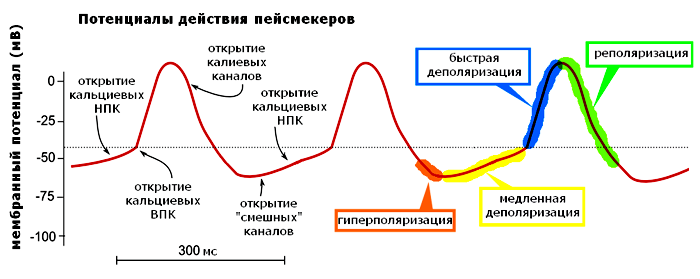
Рисунок 4. Пейсмейкерный потенциал действия. НПК — низкопороговые каналы, ВПК — высокопороговые каналы. Штриховая линия — пороговое значение потенциала для ВПК. Разными цветами показаны последовательные стадии потенциала действия.
Итак, проводящая система сердца состоит из клеток-пейсмейкеров (водителей ритма), которые способны автономно и ритмически генерировать импульсы путем открывания и закрывания целого набора ионных каналов. Особенность пейсмейкерных клеток — наличие в них таких типов ионных каналов, которые смещают потенциал покоя к пороговому сразу после того, как клетка достигнет последней фазы возбуждения, что позволяет непрерывно генерировать потенциалы действия.
Благодаря этому сердце так же автономно и ритмически сокращается под действием импульсов, распространяющихся в миокарде по «проводам» проводящей системы. Причем собственно сокращение сердца (систола) приходится на фазу быстрой деполяризации и реполяризации пейсмейкеров, а расслабление (диастола) — на медленную деполяризацию (рис. 4). Ну а общую картину всех электрических процессов в сердце мы наблюдаем на электрокардиограмме — ЭКГ (рис. 5) [9].
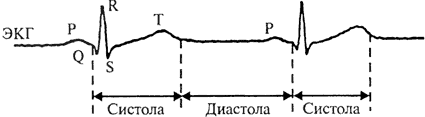
Рисунок 5. Схема электрокардиограммы. Зубец Р — распространение возбуждения по мышечным клеткам предсердий; комплекс QRS — распространение возбуждения по мышечным клеткам желудочков; сегмент ST и зубец T — реполяризация мышцы желудочков. Рисунок из [6].
Калибровка метронома
Ни для кого не секрет, что подобно метроному, частота отстукиваний которого находится во власти музыканта, сердце может биться чаще или реже. Таким музыкантом-настройщиком у нас выступает вегетативная нервная система, а ее регулирующими колесиками — адреналин (в сторону учащения сокращений) и ацетилхолин (в сторону уменьшения). Интересно, что изменение частоты сердечных сокращений происходит в основном за счет укорочения или продления диастолы. И это логично, ведь время срабатывания самой сердечной мышцы довольно тяжело ускорить, намного проще изменить время ее отдыха. Поскольку диастоле отвечает фаза медленной деполяризации, то и регуляция должна осуществляться путем влияния на механизм ее протекания (рис. 6). На самом деле так и выходит. Как мы обсуждали раньше, медленная деполяризация обеспечивается деятельностью низкопороговых кальциевых и «смешных» неселективных (натрий-калиевых) каналов. «Приказы» вегетативной нервной системы адресованы преимущественно этим исполнителям.
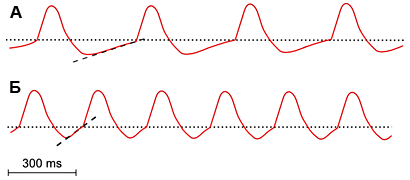
Рисунок 6. Медленный и быстрый ритм изменения потенциалов пейсмейкерных клеток. При увеличении продолжительности медленной деполяризации (А) ритм замедляется (показано штриховой линией, сравните с рис. 4), тогда как ее уменьшение (Б) приводит к учащению разрядов.
Адреналин, под действием которого наше сердце начинает колотиться как сумасшедшее, открывает дополнительные кальциевые и «смешные» каналы (рис. 7А). Взаимодействуя с рецепторами β1*, адреналин стимулирует образование из АТФ цАМФ (вторичного посредника), который в свою очередь активирует ионные каналы. Вследствие этого в клетку проникает еще больше положительных ионов, и деполяризация развивается быстрее. В результате время медленной деполяризации сокращается, и ПД генерируются чаще.
* — Структуры и конформационные перестройки активированных G-белоксопряжённых рецепторов (в т.ч. адренорецепторов), участвующих во множестве физиологических и патологических процессов, описаны в статьях: «Новый рубеж: получена пространственная структура β2-адренорецептора» [10], «Рецепторы в активной форме» [11], «β-Адренорецепторы в активной форме» [12]. — Ред.
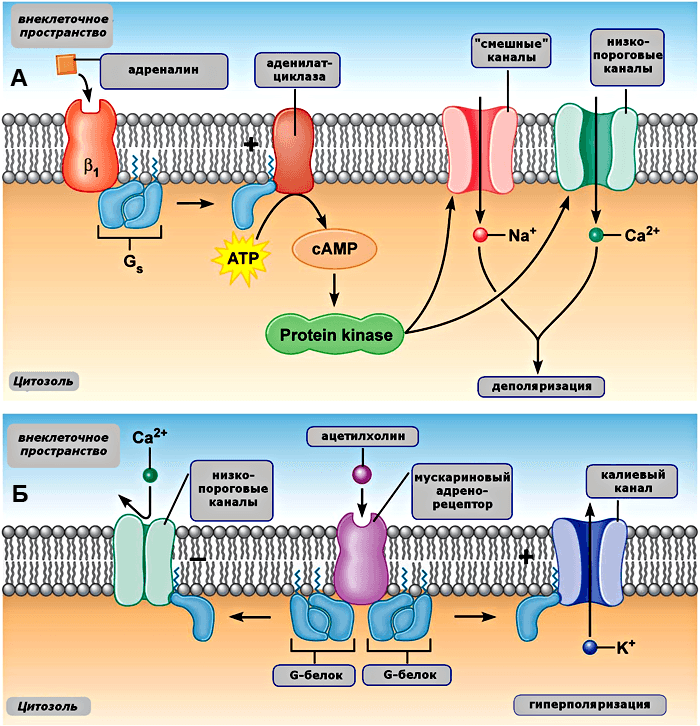
Рисунок 7. Механизм симпатической (А) и парасимпатической (Б) регуляции деятельности ионных каналов, вовлеченных в генерацию потенциала действия пейсмейкерных клеток сердца. Пояснения в тексте. Рисунок из [13].
Другой тип реакции наблюдается при взаимодействии ацетилхолина со своим рецептором (также находящимся в мембране клеток). Ацетилхолин — «агент» парасимпатической нервной системы, которая, в отличие от симпатической, позволяет нам расслабиться, замедлить сердцебиение и спокойно наслаждаться жизнью. Так вот, активированный ацетилхолином мускариновый рецептор запускает реакцию преобразования G-белка, который угнетает открытие низкопороговых кальциевых каналов и стимулирует открытие калиевых (рис. 7Б). Это приводит к тому, что в клетку положительных ионов (Ca2+) заходит меньше, а выходит (K+) больше. Всё это принимает форму гиперполяризации и замедляет генерацию импульсов [13].
Выходит, что наши пейсмейкеры хоть и обладают автономностью, но не освобождены от регуляции и корректировки со стороны организма. Если нужно, мы мобилизуемся и будем быстрыми, а если бежать никуда не нужно — расслабимся.
Ломать — не строить
Чтобы понять, насколько «дóроги» организму те или иные его элементы, ученые научились их «выключать» [14]. Например, блокирование низкопороговых кальциевых каналов сразу приводит к заметным нарушениям ритма: на ЭКГ, записанных на сердце таких подопытных животных, заметно удлинение интервала между сокращениями (рис. 8А), а также наблюдается снижение частоты пейсмейкерной активности (рис. 8Б) [15]. Пейсмейкерам тяжелее сдвинуть мембранный потенциал до пороговых значений. А если «выключить» каналы, которые активируются гиперполяризацией? В этом случае у эмбрионов мышей вообще не сформируется «зрелая» пейсмейкерная активность (автоматизм). Печально, но такой эмбрион умирает на 9–11 день своего развития, как только сердце делает первые попытки сокращаться самостоятельно [16]. Получается, что описанные каналы играют критическую роль в функционировании сердца, и без них, как говорится, никуда.
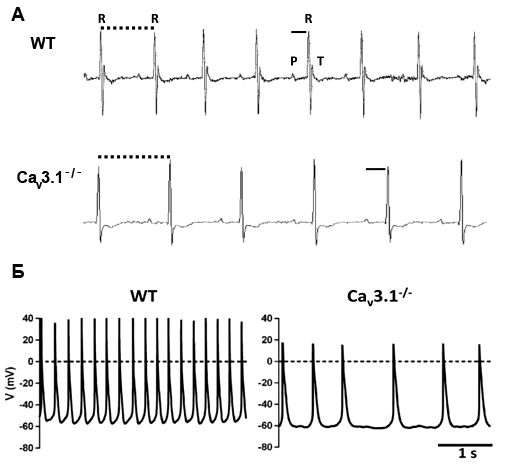
Рисунок 8. Последствия блокирования низкопороговых кальциевых каналов. А — ЭКГ. Б — ритмическая активность клеток-пейсмейкеров атриовентрикулярного узла* нормального сердца мыши (WT — wild type, дикий тип) и мыши генетической линии с отсутствующим подтипом Cav3.1 низкопороговых кальциевых каналов. Рисунок из [15].
* — Предсердно-желудочковый узел контролирует проведение импульсов, в норме генерируемых синусно-предсердным узлом, в желудочки, а при патологии синоатриального узла становится главным водителем сердечного ритма.
Вот такая небольшая история о маленьких винтиках, пружинках и грузиках, которые, будучи элементами одного сложного механизма, обеспечивают согласованную работу нашего «метронома» — водителя ритма сердца. Остается только одно — поаплодировать Природе, что смастерила такой чудо-прибор, который служит нам верой и правдой каждый день и без наших усилий!
Литература
- Эшкрофт Ф. Искра жизни. Электричество в теле человека. М.: Альпина Нон-фикшн, 2015. — 394 с.;
- Википедия: «Потенциал действия»;
- Формирование мембранного потенциала покоя;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Калиевый канал in silico;
- Шуба Я.М. Основи молекулярної фізіології іонних каналів: Навчальний посібник. Киев: Наукова думка, 2010. — 446 с.;
- Perez Reyes E. (2003). Molecular physiology of low voltage activated T-type calcium channels. Physiol. Rev. 83, 117–161;
- Досенко В.Е. Молекулярна фізіологія системи кровообігу. Лекция в Институте физиологии им. Богомольца НАН Украины;
- Автор главного треугольника медицины;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Рецепторы в активной форме;
- биомолекула: «β-Адренорецепторы в активной форме»;
- Stanfield C.L., Germann W.J. Principles of Human Physiology (4th Edition). NY: Pearson, 2010. — 848 p.;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Marger L., Mesirca P., Alig J., Torrente A., Dübel S., Engeland B. et al. (2014). Functional roles of Cav1.3, Cav3.1 and HCN channels in automaticity of mouse atrioventricular cells. Channels. 5, 251–261;
- Stieber J., Herrmann S., Feil S., Löster J., Feil R., Biel M. et al. (2003). The hyperpolarization-activated channel HCN4 is required for the generation of pacemaker action potentials in the embryonic heart. Proc. Natl. Acad. Sci. USA. 100, 15235–15240..





