
Клинические исследования в России — истории успеха
07 февраля 2019
Клинические исследования в России — истории успеха
- 3626
- 0
- 9
сайт sp13dzm.ru
-
Автор
-
Редактор
-
Рецензент
В предыдущей, третьей, статье этого цикла мы писали о том, как проводятся клинические исследования во всем мире. В этой статье мы сосредоточимся на России: расскажем историю становления фармацевтической промышленности нашей страны с начала 20 века и до наших дней. Для более полной картины мы зададим несколько вопросов наиболее успешным российским CRO (contract research organisation, контрактным исследовательским организациям). Их ответы органично дополнят данные аналитических источников.
Клинические исследования

В статьях спецпроекта мы подробно расскажем о том, что такое клинические исследования, кто и как их проводит и с какими трудностями можно столкнуться при выводе нового лекарства на фармацевтический рынок.
Независимый рецензент спецпроекта — Алексей Водовозов, врач-терапевт высшей категории, медицинский журналист. Регулярно выступает с научно-популярными лекциями и ведёт блог «Смотровая военврача».
Партнер спецпроекта — компания «Атлант Клиникал»: международная контрактно-исследовательская организация, занимающаяся проведением клинических исследований.
Требование органов здравоохранения обязательно проводить клинические исследования (КИ) при фармацевтической разработке появилось относительно недавно. В зарубежных странах начали говорить об этом после талидомидовой трагедии (о которой мы писали в первой статье цикла [1]), а реальная система появилась в 1996 году, после утверждения стандарта GCP (Good Clinical Practice).
Рынок клинических исследований в России стал развиваться в начале 2000-х. Этому способствовали стабилизация экономической обстановки в РФ и мировой тренд переноса клинических исследований из развитых в развивающиеся страны [2]. Политические изменения последних пяти лет с одной стороны способствуют формированию российского рынка лекарственных средств, с другой — дестабилизируют обстановку на этом рынке. При этом некоторые тенденции, характерные для российского рынка КИ, начали складываться еще в первой половине ХХ века: например, многие российские фармкомпании и сейчас предпочитают проводить клинические исследования своими силами [3]. К тому же еще в Российской Империи начала развиваться наука фармакология, которой уделяли большое внимание и в СССР, благодаря чему в современной России высок уровень подготовки специалистов, проводящих КИ.
Развитие фармацевтической индустрии: от последних лет Российской Империи до распада СССР
В последние годы в Российской Империи было около 100 больших и маленьких независимых фармацевтических фирм. Их продукция регулировалась Медицинским советом МВД, который анализировал все лекарственные препараты, изготовленные и проданные в Империи. Он регулировал создание и функционирование аптек, например, требуя, чтобы те были открыты круглосуточно и бесплатно выдавали лекарства неимущим [4].
Ассортимент лекарств в последние годы Российской Империи был похож на американский позднего XIX — раннего XX веков. Но, хотя в Российской Империи действовало около 300 химических предприятий, в основном продукция была растительного происхождения [5]. Химически синтезированные препараты импортировали из Германии и Швейцарии. Химическое и растительное сырье — хинин, йод, кокаин, опиум и опиаты — тоже импортировали. Вакцины производили на отдельных предприятиях.

Рисунок 1. Основоположник советской фармакологии Николай Павлович Кравков, чей учебник «Основы фармакологии» выдержал 14 изданий (с 1904 до 1933 гг.) и стал базовым руководством для нескольких поколений отечественных фармакологов.
Развивалась фармакология, которую в 1904 году фармаколог профессор Николай Кравков (рис. 1) определил как «учение о действии на организм вообще всех веществ, способных растворяться в нем и всасываться». Применение лекарств основывалось на клинической практике, и уже тогда говорили о побочных действиях каждого препарата, дозировках, влиянии на пациента в зависимости от его состояния и возраста.
Во время Первой мировой войны российская фармацевтическая индустрия стала расти. Этому способствовали необходимость импортозамещения, субсидии со стороны правительства, иностранные и народные вложения, а также конфискация немецких фирм. Эти процессы наблюдались и в США во время Первой мировой войны.
Положение российской фармотрасли ухудшилось после того, как большевики захватили власть в 1917 году [6]. Произошла национализация фармацевтических фабрик и аптек, многие из них остались без должного менеджмента во время гражданской войны. Началась реорганизация физико-химической промышленности. Государство обеспечивало ее финансирование, контролировало импорт, экспорт и цены на продукцию.
Многие сформированные в то время заводы существуют и по сей день. Примером может стать созданный по решению Главфармздрава в январе 1919 г. химико-фармацевтический завод №10, ныне — «Нижфарм». Другой пример — химико-фармацевтический завод «Акрихин», построенный для производства противомалярийного препарата.
К 1940 году был налажен промышленный выпуск почти всех известных в то время важнейших лекарственных средств — болеутоляющих, снотворных и сульфаниламидных (рис. 2 и 3).
В годы Великой Отечественной войны были открыты химико-фармацевтические заводы в городах Урала и Западной Сибири. Так, в 1942 году «Акрихин» эвакуировали на Урал и на его базе создали Ирбитский химико-фармацевтический завод.
Страна нуждалась в квалифицированных кадрах, поэтому параллельно с созданием заводов учреждали и различные научно-исследовательские центры химической фармакологии.
Благодаря централизованному контролю выпуска и применения лекарственных средств в СССР были не так выражены некоторые проблемы, распространенные в то время на Западе — например, вывод на рынок сомнительных препаратов, реклама и навязывание ненужных лекарств. С другой стороны, такая система несколько замедляла разработку и вывод на рынок новых лекарств.

Рисунок 4. Михаил Давыдович Машковский, выдающийся специалист в области создания, классификации и описания лекарственных средств и фармакотерапии. Автор книги «Лекарственные средства (пособие по фармакотерапии для врачей)», ставшей настольной книгой советских и российских врачей.
В 1942 году вышла первая книга Михаила Машковского (рис. 4) «Новые лекарственные препараты (справочник для врачей)», написанная им еще до войны, в 1939 году, и ставшая предтечей известной книги «Лекарственные средства (пособие по фармакотерапии для врачей)». Первое издание «Лекарственных средств» вышло в 1954 году, а в 2010 году увидело свет уже 16-е издание этой книги. В ней описаны лекарственные средства, их механизм действия и условия рационального использования, сравнительные характеристики препаратов, примеры взаимодействия с другими препаратами и возможные побочные эффекты. Этот колоссальный труд основан на клинической практике. По словам член-корреспондента РАМН В.П. Фисенко, Михаил Машковский боролся за честность научной работы, а не за интересы компании-производителя лекарственных средств, и сформулировал основные положения по лекарственной безопасности страны.
В качестве примера клинического исследования того времени можно привести исследование пенициллина, который советским ученым пришлось разрабатывать в годы Великой Отечественной войны [7]. Наибольший вклад в эти разработки внесли Зинаида Виссарионовна Ермольева [8] и ее сотрудница Тамара Иосифовна Балезина (рис. 5). «Устав от напрасного ожидания, весной 1942 года я с помощью друзей стала собирать плесени из самых различных источников. Те, кто знал о сотнях неудачных попыток Флори найти свой продуцент пенициллина, относились к моим опытам иронически. 93-м по счету образцом был грибок, случайно выросший в другой лаборатории на культуре микроорганизма, над которым там работали. Этот штамм был идентифицирован как “близкий к Penicillium crustosum”. Из него мы и стали получать советский препарат, который назвали “пенициллин-крустозин ВИЭМ”», — вспоминала Балезина. Сначала сотрудники Всесоюзного института экспериментальной медицины (ВИЭМ) убедились в безопасности препарата, проверив на себе. Первые клинические испытания прошли в госпитале под Сталинградом на 25 безнадежных септических раненых — и все выжили. После этого штамм Ермольевой и Балезиной стал основой для производства советского пенициллина [9].
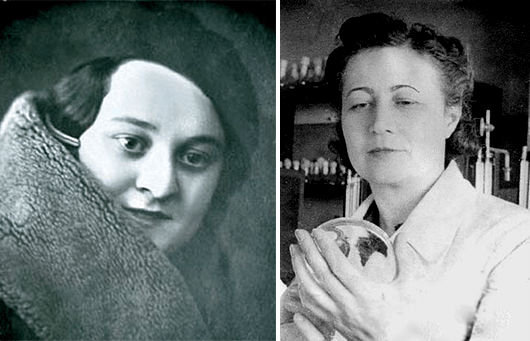
Рисунок 5. Тамара Балезина (слева) и Зинаида Ермольева (справа) — создательницы отечественного пенициллина
В 1947 году был создан Всесоюзный научно-исследовательский институт антибиотиков (ВНИИА) и начато промышленное производство пенициллина, стрептомицина, грамицидина и других препаратов. Для расширения производства требовалась серьезная научная база, поэтому также открыли новые научно-исследовательские институты — Всероссийский научно-исследовательский технологический институт антибиотиков и ферментов медицинского назначения (ВНИТИАФ) в Ленинграде и Научно-исследовательский институт по изысканию новых антибиотиков в Москве.
В итоге, к 1950 году был организован выпуск синтетических гормональных препаратов, инсулина, наганина, синтетического папаверина, кофеина и других — всего свыше 50 наименований. Производство лекарственной продукции продолжало расти. В начале 1950-х годов выпускали уже более 65 новых лекарственных средств, а в девятой пятилетке (1971–1975 гг.) к ним добавились еще 180 наименований лекарств. Были созданы Всесоюзный научно-исследовательский институт технологии кровезаменителей и гормональных препаратов и Научно-исследовательский институт по биологическим испытаниям химических соединений.

Рисунок 6. Фотография из архива завода «Акрихин» (1960-е годы)
Несмотря на быстрый рост, индустрия лекарств в советской России не была главной отраслью экономики. В 1960 году был создан СЭВ — Совет экономической взаимопомощи. Между странами СЭВ существовало разделение труда: СССР поставлял компоненты для производства медикаментов, а взамен получал готовую фармацевтическую продукцию из Польши, Чехословакии, ГДР, Венгрии и Болгарии. Впоследствии KRKA, «Гедеон Рихтер» и «Польфарма» выросли именно из-за специализации внутри СЭВ.
В конце 1980-х в СССР разрабатывали и тестировали новые препараты. Конечно, это еще не были клинические исследования в нынешнем понимании, но многие черты современной практики выработали уже тогда — например, добровольцы подписывали формальное согласие, похожее на современное. В качестве примера можно привести исследования амиксина 1989 года на здоровых добровольцах с помощью двойного слепого метода [10].

Рисунок 7. Фотография из архива завода «Акрихин» (1980-е годы)
К 1991 году в фармацевтической промышленности России накопилось много проблем. Среди них — серьезное отставание технического уровня отечественных фармпредприятий от мирового и недостаточное финансирование. Отрасль ориентировалась на выпуск несложных лекарственных средств и препаратов первой необходимости. Доля инновационных препаратов в советской фармацевтической индустрии была низка — в 1975–1985 годах она составляла всего 2% от объема выпускаемой продукции, при этом в ведущих западных странах на инновационные препараты уже тогда приходилось более половины объема производства. 1 января 1988 году все химико-фармацевтические производства перевели на полный хозяйственный расчет и самофинансирование, что, с одной стороны, привело к значительному спаду производства, с другой — открыло новый этап развития фармацевтической промышленности России.
После распада СССР:
кризис 1990-х, возрождение 2000-х
Разделение труда в рамках СЭВ привело к тому, что после распада СССР в России оказались сосредоточены практически все крупнотоннажные предприятия — «Акрихин», «Микроген», предприятия объединения «Биосинтез», — в то время как заводы, выпускающие готовые лекарственные формы, оказались за границей нового государства. Из-за нехватки ресурсов в 1994 году остановилось производство 57 препаратов. К 1997 году объем товарной продукции упал в сопоставимых ценах почти в два раза [11].
Со второй половины 1990-х годов положение фармацевтической промышленности стало улучшаться. Россия постепенно входила в мировое экономическое пространство, и крупные иностранные компании начали обращать внимание на российский рынок, покупать и поглощать предприятия. Так, корпорация ICN Pharmaceuticals (сейчас это Bausch Health Companies Inc.) поглотила пять предприятий в Санкт-Петербурге, Курске, Томске, Йошкар-Оле и Челябинске. В 2000-х годах в России начали производство уже упомянутые выше «Гедеон Рихтер», KRKA, а также «Герофарм» и «Сервье». Транснациональная компания «Солвей» совместно с российским научно-производственным объединением «Петровакс» создали совместное предприятие по производству вакцин. В 2005 г. немецкий фармацевтический концерн «Штада» стал владельцем «Нижфармы», а «Акрихин» стал собственностью «Гедеона Рихтера».

Рисунок 8. Завод «Гедеон Рихтер — Рус» — дочернее предприятие ОАО «Гедеон Рихтер» (Венгрия), расположенный в 100 км к югу-востоку от Москвы, вблизи районного центра Егорьевск.
В конце 1990-х годов и в ранних 2000-х в России открыли офисы международные CRO (контрактные исследовательские организации), среди которых первыми были MB Quest (Pharm-Olam International Group of Companies) (1997), PSI (1997), Quintiles (1997). Чуть позже открыла российский офис компания ClinStar (в 2000 году), PharmaNet (в 2004), Covance (в 2006). В это же время на рынок стали выходить отечественные организации, проводящие клинические исследования, такие как «Русклиник» (2000), Synergy Research Group (2002), «Смуз Драг Девелопмент» (2004), ОСТ (2005), «Атлант Клиникал» (2007). Ситуация на рынке тогда была благоприятная, чему также способствовал общемировой тренд роста спроса на клинические исследования в развивающихся странах. Этот тренд все еще присутствует, хотя до сих пор подавляющее большинство клинических исследований проводится в развитых странах [12].
Иностранные инвестиции в российскую фармотрасль за 2006–2007 годы составили около 1 млрд долларов [11].
Состояние мирового и отечественного рынков КИ мы подробно разобрали в статье «Клинические исследования: рыночный вопрос» [2]. В этой статье опишем взгляд на российский рынок клинических исследований изнутри, для чего специально опросили представителей шести отечественных компаний, занимающихся клиническими исследованиями. Основываясь на количестве работников, наличии сертификата международного стандарта системы менеджмента качества и repeat business rate (количестве постоянных заказчиков), мы расположили компании, принявшие участие в опросе, в следующем порядке: от уже крупных компаний к тем, у которых еще все впереди.
| Название CRO | Число сотрудников | Наличие сертификата международного стандарта системы менеджмента качества ISO | В каких странах открыты офисы | Repeat business rate (количество постоянных заказчиков) | Спонсоры |
|---|---|---|---|---|---|
| «Атлант Клиникал» | 150 | 9001:2008 и 9001:2015 | РФ, Украина, Великобритания, Германия, США | 95% | Из стран Центральной Европы, России, Индии и США |
| «Смуз Драг Девелопмент» | 70 | 9001:2008 и 9001:2015 | РФ, Венгрия, Эстония, США | 99% | Преобладают российские спонсоры |
| ОСТ | 180 | нет | РФ, Украина, Беларусь, Грузия, Болгария, Латвия, США | 80% | 50% российских, 50% зарубежных |
| «Русклиник» | 10 | 9001:2008 | РФ | 75% | 50% российских, 50% зарубежных (большинство — из стран Европы) |
| «ИФАРМА» | 60 | нет | РФ | 65% | 50% российских, 50% зарубежных |
| «КлинФармИнвест» | 25 | нет | РФ | 90% | Из России, Европы и стран СНГ |
Как и когда началась история российских CRO?
«Русклиник»
«Как и с чего все началось, достоверных сведений не сохранилось. Давно это было. Если об этом написать в общих чертах, то было все примерно так: однажды в 1999 году встретились три человека, ну, скажем, на конференции. Один из них был научным сотрудником и занимался экспериментальными исследованиями по разработке препаратов, второй — работал на фармацевтическом заводе технологом, третий — был врачом и занимался клиническими исследованиями. И вот они встретились, и каждый рассказал о том, чем занимается, что знает и умеет. И, в общем, так получилось, что каждый по отдельности знает часть того, что вместе называется регистрацией лекарственных средств. Стали делиться своим опытом, помогать другим, и из этого получилась консалтинговая компания.
Условия для рынка такого бизнеса были оптимальными: в начале 2000-х в России стало регистрироваться много препаратов, в основном иностранных. Отечественная отрасль постепенно забуксовала, стала понемногу разваливаться, и на рынок активно пошли иностранные препараты. Работа по регистрации препаратов — комплексная: это и подготовка регистрационного досье, и проведение доклинических испытаний, и, конечно, клинические исследования.
Первым проектом стала регистрация отечественного антибиотика, аналога зарубежного. В качестве КИ проводили исследование по биоэквивалентности. Исследование небольшое, но сразу же возникла проблема с добровольцами: про клинические исследования знали немногие, найти добровольцев было непросто, пришлось в качестве добровольцев использовать сотрудников компании.
Следующий проект был по регистрации европейского препарата — тогда сотрудники впервые увидели уровень работы в Европе, увидели настоящее досье на препарат, где отчеты по доклиническим исследованиям занимали целую папку, исследования по клиническим исследованиям целых три папки (отдельная папка по каждой фазе исследования), а фармацевтическая часть — пять папок! Изучали этот материал, как наглядное пособие. Потом при разработке собственных документов, в том числе по клиническим исследованиям, брали это досье за образец».
«Смуз Драг Девелопмент»
«При выходе на рынок CRO в 2004 году мы увидели “нишу” — было много западных и несколько российских компаний, которые работали на уровне западных стандартов по западным ценам, и ряд российских, которые работали по минимальным требованиям для регистрации препаратов в РФ. Видя растущие требования к проведению исследований в России, а также растущий спрос российских компаний к проведению исследований на мировом уровне, мы поставили задачу — создать CRO полного цикла с мировыми стандартами качества и доступным уровнем стоимости. В результате на нас обратили внимание не только российские, но и многие региональные представительства лидирующих западных компаний для проведения локальных регистрационных исследований в РФ».
ОСТ
«Компания ОСТ появилась в 2005 году. Тогда ситуация на рынке клинических исследований России была настолько благоприятна, насколько это возможно для амбициозных профессионалов своего дела. На фоне устойчивой экономики и относительно спокойной политической обстановки все трудности становления носили локальный характер.
Первые заказы мы получили из США, что мгновенно заставило компанию работать в соответствии с международными стандартами. За короткое время компетентность команды ОСТ выросла до уровня передовых стран. Нам стало очевидно, что Россия как территория для проведения клинических исследований может на равных конкурировать с Европой и Америкой, поэтому четко нацелились на глобальный рынок».
«Атлант Клиникал»
«Компания зарождалась как локальное нишевое CRO, предоставлявшее лишь несколько видов услуг: проектный менеджмент, мониторинг и регуляторное сопровождение. Команда состояла из 25–30 сотрудников в 2007 году. Офис находился в Москве. Так компания функционировала до 2012 года. В те годы особых трудностей не возникало, так как CRO было мало, а российский рынок был достаточно привлекателен для международных компаний».
«КлинФармИнвест»
«Идея создать компанию, организующую проведение клинических исследований, возникла в 2010 году у специалистов, клинических фармакологов, которые к этому моменту уже в течение десяти лет активно принимали участие в исследованиях на базе клинических центров Ярославля».
«ИФАРМА»
«Компания была создана осенью 2012 года и уже в первые годы работы стала соисполнителем по десяти государственным контрактам в области трансфера зарубежных разработок, организации и проведения клинических исследований инновационных лекарственных средств. В 2013 году мы запустили 11 клинических исследований по сахарному диабету, шизофрении, гепатиту С, меланоме, раку легкого, раку яичников и профилактике тромбоэмболических осложнений в ортопедии».
Последние 10 лет: политические изменения, импортозамещение, исследования биоэквивалентности — мнения представителей CRO
Из-за изменений российского законодательства после 2012 года наблюдался спад количества клинических исследований [3]. Однако заявленная в 2014 году в России политика импортозамещения привела к их общему росту (рис. 9).
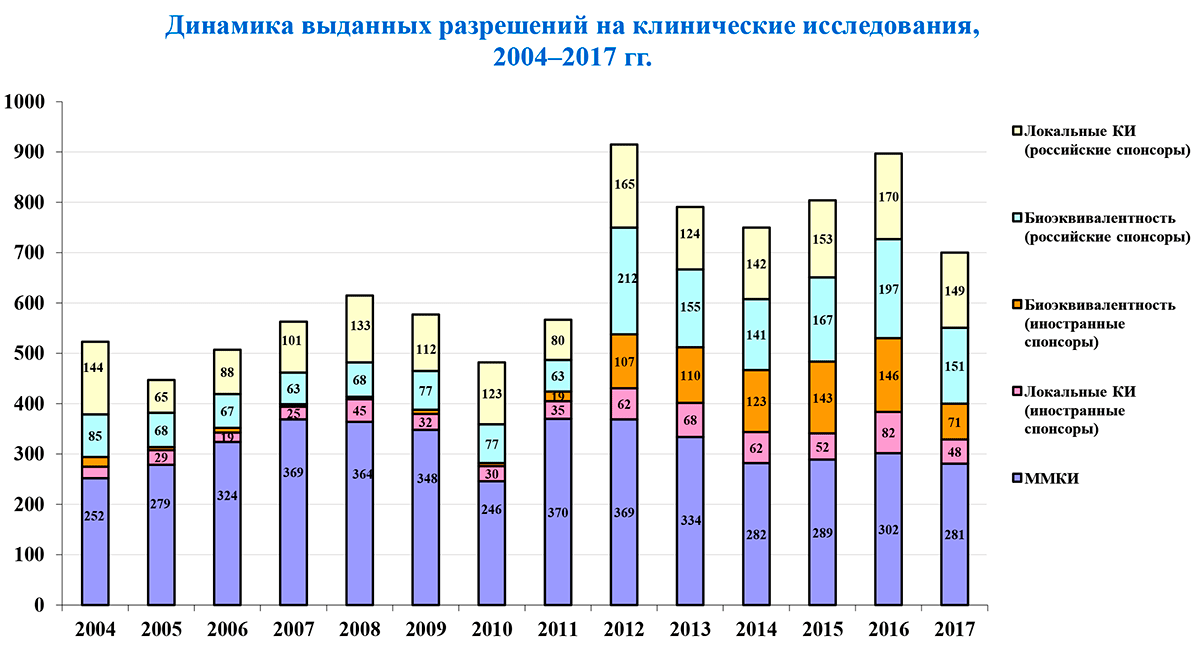
Рисунок 9. Динамика выданных разрешений на клинические исследования
Согласно бюллетеню АОКИ, в 2017 году число разрешений на проведение КИ снова значительно сократилось (табл. 2).
| Выданные разрешения на клинические исследования: 2017 г. vs. 2016 г. | ||||||
|---|---|---|---|---|---|---|
| Год | Всего | ММКИ | Локальные КИ (иностранные спонсоры) | Биоэквивалентность (иностранные спонсоры) | Локальные КИ (российские спонсоры) | Биоэквивалентность (российские спонсоры) |
| 2017 | 700 | 281 | 48 | 71 | 149 | 151 |
| 2016 | 897 | 302 | 82 | 146 | 197 | 170 |
| 2017 г. vs. 2016 г., % | –22,0% | –7,0% | –41,5% | –51,4% | –24,4% | –11,2% |
Этот тренд касается всех секторов, кроме международных многоцентровых КИ (ММКИ) и исследований биоэквивалентности российских спонсоров и во многом связан с изменениями в законодательстве и требованием обязательной проверки иностранных производственных площадок российскими инспекторами. По данным РБК, самая распространенная причина, по которой российские инспекторы отказывают фармкомпании в выдаче сертификата, — несоответствия в документации [14]. Число выданных разрешений на исследования биоэквивалентности иностранных спонсоров в первом полугодии 2018 года на 66,3% меньше, чем в первой половиной 2016 года, что связано с освобождением некоторых форм дженериков от обязательного исследования на «терапевтическую эквивалентность».
«Атлант Клиникал»
«Монополизации рынка нет, но тенденция такова, что в последнее время Big pharma выбирает провайдера на уровне HQ (headquarters), и именно с этим провайдером они работают на уровне всех подразделений и географии. Это затрудняет вход в проекты локальных CRO в различных регионах.
Количество исследований биоэквивалентности увеличивается за счет нескольких тенденций. Во-первых, безусловно, это импортозамещение. Вторая важная мировая тенденция — это снижение стоимости лекарственных средств для плательщиков, что способствует увеличению количества дженериков, а это, в свою очередь, влечет за собой увеличение количества клинических исследований по биоэквивалентности. Текущая международная обстановка, безусловно, сказывается на нашей работе. Мы видим сокращение числа международных проектов, в которых российские компании помогают международным спонсорам проводить клинические исследования в России. Также небольшие биотехнологические компании стараются проводить исследования в других регионах, так как видят определенные риски, связанные с нестабильной геополитической обстановкой.
Так как за последние три года нам удалось покорить европейский рынок, мы можем перенести ряд КИ на европейские площадки, тем самым минимизировав риски наших клиентов. В то же время в силу импортозамещения гораздо активнее стал развиваться отечественный фармкластер, и количество локальных клиентов также начало возрастать».
«Смуз Драг Девелопмент»
«Стоит признать, что рынок клинических исследований в России является довольно волатильным (изменчивым — Ред.): за десять лет мы наблюдали 3–4 кризиса. Экономика делает свое дело и отсеивает не успевших адаптироваться к реальности. Сегодня рынок находится в состоянии здоровой конкуренции, так как экономические изменения последнего года пережили в основном самые устойчивые компании. Еще одним подтверждением здоровой рыночной среды является появление всё новых компаний, работающих в сфере КИ».
ОСТ
«Мы видим снижение количества проводимых КИ на территории России на фоне роста числа молодых контрактно-исследовательских организаций. Происходит расслоение рынка на откровенно демпинговые предложения с сомнительным качеством услуг и на предложения от опытных компаний, за качество услуг которых нужно платить. Требования к подаваемым данным постоянно ужесточаются, и регулятор всё чаще отказывает в проведении КИ из-за плохо подготовленной документации или не принимает результаты уже проведенных КИ. Такая политика уже приносит свои плоды: спонсоры готовы платить за качество, поэтому можно смело говорить о перспективности российского рынка».
«ИФАРМА»
«На рынке клинических исследований очень высокая конкуренция, и, как и в любой другой области, без инновационного продукта или предложения не представляется возможным выйти в топ. В связи с этим, мы сразу начали заниматься исследованиями российских инновационных лекарственных препаратов. Согласно “Информационно-аналитическому бюллетеню” Ассоциации организаций по клиническим исследованиям (АОКИ) [13], “ИФАРМА” стала лидером по количеству исследований российских инновационных препаратов и получила аккредитацию Центра коллективного пользования “Сколково”.
Программа импортозамещения также сильно повлияла на работу: отечественных препаратов в разработке стало заметно больше».
«Русклиник»
«Компания уже давно на рынке, но, конечно, постоянно приходится меняться, учиться, адаптироваться. В начале компания больше занималась регистрацией лекарственных средств, и клинические исследования были в основном регистрационные, то есть в том объеме, в каком требуется для регистрации. Потом, помимо регистрации, появились проекты только по клиническим исследованиям или по разработке новых препаратов. Первое изменение было в 2005 году, когда появился ГОСТ о надлежащей клинической практике. Многие заказчики приходили в CRO выполнять клинические исследования, потому что их теперь надо было делать по правилам, а это оказалось намного сложнее. Протоколы клинических исследований писали по образцу иностранных, большое внимание уделяли обоснованию исследования, научной доказательности, статистической достоверности, выборку пациентов рассчитывали по статистической гипотезе. Потом в 2010 году начал действовать 61 ФЗ о лекарственных средствах, изменились правила регистрации препаратов и опять же требования по проведению клинических исследований. Клинических исследований стало больше — снова увеличился поток заказов».
«КлинФармИнвест»
«В 2017 году компания вошла с состав Ярославского фармацевтического кластера — “Ассоциации современной фармацевтической промышленности и инновационной медицины Ярославской области”, объединяющей 16 участников, в числе которых фармацевтические компании, компании инновационной медицины и образовательные организации высшего и среднего профессионального образования».
Что является мерилом успеха для российской CRO?
«Атлант Клиникал»
«К 2015 году компания значительно расширилась, мы открыли офисы в Мюнхене и Лондоне — первые офисы за пределами РФ. В этот же год получили сертификат ISO 9001:2008. “Атлант Клиникал” стала первой российской CRO, которая получила этот сертификат, подтверждающий высочайшее качество работы. Уже в 2016-м открыли офисы в Санкт-Петербурге, Киеве и Нью-Джерси. В этом же году мы получили статус предпочтительного поставщика услуг КИ в двух крупнейших международных фармкомпаниях. В 2018-м подтвердили стандарты — ISO 9001:2015.
Мы гордимся высоким уровнем repeat business rate — 95%, а также тем, что мы собрали команду профессионалов, каждый из которых несет ответственность за качество нашей работы. Это подтверждено многочисленными аудитами и сертификатом ISO 9001:2015».
«Смуз Драг Девелопмент»
«Для нас успех делится на научный прогресс и успех в бизнесе.
В данный момент мы работаем над несколькими проектами, которые имеют все шансы закончиться регистрацией новых препаратов-блокбастеров. Нам очень важно сделать все возможное, чтобы помочь развить научную основу для вывода этих препаратов на международный уровень и повлиять на развитие медицины.
С точки зрения бизнеса, мерилом успеха является передовой технологический уровень компании, рост оборотов, возможность вкладывать в развитие и максимальная автоматизация процессов. В рамках этой части нашей деятельности мы гордимся разработанными системами электронных дневников и CTMS (Clinical Trial Management System).
Кроме того, мы гордимся тем, что к нам возвращаются сотрудники, которые решили попробовать себя в других CRO. Это значит, что мы хорошо работаем с самым ценным, что есть в CRO, — людьми. Кроме того, нам важен интерес крупных CRO к слиянию с нашей компанией. Этот индикатор позволяет нам оценить реальную рыночную значимость наших вложений в компанию и еще раз убедиться в том, что наш бизнес-проект успешен».
ОСТ
«Когда-то в рамках ОСТ существовал отдел, который занимался автоматизацией проводимых компанией клинических исследований. Сейчас это отдельная самостоятельная компания Data MATRIX, которая в ближайшие месяцы выпустит на российский и американский рынки собственную платформу Matrix Cloud для работы со всей информацией по клиническому исследованию, проектным командам, логистике, бюджету и пр., состоящую из нескольких модулей.
Другое направление работы, которое в 2015 году стало самостоятельным, — это венчурный инвестиционный фонд Primer Capital. Сейчас в его портфеле 10 биотех-стартапов со всего мира».
«ИФАРМА»
«В нашей сфере принято считать “мерилом” успеха количество одобренных клинических исследований. Так, по данным АОКИ за 2017 г., “ИФАРМА” вошла в топ-3 CRO России наряду с международными компаниями. Для нас это большое достижение и признание со стороны индустрии.
Особым предметом гордости является наш опыт внедрения адаптивного дизайна в разработку лекарственных препаратов. Это позволило в короткие сроки вывести на российский рынок два инновационных препарата для лечения сахарного диабета и ВИЧ-инфекции».
«Русклиник»
«Нашу успешность можно охарактеризовать двумя условиями: это постоянство заказчиков и сложность выполняемых проектов. Особыми достижениями, наверное, является регистрация орфанных препаратов».
Какие проекты интересны российским CRO?
В 2017 году по количеству разрешенных исследований лидировали онкология, ревматология и неврология (табл. 3). Эта тройка не меняется уже с 2015 года (в 2014 году лидирующие позиции занимали онкология, эндокринология и ревматология) [15]. По сравнению с 2016 годом, в 2017 году увеличилось число исследований в области гематологии, кардиологии и сердечно-сосудистых заболеваний. При этом примерно в два раза сократилось число исследований по психиатрии, ВИЧ, гепатиту С и туберкулезу [13].
| Распределение ММКИ по терапевтическим областям, 2017 г. | |||
|---|---|---|---|
| Терапевтическая область | Число ММКИ | Доля от общего числа (%) | Планируемое число участников |
| Онкология | 68 | 24,2% | 5141 |
| Ревматология | 28 | 10,0% | 2422 |
| Неврология | 24 | 8,5% | 2622 |
| Онкогематология | 22 | 7,8% | 833 |
| Гематология | 20 | 7,1% | 301 |
| Эндокринология | 19 | 6,8% | 3255 |
| Гастроэнтерология | 16 | 5,7% | 1048 |
| Пульмонология | 15 | 5,3% | 2700 |
| Кардиология и ССЗ | 15 | 5,3% | 3957 |
| Инфекционные заболевания (за искл. ВИЧ/ВГС/ТБ) | 10 | 3,6% | 744 |
| Психиатрия | 8 | 2,8% | 673 |
| Нефрология | 8 | 2,8% | 1269 |
| ВИЧ/ВГС/ТБ | 6 | 2,1% | 447 |
| Дерматология | 4 | 1,4% | 167 |
| Гинекология | 4 | 1,4% | 436 |
| Оториноларингология | 4 | 1,4% | 251 |
| Хирургия | 3 | 1,1% | 300 |
| Офтальмология | 2 | 0,7% | 138 |
| Аллергология | 2 | 0,7% | 155 |
| Гериатрия | 2 | 0,7% | 140 |
| Иммунология | 1 | 0,4% | 30 |
| Всего | 281 | 100,0% | 27 029 |
Отдельно хотелось бы упомянуть орфанные препараты — фармацевтические средства, разработанные для лечения редких заболеваний. По официальным данным в России живут 40 000 человек, страдающих редкими (орфанными) заболеваниями; более половины из них — дети [16]. Большинству таких пациентов ежедневно нужны дорогие лекарства. Несмотря на то, что для орфанных препаратов предусмотрены особые регуляторные правила (например, они не должны проходить обязательные клинические испытания на территории РФ), после введения в 2010 году закона об импортозамещении положение пациентов значительно ухудшилось. В России зарегистрировано 226 орфанных заболеваний, а внимание системы здравоохранения сосредоточено только на 28. Это означает, что те люди, чьих болезней нет среди этих 28, медицинскую помощь получат только в случае инвалидности.
По информации издания «Фармацевтический вестник», в 2019 году отечественные производители орфанных препаратов получат поддержку государства — как материальную, так и регуляторную (ускоренную процедуру регистрации препаратов) [17]. Однако разработка таких препаратов технически сложна и не всегда выгодна производителям, поэтому производители лекарств говорят о необходимости дополнительной поддержки со стороны государства. В пример ставят опыт США, где в 1983 году был принят закон об орфанных препаратах [18]. В нем предусмотрены гранты для производителей, налоговые вычеты на проведение клинических исследований, помощь в составлении протоколов испытаний, ускоренное рассмотрение и исключительные права на рынке сроком на 7 лет. В итоге сейчас США являются лидером в производстве таких препаратов.
«Атлант Клиникал»
«Конечно, мы находимся под влиянием мировых трендов. Например, доминирующей терапевтической областью в мировой практике сегодня является онкология, соответственно, и наша страна не исключение».
«Смуз Драг Девелопмент»
«У нас в работе сейчас находятся разные проекты: проекты биоэквивалентности, исследования 1, 2 и 3 фаз, наблюдательные программы. Все проекты интересны нам. Однако мы бы хотели отметить работы по орфанным заболеваниям в педиатрии. Для нас это самые важные проекты, так как они касаются детей. Мы очень заинтересованы в выводе этих препаратов на рынок».
«ИФАРМА»
«Кроме клинических исследований, каждое из которых является уникальным и интересным проектом, в настоящее время мы работаем над развитием интернет-платформы по клиническим исследованиям ClinLine для взаимодействия пациентов/добровольцев, врачей-исследователей и организаторов КИ».
«Русклиник»
«Самый интересный проект всегда — это разработка новых препаратов. Например, разработка современных препаратов на основе клеточных технологий».
Перспективен ли рынок клинических исследований в России?
«Атлант Клиникал»
«Российский рынок относится к числу развивающихся, и в целом его можно назвать перспективным. Однако есть ряд особенностей. Например, ранее доминировало число исследований, проводимых международными и иностранными компаниями, сегодня же увеличивается доля проектов российских игроков фармацевтического рынка. С развитием политики импортозамещения происходит изменение структуры спонсоров клинических исследований, что ведет к изменению объемов рынка в целом. Международные компании позволяли рынку развиваться не только количественно, но и качественно: уровень сложности проводимых исследований был высоким, возможности компаний — большими. Отчасти этим обусловлен высокий уровень качества проводимых исследований в России. Если внутренним спонсорам удастся поддержать данный уровень качества исследований, то однозначно перспективность российского рынка сохранится вне зависимости от внешних условий. Регуляторные органы со своей стороны держат этот момент под контролем, постоянно ужесточая требования к проводимым исследованиям».
«Смуз Драг Девелопмент»
«Россия теряет свой статус быстро развивающегося региона, но все равно аккумулирует большое количество исследований как из-за рубежа, так и внутри страны. Пик еще впереди и, скорее всего, он придет с раскрытием России как рынка онкологических исследований для малых и средних зарубежных фармацевтических компаний».
ОСТ
«Уже который год мы наблюдаем снижение количества проводимых клинических исследований на территории России на фоне роста числа молодых контрактно-исследовательских организаций. Закономерно, что в таких условиях происходит расслоение рынка на откровенно демпинговые предложения с сомнительным качеством услуг и на предложения от опытных компаний, за качество услуг которых нужно платить. Сейчас, когда требования к подаваемым данным постоянно ужесточаются, регулятор всё чаще отказывает в проведении КИ из-за плохо подготовленной документации или, что еще неприятнее, не принимает результаты уже проведенных КИ. Такая политика уже приносит свои плоды: спонсоры готовы платить за качество, поэтому можно смело говорить о перспективности российского рынка».
«ИФАРМА»
«Любой рынок перспективен, если правильно действовать. В России сейчас идет программа импортозамещения и локализации фармацевтических производств, поэтому российский рынок был и остается в фокусе нашего внимания».
«Русклиник»
«Российский рынок даже очень перспективен. Клинические исследования нужно проводить не только для лекарственных препаратов, но и для медицинских изделий, биологически активных добавок, других продуктов, позиционирующих себя как лечебные. Продукт нужно постоянно развивать, для этого также проводят исследования: пострегистрационные, для расширения показаний, для выявления новых свойств и нежелательных явлений. Обязательно надо проводить исследования для подтверждения эффективности, если в свое время (когда еще можно было) лекарственное средство регистрировали без проведения клинического исследования.
Конкуренция на рынке КИ, конечно же, высокая, но тем интереснее работать — всегда чему-то учишься, улучшаешь».
Какие планы у российских CRO на ближайшие 3–5 лет?
«Атлант Клиникал»
«Продолжать развиваться, расти, покорять новые рынки, увеличивать объемы и сложность выполняемых исследований. Один наш клиент как-то сказал: “С простым исследованием я бы к вам и не пришел”. Мы зарекомендовали себя как профессионалы, способные выполнить самые трудные задачи, и наш план — оставаться всегда самым профессиональным и качественным CRO не только в России, но и за ее пределами».
«Смуз Драг Девелопмент»
«Развиться в Центральной Европе, куда только недавно вышли, и значительно расширить международное партнерство с фармацевтическими компаниями. Продолжать работать на рынке клинических исследований в России и Восточной Европе, приводить сюда новые компании и помогать российским компаниям выходить на европейские рынки через наш венгерский офис. В планах у нас есть мысли по развитию в глобальное CRO».
ОСТ
«В ближайшие годы планируем усилить свое присутствие в Центральной Европе и Америке».
«ИФАРМА»
«Расширение нашего присутствия на рынке ЕАЭС, развитие электронных сервисов в клинических исследованиях, внедрение пациент-ориентированного подхода при планировании и реализации исследований, а также выведение на российский рынок новых эффективных и безопасных препаратов».
«Русклиник»
«Составить конкуренцию глобальным CRO и проводить международные многоцентровые клинические исследования».
«КлинФармИнвест»
«Планируем открыть филиалы в странах ЕАЭС, выйти на рынок Восточной Европы».
Заключение
На развитие клинических исследований в России влияет множество факторов. Ему способствует общемировой тренд постепенного переноса КИ из развитых в развивающиеся страны, среди которых Россия — перспективный кандидат, во многом благодаря высокому уровню подготовки кадров. Рост исследований биоэквивалентности в России связан и с мировой тенденцией удешевления препаратов, и с государственной политикой импортозамещения.
С другой стороны, в последние 3–4 года наблюдается спад количества клинических исследований, проводимых в России, главная причина которого — не только изменения в законодательстве и повышенный контроль, усложняющие получение разрешения на КИ и регистрацию препаратов, но и общая нестабильность, которую ощущают участники рынка. Этим во многом объясняется желание российских компаний выходить за пределы страны и открывать филиалы в странах Европы.
Литература
- С миру по нитке: как соединились компоненты клинического исследования;
- Клинические исследования: рыночный вопрос;
- Путь к тысячам аптек начинается с одной молекулы;
- Conroy M.S. (2004). Russian-American pharmaceutical relations, 1900–1945. Pharm. Hist. 46, 143–166;
- Зеленые лекарства будущего;
- Родионова И.А. и Овчаров Е.Г. (2001). Фармацевтическая промышленность российской Федерации. «Вестник Российского университета дружбы народов. Серия: Экономика». 1, 70–79;
- Шифрин М.Е. (2006). Гонка вооружений, или Война с микромиром. «Вокруг Света»;
- Волкова О.В. (2003). Смерть обходит задворки науки. «Гамма»;
- Свиридов А. (2015). Самое яркое впечатление военного времени: «Представляете, ни одной ампутированной ноги!». «Коммерсантъ Наука». 3, 7;
- Чижов Н.П., Смольская Т.Т., Бойченко П.И., Лукьянова Р.И., Тесленко В.М., Бавра Г.П. и др. (1990). Клинические исследования переносимости и интерферониндуцирующей активности «Амиксина». «Вопросы вирусологии». 5, 411–414;
- Балашов А.И., Жиглявская О.А., Заболотная Н.С. (2008). Особенности и проблемы развития фармацевтической промышленности в РФ. «Высшая школа экономики»;
- Chalachew Alemayehu, Geoffrey Mitchell, Jane Nikles. (2018). Barriers for conducting clinical trials in developing countries- a systematic review. Int J Equity Health. 17;
- Информационно-аналитический бюллетень АОКИ №16. (2017). АОКИ;
- Парфененкова М. (2016). Проверки по российским стандартам. РБК;
- Информационно-аналитический бюллетень АОКИ №10. (2014). АОКИ;
- Саркисов Д. (2018). «Чем реже болезнь — тем она дороже». «Лента.ру»;
- Отечественные производители орфанных препаратов получат поддержку государства. (2018). «Фармацевтический вестник»;
- Белогубцева С. (2018). Нештучный продукт. Закупка лекарств для редких заболеваний из федерального бюджета даст шанс фармбизнесу. dp.ru.









