
Кишечный тайм-менеджмент
04 мая 2023
Кишечный тайм-менеджмент
- 1943
- 0
- 9
Работа кишечника тесно связана с нашими биоритмами и наоборот
-
Автор
-
Редакторы
Тема взаимодействия нашего организма с населяющими его бактериями стала особенно популярной в последние годы. Наш кишечник — не исключение, ведь в нем обитают миллиарды различных микроорганизмов. И они не простые соседи — кишечная микробиота способна влиять на всю нашу жизнь: от ощущения радости и появления астмы до планирования режима дня!
Микробиота — это совокупность живых микроорганизмов, населяющих тело человека. Среди прочего она включает стрептококки, лактобациллы, бифидобактерии в тонком кишечнике, а также бифидобактерии, бактероиды, пропионибактерии, пептострептококки, вейонеллы, эубактерии, фузобактерии, катенобактерии и др. в толстом кишечнике. С телом человека они находятся в симбиотических отношениях. Наиболее многочисленная кишечная микробная популяция обитает в толстой кишке и содержит примерно 1014 бактериальных клеток. Это в десятки раз превышает общее количество клеток всего нашего организма [1].
Два основных типа кишечных бактерий — это Bacteroidetes и Firmicutes, которые составляют примерно 90–95% бактериальной популяции в кишечнике здорового человека (рис. 1). В небольшом количестве в кишечнике также содержатся Proteobacteria, Cyanobacteria, Verrucomicrobia и Actinobacteria, количество которых в сумме может быть примерно от 1 до 10% [2].

Рисунок 1. Микрофотографии представителей двух преобладающих типов кишечной микрофлоры (~90–95%) — фирмикутов (Faecalibacterium prausnitzii — слева) и бактероидов (Bacteroides fragilis — справа). Фирмикуты включают в себя множество видов бактерий, многие из которых — условные патогены, их в организме должно быть как можно меньше (яркий пример такого патогена — золотистый стафилококк). Другое дело — бактероиды, они считаются положительными героями кишечника, и их должно быть большинство. Соотношение фирмикутов и бактероидов — важный фактор здоровья микробиоты.
Соотношение фирмикутов и бактероидов в кишечнике влияет на здоровье всего организма. Фирмикуты могут включать как полезные микроорганизмы, так и множество патогенных (золотистый стафилококк, клостридии и др.). Например, Clostridium difficile (тип Firmicutes) является основной причиной диареи [3–5]. Бактероиды в свою очередь объединяют более безобидные виды, часто отвечающие за процессы брожения. Именно бактероиды должны преобладать в кишечной микрофлоре для ее нормального функционирования. Еще одна многочисленная положительная группа бактерий — это бифидобактерии Bifidobacterium sp. (тип Actinobacteria). Они могут оказывать противовоспалительный эффект и помогают сохранять целостность кишечного барьера.
Стресс может увеличивать количество клостридий, что негативно сказывается на организме. Соотношение типов бактерий может кардинально меняться и по другим причинам (переезд, недостаток сна, смена питания и т.д.), при этом существенное увеличение одного типа всегда ведет к снижению количества другого, что может создать риск дисбиоза — дисбаланса, который будет влиять на здоровье. В первую очередь это, конечно же, соотношение бактероидов и фирмикутов. Резкий рост отрицательной микробиоты может стать причиной многих заболеваний — от депрессии до дерматита. Примерный теоретически правильный состав микробиоты и соотношение видов кишечных бактерий показаны в таблице 1.
| Виды микроорганизмов | Возраст человека, годы | ||
|---|---|---|---|
| <1 | 1–60 | >60 | |
| Бифидобактерии | 1010–1011 | 109–1010 | 108–109 |
| Лактобактерии | 106–107 | 107–108 | 106–107 |
| Бактероиды | 107–108 | 109–1010 | 1010–1011 |
| Энтерококки | 105–107 | 105–108 | 106–107 |
| Фузобактерии | <106 | 108–109 | 108–109 |
| Эубактерии | 106–107 | 109–1010 | 109–1010 |
| Пептострептококки | <105 | 109–1010 | 1010 |
| Клостридии | ≤ 103 | ≤ 105 | ≤ 106 |
| E. coli типичные | 107–108 | 107–108 | 107–108 |
| E. coli лактозонегативные | <105 | <105 | <105 |
| Другие условно патогенные энтеробактерии | <104 | <104 | <104 |
| Стафилококки (сапрофитный, эпидермальный) | ≤ 104 | ≤ 104 | ≤ 104 |
| Дрожжеподобные грибы рода Candida | ≤ 103 | ≤ 104 | ≤ 104 |
При этом надо понимать, что нормальная микробиота — это в основном полезные бактерии и немного плохих. В таблице, например, мы видим, что положительных бифидобактерий, лактобактерий, бактероидов — большинство. В то время как негативных клостридий, E. coli, лактозонегативных и других патогенов должно быть в разы меньше.
Микробиота у каждого уникальна и меняется в течение жизни под воздействием самых разных внешних факторов, таких как окружающая среда, диета, прием лекарств и т.д. Кишечная микробиота в свою очередь влияет на мозг, легкие, печень, кожу и другие органы, в связи с чем появились такие термины, как «ось кишечник—мозг» или «ось кишечник—легкие». Например, кишечник играет важную роль в выработке серотонина, необходимого для грамотной работы мозга и центральной нервной системы — ЦНС (рис. 2) [6], [7]. Также микробиота влияет на созревание микроглии в ЦНС, что важно для функционирования нервной системы и может отражаться на патогенезе заболеваний [8–10].
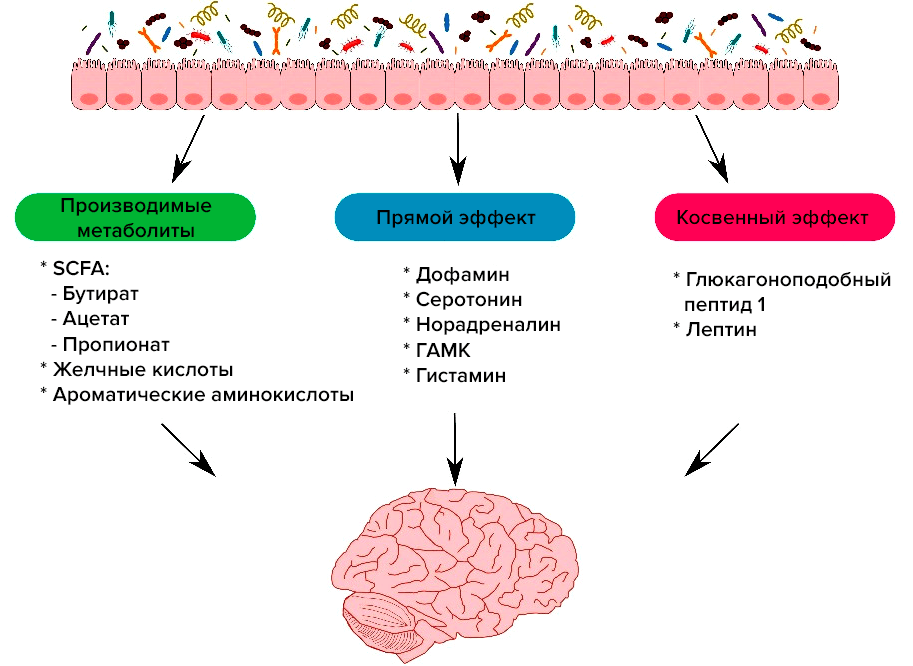
Рисунок 2. Как кишечник влияет на работу центральной нервной системы. На рисунке показано, как микробиота кишечника может взаимодействовать с ЦНС несколькими путями: через продуцируемые метаболиты, такие как короткоцепочечные жирные кислоты (SCFAs) [11], напрямую, выделяя нейротрансмиттеры, такие как дофамин и серотонин [12–14], и косвенно, влияя на высвобождение кишечных гормонов [15–17].
[41], рисунок адаптирован
Многие исследования показали, что кишечник играет большую роль в формировании иммунитета человека (а точнее, влияет на развитие аллергий, дерматита и астмы). Здесь работает принцип «все из детства». Будущее здоровье неразрывно связано с тем, какая обстановка окружала мать ребенка во время беременности, а также где сам ребенок рос, с какими микробами он сталкивался, каких животных трогал, что совал в рот и чем питался. Показатели здоровья человека, выросшего в мегаполисе, будут разительно отличаться от показателей людей из деревни. Одно из самых известных исследований на эту тему — сравнение иммунной реакции финнов и карелов [18]. По его завершении ученые выяснили, что иммунные показатели карелов значительно лучше благодаря более разнообразной среде обитания, в которой формируется богатый кожный микробиом [19]. Финские дети, реже сталкивающиеся с почвой, растениями и домашним скотом, напротив, демонстрировали скудное разнообразие кожных бактерий и гораздо чаще страдали атопией. Есть также и другие исследования, показывающие, что проживание человека в сельской местности благотворно влияет на здоровье, насыщая нас полезными бактериями-комменсалами. В частности, что контакт со скотом в три раза уменьшает риск проявления аллергии [20]. Важность собственной микробиоты в этом плане трудно переоценить, у здоровых людей она доказанно стимулирует иммунную систему, высвобождает провоспалительные цитокины IL-1β, IL-6 или TNF-α, тем самым моделируя иммунный ответ и защищая хозяина.
И это только вершина айсберга. Специалисты сегодня все чаще говорят о том, что человеческий микробиом практически вездесущ. Область его влияния не ограничивается ЦНС и иммунитетом (что уже немало), но распространяется на множество других систем организма (рис. 3).
На «Биомолекуле» публиковалось несколько прекрасных статей о кишечной микробиоте, ее влиянии на организм человека и даже о ее роли в лечении некоторых заболеваний. Среди них: «Новые функции кишечной микрофлоры»[21], «Чего от нас хотят микробы?» [22], «Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм» [23], «Кишечная микрофлора: третий нелишний в иммунотерапии рака» [24]. — Прим. ред.
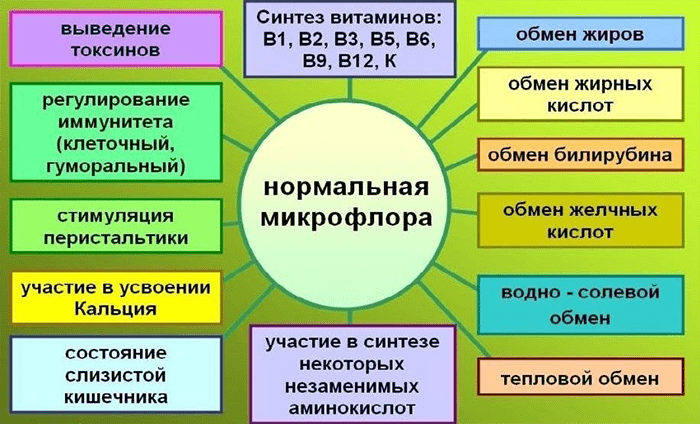
Рисунок 3. Нормальная микрофлора и ее функции в организме
Что формирует микробиом человека
Состав микробиоты закладывается в младенчестве и начинает формироваться как только ребенок появляется на свет, изменяясь с течением времени. Наиболее важную роль здесь играют способ родоразрешения и тип вскармливания, а также первое время после родов.
Принято считать, что наилучший иммунитет у детей, рожденных естественным образом и вскормленных грудным молоком матери (рис. 4; более подробно об этом читайте в статье «Микробиом кишечника: мир внутри нас» [25]). Однако в последние годы появилось много перспективных способов выровнять микробиом и у малышей, рожденных через кесарево сечение и питавшихся смесью. Это более частый контакт с микробами на коже матери (метод кенгуру), обтирание влагалищными выделениями [26–28], прием пробиотиков с бифидобактериями [29] и т.д.
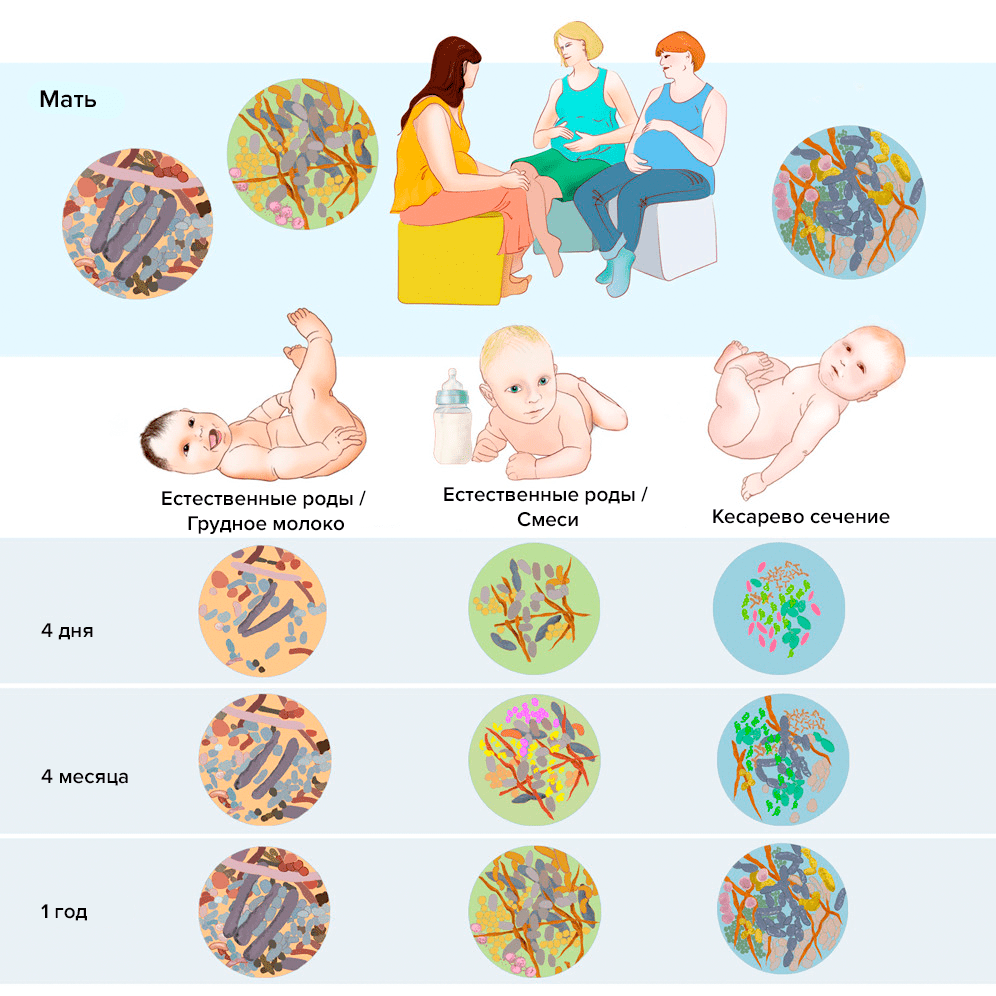
Рисунок 4. Изменение микробиоты младенцев в зависимости от способа родоразрешения и кормления. У ребенка, рожденного естественным путем и вскормленного грудным молоком, кишечная микробиота богата бактериями Prevotella, Sneathia, Lactobacillus, Bacteroidetes, Firmicutes и класса Clostridium: Clostridium, Ruminococcus, Faecalibacterium, Roseburia и Anaerostipe. Микробиота малыша после естественных родов, который питался смесью, содержит организмы родов Prevotella, Sneathia, Lactobacillus, Bacteroides fragilis, Staphylococcus. Бактериальный состав у ребенка, рожденного через кесарево сечение, в основном представлен родами Propionibacterium, Corynebacterium и Streptococcus.
[30], рисунок адаптирован
В более взрослом возрасте корректировать уже сложившийся микробиом не так просто, но некоторые факторы все же заметно влияют на состояние бактерий внутри нашего кишечника [30], [31].
Важную роль здесь, конечно же, играет рацион. Как мы уже упоминали, неверное соотношение бактерий Firmicutes и Bacteroides может стать причиной дисбиоза. Современная западная (в частности, американская) диета с высоким количеством насыщенных жиров, красного мяса и простых углеводов меняет микрофлору в сторону Firmicutes с уменьшением количества Bacteroides. Употребление продуктов с высоким содержанием сахара приводит к преобладанию протеобактерий и уменьшению бактероидов. В дальнейшем это может увеличивать риск воспалительных процессов в организме и снижать защитные свойства эпителия и слизистой оболочки [32]. Средиземноморская диета, напротив, пример полезного питания. Она отдает предпочтение большому количеству овощей и фруктов, ненасыщенных жиров и цельнозерновых продуктов с низким количеством красного мяса, что формирует здоровую микробиоту, когда бактерии типа Bacteroides преобладают над Firmicutes.
Еще один важный вопрос — это чрезмерное употребление антибиотиков, провоцирующее появление дисбиоза. К сожалению, большинство назначаемых препаратов являются антибиотиками широкого спектра действия, которые уничтожают как «хорошие», так и «плохие» бактерии [16], что в дальнейшем отрицательно сказывается на микрофлоре кишечника. И это только полбеды, поскольку выжившие патогены приобретают устойчивость к лекарствам и активно размножаются в опустевшей среде, заменяя чувствительные к антибиотикам штаммы. В наши дни гибель людей от, например, устойчивого к антибиотикам золотистого стафилококка уже не новость. Отрицательные бактерии постепенно адаптируются к новым антибиотикам, поэтому, проблема антибиотикорезистентности сейчас одна из главных в медицине. И отсутствие решения в теории грозит возвратом в век отсутствия антибактериальных препаратов. Ситуацию значительно усугубляет то, что многие люди в наши дни пьют антибактериальные препараты при малейшей простуде без назначения врача [33].
Наконец, один из основных факторов, влияющих на поведение микробиома во взрослом возрасте, — это наши циркадные ритмы. Нашему кишечнику важна не только еда, но и четкий распорядок дня. Ему требуется знать, во сколько мы будем есть, когда спать, как будет меняться наша суточная выработка гормонов и даже в каком часовом поясе мы находимся. Об этом и поговорим.
Наши биоритмы и микробиота
Размышляя о том, как можно улучшить здоровье собственного кишечника, важно помнить о цикличности взаимосвязи сна и микробиоты. Но не стоит забывать и про гигиену самого кишечника, поскольку у этой медали две стороны. Здоровый сон помогает кишечнику, а здоровый кишечник и налаженный по времени и качеству рацион — сну.
Нарушение циркадных ритмов происходит, когда сон или питание не синхронизированы с окружающей средой (циклы темноты/света), из-за чего начинается нарушение гомеостаза. Это в свою очередь влияет на выработку гормонов, которые связаны со сном и аппетитом. Нарушение режимов сна и питания может поменять выработку гормонов и, следовательно, ухудшить метаболизм. В результате образуется своеобразный снежный ком — одно тянет за собой другое.
Большую роль в синхронизации организма с окружающей средой играют «водители ритма» — факторы внешней среды, которые помогают внутренним часам подстраиваться под ее изменения. Наиболее значимые из них — это свет, температура, атмосферное давление, пищевые привычки, физические упражнения и медикаменты. Короткая продолжительность и фрагментация сна, отсутствие синхронизации с водителями ритма может привести к проблемам, вызванным активацией оси НРА (гипоталамо-гипофизарно-надпочечниковая ось). Поскольку ось HPA отвечает в том числе за стресс-реакцию (а отсутствие сна — это явный стресс), в ответ на ее активацию вырабатываются провоспалительные цитокины. В дальнейшем это может истощать микробную популяцию. Потеря сна отрицательно влияет на работу желудочно-кишечного тракта, поскольку его работа зависит как от синхронизации с сутками, так и от выработки гормонов, на работу которых уже в свою очередь могут повлиять кишечные бактерии [32], [34], [35]. В итоге нарушения циркадного ритма, например сменный график работы, негативно влияют на работу пищеварения, процессы обмена веществ и даже на аппетит. А пробиотические добавки (лактобациллы, бифидобактерии и др.), наоборот, могут помочь повысить субъективное качество сна.
Отдельно стоит упомянуть часто путешествующих людей, нередко страдающих джетлагом — нарушением сна и пищеварения. Все из-за того, что у них сбиваются циркадные ритмы. Таким образом происходит временная десинхронизация ритмов отдельных органов, что не может не сказаться на их работе. Частые сбои циркадных ритмов органов пищеварения в конечном счете нередко приводят к нарушению обмена веществ и ожирению.
Конечно, на работу кишечника влияет не только сон. Недавние исследования показали, что кишечная микробиота и ее метаболиты активно реагируют на суточные биоритмы с точки зрения циклов «кормление/голодание». Циклы «голодание/кормление» и физическая активность влияют на периферические циклы (в сердечно-сосудистой системе), регулирующие физиологию, включая гормональную секрецию, иммунный ответ и пищеварение. Главные гормоны голода, посылающие соответствующие сигналы в мозг — это лептин (уменьшает аппетит, его вырабатывают жировые клетки) и грелин (усиливает голод, вырабатывается в основном в желудке). Контроль и выработку лептина и грелина регулируют в первую очередь приемы пищи. Но и недостаток сна здесь тоже не остался в стороне, он снижает уровень лептина и увеличивает количество грелина. Поэтому при недосыпании лептин не может нормально сигнализировать мозгу о сытости, а грелин говорит нам продолжать есть больше. Это помогает объяснить, почему люди, которые регулярно недосыпают, чаще быстрее набирают вес и подвергаются более высокому риску ожирения.
Вместе кишечный микробиом и молекулярные циркадные ритмы скоординированно участвуют в обработке нервных сигналов, метаболизме, адипогенезе (образовании клеток жировой ткани — адипоцитов из стволовых клеток), воспалении, начале и прогрессировании некоторых заболеваний (например болезни Альцгеймера).
Практически в каждом органе нашего тела есть клетки, обладающие индивидуальным «молекулярным часовым механизмом». У млекопитающих это механизм саморегуляции, состоящий из взаимосвязанных транскрипционно-трансляционных петель обратной связи (TTFL). TTFL — это механизм отрицательной обратной связи, в котором выключение генов внутренних часов регулируется их собственными белковыми продуктами. TTFL состоят из положительных регуляторных элементов, которые способствуют транскрипции (считыванию гена, после чего клетка синтезирует определенный белок), и собственно белковых продуктов, которые ее подавляют. Как только в цитоплазме клетки накапливается достаточно белковых продуктов — транскрипция часовых генов останавливается и запускается лишь тогда, когда их белковые продукты расщепляются. Таким образом, в организме в течение суток часовые гены включаются и выключаются, а белковые продукты накапливаются и расщепляются ритмично, то есть по графику. При этом белки часовых генов, накапливаемые во время TTFL, управляют нижележащими генами, позволяя часовым генам создавать суточные ритмы в таких процессах, как, например, метаболизм. Эта петля и есть механизм, благодаря которому наш организм работает как часы, и мы синхронизируемся с 24-часовым циклом Земли [36].
У кишечной микробиоты своя важная роль в регуляции циркадных ритмов и нашей синхронизации с окружающей средой. Бактерии активно общаются с клетками стенки кишечника (а через них — с мозгом хозяина), выделяя вещества, действующие на желудочные энтерохромаффинные клетки, секретирующие гистамин. Сигнальные вещества бактерий являются прямыми аналогами наших собственных гормонов и нейромедиаторов. Кишечная микрофлора может производить норадреналин, дофамин, серотонин, тестостерон, гистамин, а также нейромедиатор гамма-аминомасляную кислоту (она ответственна за своевременное гашение процессов возбуждения в ЦНС и, возможно, помогает поддерживать нормальный сон и усваивать глюкозу) и белки-регуляторы аппетита (например, грелин и лептин) [37]. Более того, некоторые бактерии могут выделять бензодиазепины — вещества, оказывающие успокаивающее действие (среди их родственников, например, известный транквилизатор «Феназепам»). Ученые полагают, что все эти сигнальные молекулы очень древние и использовались бактериями для общения друг с другом еще в те времена, когда многоклеточные организмы только начинали свой эволюционный путь. То есть кишечная микрофлора выступает как дополнительная железа в организме человека.
Разнообразные микробные метаболиты кишечника (короткоцепочечные жирные кислоты, витамины группы В и другие) непрямым образом влияют на экспрессию генов. Это происходит при изменении состава метаболитов, который зависит от работы кишечных бактерий.
Последствия дисбаланса
Учитывая, что кишечная микрофлора так сильно влияет на нашу жизнь, неудивительно, что прослеживается определенное нарушение связи «кишечник — циркадные ритмы» и началом некоторых заболеваний. Малоподвижный образ жизни, западная диета с высоким содержанием жиров и рафинированных углеводов и низким содержанием клетчатки, а также поведение, способствующее нарушению естественных циклов сна/бодрствования (например, сменная работа, хроническое ограничение сна и джетлаг) сыграли свою роль в нынешней всемирной эпидемии избыточного веса/ожирения и сердечно-сосудистых заболеваний.
Первая проблема связана с тем, что при длительном нарушении человеком суточных ритмов содержание лептина (гормона сытости) снижается на 7–10% и возрастает показатель грелина (гормона голода). Это чревато перееданием, чему более подвержены женщины вследствие особенностей обмена веществ. А вот проблемы с сердцем и даже сахарный диабет могут появиться из-за хронического недосыпа, который снижает иммунную защиту организма [38]. У сменных работников (ветеринары, стюардессы, врачи, работники заводов и т.д.) более высокие показатели повышенного кровяного давления и выше распространенность диабета 2 типа по сравнению с дневными работниками.
Нынешние исследования показывают не только то, что состав кишечной микробиоты связан с изменениями нашей метаболической активности, но и что отдельные продукты метаболизма микроорганизмов воздействуют на физиологию организма и способны изменять патогенез некоторых заболеваний, в частности, оказывая влияние на способность организма расщеплять лекарственные препараты.
Наконец, последние научные разработки нашли связь состава кишечной микробиоты даже с проявлением депрессии [39]. Также существует много доказательств, свидетельствующих об изменении состава микробиоты при нескольких неврологических заболеваниях, включая болезнь Паркинсона и расстройства аутистического спектра (рис. 5). Изменения в составе и содержании микробиоты наблюдаются и у лиц с умеренными когнитивными нарушениями.

Рисунок 5. Связь между работой кишечника и некоторыми заболеваниями нервной системы. Рисунок наглядно показывает, как определенные факторы окружающей среды могут запускать воспаление, начавшееся в кишечнике, которое со временем доходит до мозга и может оказывать отрицательное влияние на здоровье, способствуя появлению различных заболеваний. Под действием стресса, диеты, инфекции и антибиотиков нарушается состав микробиоты, в кишечник выпускаются компоненты мембран грамотрицательных бактерий — амилоиды и липополисахариды, обладающие токсичным действием. Через стенки кишечника они всасываются в кровь, что ведет к системному воспалению, а через ГЭБ (гематоэнцефалический барьер) попадают и в мозг, а потому могут со временем способствовать появлению депрессии, утомляемости и даже болезни Паркинсона, Альцгеймера и аутизма (через поколения).
[41], рисунок адаптирован
Примечательно, что на примере людей с целиакией (непереносимость глютена) можно проследить влияние микробиоты на мозг. Иммунная система через кишечник отторгает глютен, что вызывает не только проблемы с пищеварением, но и множество других системных нарушений, в том числе неврологических. Таким образом, целиакия может выражаться и через депрессию, атаксию, деменцию, эпилепсию и другие проявления [40].
Можно ли улучшить связь кишечника с биоритмами организма?
Каждому человеку важно внедрять в свою ежедневную рутину полезные бытовые привычки, которые будут обеспечивать бесперебойную работу организма, а значит, хорошее здоровье и самочувствие. Для этого действительно необходимы простые, до боли известные каждому вещи — хороший сон, качественное питание, спорт, режим дня. На что стоит особенно обратить внимание, так это на подъем и укладывание спать в одно и то же время, расписание приемов пищи и соблюдение правил помощи своему организму в случае джетлага.
То, насколько мы можем повлиять на состав микрофлоры во взрослом возрасте, все еще изучается. Как мы уже упоминали, с помощью распорядка дня и питания в какой-то степени можно воздействовать на микробиом, скажем, увеличить количество полезных бактерий и уменьшить популяцию вредных. В целом жизнь в естественных условиях, в деревне, может способствовать улучшению иммунитета за счет увеличения количества контактов с бактериями. К сожалению, коренным образом поменять иммунитет (например, вылечить астму), прибегая к питанию, сну и улучшению состава микробиома, не получится, и в этом случае нужно искать помощи у врачей.
Тем не менее сейчас нам уже в целом становится ясна общая картина работы кишечника и наших внутренних ритмов, а значит, мы уже способны повлиять на наше здоровье.
Литература
- L. Fändriks. (2017). Roles of the gut in the metabolic syndrome: an overview. J Intern Med. 281, 319-336;
- Сафина Д.Д., Абдулхаков С.Р., Амиров Н.Б. (2021). Микробиота кишечника и ее значение для здоровья человека. «Вестник современной клинической медицины». 14, 81–94;
- Zhong Peng, Lifen Ling, Charles W. Stratton, Chunhui Li, Christopher R. Polage, et. al.. (2018). Advances in the diagnosis and treatment of Clostridium difficile infections. Emerging Microbes & Infections. 7, 1-13;
- Циммерман Я.С. (2017). Учение о дисбиозе («дисбактериозе») кишечника: состояние проблемы и новые тенденции. «Клиническая медицина». 95, 677–686;
- Michael I McBurney, Cindy Davis, Claire M Fraser, Barbara O Schneeman, Curtis Huttenhower, et. al.. (2019). Establishing What Constitutes a Healthy Human Gut Microbiome: State of the Science, Regulatory Considerations, and Future Directions. The Journal of Nutrition. 149, 1882-1895;
- Suhrid Banskota, Jean-Eric Ghia, Waliul I. Khan. (2019). Serotonin in the gut: Blessing or a curse. Biochimie. 161, 56-64;
- Rahul Mittal, Luca H. Debs, Amit P. Patel, Desiree Nguyen, Kunal Patel, et. al.. (2017). Neurotransmitters: The Critical Modulators Regulating Gut–Brain Axis. J. Cell. Physiol.. 232, 2359-2372;
- Daniel Erny, Anna Lena Hrabě de Angelis, Diego Jaitin, Peter Wieghofer, Ori Staszewski, et. al.. (2015). Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 18, 965-977;
- Christina N. Heiss, Louise E. Olofsson. (2019). The role of the gut microbiota in development, function and disorders of the central nervous system and the enteric nervous system. J Neuroendocrinol. 31, e12684;
- Iaroslav Semin, Justus Ninnemann, Marina Bondareva, Ilia Gimaev, Andrey A. Kruglov. (2021). Interplay Between Microbiota, Toll-Like Receptors and Cytokines for the Maintenance of Epithelial Barrier Integrity. Front. Med.. 8;
- Davide Priori, Michela Colombo, Paolo Clavenzani, Alfons J. M. Jansman, Jean-Paul Lallès, et. al.. (2015). The Olfactory Receptor OR51E1 Is Present along the Gastrointestinal Tract of Pigs, Co-Localizes with Enteroendocrine Cells and Is Modulated by Intestinal Microbiota. PLoS ONE. 10, e0129501;
- Philip Strandwitz. (2018). Neurotransmitter modulation by the gut microbiota. Brain Research. 1693, 128-133;
- Tsavkelova E., Botvinko I.V., Kudrin V., Oleskin A. (2000). Detection of neurotransmitter amines in microorganisms with the use of high-performance liquid chromatography. Dokl. Biochem. 372, 115–117;
- P M Stanaszek, J F Snell, J J O'Neill. (1977). Isolation, extraction, and measurement of acetylcholine from Lactobacillus plantarum. Appl Environ Microbiol. 34, 237-239;
- Navena Navaneetharaja, Verity Griffiths, Tom Wileman, Simon Carding. (2016). A Role for the Intestinal Microbiota and Virome in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS)?. JCM. 5, 55;
- Gianluca Ianiro, Herbert Tilg, Antonio Gasbarrini. (2016). Antibiotics as deep modulators of gut microbiota: between good and evil. Gut. 65, 1906-1915;
- Brittany A. Matenchuk, Piush J. Mandhane, Anita L. Kozyrskyj. (2020). Sleep, circadian rhythm, and gut microbiota. Sleep Medicine Reviews. 53, 101340;
- T. Haahtela, T. Laatikainen, H. Alenius, P. Auvinen, N. Fyhrquist, et. al.. (2015). Hunt for the origin of allergy - comparing the Finnish and Russian Karelia. Clin Exp Allergy. 45, 891-901;
- Дом для бактерий, или Что мы знаем о кожной микрофлоре;
- BRAUN-FAHRLÄNDER, GASSNER, GRIZE, NEU, SENNHAUSER, et. al.. (1999). Prevalence of hay fever and allergic sensitization in farmer's children and their peers living in the same rural community. Clinical & Experimental Allergy. 29, 28-34;
- Новые функции кишечной микрофлоры;
- Чего от нас хотят микробы?;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- Микробиом кишечника: мир внутри нас;
- DA Eschenbach. (2018). Vaginal seeding: more questions than answers. BJOG: Int J Obstet Gy. 125, 537-537;
- T Haahr, J Glavind, P Axelsson, M Bistrup Fischer, J Bjurström, et. al.. (2018). Vaginal seeding or vaginal microbial transfer from the mother to the caesarean-born neonate: a commentary regarding clinical management. BJOG: Int J Obstet Gy. 125, 533-536;
- Kathleen Rice Simpson. (2018). Vaginal Seeding of Babies Born via Cesarean. MCN: The American Journal of Maternal/Child Nursing. 43, 60-60;
- Mark A. Underwood, J. Bruce German, Carlito B. Lebrilla, David A. Mills. (2015). Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res. 77, 229-235;
- Fredrik Bäckhed, Josefine Roswall, Yangqing Peng, Qiang Feng, Huijue Jia, et. al.. (2015). Dynamics and Stabilization of the Human Gut Microbiome during the First Year of Life. Cell Host & Microbe. 17, 690-703;
- Yvonne Vallès, Alejandro Artacho, Alberto Pascual-García, Maria Loreto Ferrús, María José Gosalbes, et. al.. (2014). Microbial Succession in the Gut: Directional Trends of Taxonomic and Functional Change in a Birth Cohort of Spanish Infants. PLoS Genet. 10, e1004406;
- Moon Do, Eunjung Lee, Mi-Jin Oh, Yoonsook Kim, Ho-Young Park. (2018). High-Glucose or -Fructose Diet Cause Changes of the Gut Microbiota and Metabolic Disorders in Mice without Body Weight Change. Nutrients. 10, 761;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Dorottya Nagy-Szakal, Brent L. Williams, Nischay Mishra, Xiaoyu Che, Bohyun Lee, et. al.. (2017). Fecal metagenomic profiles in subgroups of patients with myalgic encephalomyelitis/chronic fatigue syndrome. Microbiome. 5;
- Ludovic Giloteaux, Julia K. Goodrich, William A. Walters, Susan M. Levine, Ruth E. Ley, Maureen R. Hanson. (2016). Reduced diversity and altered composition of the gut microbiome in individuals with myalgic encephalomyelitis/chronic fatigue syndrome. Microbiome. 4;
- Айтбаев К.А., Муркамилов И.Т., Фомин В.В., Муркамилова Ж.А. (2018). Влияние кишечной микробиоты на эпигенетику: механизмы, роль в развитии заболеваний, диагностический и терапевтический потенциал. «Экспериментальная и клиническая гастроэнтерология». 6, 122–129;
- Joe Alcock, Carlo C. Maley, C. Athena Aktipis. (2014). Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms. BioEssays. 36, 940-949;
- Кашаев И.Х. (2018). Функционирование циркадных ритмов активности человека и их изменение вследствие нарушения суточного режима сна и бодрствования, у лиц юношеского и зрелого возраста. «Международный студенческий научный вестник». 2, 2;
- A.B. Katasonov. (2021). Gut microbiome as a therapeutic target in the treatment of depression and anxiety. Z. nevrol. psikhiatr. im. S.S. Korsakova. 121, 129;
- Дмитриева Ю.А. и Захарова И.Н. (2017). Неврологические проявления у больных целиакией. «Медицинский совет». 9, 93–96;
- Julia Doroszkiewicz, Magdalena Groblewska, Barbara Mroczko. (2021). The Role of Gut Microbiota and Gut–Brain Interplay in Selected Diseases of the Central Nervous System. IJMS. 22, 10028.






