
Кавеолы: уникальные «порталы» клеточной мембраны
04 июля 2018
Кавеолы: уникальные «порталы» клеточной мембраны
- 3291
- 1
- 7
Кавеолы — особые «впячивания» на клеточной мембране. Белок кавеолин вставлен в мембрану кавеолы таким образом, что его концы обращены в цитоплазму (показан синими линиями). Кружками разных цветов обозначены различные мембранные фосфолипиды.
-
Автор
-
Редакторы
Любая клетка имеет мембрану, состоящую из двойного слоя липидов со встроенными в него белками. Разумеется, клетка должна обмениваться с окружающей средой сигналами и веществами. Малые молекулы просто диффундируют через мембрану или проникают через особые белковые каналы. Но как быть с более крупными молекулами — например, с небольшими белками? Для этого существует специальный путь — эндоцитоз. В общем случае его схема выглядит так: от клеточной мембраны отпочковывается пузырёк (везикула), переносящая вещество; далее везикула сливается с лизосомами, ферменты которых расщепляют ее содержимое. Но эндоцитоз может идти и другим путём — посредством структур, известных как кавеолы. Именно им и будет посвящена наша статья.
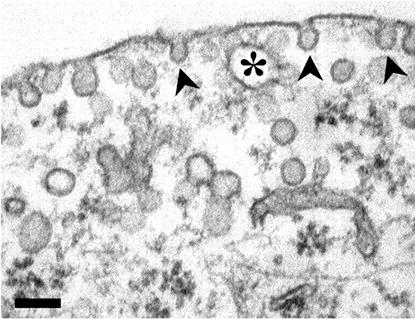
Рисунок 1. Электронная микрофотография кавеол (отмечены стрелками) в мембране первичного фибробласта. Звездочкой отмечена связанная с мембраной вакуоль. Масштабная линейка 100 нм.
Клеточную мембрану можно назвать «колыбелью жизни» [1], и она отнюдь не является чем-то неподвижным, статическим, навсегда сформированным. Напротив, это «живая» и активно трансформирующаяся структура, об одной из «опций» которой — кавеолах — мы и расскажем. Впервые открытые почти 40 лет назад [2], кавеолы всё ещё хранят в себе немало загадок (рис. 1). Хотя за это время прояснились многие черты их строения и состава, мы всё ещё не до конца представляем, на что способны эти невзрачные «впячивания» клеточной мембраны. Известно, однако, что кавеолы активно участвуют во внутриклеточной передаче сигналов. Кроме того, они служат клеточными «сенсорами» механического стресса. В нашей статье собраны последние данные о структуре и функционировании кавеол.
Структура
Кавеолы — это стабильные впячивания мембраны клетки (в форме буквы Ω) диаметром от 50 до 100 нм (отсюда их название, в буквальном переводе означающее «маленькая пещерка»). Кавеолы имеют необычный липидный состав: наружный слой мембраны в области кавеол обогащён холестерином и сфинголипидами. В связи с этим кавеолы можно рассматривать как разновидность липидных рафтов — микродоменов клеточной мембраны, содержащих много сфинголипидов и холестерина . Однако кавеолы состоят отнюдь не только из липидов: в их состав входят также различные белки, в первую очередь — кавеолины и кавины.
«Биомолекула» уже подробно рассказывала о сложном составе и многочисленных функциях биологических мембран: «Липидный фундамент жизни» [1]. — Ред.
Считается, что ключевую роль в формировании кавеол играет кавеолин-1. Белки кавины распознают два особых мембранных фосфолипида — фосфатидилсерин (PS) и фосфатидилинозитол-(4,5)-бисфосфат (PI(4,5)P2), — однако только при участии кавеолина-1. Согласно наиболее общепринятой модели, собственно впячивание мембраны обеспечивает кавеолин-1, который вставляется в мембрану будущей кавеолы, взаимодействуя с холестерином. Кавины олигомеризуются на кавеолиновой «платформе» и, взаимодействуя с мембранными фосфолипидами, дополнительно стабилизируют кавеолу (рис. 2). В пользу этой модели свидетельствует тот факт, что при экспрессии кавеолина-1 в бактериальных клетках он сам способен вызывать впячивание мембраны без вспомогательных белков. Кроме того, в отсутствие кавеолина-1 кавеолы не образуются [2]. При этом кавеолин-1 можно обнаружить и вне кавеол, что говорит о возможных его ролях в других частях клетки [3].
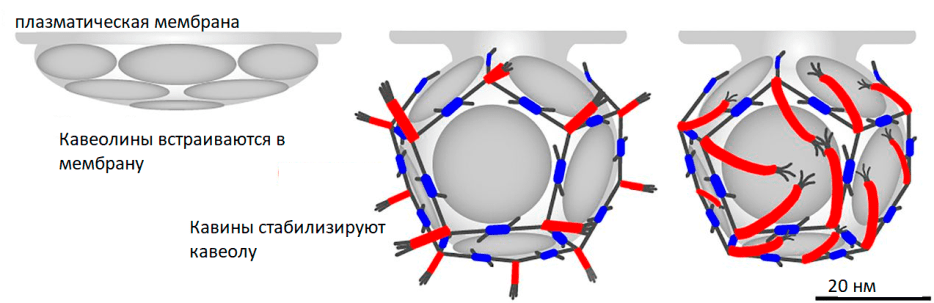
Рисунок 2. Схема образования кавеол
[10], с изменениями
Динамика
Кавеолы можно найти не во всех тканях млекопитающих. Их очень много в клетках, подвергающихся механическому стрессу — мышечных клетках, фибробластах, клетках эндотелия и адипоцитах, но они полностью отсутствуют в нейронах и лимфоцитах [3]. Вероятно, это связано с тем, что одна из важнейших функций кавеол — передача сигналов механического стресса, поэтому клеткам, которые не подвергаются интенсивным механическим воздействиям, кавеолы не очень-то и нужны.
Кавеолы, как и обычные участки клеточной мембраны, способны к эндоцитозу. Например, в фибробластах кавеолы отпочковываются от мембраны, но не утрачивают белковую оболочку и сливаются с ранними эндосомами. В дальнейшем они могут отпочковаться от эндосомы обратно (благодаря тому, что их белковая оболочка осталась нетронутой) и вернуться в мембрану (рис. 3). По этому пути кавеолы покидают клеточную мембрану в метафазе митоза и возвращаются в неё в телофазе. Схожим образом ведут себя кавеолы в клетках эндотелия: они доставляют в ранние эндосомы молекулы, захваченные ими из кровотока [3].
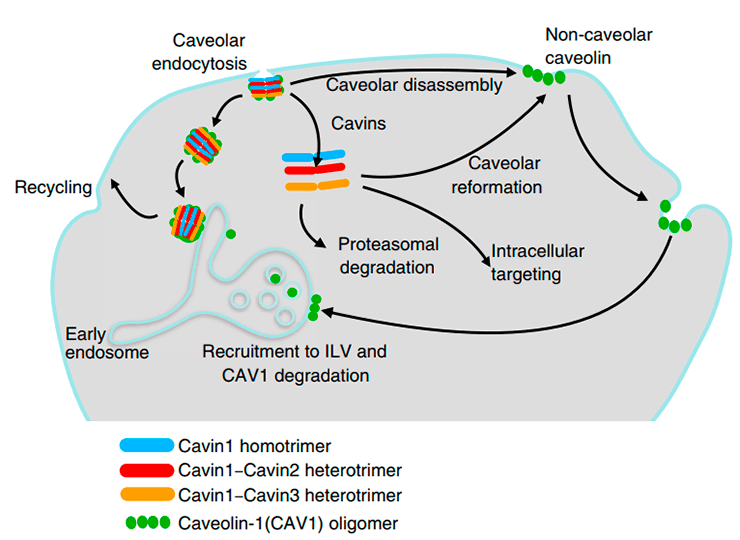
Рисунок 3. Кругооборот кавеол. Кавеолы могут отшнуровываться внутрь клетки или разбираться в ответ на увеличение напряжения мембраны. Высвобожденные кавины могут разрушаться, взаимодействовать с другими клеточными белками или вновь формировать кавеолы.
Эндоцитоз кавеол запускается при утрате клеткой контактов с соседними клетками или межклеточным матриксом (клеточной адгезии), ингибировании серин/треониновых фосфатаз или при заражении вирусом SV40. Эндоцитоз кавеол происходит при участии белка динамина и актиновых микрофиламентов. В условиях утраты клеточной адгезии кавеолин покидает кавеолы в составе маленьких везикул, которые при участии микротрубочек накапливаются в цитоплазме вокруг ядра [4].
В некоторых условиях белковая оболочка кавеол разбирается. Так происходит, в частности, при механических нагрузках, которые приводят к увеличению натяжения клеточной мембраны. В следующем разделе рассмотрим роль кавеол в передаче сигналов механического стресса.
Функции
Одной из функций кавеол является участие в разнообразных путях внутриклеточной передачи сигналов. Показано, что множество факторов роста, рецепторов, киназ и других молекул, участвующих во внутриклеточной сигнализации, локализованы в кавеолах. Кроме того, кавеолин взаимодействует со многими клеточными белками, участвующими в передаче сигналов, благодаря особому домену, обращённому в цитоплазму. Например, кавеолин регулирует синтез оксида азота (NO) в клетках эндотелия, подавляя в них активность синтазы оксида азота. Наконец, сами по себе кавеолы тоже могут принимать участие в передаче сигналов. Например, изменение кривизны клеточной мембраны вблизи кавеол влияет на передачу сигнала малой ГТФазой Ras, которая заякорена в мембране [3].
Кавеолы играют важную роль в механотрансдукции. Дело в том, что они нередко ассоциированы со стресс-фибриллами — волокнами, состоящими из актина и немышечного миозина-II. Они регулируют натяжение мембраны и форму клетки в ответ на механический стресс. Эту связь обнаружили ещё в 70-х годах прошлого века . Более того, кавеолы связаны и с актиновым цитоскелетом. Эта связь опосредуется линкерными белками — например, филамином А (рис. 4). Актиновый цитоскелет и стресс-фибриллы мешают образовываться скоплениям кавеол — кавеолярным розеткам (рис. 5). Этим можно объяснить большое количество кавеолярных розеток в адипоцитах, лишенных стресс-фибрилл. Считается, что плотные кавеолярные розетки придают дополнительную прочность мембранам клеток, которые подвергаются постоянному механическому стрессу [4].
Подробнее про биомеханические свойства клеток можно почитать в обзоре на «Биомолекуле»: «Биомеханика живой клетки» [11]. — Ред.
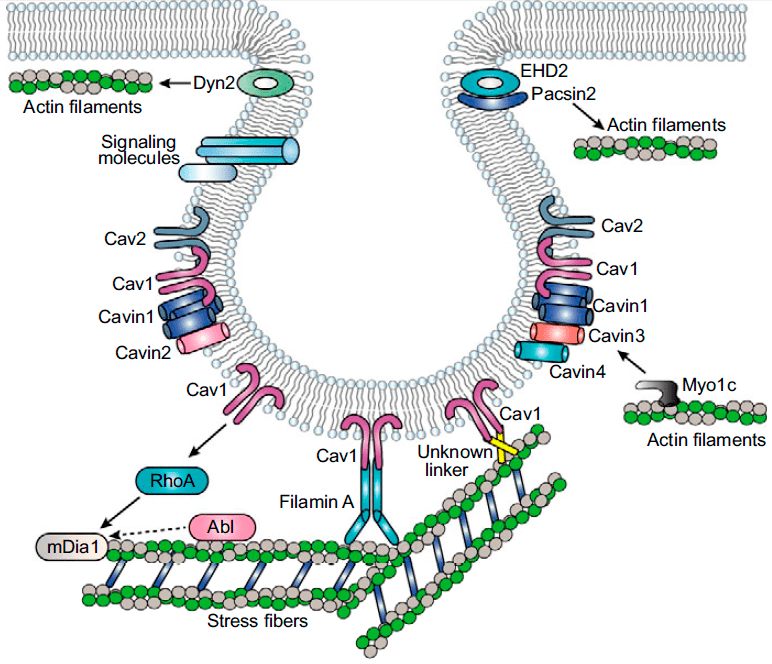
Рисунок 4. Связь кавеол со стресс-фибриллами и актиновым цитоскелетом
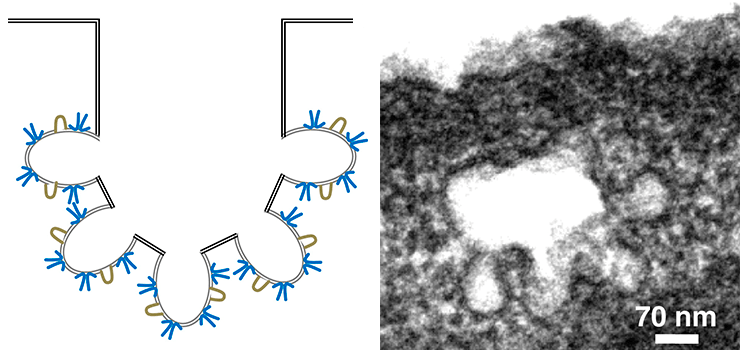
Рисунок 5. Кавеолярные розетки: схема (слева; синим цветом изображены кавеолины, жёлтым — кавины) и электронная микрофотография (справа).
[12], с изменениями
Кавеолы и вирусы
Как особые домены в липидной мембране, кавеолы могут играть важную роль в жизненном цикле вирусов. Например, сдерживают выход из клетки вируса Tiger Frog, который поражает лягушек Rana tigrina rugulosa, причём в состав вирусных частиц попадают некоторые белки кавеол [6]. Вероятно, таким образом вирус мешает формированию кавеол, которые сдерживают его размножение. В некоторых случаях, наоборот, проникновение вируса в клетку происходит через кавеолы, как в случае вируса Peste des Petits Ruminants, который вызывает некротическое разрушение эпителиальной и лимфоидной тканей у овец и коз [7].
Медицинское значение
Мутации, затрагивающие кавеолярные белки, нередко приводят к разнообразным болезням. Например, у мышей, лишенных кавина-1, развивается липодистрофия, которая проявляется в снижении массы жировой ткани. Мутации в гене кавина-1 приводят к схожим симптомам и у человека. Дело в том, что в отсутствие этого белка (и, соответственно, кавеол) адипоциты становятся более восприимчивыми к механическому стрессу и могут накапливать внутри лишь небольшое количество жира.
Кроме того, мутации в гене кавина-1 приводят к нарушениям в сердечно-сосудистой системе. Это связано с тем, что эндотелиальные клетки, лишенные кавеол, не выдерживают механических нагрузок. Нарушения в клеточном ответе на механический стресс, вызванные дисфункцией кавеол, могут также приводить к легочной артериальной гипертонии, фиброзу и атеросклерозу. Мутации, затрагивающие гены кавина-1, −3 и −4, связаны с несколькими формами мышечной дистрофии и кардиомиопатии. В отсутствие кавеол в мышечных клетках разрушается система Т-трубочек, и мышцы не могут нормально сокращаться. Многочисленные исследования показали важную роль кавина-1 в развитии разнообразных раковых заболеваний, причем он может обладать как онкогенными свойствами, так и выступать в роли супрессора опухолей. Вероятно, роль кавеол в развитии рака объясняется их участием во многих сигнальных путях, связанных с развитием опухоли [2].
Любопытно, что яд паука Phoneutria nigriventer действует на кавеолы. Под действием этого яда происходит усиленный эндоцитоз кавеол, что приводит к резкому увеличению проницаемости гематоэнцефалического барьера. Это, в свою очередь, вызывает нарушения функционирования мозга, чем и обусловлены некоторые симптомы отравления [5].
В настоящее время происходит бурное развитие многих областей биологии, и клеточная биология, в которой, казалось бы, уже всё давно изучено, не остается в стороне: постоянно обнаруживаются всё новые и новые молекулярные подробности функционирования органелл, а усовершенствование методов микроскопии позволяет в мельчайших подробностях изучить их ультраструктуру. Мы продолжаем следить за судьбой кавеол и других клеточных структур, которые, несомненно, ещё принесут немало сюрпризов.
Литература
- Липидный фундамент жизни;
- Christophe Lamaze, Nicolas Tardif, Melissa Dewulf, Stéphane Vassilopoulos, Cédric M Blouin. (2017). The caveolae dress code: structure and signaling. Current Opinion in Cell Biology. 47, 117-125;
- Robert G. Parton, Vikas A. Tillu, Brett M. Collins. (2018). Caveolae. Current Biology. 28, R402-R405;
- A. Echarri, M. A. Del Pozo. (2015). Caveolae - mechanosensitive membrane invaginations linked to actin filaments. Journal of Cell Science. 128, 2747-2758;
- Edilene Siqueira Soares, Monique Culturato Padilha Mendonça, Maria Alice da Cruz-Höfling. (2016). Caveolae as a target for Phoneutria nigriventer spider venom. NeuroToxicology. 54, 111-118;
- Jian He, Yi-Wen Zheng, Yi-Fan Lin, Shu Mi, Xiao-Wei Qin, et. al.. (2016). Caveolae Restrict Tiger Frog Virus Release in HepG2 cells and Caveolae-Associated Proteins Incorporated into Virus Particles. Sci Rep. 6;
- Bo Yang, Xuefeng Qi, Hui Guo, Peilong Jia, Shuying Chen, et. al.. (2018). Peste des Petits Ruminants Virus Enters Caprine Endometrial Epithelial Cells via the Caveolae-Mediated Endocytosis Pathway. Front. Microbiol.. 9;
- Robert G. Parton, Kai Simons. (2007). The multiple faces of caveolae. Nat Rev Mol Cell Biol. 8, 185-194;
- R. G. Parton. (2006). Biogenesis of caveolae: a structural model for caveolin-induced domain formation. Journal of Cell Science. 119, 787-796;
- Miriam Stoeber, Pascale Schellenberger, C. Alistair Siebert, Cedric Leyrat, Ari Helenius, Kay Grünewald. (2016). Model for the architecture of caveolae based on a flexible, net-like assembly of Cavin1 and Caveolin discs. Proc Natl Acad Sci USA. 113, E8069-E8078;
- Биомеханика живой клетки;
- Asier Echarri, Miguel A. Del Pozo. (2012). Caveolae. Current Biology. 22, R114-R116.






