
Как вылечить сердце? Достижения современной науки
19 ноября 2017
Как вылечить сердце? Достижения современной науки
- 2472
- 0
- 6
Сердечные заболевания — одна из ведущих причин смерти в мире, поэтому количество исследований этого органа огромно. Больше всего внимания уделяют изучению регенеративных способностей, улучшению процесса и последствий трансплантаций и трехмерной печати сердца.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Отрастить новую конечность, напечатать сердце, заменить кожу — всё это кажется взятым из фантастического фильма. Однако и полет человека в космос тоже когда-то считался немыслимым. Что же касается дня сегодняшнего, то всё выше перечисленное представляет собой весьма реальные перспективы современных биотехнологий и регенеративной медицины. Но откуда же мы черпаем идеи и где искать новые подсказки для дальнейших разработок? Об этом вы узнаете в этой статье.
Конкурс «био/мол/текст»-2017
 Эта работа заняла первое место в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Эта работа заняла первое место в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Ни для кого не секрет, что прыткие ящерицы способны отбрасывать хвост, а затем успешно восстанавливать его [1]. Подобным свойством обладают не только пресмыкающиеся, но и не менее известный аксолотль — половозрелая личинка саламандры амбистомы, способная отращивать отрезанные конечности. Явление регенерации встречается и у более примитивных представителей царства животных, например, у различных червей и гидр. У человека оно также присутствует, но только масштабы сильно ограничены. Например, мы способны заживлять порезы, восстанавливать переломы, почти заново наращивать печень, однако до создания целого организма из кусочка изначального материала людям откровенно далеко. К тому же это, собственно, и невозможно в силу слишком высокой биологической организации. Однако современная регенеративная медицина утверждает, что не все потеряно: возможно, в будущем мы сможем восстанавливать органы, системы органов или же целые части человеческого тела.
Первые шаги уже действительно сделаны. Все слышали про стволовые клетки, которые способны превращаться в клетки любой ткани нашего организма в зависимости от условий, в которые будут помещены. Звучит впечатляюще, но все не так просто. Стоит отметить, что подобные «волшебные кирпичики» бывают еще и разных типов. Существуют эмбриональные, фетальные, постнатальные и индуцированные стволовые клетки. Давайте рассмотрим каждые из них в отдельности.
Эмбриональные стволовые клетки — это те клетки, которые образуют первоначальную клеточную массу эмбриона и являются плюрипотентными, то есть способными в дальнейшем развиваться по различным сценариям [2]. Еще одним свойством этих клеток является их неспособность синтезировать антигены — следовательно, их можно пересаживать любому человеку без риска иммунного ответа. Казалось бы, все просто и идеально, однако, чтобы добыть эти универсальные «кирпичики», необходимо извлечь их из эмбриобласта, без которого развитие организма на ранних стадиях просто невозможно.
Фетальные стволовые клетки получают из плодного материала после аборта. Они прошли определенную степень дифференцировки и не могут развиваться абсолютно в любом направлении. Стоит отметить, что в обоих случаях назревают довольно серьезные вопросы морального характера, а также опасности, связанные с возникновением раковых опухолей, вследствие огромного варианта путей развития этих клеток [3].
Постнатальные стволовые клетки в этом плане считаются в целом безопасными, так как почти полностью дифференцированы и способны образовывать клетки только какой-то определенной ткани, например костной (и в этом заключается их минус). Они существуют во взрослом организме и способны передаваться от матери к ребенку или при гемотрансфузии, если речь идет о стволовых клетках крови [4].
Учитывая все выше перечисленные минусы, ученые решили попробовать с помощью методов генной инженерии вернуть уже дифференцированную клетку в ее прежнее плюрипотентное состояние и создать тем самым индуцированные стволовые клетки. Да, успехи в этой области действительно были достигнуты, однако сама технология еще не отточена до конца. Сегодня индуцированные стволовые клетки используют, в основном, для испытаний лекарств, моделирования болезней, планируют их дальнейшее применение для выращивания органов.
Именно по вышеуказанным причинам сейчас регенеративная медицина вновь в поисках альтернативы.
Сердце — орган с большим количеством проблем
Существуют различные болезни, способные поразить любой орган тела. Повреждение тканей, нарушение метаболизма в той или иной части человеческого организма порой способно привести его к гибели. Одной из таких важных «деталей», выход из строя которой точно гарантирует смерть, является сердце — мышечный насос, неустанно перекачивающий кровь, доставляющую необходимые макро- и микроэлементы в самые отдаленные участки тела. Правильная работа клапанов и ритмичное сокращение мышцы — вот главные основы, на которых держится функция сердца. Нарушение хотя бы одного из них влечет за собой полный коллапс сердечного ритма. Раз уж сегодня речь больше пойдет о втором из них, важно отметить, что основной причиной смертности в мире, по данным Всемирной организации здравоохранения за 2015 год [5], является ишемическая болезнь сердца. При этой болезни мышечная ткань не получает достаточное количество кислорода в результате поражения коронарных артерий и, следовательно, начинает отмирать, нарушая тем самым функцию кровоснабжения. Именно поэтому ученые интересуются, можно ли заставить человеческое сердце самовосстанавливаться после перенесенного инфаркта или каких-либо других повреждений.
На самом деле уже давно известно, что этот орган имеет потенциал к регенерации [6], так как в нем присутствуют своеобразные стволовые клетки — эндоэпителиальные клетки сосудов, способные дифференцироваться в другие типы «живых строительных кирпичиков». Однако подобное явление остается лишь в рамках эмбриогенеза или действует недостаточно интенсивно. Как заставить клетки человека делиться заново уже в зрелом состоянии — большой вопрос. Именно поэтому ученые изучают регенерацию сердца у других представителей животного царства, чтобы найти аналогии, которые могли бы им помочь при решении выше поставленной задачи.
Аквариумные рыбки — спасители человеческого сердца?
Сегодня аквариумная рыбка Danio rerio (рис. 1) — один из наиболее изученных модельных объектов в биологии, обладающий рядом преимуществ по сравнению с другими позвоночными. Эмбрион у этих рыбок развивается быстро и проходит стадии от яйца до личинки всего за три дня. Зародыши крупные, выносливые, крепкие, прозрачные и развиваются вне матери, что облегчает манипуляции с ними и наблюдение [7].

Рисунок 1. Аквариумная рыбка Danio rerio.
сайт akvariumnyerybki.ru
Сейчас существует устоявшаяся концепция о том, что с усложнением устройства организма его способность к регенерации отдельных органов, а тем более частей тела, резко падает. В целом это действительно так, однако одним из таких исключений является Danio rerio. Особенность этих рыб в том, что их сердце способно к самовосстановлению на протяжении всей жизни [8–10]. Уделите этому факту должное внимание! Подобное свойственно разве только некоторым амфибиям, которые стоят на ступеньку эволюционной лестницы ниже, а также более примитивным представителям животного царства. В связи с вышесказанным нам необходимо остановиться на этом исследовании подробно и попытаться вникнуть в суть дела, чтобы понять, сможет ли аквариумная рыбка как-то помочь в лечении последствий ишемической болезни сердца у человека.
Группа ученых из университета Миннесоты в 2016 году опубликовала статью о регенерационных способностях Danio rerio [8]. В ходе эксперимента исследователи наносили сердцу рыбки повреждения различного типа и степени тяжести (как показано на рис. 2), на месте которых постепенно образовывался кровяной сгусток. Затем следовал процесс регенерации из двух этапов: восстановление утраченного миокарда и неоваскуляризация (разрастание сосудов) этой зоны.
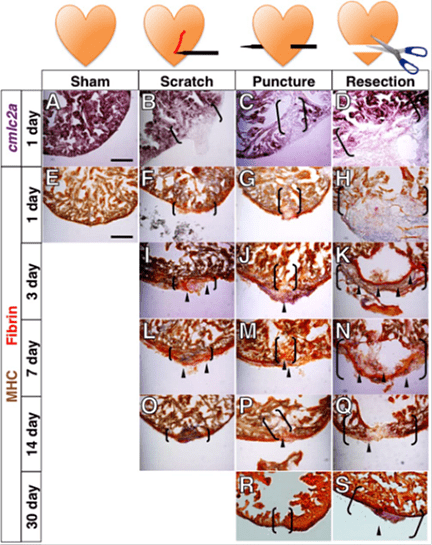
Рисунок 2. Сравнение повреждений в миокардовом слое, нанесенных разными способами рыбке Danio rerio. На рисунке изображена фототаблица, которая отражает степень заживления миокарда за определенный промежуток времени (1 день, 3 дня, 7 дней, 14 дней, 30 дней), указанный в вертикальной графе, в зависимости от степени повреждения (горизонтальная графа). В первом столбце представлен образец без каких-либо деструктивных вмешательств, он необходим для сравнения (sham), во втором столбце представлен образец, на который нанесена царапина (scratch), в третьем — сердечный препарат проткнули (puncture), а в четвертом — от него отрезали небольшую часть (resection). Как вы видите из таблицы, чем серьезнее повреждение, тем дольше оно заживляется.
Уникальным оказался еще и тот факт, что заживление происходило не за счет стволовых клеток, а за счет разрастания самих кардиомиоцитов. Ученые выяснили это с помощью микрофотографий препаратов на различных этапах регенерации миокарда, которые и представлены в таблице (рис. 2). Кардиомиоциты выходят из стадии покоя G0 и снова вступают в клеточный цикл, начиная делиться. Также в процессе восстановления принимают участие клетки эпикарда (внешней оболочки сердца), эндокарда (внутренней оболочки) и эндотелиальные клетки сосудов (рис. 3).

Рисунок 3. Строение сердца костной рыбы. Венозный синус и артериальная луковица не входят в его состав.
Они дают паракринные сигналы кардиомиоцитам (сигналы, передающиеся от близлежащих клеток клеткам-мишеням с помощью диффузии химических веществ через межклеточное вещество), заставляя их заново наращивать мышечную ткань [7], [8]. Всеми вышеперечисленными процессами руководят сложные молекулярные каскады реакций. Во время проведения экспериментов ученые выяснили, что желудочковая ампутация индуцировала экспрессию генов cxcl12a и cxcr4b, кодирующих хемокиновый лиганд и его рецептор — комплекс специальных молекул, ответственных за миграцию клеток в организме. Обнаружилось, что ген cxcl12a экспрессируется в эпикардиальной ткани, а сxcr4b — в кардиомиоцитах.
Так последние работы показали особую роль клеток эпикарда в регенерации. Во время эмбриогенеза, как известно, эпикард образуется как часть проэпикарда, сформировавшегося из кластера мезодермальных клеток как оболочка развивающейся миокардиальной трубки. Затем его клетки проникают в толщу мышечной ткани, чтобы сформировать эндотелий и слои гладкой мускулатуры будущих коронарных сосудов. Но самое интересное то, что эпикардиоциты Danio rerio сохраняют свою пластичность и во взрослом состоянии. Они очень быстро реагируют на повреждения и заставляют кардиомиоциты делиться, тем самым инициируя регенерацию, как было сказано выше. Также в ходе фармакологических экспериментов установили, что деление сердечных мышечных клеток и их миграция химически не зависят друг от друга, но для успешного восстановления органа необходима корреляция обоих процессов [7]. Звучит оптимистично, но, к сожалению, по-прежнему до конца не изучены механизмы, заставляющие клетки сердца инициировать деление так быстро в ответ на повреждение.
Сегодня ученые, занимающиеся биологией развития, пытаются найти ответы на эти вопросы в эмбриогенезе, изучая экспрессию так называемых Hox-генов — очень консервативных участков ДНК, найденных у многих видов животных, в том числе у насекомых, рыб, птиц, пресмыкающихся и млекопитающих [11]. Эти гены ответственны не только за правильное расположение органов, но и за их строение. Различными вариантами экспрессии таких участков ДНК обусловливается разнообразие животных форм. Известно, что в регенерации конечностей аксолотля как раз и участвуют вышеупомянутые гены. Возможно, в миокарде Danio rerio происходит что-то подобное, что провоцирует экспрессию других участков ДНК, которые необходимы для восстановления мышечной ткани по механизму, описанному ранее? Этот вопрос требует дальнейшего детального изучения.
Каждый вправе задаться следующим вопросом: какова же все-таки перспектива данного исследования? Читатель может усомниться в ней, сказав, что сердце рыбки устроено гораздо примитивнее, чем сердце человека, и будет прав! Орган кровоснабжения Danio rerio действительно выглядит гораздо проще, чем его человеческий аналог (рис. 4).
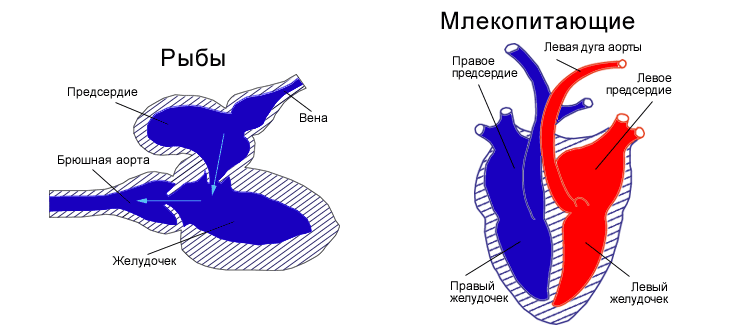
Рисунок 4. Сравнительная морфология сердца рыб и млекопитающих. Сердце рыб, как правило, представлено одним предсердием и одним желудочком. У него имеются дополнительные структуры: венозный синус и артериальная луковица (у костных рыб) и артериальный конус (у хрящевых). Принято считать, что миокард рыб специфичен и представлен однородной сердечной тканью, равномерно пронизанной трабекулами и капиллярами. Диаметр мышечных волокон у рыб составляет 6–7 мкм, что меньше, чем у теплокровных (например, у собаки в два раза больше). Такой миокард называют губчатым. Он снабжается венозной кровью из трабекулярных полостей, которые, в свою очередь, заполняются кровью из желудочка через сосуды Вьессена—Тебезия. У рыб нет коронарного кровообращения в классическом понимании, то есть специальных сосудов, снабжающих сердце кровью. У млекопитающих же, и человека в том числе, главный орган кровообращения состоит из четырех отделов: двух предсердий и двух желудочков. Он имеет коронарную систему, представленную двумя основными артериями, отходящими от луковицы аорты, и совокупностью вен, собирающихся в венозный синус, который открывается в правое предсердие [12].
сайт www.myshared.ru
Так же можно спорить, указывая на исследование регенерации сердца, которая была открыта у новорожденных мышей учеными из Техасского университета [13–15], и спрашивать: почему мы говорим о рыбе, если существуют данные по организму, который гораздо ближе стоит к нам на эволюционной лестнице? Как указали сами исследователи, механизм регенерации у грызунов на клеточном уровне схож с механизмом, описанным выше для Danio rerio: в регенерации участвуют сами кардиомиоциты, а не постнатальные стволовые клетки. Однако после семи дней мыши теряют способность к самовосстановлению сердца. Исследователи попробовали искусственно запустить ген, ответственный за деление кардиомоцитов, но сердце у мышей получалось слишком большим, и особи с мутантным органом погибали. Аквариумные рыбки же способны к регенерации сердца всю жизнь, и оно после восстановления вполне полноценно работает. Несмотря на то, что Danio rerio холоднокровные, а мы, люди, все-таки теплокровные, молекулярные механизмы, ответственные за регенерацию сердечных тканей, могут вполне оказаться схожими, так как кодируются участками ДНК с консервативными последовательностями, которые практически неизменны. Однозначно дать ответ на данный вопрос пока невозможно. Стоит попробовать найти белки, обеспечивающие аналогичные реакции или молекулярные каскады, которые были выключены в связи с усложнением морфологии организма или по каким-либо другим причинам. Так что исследование авторов статьи об аквариумных рыбках может оказаться перспективным. К тому же, теоретически можно выявить родственную линию организмов, обладающих подобным свойством, определить закономерности, позволившие им достичь таких успехов в регенерации сердца, а также определить, когда и почему это свойство было утеряно другими живыми существами.
Трудности при трансплантации сердца
Есть и другой путь восстановления поврежденных органов — их можно просто заменить! Трансплантология — одно из передовых направлений регенеративной медицины. Первую успешную операцию по пересадке сердца от человека к человеку 3 декабря 1967 года провел хирург из ЮАР Кристиан Барнард, открывший тем самым новые горизонты в развитии данного направления (рис. 5) [16]. Пересадку сердца воистину можно считать революционным событием, однако, если быть более точным, первым органом, искусственно вживленным в организм человека взамен старого, была почка. Эта операция произошла в 1933 году в Херсоне, и руководил ею профессор, доктор медицинских наук Юрий Юрьевич Вороной [17]. Трансплантация, увы, не оказалась успешной, так как впоследствии больной девушке влили неподходящую донорскую кровь, и она умерла. Сделано это было не по ошибке врача, а просто потому, что на тот момент ученые не были знакомы с группами крови.

Рисунок 5. Первая операция по пересадке сердца от человека к человеку. Слева: хирург Кристиан Барнард; справа: пациент Луис Вашкански.
Хотя, как вы видите, трансплантология может похвастаться довольно богатой историей и солидным опытом, она до сих пор сталкивается с рядом проблем. Как правило, основные сложности при трансплантации связаны с правильной подборкой донорского органа и преодолением иммунологических барьеров. Сейчас выделен целый список так называемых белков гистосовместимости (совместимости тканей), располагающихся на клеточных мембранах, совпадения по которым между донором и реципиентом обязательны для успешной пересадки органа [17]. Они представляют собой антигены — особенные маркеры, которые позволяют иммунным клеткам распознать чужеродные структуры и не спутать их со «своими». В противном же случае рано или поздно происходит отторжение имплантата. Суть этого процесса примерно всегда одинакова. Иммунная система просто разрушит пересаженный орган, вызвав в нем необратимые процессы гибели клеток. Для решения этой проблемы не всегда бывает достаточно тщательной проверки доноров, у которых при полной совместимости по всем показателям, могут выявиться дополнительные белки-антигены, на которые будут реагировать антитела реципиента, вызывая описанный выше эффект. Сегодня, как правило, пациенты вынуждены годами ждать подходящих доноров, ведь, как мы узнали, орган далеко не каждого человека подойдет. Согласно статистике по европейским странам за 1991–2016 годы, список людей, нуждающихся в пересадке сердца, неуклонно растет, в то время как количество трансплантатов снижается (рис. 6).
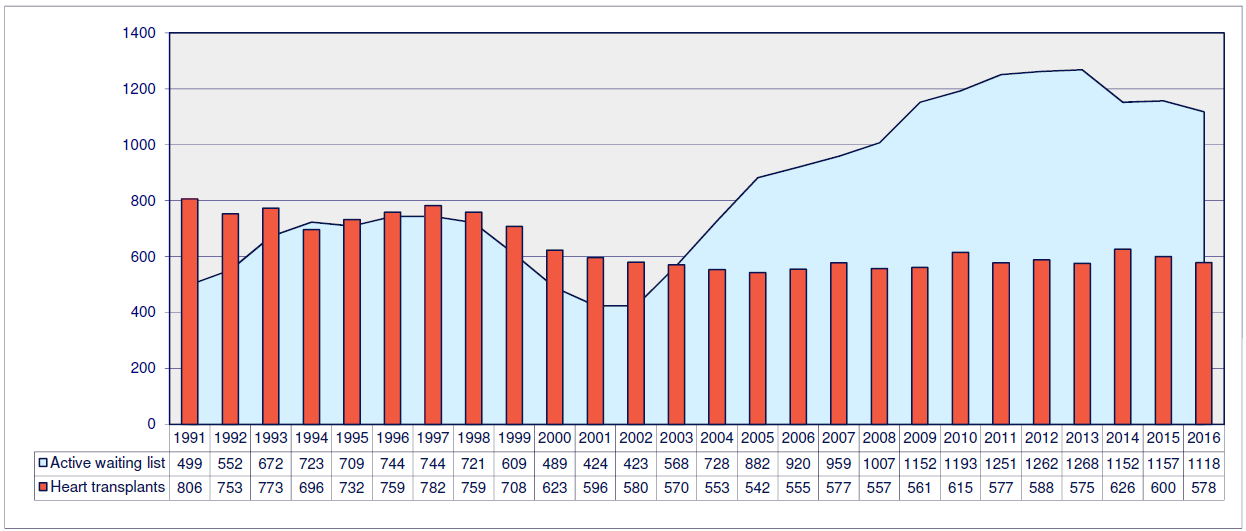
Рисунок 6. Диаграмма, отражающая уровень востребованности донорских органов. Красные столбцы — количество донорских органов по годам. Светло-зеленая область — количество людей, нуждающихся в операции.
Именно поэтому медики используют еще и иммунодепрессанты — специальные препараты различной природы, призванные блокировать действие защитной системы организма. Но в ряде их побочных эффектов, к сожалению, присутствуют посттрансплантационные септические поражения (вирусные заражения), почечная недостаточность или даже возникновение злокачественных опухолей, как результат уменьшения иммунокомпетентности пациента, которые могут проявиться порой только через несколько лет [18]. Однолетняя выживаемость составляет около 85–90%, а трехлетняя — приближается к 75%. Исход у пациентов, перенесших трансплантацию при комплексной врожденной болезни сердца, аналогичен результатам пациентов с другими формами сердечных заболеваний. Однолетняя выживаемость у людей с врожденными пороками сердца — 79%; выживаемость за пять лет составляет 60%. В настоящее время 15% пациентов страдают от злокачественных новообразований через 5 лет после трансплантации [19].
Возможность безопасной заморозки и консервации живой ткани также очень важна для медицины. На данный момент кровь для переливания может храниться всего пару недель, а орган для пересадки — лишь несколько часов. Чтобы продлить эти сроки, нужно заморозить живую ткань до температуры ниже нуля. Но проблема в том, что при этом вода в клетках превращается в лед, расширяется и разрывает клетку изнутри. Для решения этой проблемы ученые придумали специальные криоконсерванты, которые препятствуют образованию льда. К сожалению, они оказались токсичны, и при разморозке в живых оставалось лишь 10% клеток. Однако в 2015 году группа разработчиков из Университета Орегона заявила, что им удалось повысить процент выживших клеток до 80%, а в перспективе возможно довести это число до 99% [20]. Путем экспериментов они нашли оптимальную формулу раствора глицерина и ряда минеральных солей, который оказался наименее токсичен для живых клеток.
Орган мало просто качественно законсервировать, его надо еще успеть доставить. Для этого существуют специальные контейнеры, которые могут поддерживать жизнеспособность трансплантата, но этот период составляет в лучшем случае сутки, обычно — несколько часов. Доставка, как правило, осуществляется по воздуху. Таким образом, себестоимость трансплантатов серьезно увеличивается. На 2017 год цена донорского сердца в США составляла 1,4 миллионов долларов, почки — 415 тысяч, печени — 813 тысяч, одного легкого — 862 тысяч, а поджелудочной — 347 тысяч долларов [21].
Ко всему прочему существуют еще и проблемы морального характера, связанные с изъятием органов из тела человека после смерти (такие трансплантаты используются чаще всего), которая официально во многих странах констатируется после остановки мозговой активности и возникновения необратимых изменений в остальных жизненно важных частях организма.
Как вы видите, даже сегодня трансплантология сталкивается со множеством трудностей, помочь решить которые призваны новые достижения регенеративной медицины, например трехмерная биопечать (рис. 7).

Рисунок 7. Печать почки на биопринтере. Раздаточная головка выдавливает по слоям на подложку биоматериал, передвигаясь согласно загруженной в принтер программе и создавая 3D-объект.
Может, сердце проще «напечатать»?
Технология трехмерной биопечати довольно проста: объект строится путем наложения одного слоя материала на другой [22]. Подобным образом на 3D-принтере можно создать детали для самолета, дома или настоящее оружие, а также напечатать человеческие органы из биополимеров! Идея кажется многообещающей, но она все равно требует преодоления ряда трудностей.
Сначала необходимо создать точную модель нужного органа, с выверенным расположением его отдельных компонентов, в том числе нервов и сосудов [26]. Здесь на помощь приходят компьютерная и магниторезонансная томографии (КТ и МРТ соответственно), которые позволяют определить положение тканей в пространстве. МРТ, кроме того, может визуализировать и четкие контуры перехода между тканями и выделить отдельные детали органа из окружения. Затем после математической и компьютерной обработки 3D-изображение разрезают на 2D-поперечные срезы (слои), которые импортируют в буферное запоминающее устройство биопринтера с учетом их толщины и положения в пространстве.
Суть самого метода печати заключается в сборке тканей или органов из конгломератов клеток, которые наносят на специальную подложку — биобумагу [22]. Основу процесса составляет способность «живых кирпичиков» сливаться друг с другом, образуя ткани с нормальной морфологией (рис. 9). Клетка как основная единица гистогенеза способна самостоятельно управлять структурой и расположением компонентов вокруг нее. Это известно на примере эмбрионального развития. Такой метод называется самосборкой, он требует довольно глубоких познаний в области молекулярных механизмов межклеточного взаимодействия и формирования тканей.

Рисунок 9. Эволюция кольца из 10 сфероидов в коллагеновом геле. На микрофотографии видно, как отдельные клеточные сфероиды полностью сливаются за 168 часов (7 суток). Сращивание клеточных сфероидов — фундаментальная основа технологии.
Однако вышеописанная технология сталкивается с проблемой создания нервной и сосудистой систем отдельного органа, которые тоже должны входить в его состав. Для этого планируют использовать технологию мини-тканей: встраивать сосуды и нервы из нескольких типов клеток уже в конгломераты до непосредственного их использования в печати. К сожалению, пока никому не удавалось осуществить подобное на практике. Агентство NASA даже объявило приз в размере 500 000 долларов первой исследовательской команде, которая сможет создать кусок человеческой ткани толщиной 1 см с полностью работоспособной кровеносной системой, которая будет жить в течение 30 дней in vitro [27].
В 3D-печати при создании органа можно также не учитывать некоторые «детали», без которых на первых порах придется обойтись. Например, в почке помимо коркового и мозгового веществ c функциональными единицами — нефронами — существуют еще лимфоидные структуры. Они не так важны для осуществления главной функции органа, следовательно, в процессе его создания их можно «опустить». Сегодня уже известна печать (из настоящих клеток) искусственной кости, трахейных шин, почки и щитовидной железы, которые, правда, пока не используют в реальной медицинской практике [28].
Напечатанные органы не внедряются в тело человека, но зачастую служат 3D-моделями, которые предваряют сложнейшие операции. Например, в 2016 году в одном из госпиталей китайского Шанхая разделили сиамских близнецов, которые срослись грудиной, диафрагмой, печенью и сердцем [29]. Доктор Дженнифер Ко-Ву начала готовиться к операции, когда мать близнецов была на 21 неделе беременности. Команда специалистов сделала множество КТ- и МРТ-снимков малышей как до, так и после их рождения, и спроектировала модель, которая позволила им уточнить особенности анатомического строения и разработать дальнейший план действий. В итоге в распоряжении ученых оказалось 3D-изображение органов на компьютере, а затем и напечатанный макет сердца из искусственных материалов (рис. 10). Именно оно и стало залогом успешного разделения близнецов.

Рисунок 10. 3D-модель сросшегося сердца близнецов, сделанная из искусственных материалов.
Но искусственно создать орган — это еще полдела. Если говорить об имплантате, который реально будут пересаживать человеку, а не использовать как наглядную модель, возникает ряд серьезных вопросов, над которыми стоило бы задуматься. Сколько лет такой орган будет храниться? Существует ли срок годности? Придется ли его со временем менять на новый? Владимир Миронов — один из пионеров в области 3D-биопечати, профессор Университета Вирджинии (Virginia Commonwealth University, США) и научный руководитель компании 3D Bioprinting Solutions — утверждает, что с учетом хранения органа до пересадки в специальном растворе, он будет поддерживаться в нужном состоянии до нескольких дней, а после имплантации не выйдет из строя до конца жизни [22].
Если говорить о безопасности искусственных органов, напечатанных на биопринтере, то в случае выращивания клеток для агрегатов с помощью клеток самого пациента (как это сделал Энтони Атала с мочевыми пузырями) и использования при печати одноразовых картриджей данная методика может снизить риски иммунного конфликта и попадания инфекции. Однако существует риск развития раковых заболеваний в искусственном органе после пересадки. Теоретически эту вероятность можно уменьшить проверкой материала на наличие в клетках потенциальных онкогенов — участков ДНК, которые в случае мутации способны превратить обыкновенную клетку в «бессмертного убийцу» [22]. Также важно, чтобы клетки, используемые в качестве материала для биопечати, имели соответствующие характеристики пролиферации. Если клетки делятся слишком мало или медленно, напечатанный орган быстро придет в негодность, а если наоборот, то на нем будут появляться ненужные новообразования. Учесть и проверить все вышеперечисленные параметры довольно сложно. Этот процесс требует определенных затрат времени, персонала и оборудования. Тем более такая технология 3D-биопринтинга сегодня считается довольно дорогостоящей. По предварительным оценкам, в 2016 году один искусственный имплантат стоил примерно 272 000 евро [30].
Чтобы избежать трудностей с подбором клеточного материала, в 2017 году ученые из Цюрихского университета предложили свое решение проблемы (которое, правда, вряд ли может быть применимо ко всем органам). Они напечатали на 3D-принтере силиконовое сердце [31]. Один из членов команды — Николас Корс — отметил, что их цель состояла в том, чтобы создать орган, который будет максимально приближен к оригиналу с учетом особенностей форм и функций. Действительно, искусственное сердце получилось мягким, не превышающим настоящее человеческое сердце по размеру, а его сокращения выглядят вполне естественными. Такой эффект достигли благодаря максимальной имитации морфологического строения реального органа. Искусственный аналог имеет два основных желудочка (как обыкновенное сердце) и третий дополнительный, который является «двигателем». В него входит и выходит сжатый воздух, за счет чего камера, сжимаясь и разжимаясь, перекачивает жидкость, которая в целях правдоподобности эксперимента имела ту же вязкость, что и кровь (рис. 11).

Рисунок 11. Силиконовое сердце, перекачивающее жидкость в экспериментальной установке.
сайт digitaltrends.com
Подобное изобретение, возможно, сможет заменить титановые или пластмассовые имплантаты, кардиостимуляторы. Однако пока оно имеет огромный недостаток. Силиконовое сердце способно сокращаться в естественном ритме лишь полтора часа, так как сам материал начинает деформироваться, что делает его абсолютно неприменимым на практике.
Сегодня одним из последних достижений 3D-биопечати является инновационная методика биопринтинга, основанная на магнитной и акустической левитации тканевых сфероидов (конгломератов), разрабатываемая лабораторией клеточных исследований российской компании 3D Bioprinting Solutions, которую представили 15 сентября 2017 года на международном симпозиуме в Индианополисе, США [32]. Эта методика позволяет не использовать в качестве временной поддержки при сборке тканевых конструктов гидрогели, которые часто оказывают негативное токсическое влияние на напечатанную ткань при дальнейшем созревании. Дополнительно при левитационном способе сборки конструкта тканевые сфероиды не испытывают механический стресс, который характерен при экструзионном способе биопечати (технология получения изделий путем продавливания вязкого расплава материала или густой пасты через формующее отверстие). Способ биопечати, представленный лабораторией 3D Bioprinting Solutions, впечатлил присутствующих своей уникальностью и вызвал живой отклик и поток вопросов из аудитории. На сегодняшний день данная методика находится в разработке.
Развитие 3D-технологий могло бы оказаться полезным не только на медицинском поприще! Если биопечать окажется успешной и безопасной методикой (и не очень дорогой), то, по мнению уже упомянутого выше Владимира Миронова, мировой рынок нелегальной торговли донорскими органами потерпит крах, так как на них просто исчезнет спрос [22]. Известны средние нелегальные цены на имплантаты: почка оценивается от 10 до 100 тыс. евро, печень — 20–150 тыс. долларов, сердце — 250 тыс. долларов, поджелудочная железа — 45 тыс. долларов, роговица глаза — 5 тыс. долларов. Высокие цены на нелегальном рынке обусловливают вовлечение в подпольный бизнес организованной, в том числе транснациональной, преступности [33].
Возможно, напечатанные органы и ткани также можно будет использовать в пластической хирургии, например для омоложения. Какие именно стороны жизни человека технология объемной печати действительно изменит, пока не ясно. В любом случае, это вопрос будущего: сейчас технология производства 3D-органов находится на ранних стадиях своего развития.
Куда нас приведут новые технологии?
Да, сегодня мы много говорим о новейших идеях, перспективах, технических трудностях, моральных проблемах, неоткрытых молекулярных механизмах, о возможностях их поставить на службу человечеству... Однако с каждым открытием необходимо задумываться о его рациональном и правильном применении, а также о последствиях, которые оно может повлечь за собой. Каков же будет конечный результат внедрения подобных технологий в масштабах всего человечества? Достижения регенеративной медицины направлены на улучшение человеческой жизни с исключительно благородной целью, но к чему это может привести в будущем? Будет ли момент, когда подобной технологии надо будет сказать «стоп»? Вдруг дело дойдет до создания организмов целиком с помощью 3D-принтера, как бы фантастически это ни звучало? На эти вопросы тоже придется искать ответ.
Литература
- E. A. B. Gilbert, S. L. Delorme, M. K. Vickaryous. (2015). The regeneration blastema of lizards: an amniote model for the study of appendage replacement. Regeneration. 2, 45-53;
- Ежова Т.А. (2017). Генетика стволовых клеток. Лекция в «Сириусе»;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Ковалев А.В. (2014). Стволовые клетки и рак. Лаборатория инновационных биомедицинских технологий;
- 10 ведущих причин смерти в мире. (2017). Информационный бюллетень ВОЗ;
- Брутер А. (2015). Регенерация сердца. «Полит.ру»;
- Talwar P.K. and Jhingran A.G. Inland fishes of India and adjacent countries. Oxford & IBH Pub. Co., 1991. — 1158 p.;
- Naoyuki Tahara, Michael Brush, Yasuhiko Kawakami. (2016). Cell migration during heart regeneration in zebrafish. Dev. Dyn.. 245, 774-787;
- Junji Itou, Ryutaro Akiyama, Steve Pehoski, Xiaodan Yu, Hiroko Kawakami, Yasuhiko Kawakami. (2014). Regenerative responses after mild heart injuries for cardiomyocyte proliferation in zebrafish. Dev. Dyn.. 243, 1477-1486;
- J. Itou, I. Oishi, H. Kawakami, T. J. Glass, J. Richter, et. al.. (2012). Migration of cardiomyocytes is essential for heart regeneration in zebrafish. Development. 139, 4133-4142;
- Ежова Т.А. (2017). Генетическая программа развития. Лекция в «Сириусе»;
- Сердце и кровообращение рыб. BioFile;
- E. R. Porrello, A. I. Mahmoud, E. Simpson, J. A. Hill, J. A. Richardson, et. al.. (2011). Transient Regenerative Potential of the Neonatal Mouse Heart. Science. 331, 1078-1080;
- Смирнова Ю. (2011). Регенерация сердца. «Наука и жизнь»;
- Gabriele D’Uva, Alla Aharonov, Mattia Lauriola, David Kain, Yfat Yahalom-Ronen, et. al.. (2015). ERBB2 triggers mammalian heart regeneration by promoting cardiomyocyte dedifferentiation and proliferation. Nat Cell Biol. 17, 627-638;
- Васильева Н. (2004). Кристиан Барнард // Помощник Бога. «Дело»;
- Будчатов Ю.И. Трансплатационная иммунология. Тверь: ТГМА, 2012. — 36 с.;
- Wilhelm M.J. (2015). Long-term outcome following heart transplantation: current perspective. J. Thorac. Dis. 7, 549–551;
- Eisen H.J. (2016). Patient education: heart transplantation (beyond the basics). UpToDate;
- Allyson Fry Davidson, Cameron Glasscock, Danielle R. McClanahan, James D. Benson, Adam Z. Higgins. (2015). Toxicity Minimized Cryoprotectant Addition and Removal Procedures for Adherent Endothelial Cells. PLoS ONE. 10, e0142828;
- Rapp N. and Vandermey A. (2017). Here’s what every organ in the body would cost to transplant. Fortune;
- Миронов В. (2013). Биопечать вместо донорских органов. «Наука и Жизнь»;
- A. Atala. (2011). Tissue engineering of human bladder. British Medical Bulletin. 97, 81-104;
- Sean V Murphy, Anthony Atala. (2014). 3D bioprinting of tissues and organs. Nat Biotechnol. 32, 773-785;
- Искусственные органы и тканевая инженерия;
- Thore M. Bücking, Emma R. Hill, James L. Robertson, Efthymios Maneas, Andrew A. Plumb, Daniil I. Nikitichev. (2017). From medical imaging data to 3D printed anatomical models. PLoS ONE. 12, e0178540;
- Bryan W. (2016). Vascular tissue challenge. NASA;
- Russian scientists use first-ever 3D printed thyroid gland in successful transplant surgery. (2015). Open Biomedical Initiative;
- Millsaps B.B. (2016). Conjoined twins with rare atrial attachment are successfully separated thanks to 3D printed cardiac model. 3Dprint.com;
- Barnes E. (2016). 3D printing of human organs on the horizon. Medical Physics Lab.;
- Nicholas H. Cohrs, Anastasios Petrou, Michael Loepfe, Maria Yliruka, Christoph M. Schumacher, et. al.. (2017). A Soft Total Artificial Heart-First Concept Evaluation on a Hybrid Mock Circulation. Artificial Organs. 41, 948-958;
- Участие лаборатории в международном симпозиуме в Индианополисе, США. (2017). 3D Bioprinting Solutions;
- Степанов И. (2016). Черный рынок человеческих органов. «Право-мед.ру».







