Как анеуплоидия раковых клеток снижает эффективность химиотерапии и что с этим делать?
27 февраля 2021
Как анеуплоидия раковых клеток снижает эффективность химиотерапии и что с этим делать?
- 949
- 0
- 5
Раковые клетки легких
Anne Weston, EM STP, The Francis Crick Institute/Science Photo Library
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Лечение рака — сложный многоступенчатый процесс, на успешность которого влияет множество факторов. Их изучение необходимо для того, чтобы определить наиболее действенные методы борьбы с онкологическими заболеваниями. При этом механизмы устойчивости иногда срабатывают довольно парадоксальным, на первый взгляд, образом. Так, анеуплоидия характерна для большинства раковых клеток и снижает эффективность химиотерапии. При этом анеуплоидные клетки проходят клеточный цикл куда медленнее, чем эуплоидные, а значит, опухоль растет не так активно. Новое исследование объясняет механизмы этой резистентности и на их основе предлагает способы повысить эффективность терапии.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В этой статье мы расскажем об исследовании [1], которое подтвердило, что устойчивость (резистентность) раковых клеток к воздействию распространенных препаратов химиотерапии напрямую связана с анеуплоидией — ситуацией, при которой число хромосом отклоняется от нормального: их больше или меньше, чем в диплоидном наборе. Состояние, при котором одна хромосома отсутствует, называется моносомией, если есть одна лишняя хромосома — трисомией (рис. 1), если две — тетрасомией и т.д.
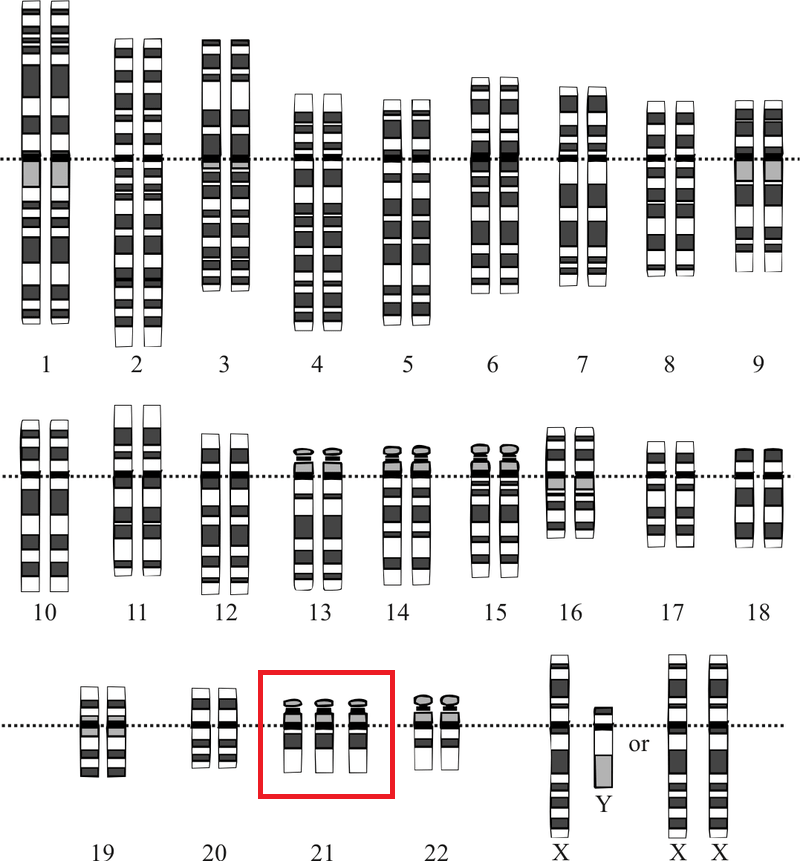
Рисунок 1. Хромосомный набор человека с синдромом Дауна — одного из самых известных проявлений анеуплоидии с трисомией по 21 хромосоме
National Human Genome Research Institute, Human Genome Project
Из-за нарушений процесса деления раковых клеток хромосомы между дочерними клетками часто распределяются аномально. Поэтому анеуплоидия характерна для 90% злокачественных образований и служит маркером рака (рис. 2) [2]. Несмотря на то, что подобные нарушения замедляют рост опухоли, обнаружение анеуплоидии ухудшает прогноз для больного с онкологией. Так, исследование итальянских ученых, проведенное в конце 80-х годов XX века, показало, что в три раза больше пациентов выживает, если клетки опухоли имеют нормальный набор хромосом [3]. Но почему? Как состояние, которое мешает благополучному развитию клетки, оказывается в итоге преимуществом для опухоли?
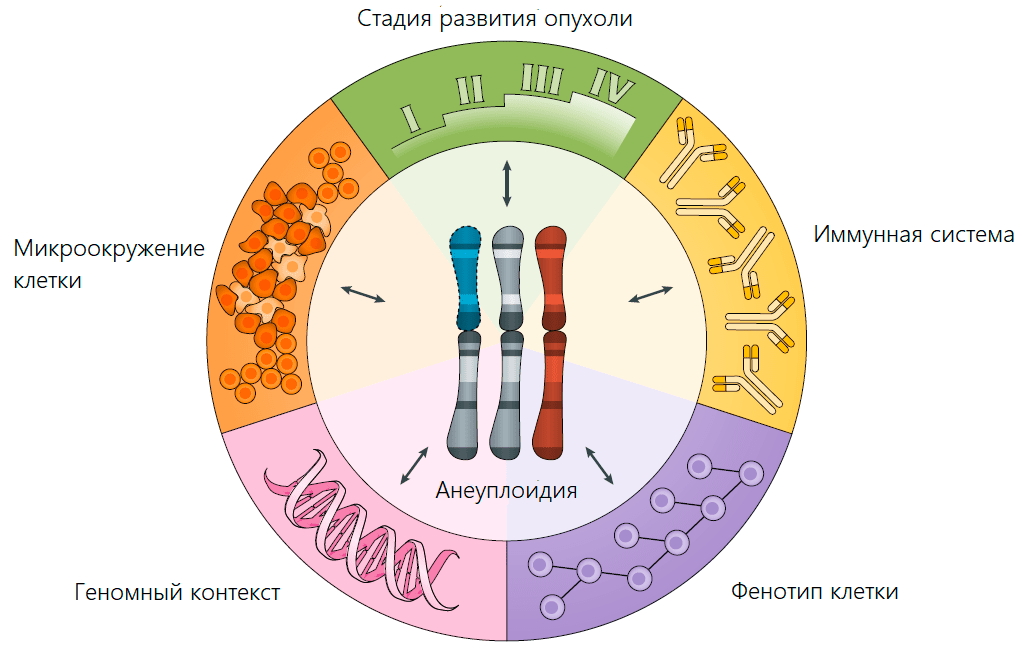
Рисунок 2. Основные факторы, определяющие адаптивную ценность анеуплоидии (то же справедливо и в обратную сторону)
Чтобы это выяснить, международный коллектив исследователей из Университета Тель-Авива, Массачусетского технологического института, Гарвардского университета и ряда других исследовательских центров США изучал, как ведут себя раковые клетки с разным набором хромосом при воздействии на них двух наиболее распространенных препаратов для химиотерапии: паклитаксела и цисплатина. Эти лекарства останавливают развитие опухоли, но имеют разные механизмы действия.
Паклитаксел (как и другие препараты из группы таксанов) влияет на сборку микротрубочек — структур внутреннего скелета клетки (см. рис. 7). Микротрубочки выполняют разные функции, в том числе формируют центриоли и веретено деления, которые разводят хромосомы к противоположным полюсам клетки во время ее деления. Паклитаксел стимулирует формирование микротрубочек, связываясь с молекулами β-тубулина — части димерного тубулина — белка, из которого построены микротрубочки. Но микротрубочки должны постоянно перестраиваться (удлиняться и укорачиваться на разных концах) за счет полимеризации тубулина или распада его полимера. А паклитаксел как раз блокирует этот распад, стабилизируя микротрубочки и предотвращая их реорганизацию. Это мешает расхождению хромосом и делает невозможным митоз — деление клетки на две генетически идентичные копии. Продолжительная задержка на этапе деления ведет к гибели клетки или возвращает ее обратно в фазу покоя. Так паклитаксел не позволяет клеткам делиться, мешая росту опухоли.
Цисплатин, в свою очередь, имеет в составе атомы платины, которые связываются с основаниями ДНК, повреждая ее. Если во время S-фазы (от англ. synthesis — «синтез») клеточного цикла, когда ДНК реплицируется — то есть на ее основе формируются две дочерних копии, — обнаружатся ее повреждения, то репликация остановится. А так как без удвоения молекулы ДНК клетка делиться не может, то в результате цисплатин предотвращает деление клеток и рост опухоли (см. рис. 7).
Итак, оба препарата нарушают клеточный цикл, но на разных его этапах. Однако при анеуплоидии механизм действия цитостатиков (таких как цисплатин и паклитаксел), предотвращающий деление клетки, не срабатывает, и опухоль благополучно растет. Почему так происходит? Авторы исследования полагают, что ключевую роль играют два фактора: замедленный рост и отложенное деление клеток с аномальным набором хромосом.
Клетки с анеуплоидией, как правило, делятся реже, чем эуплоидные (с нормальным хромосомным набором), за счет удлиненной интерфазы клеточного цикла [5], [6], которую клетка проходит между делениями (рис. 3). Точнее, затягиваются первые два этапа интерфазы: G1 (от англ. gap — «промежуток») и S, на которые приходятся многие процессы, связанные с ростом клетки. Эта задержка вызвана множественными характерными для анеуплоидии нарушениями в работе генов, влекущими за собой неправильную укладку белков, последующие нарушения их обмена и вытекающие из этого сбои в функционировании клетки — протеотоксический стресс, и нестабильность генома из-за изменений в клеточном обмене веществ. Казалось бы, медленное разрастание опухоли должно облегчать борьбу с онкологическим заболеванием, однако выходит наоборот — удлиненные фазы G1 и S связаны с бо́льшей устойчивостью клеток к препаратам.
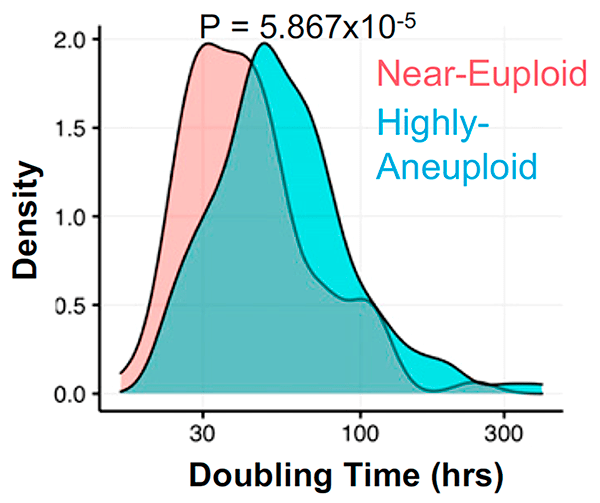
Рисунок 3. Гистограмма, иллюстрирующая, что время удвоения (doubling time) для анеуплоидных клеток выше, чем для эуплоидных. Построена на основе данных из базы Cancer Cell Line Encyclopedia (CCLE).
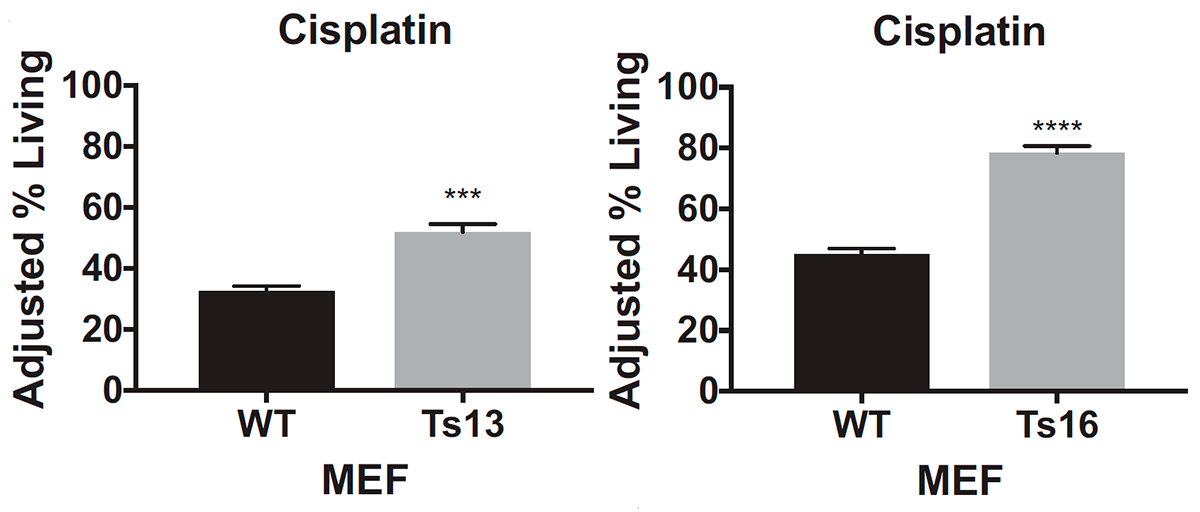
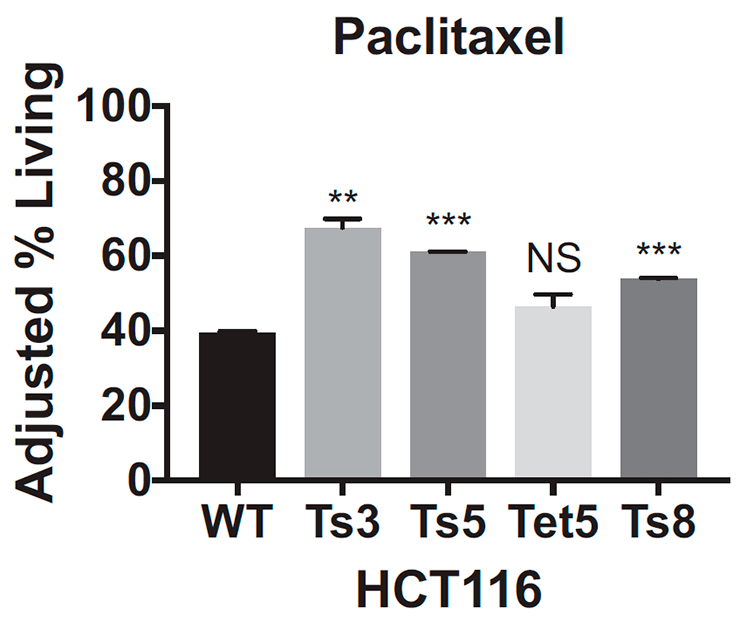
Ученые выяснили это, когда проверяли эффективность цисплатина и паклитаксела, воздействуя этими препаратами на специально выведенные клеточные линии — генетические копии одной клетки. Действие цисплатина рассматривали на материале эмбриональных клеток соединительной ткани мышей: отдельно с трисомией по 13-й и по 16-й хромосомам, а также клеток с нормальным хромосомным набором от эмбрионов того же помета. Так как клетки соединительной ткани мышей обычно отзываются на действие паклитаксела слабо, то для него были выбраны раковые клетки толстой кишки: часть из них была псевдодиплоидной, то есть имела нормальное число хромосом, но с некоторыми аномалиями в структуре, а другую часть составляли три клеточные линии с трисомией по 3-й, 5-й и 8-й хромосомам.
После воздействия на клетки цисплатином или паклитакселом ученые подсчитали количество выживших: клетки с трисомией при добавлении обоих препаратов выживали чаще, чем эуплоидные: примерно на 20–40% (рис. 4а) для цисплатина и на 10–30% для паклитаксела (рис. 4б).
Из этих данных ученые сделали вывод, что, во-первых, оба препарата оказываются неэффективными для клеток с трисомией, а во-вторых, резистентность возникает независимо от того, по какой хромосоме анеуплоидия. Ученые также посмотрели, как ведут себя раковые клетки толстой кишки с тетрасомией по 5-й хромосоме, однако результаты, полученные на этой клеточной линии, не были статистически значимыми. К сожалению, авторы исследования никак это не прокомментировали и больше клеточные линии с анеуплоидией типов, отличных от трисомии, не проверяли, поэтому как ведут себя клетки с моносомией или тетрасомией пока неизвестно. Будем надеяться, что исследования в этой области появятся в недалеком будущем.
Уже на этом этапе изучения можно предположить, что случаи трисомии по разным хромосомам должны объединять некоторые общие нарушения, вызванные анеуплоидией, которые помогают им противостоять воздействию препарата. Такой потенциальной точкой пересечения ученые посчитали изменения в длительности клеточного цикла в виде задержки фаз G1 и S.
Подтвердили гипотезу и данные о влиянии палбоциклиба — противоракового препарата, который тоже тормозит развитие клеток. Он подавляет четвертую и шестую циклинзависимые киназы, регулирующие смену фаз клеточного цикла (см. рис. 7) [7]. Были зарегистрированы случаи, когда применение палбоциклиба снижало эффективность лечения некоторыми препаратами, в том числе из группы таксанов [8]. Логично допустить, что и здесь свое влияние оказала задержка в начале интерфазы. Экспериментальные данные подтвердили догадку: после воздействия на псевдодиплоидные клетки толстой кишки палбоциклибом, а затем — цисплатином и паклитакселом, клетки действительно выживали чаще: примерно на 20% для цисплатина и на 30% для паклитаксела (рис. 5).
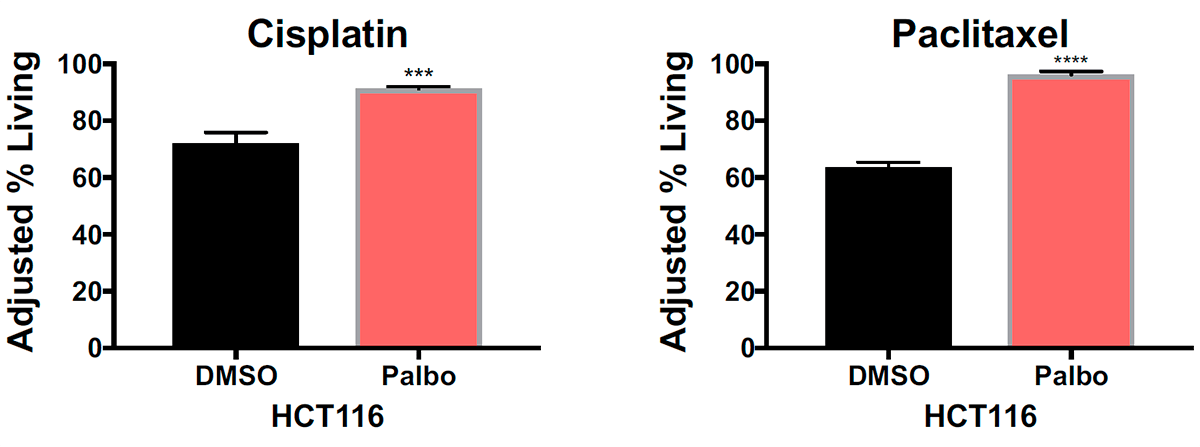
Рисунок 5. Процент выживших клеток после воздействия на псевдодиплоидные раковые клетки толстой кишки (HCT116) сначала растворителем диметилсульфоксидом (DMSO) или палбоциклибом (Palbo), а затем цисплатином (Cisplatin) или паклитакселом (Paclitaxel). *** — P<0,001; **** — P<0,0001.
Кроме того, ученые проверили, насколько эффективно другие препараты для химиотерапии, работающие за счет вмешательства в клеточный цикл, воздействуют на различные линии раковых клеток человека в зависимости от степени их анеуплоидности (по данным Cancer Cell Line Encyclopedia). Они обнаружили, что к 29 препаратам из 34 рассмотренных анеуплоидные клетки оказывались более устойчивыми, чем эуплоидные, причем в 21 случае анеуплоидии сопутствовало замедленное деление клеток (рис. 6).
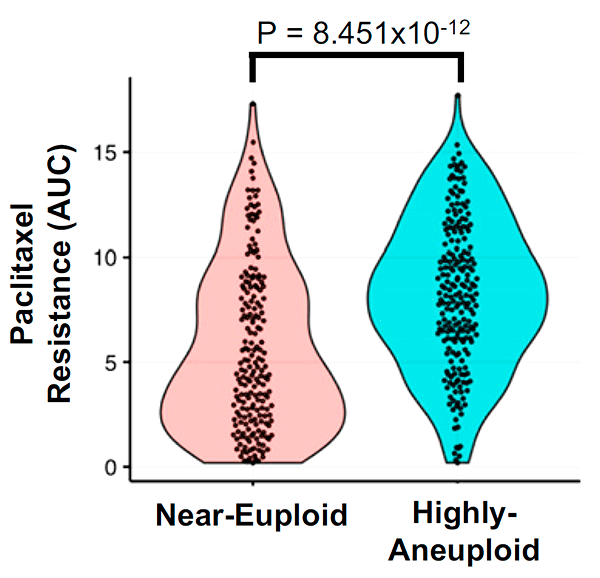
Рисунок 6. Связь между чувствительностью к паклитакселу и степенью анеуплоидности для клеточных линий. Данные взяты из базы Cancer Cell Line Encyclopedia (CCLE).
Связь между анеуплоидностью и резистентностью к цисплатину оказалась статистически незначимой, так как во всех случаях в качестве растворителя использовался диметилсульфоксид, который согласно исследованиям снижает эффективность препаратов на основе платины [9].
Таким образом, исследования подтвердили, что анеуплоидия увеличивает резистентность к очень разным по принципу действия препаратам за счет одного из своих главных последствий — замедления клеточного цикла, вызванного удлиненными фазами G1 и S. Какими механизмами это может быть вызвано?
В случае с паклитакселом все достаточно просто. Этот препарат не дает хромосомам разойтись: он предотвращает образование веретена деления, тем самым убивая клетку. Однако если она застревает в G1-фазе, то она просто не доходит до той стадии клеточного цикла, когда препарат начинает действовать, и поэтому не умирает (рис. 7). Те клетки, чей процесс деления оказывается отложенным, выживают во время терапии, а затем, после того как препарат выводится из организма, могут делиться дальше.
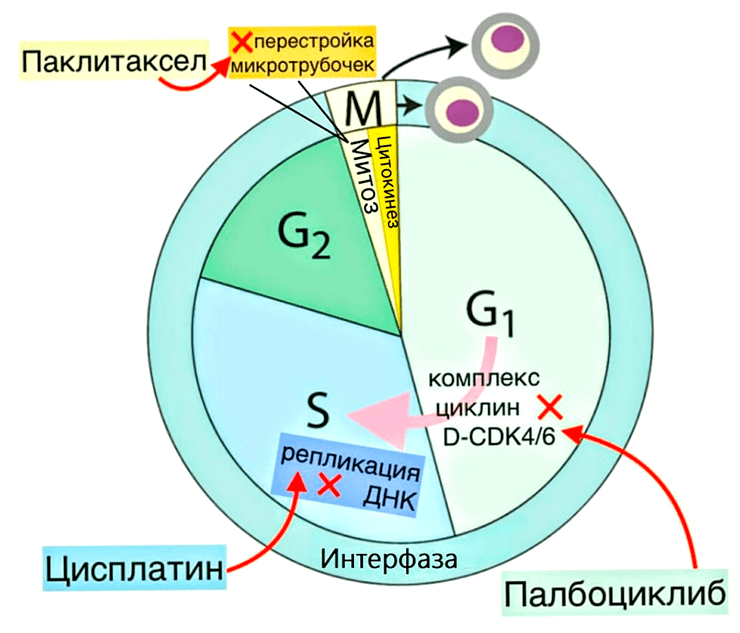
Рисунок 7. Схема клеточного цикла с указанием, в какие моменты обсуждаемые в статье препараты нарушают его работу. М-фаза включает в себя митоз и цитокинез (разделение двух дочерних клеток). Интерфаза — G1-фазу (происходит рост клетки, увеличивается количество органелл), S-фазу (репликация ДНК) и G2-фазу (рост клетки и подготовка к делению, устранение поломок в ДНК). Для перехода из G1-фазы в S-фазу в клетке должен собраться комплекс D-CDK4/6 из белков циклина D и четвертой и шестой циклинзависимых киназ (CDK4 и CDK6 от cell division protein kinase). Палбоциклиб ингибирует эти киназы, поэтому из-за его воздействия клетка уходит в фазу покоя G0, то есть не делится, — так препарат мешает росту опухоли. Цисплатин, нарушая структуру ДНК, останавливает клеточный цикл на S-фазе. Паклитаксел мешает перестройкам микротрубочек, нарушая работу веретена деления, из-за чего не происходит расхождение хромосом, и деление клетки задерживается: она либо возвращается в интерфазу, либо погибает.
Regulation of the Cell Cycle (Interactive Tutorial), рисунок с изменениями
С цисплатином все немного сложнее — он повреждает структуру ДНК вне зависимости от стадии клеточного цикла, однако эти повреждения оказываются критичны только во время S-фазы, когда происходит репликация ДНК. На первый взгляд, механизм резистентности может быть таким же, как в случае с паклитакселом: клетка просто не успевает дойти до нужной стадии цикла. Но авторы исследования полагают, что свою роль может играть и другой механизм. Так как цисплатин проникает в клетку за счет пассивной диффузии, то снижение потребления вещества клеткой с отложенной G1-фазой или повышение его оттока из нее приводят к уменьшению платиновых аддуктов в составе ДНК клетки, а соответственно к уменьшению повреждений. Однако для полного понимания того, как эти механизмы работают для цисплатина, необходимы дополнительные исследования.
Это новое знание важно не только для науки, но и для медицинской практики. Во-первых, мы теперь лучше понимаем, почему химиотерапия может становиться неэффективной, а значит — сможем придумать, как это исправить. Например, меняя геном анеуплоидных клеток и искусственно ускоряя их деление, мы можем повысить их чувствительность к препаратам. Во-вторых, стало очевидно, что нельзя использовать палбоциклиб до или во время химиотерапии, хотя после нее он может помочь. И, в-третьих, нам нужно разрабатывать лекарства, действие которых никак не привязано к конкретным стадиям цикла, потому что многие из ныне существующих, такие как цисплатин, например, хотя и не зависят, на первый взгляд, от той или иной фазы, тем не менее, оказываются неэффективными, если клетки не достигают определенного этапа.
Важно, что анеуплоидия помимо замедленного деления вызывает еще множество других последствий, которые могут повышать резистентность. Например, за счет нестабильности генома у таких клеток больше шансов приобрести мутации, которые помогут им приспособиться к неблагоприятным условиям. То, как еще анеуплоидия влияет на раковые клетки, пока что мало изучено. Несмотря на сделанный человечеством большой шаг на пути к пониманию того, как эффективно бороться с болезнью, это лишь один из множества шагов, которые нам только предстоит пройти.
Литература
- John Michael Replogle, Wen Zhou, Adrianna E. Amaro, James M. McFarland, Mariana Villalobos-Ortiz, et. al.. (2020). Aneuploidy increases resistance to chemotherapeutics by antagonizing cell division. Proc Natl Acad Sci USA. 117, 30566-30576;
- Beth AA Weaver, Don W Cleveland. (2006). Does aneuploidy cause cancer?. Current Opinion in Cell Biology. 18, 658-667;
- Sciallero S., Giaretti W., Geido E., Bonelli L., Zhankui L., Saccomanno S. et al. (1993). DNA aneuploidy is an independent factor of poor prognosis in pancreatic and peripancreatic cancer. Int. J. Pancreatol. 1, 21–28;
- Uri Ben-David, Angelika Amon. (2020). Context is everything: aneuploidy in cancer. Nat Rev Genet. 21, 44-62;
- Stefano Santaguida, Amelia Richardson, Divya Ramalingam Iyer, Ons M'Saad, Lauren Zasadil, et. al.. (2017). Chromosome Mis-segregation Generates Cell-Cycle-Arrested Cells with Complex Karyotypes that Are Eliminated by the Immune System. Developmental Cell. 41, 638-651.e5;
- Rebecca R. Thorburn, Christian Gonzalez, Gloria A. Brar, Stefan Christen, Thomas M. Carlile, et. al.. (2013). Aneuploid yeast strains exhibit defects in cell growth and passage through START. MBoC. 24, 1274-1289;
- Fry D.W., Harvey P.J., Keller P.R., Elliott W.L., Meade M., Trachet E. et al. (2004). Specific inhibition of cyclin-dependent kinase 4/6 by PD 0332991 and associated antitumor activity in human tumor xenografts. Molecular cancer therapeutics. 11, 1427–1438;
- Jeffry L. Dean, A.Kathleen McClendon, Erik S. Knudsen. (2012). Modification of the DNA Damage Response by Therapeutic CDK4/6 Inhibition. Journal of Biological Chemistry. 287, 29075-29087;
- Matthew D. Hall, Katherine A. Telma, Ki-Eun Chang, Tobie D. Lee, James P. Madigan, et. al.. (2014). Say No to DMSO: Dimethylsulfoxide Inactivates Cisplatin, Carboplatin, and Other Platinum Complexes. Cancer Res. 74, 3913-3922.