Иммунотерапия рака и молекулярная онкология — новинки на переднем крае науки
13 мая 2024
Иммунотерапия рака и молекулярная онкология — новинки на переднем крае науки
- 630
- 0
- 7
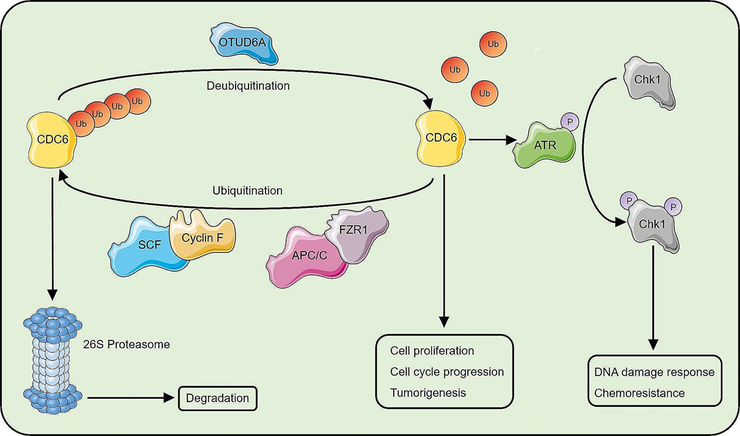
Сигнальный путь OTUD6A-CDC6 регулирует пролиферацию и реакцию на повреждение ДНК. OTUD6A связывается с регулятором клеточного цикла СDC6, деубиквитинирует его — и таким образом способствует пролиферации клеток и их устойчивости к химиотерапии.
-
Автор
-
Редакторы
Разнообразие исследований в онкологии отражает многоликость этой группы заболеваний — ежемесячно выходят десятки работ, в которых злокачественные опухоли исследуются на всех уровнях, от молекулярного до популяционного. Мы предлагаем вашему вниманию дайджест наиболее интересных исследований из самых уважаемых научных журналов мира, чтобы ориентироваться в море новой информации.
Иммунотерапия с помощью Т-клеток с химерным рецептором (CAR-T) произвела революцию в терапии онкологических заболеваний. Однако на молекулярном уровне каждый случай уникален — тем ценнее развитие single-cell технологий, которые позволяют на уровне генома, транскриптома и протеома опухолевых клеток проводить исследования, устанавливать корреляции, прогнозировать течение заболевания. Ученым из Лейпцига и Кельна (Германия) с помощью мультиомиксного анализа индивидуальных клеток удалось обнаружить потенциальные маркеры ответа на CAR-T терапию при рецидивирующей/рефрактерной множественной миеломе (РРММ). Они с помощью афереза собирали образцы мононуклеарных клеток периферической крови у людей с диагностированной РРММ сразу после введения Т-клеток с химерным рецептором и позже — на 7, 14, 30 и 100 день. Также на 30-й день у пациентов собирали образцы мононуклеарных клеток костного мозга для сравнительного анализа.
Оказалось, что CAR-T терапия вызывает изменения не только в количественном составе клеток, но также и в экспрессии генов у клеток-свидетелей (bystander cells) иммунной терапии. У пациентов, для которых терапия прошла почти или вовсе без ответа микроокружение опухоли носило иммуносупрессивный характер. Там снижалось количество CD14+ моноцитов и клеток — естественных киллеров — и значительно падала их активность. И наоборот, у пациентов с полным ответом на терапию после введения CAR-T клеток ученые наблюдали активацию Т-клеточного ответа, что было видно по CD8+ и CD4+ T-клеткам (но не тем CAR-T клеткам, которые были введены при исследовании). Полный список изменений в экспрессии генов и особенности иммунного окружения опухоли между пациентами с полным ответом и негативным ответом на терапию читайте в статье [1].
Активировать CD8+ Т клетки с помощью гибридного белка, состоящего из интерлейкина-2 (IL-2) и специфического антитела к CD8, учились онкологи из США совместно с коллегой из Голландии. IL2 влияет на самые разные иммунные клетки, поэтому иммунотерапия с его помощью хоть и показывает положительные результаты, остается не слишком эффективной из-за высокой токсичности и низкой специфичности IL-2 и необходимости частого введения препарата. Для того, чтобы усилить активность IL-2 в отношении Т-клеток, ученые совместили сигнальную часть IL-2 с антителом к CD8, которые экспрессируются на цитотоксических Т-лимфоцитах, что по задумке должно усилить их антиопухолевый эффект. Действие молекулы, названной AB248, было проверено in vitro и на модельных организмах — мышах и макаках-крабоедах. Результаты исследования опубликованы в журнале Cancer Discovery [2].
Их коллеги из Мемориального онкологического центра имени Слоуна-Кеттеринга создали свой вариант биспецифических антител [3] с несколько неканонической структурой, также призванных привлекать Т-клетки к специфическим антигенам злокачественных клеток опухоли поджелудочной железы. В статье [4] они представили результаты своей работы и данные об эффективности биспецифических антител на основе иммуноглобулина G, способных связываться с EGFR/HER2-рецепторами на раковых клетках.
Кроме того, в журнале Nature Cancer был опубликован отчет о первой стадии клинических испытаний аутологичных CAR-T-клеток, специфичных к HER2 у пациентов с запущенной саркомой. На этой стадии клинических испытаний должны определить безопасность препарата и его предельно допустимую дозу. Результаты исследования выглядят обнадеживающими: около 50% испытуемых продемонстрировали положительный (антираковый) ответ на терапию, а показатели побочных эффектов не выходят за рамки допустимого. Подробнее об успехах первой стадии исследований читайте в статье [5].
Несмотря на развитие иммунотерапии с привлечением собственных сил организма или внешних ресурсов, направлением иммунных клеток по адресу или снятием блокировок с иммунных клеток, химиотерапия остается весьма важной частью стратегии борьбы со злокачественными новообразованиями. Группа ученых из Шаньдуня (Китай) обнаружила, что деубиквитинирование белка CDC6 приводит к пролиферации раковых клеток и их устойчивости к химиотерапии.
CDC6 (Cell division cycle) — протоонкоген, концентрация которого в клетке колеблется в зависимости от стадии клеточного цикла. Этот белок подвержен протеолизу посредством убиквитинирования, однако это обратимый процесс, и убиквитиновая метка может быть снята с CDC6 неизвестной до недавнего времени деубиквитиназой. Было обнаружено, что количество CDC6 в клетке находится в прямой зависимости от концентрации белка OTUD6A, причем увеличивалось именно присутствие CDC6, но не количество его мРНК. На моделях мышей, нокаутных по гену OTUD6A, ученые подтвердили результаты, полученные на клеточных линиях. А у мышей с индуцированными опухолями и оверэкспрессией гена OTUD6A злокачественные клетки были более устойчивы к химиотерапии. В статье [6], опубликованной в журнале Molecular Cancer, ученые предполагают, что ингибирование пути OTUD6A-CDC6 может быть новой многообещающей целью в стратегиях онкотерапии.
Больше статей:
- Cancer incidence, treatment, and survival in the prison population compared with the general population in England: a population-based, matched cohort study [7] — о заболеваемости раком и возможностях лечения в тюрьмах в сравнении с свободным населением.
- Changes in hospital mortality in patients with cancer during the COVID-19 pandemic (ISARIC-CCP-UK): a prospective, multicentre, cohort study [8] — внутрибольничная смертность онкологических больных от COVID-19: больные, получавшие лечение от рака, оказались в группе риска.
- Co-transcriptional R-loops-mediated epigenetic regulation drives growth retardation and docetaxel chemosensitivity enhancement in advanced prostate cancer [9] — инсулиноподобный фактор роста и регулирование роста и миграции злокачественных клеток рака предстательной железы.
- Exclusion of HDAC1/2 complexes by oncogenic nuclear condensates [10] — первое свидетельство ремоделирования ядерного конденсата с приобретением онкогенной функции.
- Mutation of neurotrophic tyrosine receptor kinase can promote pan-cancer immunity and the efficacy of immunotherapy [11] — клинический и биоинформатический анализ мутации нейротрофической тирозинкиназы, которая повышает иммуногенность раковой опухоли.
- The incorporation of acetylated LAP-TGF-β1 proteins into exosomes promotes TNBC cell dissemination in lung micro-metastasis [12] — о микроокружении метастаз в легком при трижды отрицательном раке молочной железы и о роли трансформирующего фактора роста бета (TGF-β).
- Trametinib sensitizes KRAS‑mutant lung adenocarcinoma tumors to PD‑1/PD‑L1 axis blockade via Id1 downregulation [13] — увеличение активности протеасом ингибитором траметинибом и ограничения применения данного препарата.
- Continuously improving outcome over time after second allogeneic stem cell transplantation in relapsed acute myeloid leukemia: an EBMT registry analysis of 1540 patients [14] — о факторах, улучшающих ответ на вторичную аллогенную трансплантацию стволовых клеток при рецидиве острого миелоидного лейкоза.
- Induction of NK cell reactivity against acute myeloid leukemia by Fc-optimized CD276 (B7-H3) antibody [15] — новое моноклональное антитело для специфического привлечения клеток — естественных киллеров к злокачественным клеткам при остром миелоидном лейкозе.
- Patient-derived follicular lymphoma spheroids recapitulate lymph node signaling and immune profile uncovering galectin-9 as a novel immunotherapeutic target [16] — о моделировании микроокружения опухоли in vitro на основе сфероидов фолликулярной лимфомы, полученных от пациента.
- The Pan-RAF—MEK Nondegrading Molecular Glue NST-628 Is a Potent and Brain-Penetrant Inhibitor of the RAS—MAPK Pathway with Activity across Diverse RAS- and RAF-Driven Cancers [17] — молекулярный клей, ингибитор фосфорилирования на пути RAF—MEK в одном из основных онкогенных сигнальных каскадов MAPK.
Литература
- Michael Rade, Nora Grieb, Ronald Weiss, Jaren Sia, Luise Fischer, et. al.. (2024). Single-cell multiomic dissection of response and resistance to chimeric antigen receptor T cells against BCMA in relapsed multiple myeloma. Nat Cancer;
- Kelly D. Moynihan, Manu P. Kumar, Hussein Sultan, Danielle C. Pappas, Terrence Park, et. al.. (2024). IL2 Targeted to CD8+ T Cells Promotes Robust Effector T-cell Responses and Potent Antitumor Immunity. Cancer Discovery. OF1-OF20;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Alan W Long, Hong Xu, Brian H Santich, Hongfen Guo, Sayed Shahabuddin Hoseini, et. al.. (2024). Heterodimerization of T cell engaging bispecific antibodies to enhance specificity against pancreatic ductal adenocarcinoma. J Hematol Oncol. 17;
- Meenakshi Hegde, Shoba Navai, Christopher DeRenzo, Sujith K. Joseph, Khaled Sanber, et. al.. (2024). Autologous HER2-specific CAR T cells after lymphodepletion for advanced sarcoma: a phase 1 trial. Nat Cancer;
- Jianfeng Cui, Xiaochen Liu, Qinghong Shang, Shuna Sun, Shouzhen Chen, et. al.. (2024). Deubiquitination of CDC6 by OTUD6A promotes tumour progression and chemoresistance. Mol Cancer. 23;
- Margreet Lüchtenborg, Jennie Huynh, Jo Armes, Emma Plugge, Rachael M Hunter, et. al.. (2024). Cancer incidence, treatment, and survival in the prison population compared with the general population in England: a population-based, matched cohort study. The Lancet Oncology. 25, 553-562;
- Lance Turtle, Sarah Elliot, Thomas M Drake, Mathew Thorpe, Emma G Khoury, et. al.. (2024). Changes in hospital mortality in patients with cancer during the COVID-19 pandemic (ISARIC-CCP-UK): a prospective, multicentre cohort study. The Lancet Oncology. 25, 636-648;
- Yufan Ying, Yuqing Wu, Fenghao Zhang, Yijie Tang, Jiahe Yi, et. al.. (2024). Co-transcriptional R-loops-mediated epigenetic regulation drives growth retardation and docetaxel chemosensitivity enhancement in advanced prostate cancer. Mol Cancer. 23;
- Junqi Kuang, Pengli Li, Ziwei Zhai, Yixin Fan, HuaiYuan Xu, et. al.. (2024). Exclusion of HDAC1/2 complexes by oncogenic nuclear condensates. Mol Cancer. 23;
- Congren Wang, Yingying Li, Jinyuan Huang, Huimeng Yan, Bin Zhao. (2024). Mutation of neurotrophic tyrosine receptor kinase can promote pan-cancer immunity and the efficacy of immunotherapy. Mol Cancer. 23;
- Pei Yu, Yubao Han, Lulu Meng, Zengying Tang, Zhiwei Jin, et. al.. (2024). The incorporation of acetylated LAP-TGF-β1 proteins into exosomes promotes TNBC cell dissemination in lung micro-metastasis. Mol Cancer. 23;
- Ander Puyalto, María Rodríguez-Remírez, Inés López, Irati Macaya, Elizabeth Guruceaga, et. al.. (2024). Trametinib sensitizes KRAS-mutant lung adenocarcinoma tumors to PD-1/PD-L1 axis blockade via Id1 downregulation. Mol Cancer. 23;
- Ann-Kristin Schmälter, Maud Ngoya, Jacques-Emmanuel Galimard, Ali Bazarbachi, Jürgen Finke, et. al.. (2024). Continuously improving outcome over time after second allogeneic stem cell transplantation in relapsed acute myeloid leukemia: an EBMT registry analysis of 1540 patients. Blood Cancer J.. 14;
- Sylwia A. Stefańczyk, Ilona Hagelstein, Martina S. Lutz, Stefanie Müller, Samuel J. Holzmayer, et. al.. (2024). Induction of NK cell reactivity against acute myeloid leukemia by Fc-optimized CD276 (B7-H3) antibody. Blood Cancer J.. 14;
- Cèlia Dobaño-López, Juan García Valero, Ferran Araujo-Ayala, Ferran Nadeu, Fabien Gava, et. al.. (2024). Patient-derived follicular lymphoma spheroids recapitulate lymph node signaling and immune profile uncovering galectin-9 as a novel immunotherapeutic target. Blood Cancer J.. 14;
- Meagan B. Ryan, Bradley Quade, Natasha Schenk, Zhong Fang, Marshall Zingg, et. al.. (2024). The Pan-RAF–MEK Nondegrading Molecular Glue NST-628 Is a Potent and Brain-Penetrant Inhibitor of the RAS–MAPK Pathway with Activity across Diverse RAS- and RAF-Driven Cancers. Cancer Discovery. OF1-OF16.