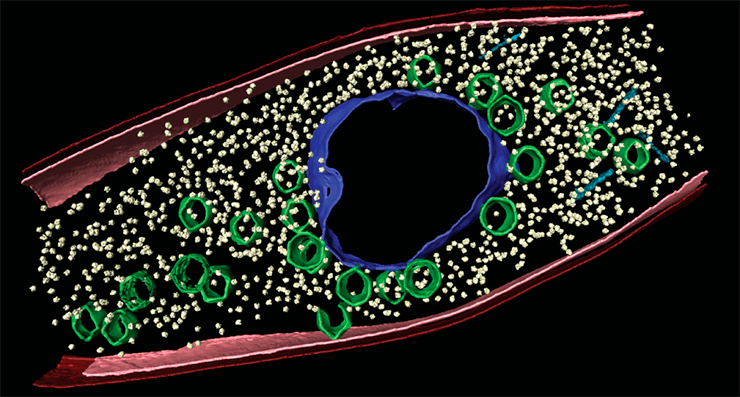
«Я в домике!»: бактериофаги, у которых есть ядра
21 декабря 2020
«Я в домике!»: бактериофаги, у которых есть ядра
- 740
- 0
- 6
Джамбо-фаги вызывают образование внутри бактериальной клетки структуры из специального вирусного белка, похожей на клеточное ядро. Внутри такого псевдоядра находится вирусная ДНК, которую белковая оболочка надежно оберегает от защитных систем CRISPR/Cas и эндонуклеаз рестрикции.
-
Автор
-
Редактор
Статья на конкурс «Био/Мол/Текст»: Крупные бактериофаги из группы джамбо-фагов вызывают формирование в инфицированной бактериальной клетке белковой структуры, похожей на клеточное ядро — псевдоядра. В него заключена вирусная ДНК и белки, необходимые для репликации и транскрипции. Псевдоядро локализовано строго в центре бактериальной клетки благодаря филаментам из кодируемого фагом аналога тубулина. Кроме того, белковое псевдоядро обеспечивает фагу защиту от систем рестрикции-модификации и CRISPR/Cas, направленных на разрушение вирусной ДНК. Эта статья посвящена биологии удивительных и во многих отношениях таинственных джамбо-фагов.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Считается, что оформленная структура, внутри которой сосредоточен генетический материал, есть только у эукариотических организмов. Однако, как показали исследования последних лет, некоторые бактериофаги, известные как джамбо-фаги, вызывают внутри клетки инфицированной бактерии образование центрально расположенной сферической белковой структуры, в которой находится вирусная ДНК и белки, необходимые для ее репликации и транскрипции. Более того, оказалось, что такие «псевдоядра» защищают генетический материал фагов от действия бактериальных систем рестрикции-модификации и CRISPR, направленных на уничтожение вирусной ДНК. Что это за загадочные джамбо-фаги и как устроены псевдоядра, которые образуются в инфицированных ими бактериях? Давайте разбираться.
Загадочные джамбо-фаги
Хотя бактериофаги были открыты более 100 лет назад, их разнообразие до последнего времени оставалось в значительной мере недооцененным. До появления методов высокопроизводительного секвенирования единственным доступным инструментом для описания различных бактериофагов был электронный микроскоп. Более 96% фагов, описанных с помощью электронной микроскопии, имеют весьма схожую организацию: они имеют «головку», внутри которой заключен генетический материал вируса, и «ножку», необходимую для взаимодействия с бактериальной клеткой, а их геном представлен кольцевой двухцепочечной молекулой ДНК длиной до 200 тысяч пар оснований (т.п.о.). По современной классификации они входят в порядок Caudovirales. Развитие метагеномики позволило получить геномные последовательности тысяч ранее неизвестных фагов из самых разнообразных природных источников — от фекалий до морской воды. Тут-то и выяснилось, что разнообразие фагов значительно больше, чем было принято считать. Оказалось, что существует множество фагов с геномами, размер которых существенно превышает 200 т.п.о. В 2009 году было предложено выделить фагов, геном которых содержит от 200 до 500 т.п.о., в особую группу — джамбо-фаги (Jumbo phages) [1]. Как оказалось, разделение это оказалось куда более глубоким, чем просто по размеру генома.
По состоянию на 2020 год в базе GenBank хранятся геномы более чем 150 джамбо-фагов. Большая часть из них относится к семейству Myoviridae и имеет длинные белковые хвосты, способные к сокращениям, а остальные принадлежат к семейству Siphoviridae, и хвосты у них не сокращаются. Стоит отметить, что джамбо-фаги довольно широко распространены в природе, однако долгое время они ускользали от внимания вирусологов из-за слишком большого размера вирусных частиц, который не позволял изолировать их с помощью стандартных протоколов для работы с бактериофагами [1].
В геномах джамбо-фагов наряду с генами, кодирующими структурные белки капсида и белки, необходимые для репликации генома, содержится множество генов, гомологи которых в других организмах на данный момент не известны. Например, в геноме фага φKZ, поражающего синегнойную палочку Pseudomonas aeruginosa, из более чем 300 идентифицированных генов лишь для 35 удалось найти родственников в геномах других организмов. Кроме того, даже у джамбо-фагов, поражающих одну и ту же бактерию, зачастую сходство по последовательностям минимально [1].
В больших, по меркам вирусов прокариот, геномах джамбо-фагов закодирован впечатляющий арсенал белков и РНК, необходимых для репликации, транскрипции и трансляции, что делает их в значительной мере независимыми от клеточных белков. Например, джамбо-фаг XacN1, инфицирующий бактерию Xanthomonas citri, кодирует 56 собственных тРНК, соответствующих всем 20 аминокислотам — абсолютный рекорд по количеству тРНК среди вирусов! Поскольку потребности джамбо-фагов в клеточных белках минимальны, спектр бактерий, заражаемых джамбо-фагами, весьма широк по сравнению с фагами, имеющими геномы меньшего размера [1].
С точки зрения структуры вириона джамбо-фаги также превосходят по сложности более мелких фагов. Например, вирион джамбо-фага 201φ2-1 состоит из 89 белков, в то время как в состав вириона относительно крупного фага T4, поражающего кишечную палочку Escherichia coli, входит около 50 белков. Кроме того, под внешней белковой оболочкой капсида у джамбо-фагов находится особая белковая структура, известная как «внутреннее тело» (inner body). На эту структуру, как на катушку, намотана геномная ДНК фага. Зачем джамбо-фагам нужно внутреннее тело, до конца неясно, но, возможно, оно обеспечивает правильную упаковку геномной ДНК [1].
Бактериофаги, у которых есть цитоскелет
Удивительно, но в геномах джамбо-фагов закодированы собственные цитоскелетные белки! Цитоскелет, состоящий из микротрубочек, актиновых и промежуточных филаментов, долгое время считался уникальной чертой эукариот, пока в 1991 году у кишечной палочки не описали гомолог тубулина (основного компонента микротрубочек), известный как FtsZ. Как и тубулин у эукариот, бактериальный тубулин участвует в процессе деления клетки. В 2012 году гомологи тубулина нашли у фага C-st, поражающего бактерию Clostridium botulinum (по размеру генома, однако, этот фаг до джамбо-фагов не дотягивает: длина его генома составляет около 186 т.п.о.). Чуть позже другой гомолог тубулина, получивший название PhuZ, был описан у упомянутого ранее джамбо-фага 201φ2-1, который инфицирует бактерию Pseudomonas chlororaphis. Белок PhuZ оказался весьма консервативным среди джамбо-фагов [2]. Но зачем бактериофагам так нужен белок цитоскелета, если у них и собственных клеток нет? Ответ оказался весьма неожиданным.
У эукариот микротрубочки играют важнейшую роль в функционировании клетки, в частности, они служат «рельсами» для внутриклеточных транспортных белков и обеспечивают расхождение хромосом при митозе. Именно из микротрубочек состоит веретено деления, которое в метафазе митоза удерживает хромосомы в центре клетки, а в анафазе растаскивает их по двум полюсам делящейся клетки. Фаговый аналог тубулина PhuZ делает что-то похожее: он формирует некое подобие митотического веретена, которое обеспечивает локализацию вирусной ДНК строго в центре бактериальной клетки [1].
Исследования структуры PhuZ показали, что этот белок формирует трехцепочечные правозакрученные филаменты весьма сложного строения (рис. 1).
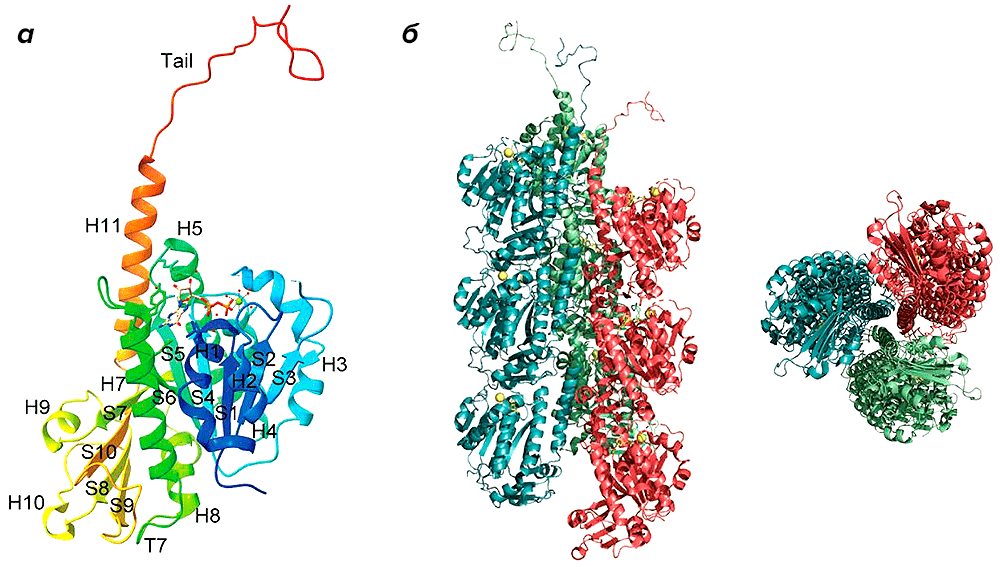
Рисунок 1. Белок PhuZ джамбо-фага 201φ2-1 в мономерной форме (а) и в виде филамента (б). Каждый филамент состоит из трех цепей (протофиламентов), окрашенных разными цветами.
При полимеризации PhuZ, как и в случае эукариотического тубулина, важную роль играет ГТФ: мономеры присоединяются к растущему филаменту в комплексе с ГТФ, после чего ГТФ гидролизуется до ГДФ. Наблюдение за поведением PhuZ, сшитого с зеленым флуоресцентным белком (GFP), в клетках бактерии Pseudomonas chlororaphis, инфицированных фагом 201φ2-1, показало, что для филаментов PhuZ характерны многие свойства, присущие эукариотическим микротрубочкам. Подобно микротрубочкам и некоторым бактериальным белкам цитоскелета, филаменты PhuZ полярны: растущие концы (плюс-концы), к которым присоединяются новые мономеры, обращены к центру клетки, в то время как не меняющиеся минус-концы закреплены у полюсов клеток. Кроме того, филаменты PhuZ стали первыми известными прокариотическими элементами цитоскелета, для которых характерна присущая микротрубочкам динамическая нестабильность: филаменты быстро переключаются с полимеризации на деполимеризацию, и наоборот. Ученые предполагают, что, как и в случае с микротрубочками, динамическую нестабильность филаментов PhuZ обеспечивает гидролиз ГТФ, который происходит при присоединении очередного мономера. Кроме того, как и у микротрубочек, на концах длинных филаментов PhuZ находятся ГТФ-кэпы, стабилизирующие филаменты и способствующие их росту [1].
Коробочка с сюрпризом: где джамбо-фаги хранят свою ДНК
И все же, зачем бактериофагам мог понадобиться свой собственный аналог тубулина? Ответить на этот вопрос помогла покадровая съемка бактериальных клеток Pseudomonas chlororaphis, чья плазмида кодирует флуоресцентно-меченный PhuZ, до и после инфицирования джамбо-фагом 201φ2-1 [3]. До момента заражения в цитоплазме клеток обнаруживались филаменты PhuZ, которые, хотя и демонстрировали динамическую нестабильность, были разбросаны по клетке случайным образом. После инфицирования фагом картина изменилась кардинальным образом: ранее неупорядоченные филаменты собрались в двухполюсную структуру, похожую на веретено деления, где минус-концы филаментов были заякорены у полюсов клетки, а растущие обращены в ее центр. В то же время окрашивание вирусной ДНК помогло показать, что после впрыскивания фагом своего генома в клетку у одного из ее полюсов, флуоресцентный сигнал от этой ДНК постепенно усиливался, видимо, из-за ее репликации. Параллельно с репликацией вирусная ДНК перемещалась в центр клетки за счет веретена из PhuZ, где в конце концов оформилась в большую структуру, первоначально названную инфекционным нуклеоидом, а сейчас более известную как фаговое ядро. При этом бактериальная ДНК оказывалась оттесненной фаговым ядром на периферию клетки, где постепенно разрушалась. Именно веретено из филаментов PhuZ сначала перемещает вирусную ДНК в центр клетки, а затем стабилизирует ее центральное положение до самого конца — до момента лизиса клетки. Эксперименты с мутантным PhuZ, лишенным способности к гидролизу ГТФ, показали, что в отсутствие веретена вирусная ДНК не достигает центра клетки, из-за чего эффективность производства новых вирусных частиц сокращается почти вдвое [1].
Вирусы эукариот тоже зачастую перестраивают под себя клетку-хозяина. Особые зоны цитоплазмы, в которых происходит репликация вирусной ДНК и сборка новых вирионов, часто называют вирусными фабриками, или вироплазмами. Но джамбо-фаги в этом отношении далеко превзошли своих «коллег», специализирующихся на эукариотах. Всё на том же фаге 201φ2-1 было показано, что фаговую ДНК, сконцентрированную в центре инфицированной бактериальной клетки, окружает сплошная белковая оболочка, полностью отгораживающая генетический материал вируса от остальной цитоплазмы (рис. 2) , [3]. Очень похоже на клеточное ядро, не правда ли?
Об этом открытии, совершенном еще в 2017 году, «Биомолекула» подробно писала в статье «Вирусы собирают внутри бактерий псевдоядра, чтобы противостоять их защитным системам» [4].
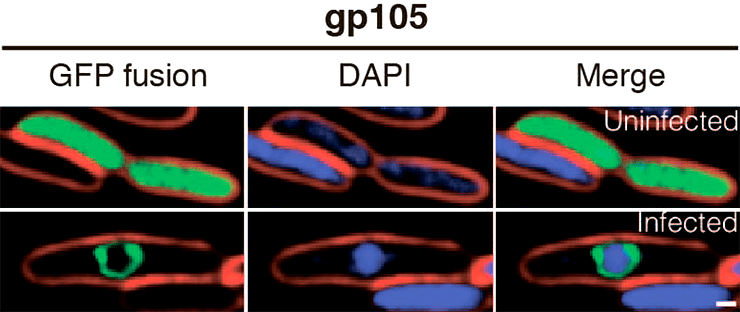
Рисунок 2. Локализация белка gp105 джамбо-фага 201φ2-1 в клетках бактерии Pseudomonas chlororaphis до инфицирования фагом (сверху) и после (снизу). gp105 сшит с GFP (зеленый цвет) и синтезируется с плазмидного вектора. ДНК окрашена синим, клеточная мембрана — красным. В присутствии вирусной ДНК gp105 образует вокруг нее сферическую оболочку. Вирусное псевдоядро локализовано строго в центре бактериальной клетки за счет биполярного веретена из белка PhuZ.
Однако в отличие от ядерной оболочки, которая представляет собой двуслойную мембрану, оболочка вирусного псевдоядра состоит из белка gp105 — самого обильно синтезируемого белка фага 201φ2-1. Внутри вирусного псевдоядра, помимо генетического материала фага, находятся белки, участвующие в репликации и транскрипции. Примечательно, что, когда вирусная ДНК фага достигает центра клетки, ее белковая оболочка начинает вращаться вокруг центральной оси — по-видимому, это обеспечивается за счет динамической нестабильности филаментов PhuZ, контактирующих с псевдоядром. Сменяющие друг друга рост и укорочение филаментов, взаимодействующих с белковой оболочкой, и заставляют псевдоядро вращаться (рис. 3) [1].
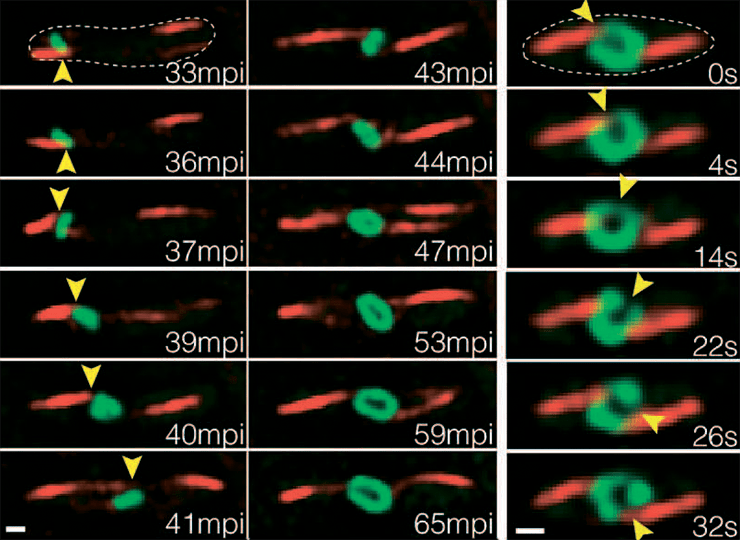
Рисунок 3. При инфицировании клетки джамбо-фагом филаменты PhuZ (красный) постепенно перемещают созревающее псевдоядро (зеленый, отмечено желтой стрелкой) в центр клетки (два левых столбца). Как видно по снимкам в правом столбце, центрально локализованное псевдоядро вращается под действием филаментов PhuZ. mpi — минуты после инфицирования.
На данный момент псевдоядра описаны у трех джамбо-фагов, поражающих бактерий рода Pseudomonas — 201φ2-1, φKZ и φPA3, а также у джамбо-фага PCH45, инфицирующего бактерии рода Serratia и филогенетически далекого от джамбо-фагов, поражающих псевдомонад. У всех этих вирусов имеется белок, образующий оболочку вокруг их геномной ДНК в цитоплазме бактерии, и белок, аналогичный тубулину. По-видимому, способность к образованию фагового ядра и специального веретена, обеспечивающего его центральную локализацию, является консервативной стратегией размножения джамбо-фагов [1].
Ядерная оболочка эукариотического клеточного ядра имеет систему селективного транспорта для макромолекул, который обеспечивают ядерные поры. Белки, функционирующие в ядре, содержат специальный сигнал ядерной локализации, за который их «хватают» особые белки-импортины и доставляют из цитоплазмы в ядро, протаскивая их через поры. Структур, похожих на ядерные поры, в фаговом ядре нет, и остается непонятным, каким образом в этом случае происходит селективный транспорт белков. Известно лишь, что, если пришить какой-нибудь маленький белок к вирусному белку, который должен быть локализован в псевдоядре, то «довесок» действительно переносится в ядро вместе с ядерным вирусным белком. Это было продемонстрировано на примере фага φKZ и рестриктазы EcoRI, сшитой с ядерным фаговым белком ORF152. С более крупным белком, таким как Cas9, этот фокус не пройдет, поэтому, видимо, существуют некоторые ограничения по размеру на транспорт белков внутрь фагового ядра. Рибосом в пределах псевдоядра нет, поэтому мРНК джамбо-фагов должны каким-то образом транспортироваться через белковую оболочку в цитоплазму. Однако пока и в этом случае механизм транспорта остается неизвестным [3].
Возникает вопрос: как же тогда фаговая ДНК попадает внутрь капсида, если попасть в фаговое ядро капсид не может? Оказалось, что и тут не обошлось без филаментов PhuZ. Вирусные капсиды собираются вблизи внутренней поверхности клеточной мембраны, после чего, как по рельсам, по филаментам PhuZ доставляются к псевдоядру, где «пришвартовываются» и, по пока не описанному механизму, начиняются фаговой ДНК (вот вам и еще одно сходство филаментов PhuZ с микротрубочками!). Вероятно, именно с этим связана потребность фага в центральной локализации ядра и его вращении: за счет этих двух механизмов максимальное количество капсидов могут присоединиться к псевдоядру и получить копию вирусного генома [1].
В свежем исследовании ученых с биологического факультета МГУ им. М.В. Ломоносова показано, что фаговый генетический материал отделен от бактериального в период всего инфекционного цикла. На примере фага φKZ продемонстрировано, что после впрыскивания генетического материала в бактерию вирусная ДНК попадает в особые круглые компартменты, располагающиеся вблизи клеточной стенки бактерии. Число круглых компартментов соответствует количеству фагов, одновременно атаковавших одну и ту же клетку (рис. 4) [5].
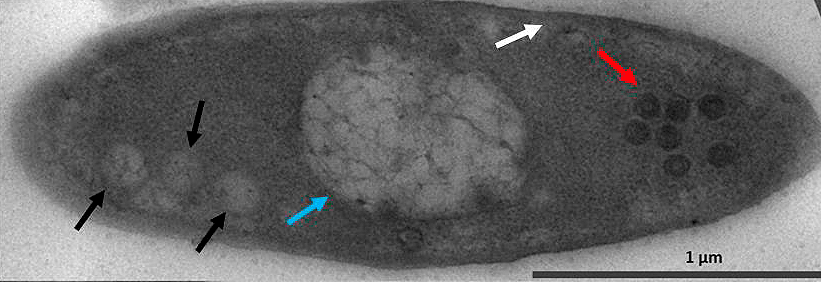
Рисунок 4. Микрофотография клетки Pseudomonas aeruginosa, инфицированной джамбо-фагом φKZ, через 40 минут после инфицирования. Черные стрелки указывают на округлые компартменты, белая — на остатки бактериальной ДНК, голубая — на псевдоядро, красная — на собранные капсиды.
Почти одновременно с появлением круглых компартментов бактериальный нуклеоид перемещается из центра клетки к полюсу, противоположному точке впрыскивания фаговой ДНК, и так и остается на периферии клетки, при этом геномная ДНК бактерии постепенно разрушается. Точный механизм перемещения бактериальной ДНК пока детально не исследовался. Стоит отметить, что, по некоторым данным, полного разрушения бактериального генома не происходит, поскольку хозяйская ДНК покрывается специальными белками, защищающими ее от ДНКаз. Круглый компартмент же постепенно перемещается в центр клетки и, в конце концов, становится зрелым псевдоядром [5]. К заполненным капсидам в цитоплазме присоединяются хвосты, в результате чего образуются зрелые вирионы, которые выходят наружу после лизиса клетки (рис. 5).
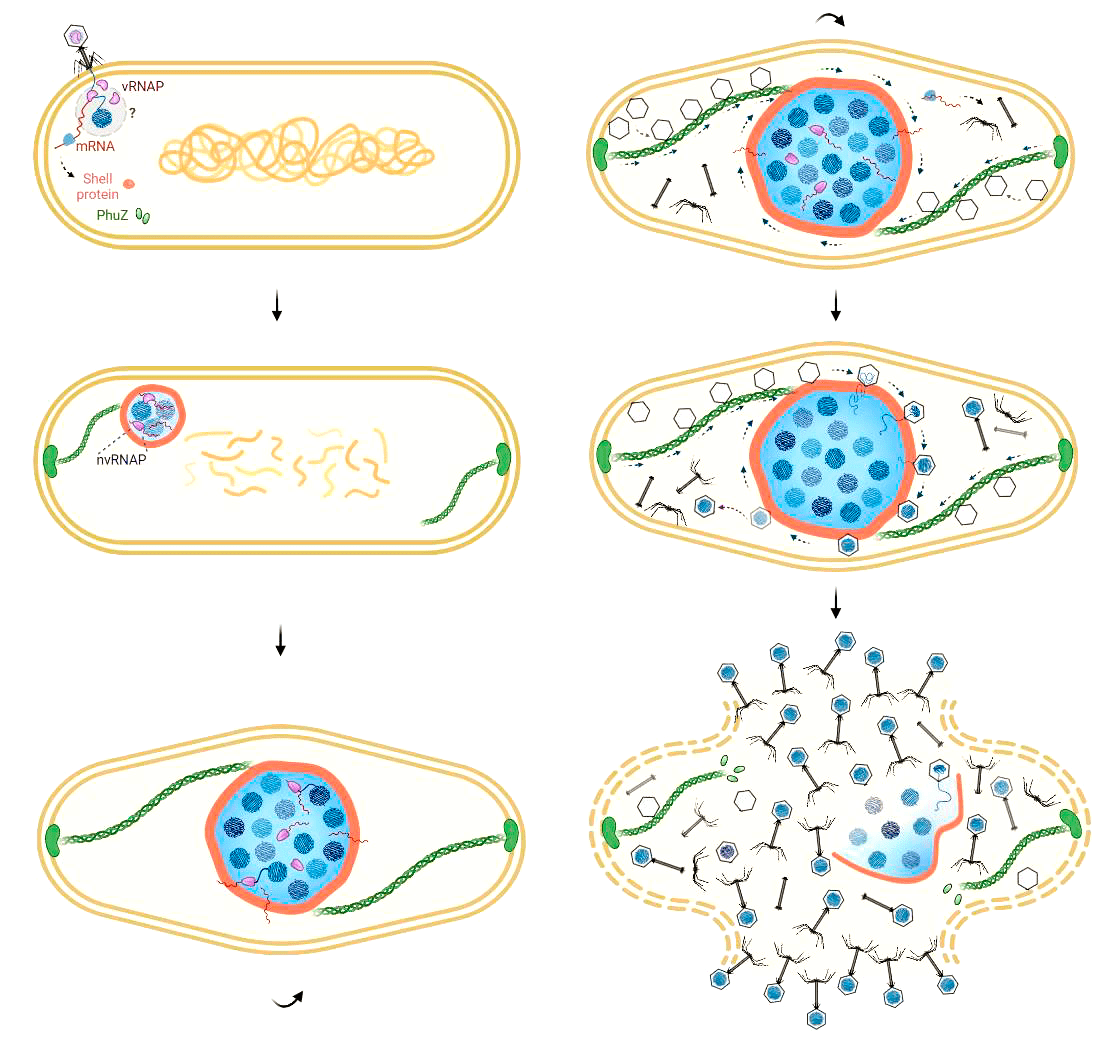
Рисунок 5. Жизненный цикл джамбо-фага. После впрыскивания в клетку геном джамбо-фага оказывается внутри круглого компартмента, который за счет филаментов PhuZ постепенно перемещается в центр и становится псевдоядром. Центральное положение псевдоядра поддерживается филаментами PhuZ. Внутри псевдоядра происходит репликация вирусных геномов и транскрипция, причем вирусные мРНК каким-то образом выходят из ядра в цитоплазму, где бактериальные рибосомы синтезируют вирусные белки. Собранные вблизи клеточной мембраны капсиды пришвартовываются к вращающемуся ядру и наполняются генетическим материалом фага. После этого в цитоплазме к капсидам присоединяются хвосты — так формируются зрелые вирионы джамбо-фагов. Выход новых вирионов наружу происходит после лизиса клетки.
В той же работе с помощью электронной томографии было исследовано содержимое фагового псевдоядра. Оказалось, что фаговая ДНК в нем находится в виде филаментов, состоящих из одной-двух двойных спиралей ДНК. Авторам исследования также удалось рассмотреть глобулярные домены, связанные с фаговой ДНК. Возможно, эти глобулы образованы белками, аналогичными гистонам эукариот (рис. 6) [5].

Рисунок 6. Внутреннее содержимое инфицированной клетки Pseudomonas aeruginosa, визуализированное с помощью электронной томографии. P-N — сеть филаментов псевдоядра; на вставке (б) — ее 3D-реконструкция. Белая стрелка указывает на филамент из фаговой ДНК, белые треугольники — на белковые глобулы в составе филаментов псевдоядра.
Фаговое ядро как защитная стратегия
Бактерии обладают внушительным арсеналом средств защиты от бактериофагов и других мобильных генетических элементов: системы рестрикции-модификации, разнообразные системы CRISPR/Cas, система BREX и многие другие системы, список которых постоянно пополняется . Но и фаги не лыком шиты. В частности, многие из них продуцируют особые белки анти-CRISPR, подавляющие работу CRISPR/Cas на разных этапах.
Подробнее о защитных системах бактерий и способах их преодоления бактериофагами читайте в статьях [6–9].
Однако джамбо-фаги и тут не остались в стороне. В начале 2020 года две исследовательские группы почти одновременно сообщили, что джамбо-фаги устойчивы почти ко всем системам CRISPR/Cas, хотя не имеют белков анти-CRISPR. Выяснилось, что псевдоядро джамбо-фагов служит универсальным защитным механизмом против систем CRISPR/Cas, нацеленных на разрушение ДНК: его белковая оболочка просто не пропускает нуклеазы Cas внутрь! Кроме того, по крайней мере в случае фага φKZ, белковая оболочка вокруг вирусной геномной ДНК обеспечивает защиту еще и от эндонуклеаз рестрикции [10]. Казалось бы, эти фаги просто непобедимы!
Однако и у джамбо-фагов, как выяснилось, есть своя «ахиллесова пята». Поскольку рибосом в пределах псевдоядра нет, мРНК джамбо-фагов транслируется в цитоплазме рибосомами бактерии. И вот тут-то вирусные мРНК разрушают системы CRISPR/Cas VI типа , мишенью которых является не ДНК, а РНК (рис. 7) [10].
С подробной классификацией систем CRISPR/Cas можно ознакомиться в статье «Разнообразие и эволюция систем CRISPR/ Cas» [11].
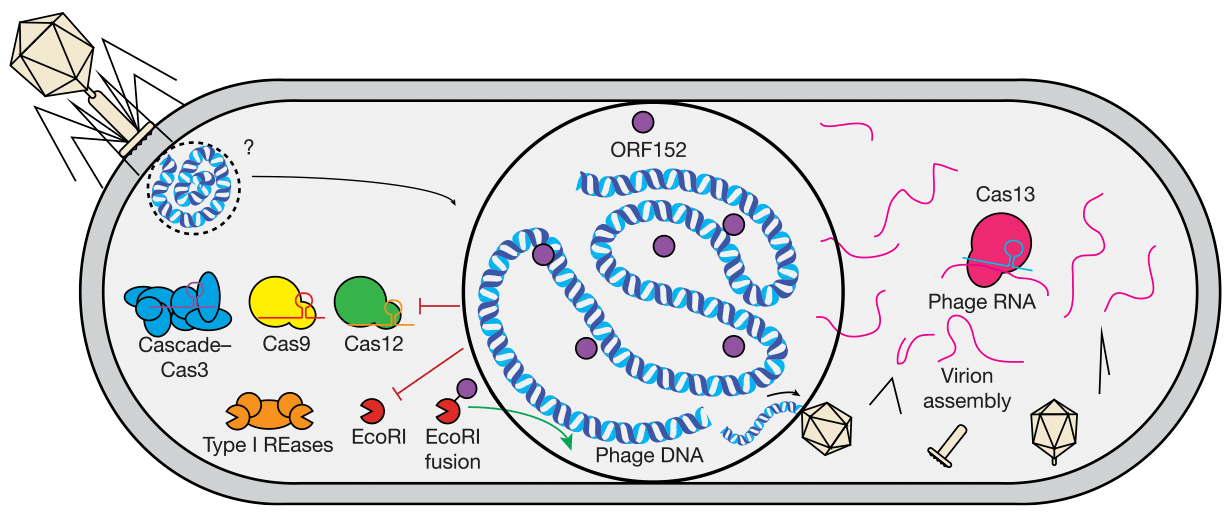
Рисунок 7. Благодаря наличию псевдоядра, не подпускающего защитные бактериальные белки к фаговой ДНК, джамбо-фаги устойчивы к действию систем CRISPR/Cas и эндонуклеаз рестрикции, разрушающих ДНК. Однако рестриктазе EcoRI, сшитой с фаговым внутренним белком псевдоядра ORF152, все же удается проходить через защитную белковую оболочку. Системы CRISPR/Cas, действующие на уровне РНК, эффективно подавляют размножение джамбо-фагов: нуклеаза Cas13 разрушает вирусные мРНК, вышедшие из псевдоядра в цитоплазму, и тем самым блокирует синтез вирусных белков.
Системы CRISPR/Cas VI типа эффективны не только против фагов, инфицирующих Pseudomonas, но и против джамбо-фага, поражающего Serratia. Вероятно, наличие мощной неспецифической защиты от систем CRISPR/Cas, кроме систем VI типа, действующих на уровне РНК, является общей чертой джамбо-фагов [10], [12].
Биоинформатический анализ спейсеров, содержащихся в 160 000 бактериальных геномов, показал, что, действительно, защитная система против джамбо-фагов, представленная системой CRISPR/Cas, «бьющей» по РНК, широко распространена среди бактерий. В то же время спейсеров, происходящих из джамбо-фагов и относящихся к «обычным» системам CRISPR/Cas, действующим на уровне ДНК, в бактериальных геномах практически не оказалось [12].
Несмотря на уже полученные интереснейшие результаты, многие аспекты биологии джамбо-фагов остаются неизвестными. Как регулируется транспорт белков в псевдоядре? Каким образом фаговые мРНК выходят из псевдоядра в цитоплазму? Все ли джамбо-фаги способны к образованию псевдоядра? На эти и многие другие вопросы ответа пока нет. Однако новые публикации, раскрывающие всё новые и новые особенности биологии джамбо-фагов, выходят все чаще, и можно не сомневаться, что в ближайшие годы мы узнаем об этих таинственных вирусах еще много неожиданного.
Литература
- Jingwen Guan, Joseph Bondy-Denomy. (2020). Intracellular Organization by Jumbo Bacteriophages. J Bacteriol. 203;
- Vorrapon Chaikeeratisak, Katrina Nguyen, MacKennon E. Egan, Marcella L. Erb, Anastasia Vavilina, Joe Pogliano. (2017). The Phage Nucleus and Tubulin Spindle Are Conserved among Large Pseudomonas Phages. Cell Reports. 20, 1563-1571;
- Vorrapon Chaikeeratisak, Katrina Nguyen, Kanika Khanna, Axel F. Brilot, Marcella L. Erb, et. al.. (2017). Assembly of a nucleus-like structure during viral replication in bacteria. Science. 355, 194-197;
- Вирусы собирают внутри бактерий псевдоядра, чтобы противостоять их защитным системам;
- Yana A. Danilova, Viktoriia V. Belousova, Andrey V. Moiseenko, Innokentii E. Vishnyakov, Maria V. Yakunina, Olga S. Sokolova. (2020). Maturation of Pseudo-Nucleus Compartment in P. aeruginosa, Infected with Giant phiKZ Phage. Viruses. 12, 1197;
- Просто о сложном: CRISPR/Cas;
- Свой среди чужих, чужой среди своих: как система BREX защищает бактерию от фагов и самой себя;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- Анти-CRISPR: ответ вирусов;
- Senén D. Mendoza, Eliza S. Nieweglowska, Sutharsan Govindarajan, Lina M. Leon, Joel D. Berry, et. al.. (2020). A bacteriophage nucleus-like compartment shields DNA from CRISPR nucleases. Nature. 577, 244-248;
- Разнообразие и эволюция систем CRISPR/Cas;
- Lucia M. Malone, Suzanne L. Warring, Simon A. Jackson, Carolin Warnecke, Paul P. Gardner, et. al.. (2020). A jumbo phage that forms a nucleus-like structure evades CRISPR–Cas DNA targeting but is vulnerable to type III RNA-based immunity. Nat Microbiol. 5, 48-55.