Генетическое разнообразие и мутагенез взаимозависимы?
04 августа 2015
Генетическое разнообразие и мутагенез взаимозависимы?
- 532
- 0
- 3
-
Автор
-
Редактор
Анализ генотипов представителей двух видов растений и их прямых потомков выявил, что новые мутации значительно чаще возникают в участках, по которым организм гетерозиготен. То есть, если он унаследовал от родителей два разных варианта гена, этот ген у него мутирует с большей вероятностью.
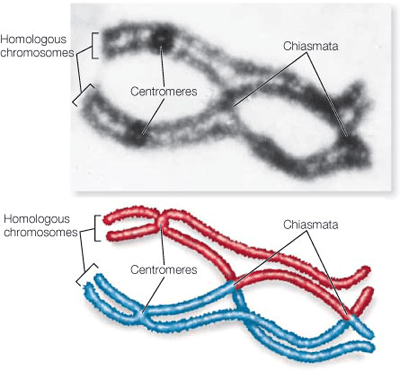
Хромосомы каждого организма отличаются от родительских хромосом по двум причинам. Во-первых, когда у родителей образуются половые клетки, пары хромосом в них обмениваются участками (процесс называется кроссинговером). Поэтому потомкам достаются мозаичные хромосомы, состоящие из случайных сочетаний фрагментов хромосом, которые были у его мамы и папы. Во-вторых, в ДНК неизбежно накапливаются мутации, которых не было ни в одном из вариантов родительских хромосом. Недавно опубликованная в Nature работа демонстрирует, что эти источники изменчивости не совсем независимы друг от друга [1]. По данным ученых, новые мутации чаще возникают в тех участках генома, где родительские варианты различаются — то есть в тех последовательностях ДНК, где организм гетерозиготен. А по каким именно участкам организм будет гетерозиготен, зависит в том числе и от того, как прошел кроссинговер у его родителей.
Благодаря тому, что секвенирование становится всё более простой и дешевой процедурой, в последнее время появилась возможность в подробностях установить генетическую историю организма, узнав точные последовательности ДНК его самогό и его родителей. Сравнение этих молекул позволяет проследить, в каких частях родительских хромосом произошел кроссинговер, как он повлиял на распределение генетических вариантов по хромосомам, по каким вариантам потомок в итоге стал гомо- или гетерозиготен и в каких участках у него скопились новые мутации, которых не было у родителей.
Такой анализ генотипов нескольких поколений ученые провели для традиционного модельного растения Arabidopsis и дополнительно (чтобы подтвердить выводы) — для риса и медоносных пчел. Первым делом последовательности ДНК организмов разделили на неперекрывающиеся участки длиной 1 млн нуклеотидов. Для таких участков обнаружилась закономерность: чем чаще в каком-то из них происходил кроссинговер, тем чаще там возникали новые мутации. Такую закономерность можно объяснить или тем, что кроссинговер способствует появлению новых мутаций, или тем, что и кроссинговер, и новые мутации затрагивают по каким-то причинам одни и те же области ДНК. Обе гипотезы выглядят разумными: во время кроссинговера в нитях ДНК образуются разрывы, к которым могут привлекаться ферменты репарации*. При репарации разрывов в ДНК важнее всего восстановить целостность участка, а не последовательность, так что ферменты, занимающиеся починкой разрывов, часто делают ошибки, из-за чего возникают мутации. В то же время, в ходе исследования обнаружились доводы и в пользу второй гипотезы: кроссинговер и новые мутации действительно часто возникают в одних и тех же участках — гетерозиготных.
* — Если подойти к вопросу распределения мутаций по ДНК с несколько иной стороны, то окажется, что вынужденное локальное бездействие «редакторов» и «ремонтников» не менее мутагенно. При репликации ДНК одна из дочерних цепей строится фрагментарно, причем синтез РНК/ДНК-затравки ведет не слишком «грамотная» полимераза (точнее, комплекс праймазы с полимеразой). Делает она это недолго, но подчищать ошибки за ней нужно. Однако если на концы фрагментов Оказаки успевают «плюхнуться» белки, то на исправление рассчитывать не приходится. Подробно о связи стыков фрагментов Оказаки с частотой мутаций: «Следы полимеразы α» [2]. На заметку: за один раунд репликации хромосомной ДНК дрожжей S. cerevisiae образуется и процессируется примерно 100 000 фрагментов Оказаки, а у человека в случае достижения полной готовности к клеточному делению их количество должно превышать 10 млн! — Ред.
Ученые обнаружили, что у гетерозиготных растений в 3,5 раза чаще возникают новые мутации, чем у их родителей, относящихся к чистым линиям (то есть из поколения в поколение гомозиготных по определенным аллелям). А когда такие гибриды в нескольких поколениях скрещивали с представителями одной линии, уменьшая у них уровень аллельного разнообразия, скорость появления новых мутаций падала.
Тот же эффект сохранялся и на уровне ДНК: мутации чаще возникали там, где парные хромосомы сильнее всего отличались друг от друга. Оценка распределения новых мутаций показала, что все они располагались ближе к участкам, различающимся у парных хромосом, чем можно было бы ожидать, если бы мутации появлялись в случайных местах. Получается, что изменения интенсивнее происходили там, где ужé наблюдалось большее разнообразие.
Раньше уже замечали, что мутации чаще возникают в тех генах, которым важно быстро меняться: например, в генах устойчивости к патогенам, с которыми организм постоянно должен соревноваться в гонке вооружений. Но до сих пор было не совсем понятно, какой механизм может поддерживать лишь локально высокую частоту мутаций. Теперь можно предположить, как это работает, если мутации действительно чаще происходят в гетерозиготных участках. Гены, которые подвергаются движущему отбору, чаще должны быть представлены гетерозиготными вариантами, и это, в свою очередь, должно помогать их быстрому изменению.
Возникает закономерный вопрос: как именно гетерозиготность может способствовать появлению новых мутаций? Авторы статьи [1] полагают, что это может быть связано с худшим спариванием непохожих участков хромосом в мейозе. Особенно это касается ситуаций с делециями или вставками участков ДНК, хотя и более обычные точечные мутации тоже могут вносить свой вклад, нарушая образование комплекса между парными хромосомами. А именно участки, выдающиеся за пределы аккуратного хромосомного дуплекса, чаще привлекают склонную к ошибкам репарационную машинерию, особенно если в них возникают разрывы (что для этих зон, видимо, характерно) [2, 3, 4]. Поэтому получается, что там, где хромосомы не похожи, они с большой вероятностью станут еще более непохожими.
Литература
- Yang S., Wang L., Huang J., Zhang X., Yuan Y., Chen J.Q. et al. (2015). Parent–progeny sequencing indicates higher mutation rates in heterozygotes. Nature. 523, 463–467;
- Следы полимеразы alpha;
- Malkova A. and Haber J.E. (2012). Mutations arising during repair of chromosome breaks. Annu. Rev. Genet. 46, 455–473;
- Ichijima Y., Ichijima M., Lou Z., Nussenzweig A., Camerini-Otero R.D., Chen J. et al. (2011). MDC1 directs chromosome-wide silencing of the sex chromosomes in male germ cells. Genes Dev. 25, 959–971;
- Boateng K.A., Bellani M.A., Gregoretti I.V., Pratto F., Camerini-Otero R.D. (2013). Homologous pairing preceding SPO11-mediated double-strand breaks in mice. Dev. Cell. 24, 196–205..