Фуллерены: неожиданные биологические свойства углеродных наночастиц
03 ноября 2013
Фуллерены: неожиданные биологические свойства углеродных наночастиц
- 32692
- 3
- 3
Может ли протон проникнуть внутрь углеродной сферы? Этот вопрос стал «краеугольным камнем» новой гипотезы.
Статья на конкурс «био/мол/текст»: Поиск соединений, способных продлить жизнь и отодвинуть старость — одна из самых актуальных задач современной науки. Сообщение о том, что исследователям из Франции удалось добиться почти двукратного увеличения продолжительности жизни экспериментальных животных при помощи фуллеренов (наночастиц углеродной природы), заставило ученых задуматься над молекулярными механизмами подобного эффекта. Эта статья повествует о компьютерном моделировании возможных механизмов биологической активности фуллеренов и о первых попытках подтвердить полученные модели в биологических экспериментах.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Мячи для нанофутболистов
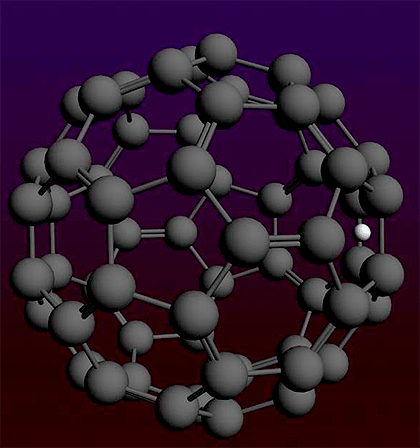
Фуллерены — это довольно необычный класс молекул, представляющих собой одну из форм существования углерода (так называемых аллотропных модификаций). Всем известные алмаз и графит — тоже не что иное, как разные аллотропные формы углерода, однако в структуре алмаза атомы углерода собраны в тетраэдры, графит состоит из плоских слоев, образованных шестиугольниками, ну а фуллерены — это шарообразные молекулы с замкнутой поверхностью. Самый простой из фуллеренов содержит 60 атомов углерода и удивительным образом напоминает по своей структуре футбольный мяч: его поверхность образована чередующимися пяти- и шестиугольниками, причем размер этого «мяча» составляет всего 1 нм (нанометр).
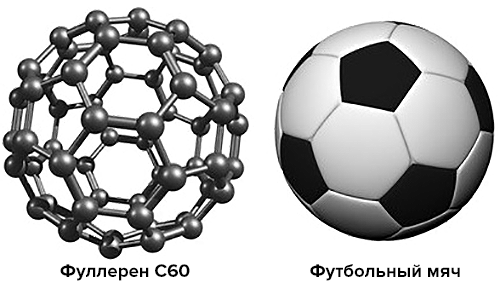
Рисунок 1. Молекула фуллерена очень похожа на футбольный мяч, только забивать им голы сможет лишь футболист наноскопического размера
Открытие фуллеренов — один из ярких примеров прогностической мощи науки: еще в 70-е годы XX века были сделаны теоретические квантово-химические расчеты, предсказывающие существование подобных молекул, однако лишь в 1985 году их впервые обнаружили при исследовании паров графита после его лазерного облучения [1]. Позднее фуллерены были найдены и в природных минералах — особняком здесь стоит такой камень, как шунгит [2]. А недавно выяснилось, что эти углеродные «шарики» встречаются даже в космических туманностях [3].
Физики и химики нашли фуллеренам множество применений: их используют при синтезе новых соединений в оптике и при производстве проводников. О биологических же свойствах фуллеренов долгое время поступали неоднозначные данные: биологи то объявляли их токсичными [4], то обнаруживали антиоксидантные свойства фуллеренов и предлагали использовать их в лечении таких серьезных заболеваний, как бронхиальная астма [5].
Крысы-долгожители
В 2012 году увидела свет публикация, которая привлекла внимание геронтологов — специалистов, работающих над проблемами старения. В этой работе Тарек Баати и соавторы [6] продемонстрировали впечатляющие результаты — крысы, которых кормили суспензией фуллеренов в оливковом масле, жили вдвое дольше обычных, и, к тому же, демонстрировали повышенную устойчивость к действию токсических факторов (таких как четыреххлористый углерод). Токсичность этого соединения обусловлена его способностью генерировать активные формы кислорода (АФК) [7], а значит, биологические эффекты фуллеренов, скорее всего, можно объяснить их антиоксидантными свойствами (способностью «перехватывать» и дезактивировать АФК).
Подробно об этом «биомолекула» уже рассказывала: «Алхимия „волшебной сажи“ — перспективы применения фуллерена C60 в медицине» [8]. — Ред.
Связь активных форм кислорода с процессами, происходящими при старении, в настоящее время уже практически не подвергается сомнению. С 60-х годов ХХ века, когда была сформулирована свободнорадикальная теория старения [9], и до настоящего времени объем данных, подтверждающих такую точку зрения, только накапливается. Однако до сих пор ни один антиоксидант — ни природный, ни синтетический — не давал столь поразительного увеличения продолжительности жизни экспериментальных животных, как в опытах Баати и коллег. Даже специально сконструированные коллективом под руководством академика Скулачева антиоксиданты «адресного действия» — так называемые «ионы Скулачева», или соединения ряда SkQ, — демонстрировали менее значительные эффекты [10].
Эти вещества представляют собой липофильные положительно заряженные молекулы с присоединенным антиоксидантным «хвостом», которые благодаря своей структуре способны накапливаться в митохондриях (именно в этих органоидах эукариотических клеток происходит генерация активных форм кислорода). Однако соединения ряда SkQ продлевали жизнь подопытных мышей в среднем всего на 30%.
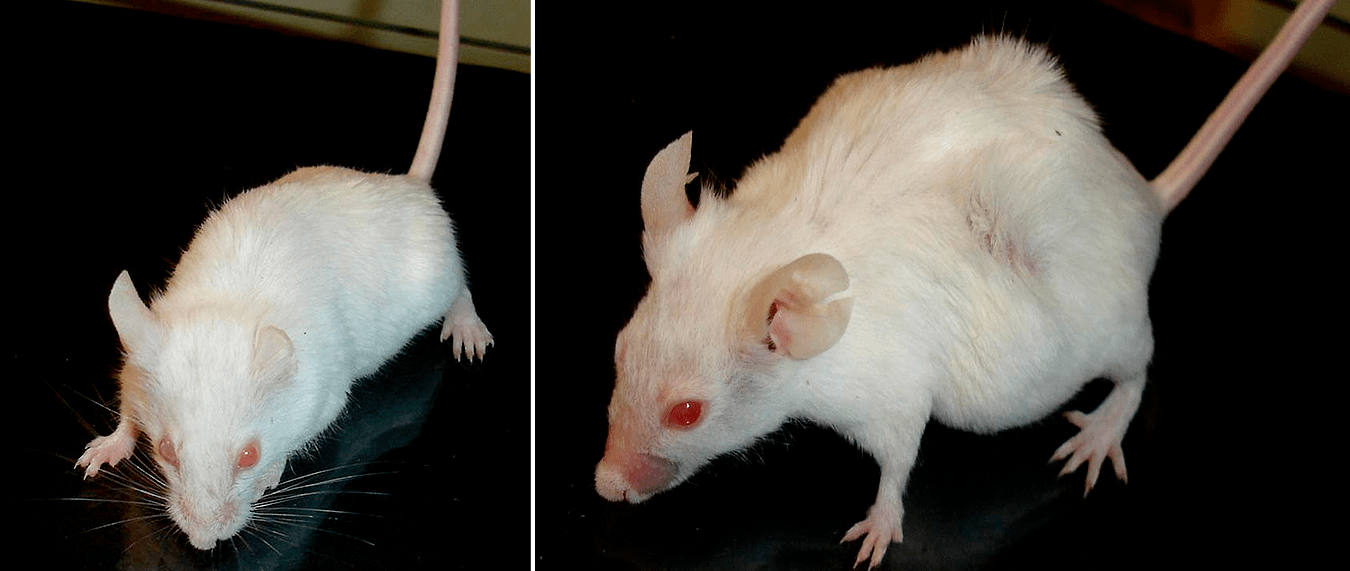
Рисунок 2. Продление жизни подопытных мышей. Слева — мышь, старение которой замедлено благодаря приему «ионов Скулачева», справа — мышь из контрольной группы.
Почему же фуллерены оказались столь эффективными в борьбе со старением?
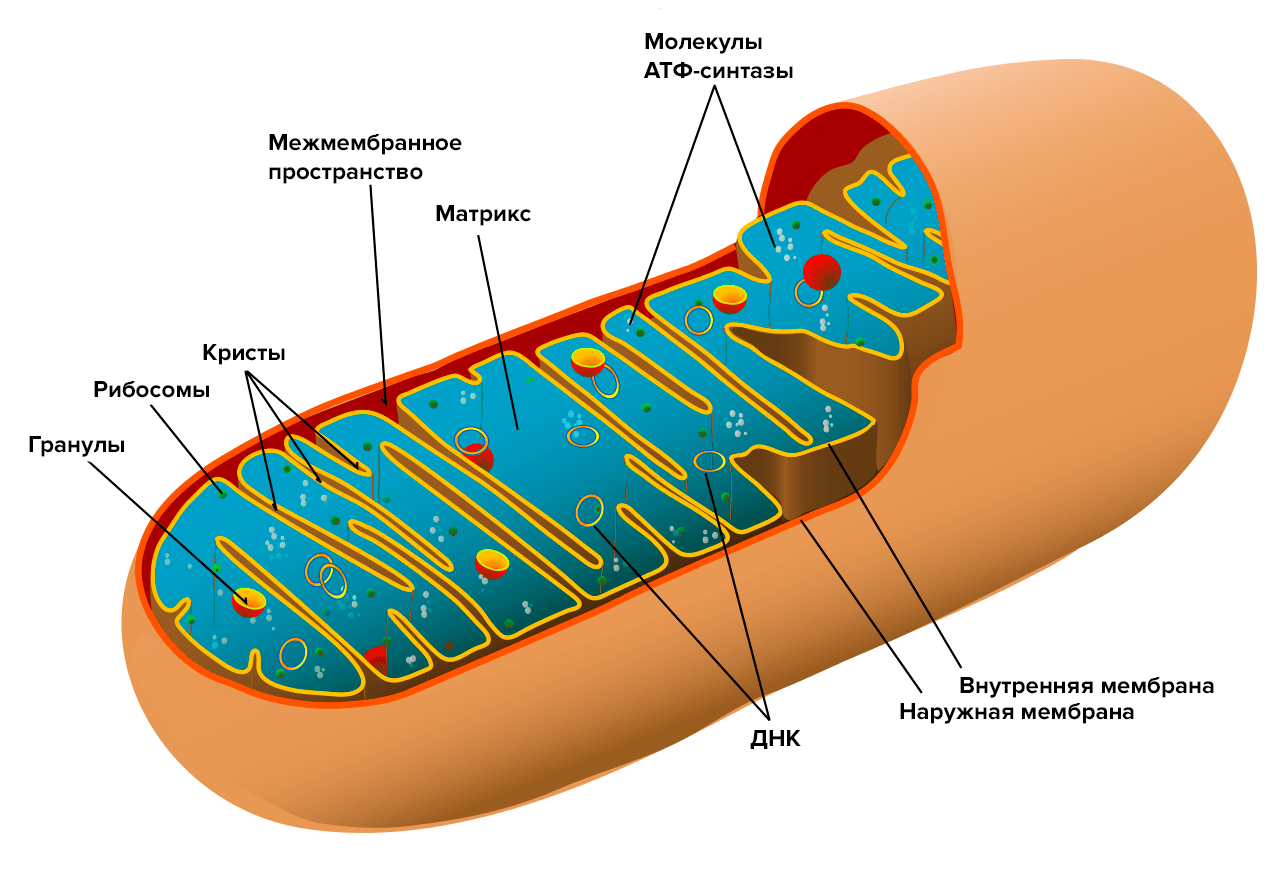
Задавшись этим вопросом, мы стали рассматривать возможность существования дополнительного механизма биологического действия фуллеренов — кроме уже известного антиоксидантного. Подсказка обнаружилась при изучении одного из соединений ряда SkQ—SkQR1, содержащего остаток родамина. Это соединение относится к группе протонофоров — молекул, способных переносить протоны из межмембранного пространства через мембрану в матрикс митохондрии, снижая, таким образом, трансмембранный потенциал (Δψ). Как известно, именно этот потенциал, существующий благодаря разнице в содержании протонов по разные стороны мембраны, и обеспечивает выработку энергии в клетке. Однако он же и является источником генерации АФК. В сущности, активные формы кислорода здесь сродни «токсическим отходам» при производстве энергии. Хотя они имеют и ряд полезных функций [12], в основном АФК — источник повреждения ДНК, липидов и многих внутриклеточных структур.
Есть сведения, что некоторое снижение митохондриального трансмембранного потенциала может быть полезным для клеток [13]. Снижение его всего на 10% приводит к уменьшению продукции АФК в 10 раз [14]! Существуют так называемые «мягкие разобщители», повышающие протонную проводимость мембран, в результате чего происходит «разобщение» дыхания и фосфорилирования АТФ [15].
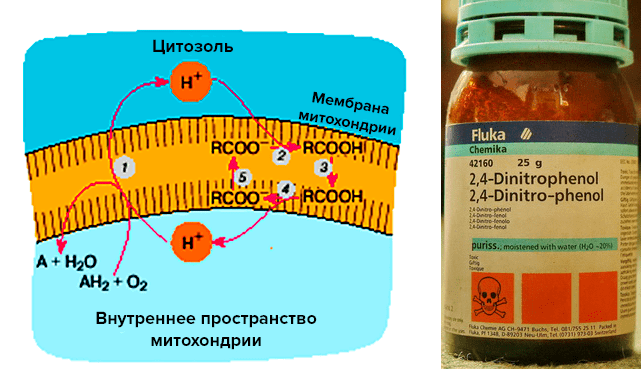
Пожалуй, самый известный «разобщитель» — DNF, или 2,4-динитрофенол (рис. 3а и 3б). В 30-е годы ХХ века им очень активно пользовались при лечении ожирения. Собственно, динитрофенол — первый «жиросжигатель», использовавшийся в официальной медицине. Под его действием клетка переключается на альтернативный путь метаболизма, запуская «сжигание» жиров, а получаемая клеткой энергия не запасается в АТФ, как обычно, а излучается в виде тепла.
Поиск легких способов похудения будет актуален всегда, пока представители Homo Sapiens будут беспокоиться о своем внешнем виде; однако для нашего исследования более интересен тот факт, что подобные «мягкие разобщители» снижают выработку АФК и в небольших дозах могут способствовать продлению жизни [16].
Возникает вопрос — а могут ли фуллерены, кроме антиоксидантных свойств, проявлять еще и свойства «переносчиков» протонов, действуя, таким образом, сразу с двух сторон? Ведь шарообразная молекула фуллерена — полая изнутри, а значит, в ней вполне могут уместиться небольшие частицы — такие как протоны.
Моделирование in silico: что сделали физики
Для проверки этой гипотезы коллективом НОЦ «Наноразмерная структура вещества» были выполнены сложные расчеты. Как и в истории с открытием фуллерена, в нашем исследовании компьютерное моделирование предшествовало экспериментам. Моделирование возможности проникновения протона в фуллерен и распределения заряда в такой системе производилось на основе теории функционала плотности (DFT). Это широко используемый инструмент квантово-химических расчетов, позволяющий вычислять свойства молекул с высокой точностью.
При моделировании один или несколько протонов помещали вне фуллерена, а затем производился расчет наиболее оптимальной конфигурации — такой, при которой полная энергия системы будет минимальной. Результаты расчетов показали: протоны могут проникать внутрь фуллерена! Оказалось, внутри молекулы C60 может накапливаться до шести протонов одновременно, а вот седьмой и последующие уже не смогут проникнуть внутрь и будут отталкиваться — дело в том, что «заряженный» протонами фуллерен приобретает положительный заряд (а, как известно, одноименно заряженные частицы отталкиваются).
Происходит это потому, что проникающие внутрь фуллеренового «шарика» протоны оттягивают на себя электронные облака атомов углерода, что приводит к перераспределению заряда в системе «протоны+фуллерен». Чем больше протонов проникает внутрь, тем сильнее положительный заряд на поверхности фуллерена, тогда как протоны, напротив, все сильнее приближаются к нейтральным значениям. Эту закономерность можно проследить и на рисунке 4: когда количество протонов внутри сферы превышает 4, они становятся нейтральными (желто-оранжевый цвет), ну а поверхность фуллерена всё сильнее «синеет».

Рисунок 4. Распределение положительного заряда внутри системы «фуллерен+протоны». Слева направо: два, четыре или шесть протонов внутри фуллерена. Цветом обозначено распределение заряда: от нейтрального (красный) до слабоположительного (синий).
Вначале расчеты были выполнены только в системе «фуллерен+протоны» (без учета влияния других молекул). Но ведь в клетке фуллерен находится не в вакууме, а в водной среде, заполненной множеством соединений разной степени сложности. Поэтому на следующем этапе моделирования физики добавили к системе 47 молекул воды, окружающих фуллерен, и проверили, не повлияет ли их присутствие на взаимодействие с протонами. Однако и в присутствии воды модель действовала успешно.
Биологи подтверждают гипотезу?
Известие о том, что фуллерены могут адсорбировать протоны, да еще и приобретают при этом положительный заряд, вдохновило биологов. Похоже, что эти уникальные молекулы и вправду действуют сразу несколькими путями: инактивируют активные формы кислорода (в частности, гидроксильные радикалы, присоединяя их по многочисленным двойным связям [17]), адресно накапливаются в митохондриях благодаря своим липофильным свойствам [18] и приобретенному положительному заряду, и, вдобавок ко всему, снижают трансмембранный потенциал, перенося протоны внутрь митохондрий, подобно другим «мягким разобщителям» дыхания и окислительного фосфорилирования.
Для изучения антиоксидантных свойств фуллеренов мы использовали систему экспресс-тестов на основе биолюминесцентных бактериальных биосенсоров. Биосенсоры в данном случае — генетически-модифицированные бактерии, способные улавливать повышение внутриклеточной генерации АФК и «сигнализировать» об этом исследователям. При создании биосенсоров в генóм одного из безвредных штаммов кишечной палочки Escherichia coli вводится искусственная конструкция, состоящая из генов люминесценции (свечения), поставленных под контроль специфических промоторов — регуляторных элементов, «включающихся» при повышении внутриклеточной генерации активных форм кислорода, или же при действии иных стресс-факторов — например, при повреждении ДНК. Стоит начать действовать на клетку таким стресс-фактором — бактерия начинает светиться, и по уровню этого свечения можно с достаточной точностью определить уровень повреждений.
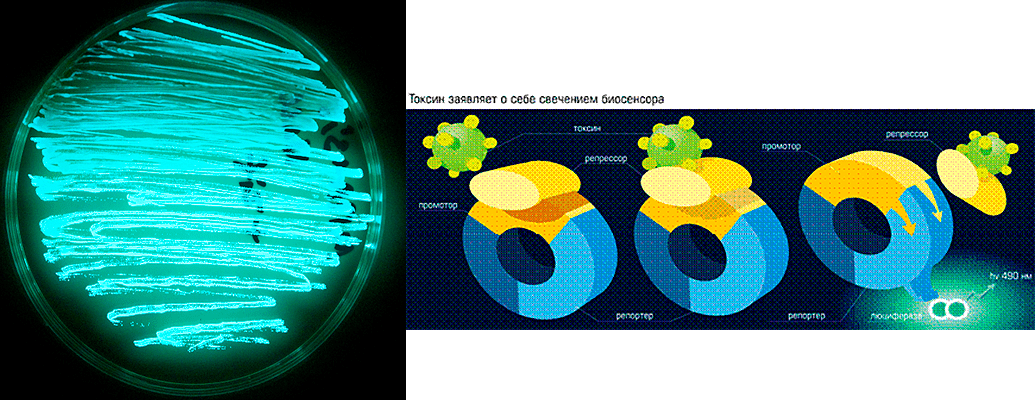
Рисунок 5. Светящиеся бактерии на чашке Петри (слева) и принцип действия биосенсоров (справа)
Такие модифицированные штаммы разрабатываются в ГосНИИ Генетики [19] и широко применяются в генетической токсикологии [20] при изучении механизмов действия излучений и окислительного стресса [21], действия антиоксидантов (в частности, SkQ1 [22]), а также для поиска новых перспективных антиоксидантов среди синтезируемых химиками веществ [23].
В нашем случае использование именно бактериальной модели обусловлено следующим: бактерии, как известно, относятся к прокариотам, и клетки их устроены проще, чем эукариотические. Процессы, происходящие в мембране митохондрий эукариот, у прокариот реализуются прямо в клеточной мембране; в этом смысле бактерии — «сами себе митохондрии». (Удивительное сходство строения этих органелл с бактериями даже послужило в свое время основой для так называемой симбиотической теории происхождения эукариот [24].) Следовательно, для изучения процессов, происходящих в митохондриях, подобная модель вполне подходит.
Первые же результаты показали, что водная суспензия фуллерена C60, для более эффективного растворения обработанная ультразвуком, при добавлении к культуре биосенсоров увеличивала их устойчивость к повреждению ДНК активными формами кислорода. Уровень таких повреждений в опыте был на 50–60% ниже, чем в контроле.
Кроме того, было зафиксировано снижение уровня спонтанной продукции супероксид-анион-радикала в клетках SoxS-lux штамма при добавлении суспензии C60. Особенностью этого штамма как раз и является связь уровня его свечения с количеством супероксид-анион-радикала. Именно такого эффекта следует ожидать от соединения, действующего по принципу «мягких разобщителей» — если снижается трансмембранный потенциал, то и АФК (в частности, супероксид) будут вырабатываться в меньших количествах.
Полученные результаты, конечно, весьма предварительны, и работы еще продолжаются, именно поэтому в подзаголовке данного раздела и стоит вопросительный знак. Время покажет, сможем ли мы со временем заменить его на уверенный восклицательный. Ясно одно — в ближайшее время фуллерены неизбежно окажутся в фокусе внимания научных коллективов, изучающих проблемы старения и занимающихся поиском геропротекторов — веществ, замедляющих старение. И кто знает, не станут ли эти крохотные «шарики» надеждой на продление столь короткой пока человеческой жизни?
Литература
- Соколов В.И. и Станкевич И.В. (1993). Фуллерены — новые аллотропные формы углерода: структура, электронное строение и химические свойства. «Успехи химии». 62б, 455;
- P. R. Buseck, S. J. Tsipursky, R. Hettich. (1992). Fullerenes from the Geological Environment. Science. 257, 215-217;
- В космосе впервые обнаружен фуллерен. (2010). «Око планеты»;
- Андриевский Г.В., Клочков В.К., Деревянченко Л.И. (2004). Токсична ли молекула фуллерена С60? Или к вопросу: «Какой свет будет дан фуллереновым нанотехнологиям — Красный или все-таки зеленый?». «Вся медицина в Интернете!»;
- Ширинкин С.В., Чурносов М.И., Андриевский Г.В., Васильченко Л.В. (2009). Перспективы использования фуллеренов в качестве антиоксидантов в патогенетической терапии бронхиальной астмы. «Клиническая медицина». 5, 56–58;
- Tarek Baati, Fanchon Bourasset, Najla Gharbi, Leila Njim, Manef Abderrabba, et. al.. (2012). The prolongation of the lifespan of rats by repeated oral administration of [60]fullerene. Biomaterials. 33, 4936-4946;
- MARY K. MANIBUSAN, MARC ODIN, DAVID A. EASTMOND. (2007). Postulated Carbon Tetrachloride Mode of Action: A Review. Journal of Environmental Science and Health, Part C. 25, 185-209;
- Алхимия «волшебной сажи» — перспективы применения фуллерена C60 в медицине;
- D. Harman. (1956). Aging: A Theory Based on Free Radical and Radiation Chemistry. Journal of Gerontology. 11, 298-300;
- Vladimir Skulachev. (2005). How to Clean the Dirtiest Place in the Cell: Cationic Antioxidants as Intramitochondrial ROS Scavengers. IUBMB Life (International Union of Biochemistry and Molecular Biology: Life). 57, 305-310;
- V. N. Anisimov, L. E. Bakeeva, P. A. Egormin, O. F. Filenko, E. F. Isakova, et. al.. (2008). Mitochondria-targeted plastoquinone derivatives as tools to interrupt execution of the aging program. 5. SkQ1 prolongs lifespan and prevents development of traits of senescence. Biochemistry Moscow. 73, 1329-1342;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Yuri N. Antonenko, Armine V. Avetisyan, Dmitry A. Cherepanov, Dmitry A. Knorre, Galina A. Korshunova, et. al.. (2011). Derivatives of Rhodamine 19 as Mild Mitochondria-targeted Cationic Uncouplers. J. Biol. Chem.. 286, 17831-17840;
- F. F. Severin, I. I. Severina, Y. N. Antonenko, T. I. Rokitskaya, D. A. Cherepanov, et. al.. (2010). Penetrating cation/fatty acid anion pair as a mitochondria-targeted protonophore. Proceedings of the National Academy of Sciences. 107, 663-668;
- Скулачев В.П. Рассказы о биоэнергетике (2-е издание). М: «Молодая гвардия», 1982;
- Северин Ф.Ф. и Скулачёв В.П. (2009). Запрограммированная клеточная смерть как мишень борьбы со старением организма. «Успехи геронтол.». 22, 37–48;
- Grigory V. Andrievsky, Vadim I. Bruskov, Artem A. Tykhomyrov, Sergey V. Gudkov. (2009). Peculiarities of the antioxidant and radioprotective effects of hydrated C60 fullerene nanostuctures in vitro and in vivo. Free Radical Biology and Medicine. 47, 786-793;
- Yao Xiao, Mark R. Wiesner. (2012). Characterization of surface hydrophobicity of engineered nanoparticles. Journal of Hazardous Materials. 215-216, 146-151;
- G.B. Zavilgelsky, V.Yu. Kotova, I.V. Manukhov. (2007). Action of 1,1-dimethylhydrazine on bacterial cells is determined by hydrogen peroxide. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 634, 172-176;
- Празднова Е.В., Севрюков А.В., Новикова Е.В. (2011). Детекция сырой нефти при помощи бактериальных Lux-биосенсоров. «Известия ВУЗов. Северо-Кавказский регион. Естественные науки». 4, 80–83;
- Празднова Е.В., Чистяков В.А., Сазыкина М.А., Сазыкин И.С., Кхатаб З.С. (2012). Перекись водорода и генотоксичность ультрафиолетового излучения с длиной волны 300–400 нм. «Известия ВУЗов. Северо-Кавказский регион. Естественные науки». 1, 85–87;
- Чистяков В.А., Празднова Е.В., Гутникова Л.В., Сазыкина М.А., Сазыкин И.С. (2012). Супероксидустраняющая активность производного пластохинона — 10-(6′-пластохинонил) децилтрифенилфосфония (SkQ1). «Биохимия». 77, 932–935;
- Олудина Ю.Н., Сазыкина М.А., Празднова Е.В., Сазыкин И.С., Хмелевцова Л.Е., Бухаров С.В. и др. (2014). Синтез модифицированных пространственно-затрудненных фенолов и исследование их способности защищать ДНК бактерий от повреждения ультрафиолетом B. «Химико-фармацевтический журнал». 12;
- Кулаев И.С. (1998). Происхождение эукариотических клеток. «Соросовский образовательный журнал». 5, 17–22;
- V. A. Chistyakov, Yu. O. Smirnova, E. V. Prazdnova, A. V. Soldatov. (2013). Possible Mechanisms of Fullerene C60Antioxidant Action. BioMed Research International. 2013, 1-4;
- Prazdnova E.V., Chistyakov V.A., Smirnova Yu.O., Soldatov A.V., Alperovich I.G. (2013). Possible mechanisms of fullerene C60 antioxidant action. II German-Russian Interdisciplinary Workshop «Nanodesign: Physics, Chemistry and Computer modeling». 23.