
Диагностика патологий клеточного метаболизма при нейродегенеративных заболеваниях
14 октября 2017
Диагностика патологий клеточного метаболизма при нейродегенеративных заболеваниях
- 4847
- 0
- 15
Нейродегенеративные заболевания характеризуются постепенной потерей нейронов в различных структурах центральной нервной системы. Одной из причин гибели нейронов могут быть нарушения работы митохондрий.
рисунок Елены Беловой, модифицирован с использованием рисунка из Research: Spinal cord injuries may cause brain degeneration
-
Автор
-
Редактор
-
Иллюстратор
Нейродегенеративные заболевания — это большая группа неврологических расстройств, связанная с постепенным уменьшением количества нервных клеток из-за специфических изменений их метаболизма. К числу этих недугов относят болезни Альцгеймера, Паркинсона и ряд других, более редких патологий (например, хорею Гентингтона). Современные методы лечения имеют ограниченную эффективность и в лучшем случае помогают замедлить их прогрессирование. Если существующие подходы к решению проблемы не работают, значит нужно подойти к ней с другой стороны. И новые данные могут оказаться полезными для разработки более эффективных методов лечения.
Биоэнергетика

Спецпроект о клеточном энергетическом метаболизме, работе митохондрий и АТФ, а также о заболеваниях, связанных с нарушениями функций клеточных «батареек».
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Статья, которую вы сейчас читаете, является частью спецпроекта «Биоэнергетика», которую «Биомолекула» делает совместно с компанией «БиоХимМак». В цикле уже вышел обзор о болезнях и изменениях клеточного метаболизма [1] и статья, посвящённая нарушению работы митохондрий при онкологических заболеваниях [2]. В них обсуждается роль митохондрий в здоровых клетках и клетках, которые подвержены патологическим изменениям. Эта, последняя статья цикла, рассказывает о митохондриальной дисфункции при нейродегенеративных заболеваниях — болезнях Альцгеймера, Паркинсона и других неврологических расстройствах. Сначала мы обсудим, как при этих болезнях меняется функционирование митохондрий. Затем рассмотрим существующие методы исследования их работы в нервных клетках и использование получаемой при этом информации.
Клетка с севшими батарейками
Каждое из нейродегенеративных заболеваний связано с изменениями разных метаболических путей внутри нервной клетки. Исследования выявили биохимические маркеры, соответствующие каждой из болезней (табл. 1) [3].
| Болезнь | Биохимические маркеры болезни |
|---|---|
| Болезнь Альцгеймера | Aβ1—42 пептид в плазме и цереброспинальной жидкости (ЦСЖ) Тау-белок в ЦСЖ Фосфорилированный тау-белок |
| Болезнь Паркинсона | Снижение уровня дофаминового транспортёра (DAT) Тельца Леви |
| Боковой амиотрофический склероз | Цитокины Глутатион 8-гидрокси-2’-деоксигуанозин Супероксиддисмутаза-1 Метаботропный рецептор к глутамату 2-го типа |
| Болезнь Гентингтона | Гормоны роста Цитокины Глутатион 8-гидрокси-2’-деоксигуанозин Супероксиддисмутаза-1 Метаботропный рецептор к глутамату 2-го типа |
Углубленный анализ метаболических изменений в нервных клетках определил, что в патологии каждого нейродегенеративного заболевания в той или иной степени задействованы митохондрии. Митохондрии — это органеллы, которые, несмотря на свой небольшой размер, являются активными участниками ключевых биохимических процессов, протекающих в клетках [1]. Основная функция митохондрий заключается в поддержании энергетического баланса клеток. Эти органеллы поддерживают окислительно-восстановительный баланс клетки и регулируют гомеостаз кальция. С работой митохондрий напрямую связаны процессы запрограммированной и не запрограммированной клеточной смерти.
Обсуждая вопрос энергетического обеспечения, надо вспомнить, что мозг потребляет до 20% всей энергии, вырабатываемой в организме. И если энергетическая функция митохондрий будет нарушена, это быстро скажется на работе центральной нервной системы. Важности митохондриям добавляет то, что нейроны в сравнении с другими типами клеток обладают меньшей способностью самостоятельно получать энергию за счет гликолиза. Получается, изменения в работе митохондрий приведут к тому, что нейрон перестает полноценно выполнять свои функции.
Правила движения митохондрий
Митохондриальная дисфункция при нейродегенеративных заболеваниях хорошо изучена [4]. Одной из ее причин может быть изменение нормальной динамики этих органелл. В нервной клетке с митохондриями постоянно что-то происходит [5]. Они:
- делятся;
- сливаются;
- перемещаются внутри клетки.
Чтобы наглядно представить себе эти процессы, сравним митохондрию с комочком теста на столе при приготовлении пирожков. Если комочек большой, то из него можно сделать два комочка поменьше. Если теста мало, то можно взять другой комочек и слепить их вместе. Когда теста в комке достаточно, он отправляется туда, куда нужно — в угол доски, где его ждет дальнейшее включение в пекарский «метаболизм».
Изменение числа и положения митохондрий в клетке помогает нейрону адаптироваться к изменению функций. Транспорт митохондрий в аксон является реакцией на повышение потребности в энергии. Число митохондрий также меняется в ответ на изменение условий. Если нужно меньше энергии, число митохондрий снижается, а вслед за этим снижается и энергопродукция клетки.
Нарушение динамики митохондрий изменяет их функциональное состояние и приводит к нарушениям в работе нервной клетки (рис. 1).
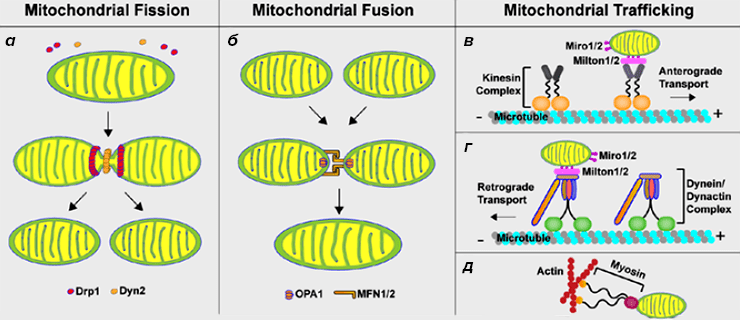
Рисунок 1. Динамика митохондрий в клетках животных. Митохондрии в нейронах могут разделяться (а) и сливаться (б). Кроме этого, в соответствии с энергетическими потребностями клетки митохондрии могут перемещаться в область аксона и покидать ее (в—д).
- В делении митохондрий важную роль играют белки Drp1 (dynamin-related protein 1) и Dyn2 (dynamin-like protein). Drp1 формирует на поверхности делящейся митохондрии два кольца, но окончательное разделение митохондрий возможно только при помощи Dyn2.
- Для нормального слияния митохондрий необходимо, чтобы белки Mfn1 (mitofusin 1), Mfn2 (mitofusin 2) и OPA1 (optic atrophy protein 1) помогли органеллам «состыковаться». Белки Mfn1/2 отвечают за «стыковку» внешних мембран митохондрий, а OPA1 соединяет их внутренние мембраны.
- Движение митохондрий по микротрубочкам в синаптическую часть нейрона и из нее осуществляется при помощи двух разных белковых комплексов. Антероградное движение (перемещение митохондрий в сторону синапса) происходит благодаря кинезиновому комплексу (kinesin complex). Ретроградное движение органелл (возвращение митохондрий из синаптической части) становится возможным при участиии динеин-динактинового комплекса (dynein/dynactin complex). Митохондрии крепятся к обоим двигательным комплексам при помощи белков Miro1/2 (mitochondrial Rho GTPase 1 и 2) и Milton1/2 (или trafficking kinesin protein 1 и 2, TRAK 1 и 2). На процесс транспорта могут влиять белки Drp1 и Mfn2, задействованные в разделении и слиянии митохондрий. Дефицит Mfn2 может привести к тому, что митохондрии будут плохо прикрепляться к микротрубочкам, по которым они доставляются в аксон и из него [6]. Проблемы с транспортом митохондрий при недостаточной функции Drp1 могут быть вызваны тем, что не разделенные, удлиненные митохондрии не могут полноценно прикрепиться к транспортным белкам [7].
Нарушение динамики митохондрий при нейродегенеративных заболеваниях
Мутации в генах, которые кодируют факторы разделения, и дефицит самих факторов приведут к избыточному слиянию митохондрий. При дефектах в белках, ответственных за слияние митохондрий, мы будем наблюдать их избыточную фрагментацию. Нарушение слияния митохондрий в конечном счете может привести к мутациям в митохондриальной ДНК и появлению органелл с измененной функцией. Прежде всего, это касается процессов окислительного фосфорилирования.
Нарушения в динамике митохондрий при отдельных нейродегенеративных заболеваниях:
- Болезнь Альцгеймера (БА) [8]. Характерна избыточная фрагментация митохондрий с повреждением внутренней мембраны [9]. Сами по себе бета-амилоид [10] и тау-белок [11], которые накапливаются в клетках при болезни Альцгеймера, способны подавлять аксональный транспорт митохондрий, приводя к нарушениям высвобождения нейромедиатора и синаптической пластичности в нейроне.
- Болезнь Паркинсона (БП). Связана с подавлением митохондриального разделения [12]. Нарушение функции митохондрий приводит к накоплению окисленного дофамина [13]. Это вызывает аккумуляцию α-синуклеина и нарушение функции лизосом. Последний фактор негативно влияет на митохондриальную функцию, и так образуется метаболический порочный круг.
- Боковой амиотрофический склероз (БАС). Мутации в гене супероксиддисмутазы-1 нарушают функцию регуляторов слияния и разделения митохондрий [14], что приводит к их фрагментации. Наблюдаемые при БАС изменения в белке TDP-43 (TAR DNA-binding protein 43) приводят к таким же изменениям [15].
- Болезнь Гентингтона (БГ). Мутации в белке HTT (huntingtin) нарушают динамику, а затем и функцию митохондрий, косвенно влияя на белок Drp1 [16].
Все изменения в функции митохондрий нельзя объяснить исключительно нарушениями их динамики. Первичные метаболические нарушения при нейродегенеративных заболеваниях (см. табл. 1) могут вмешаться в работу митохондрий и сами по себе.
Ключевой «цех» митохондрий, который активно производит АТФ — это дыхательная цепь переноса электронов (рис. 2). Она состоит из четырех комплексов, расположенных на внутренней мембране митохондрии [17].
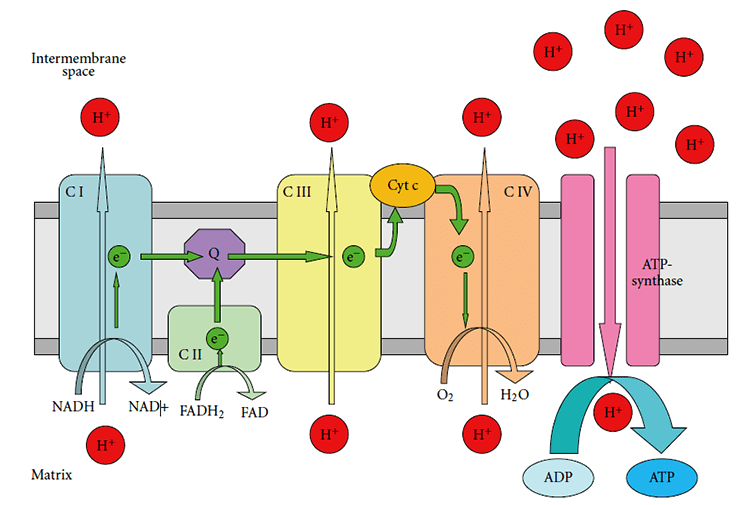
Рисунок 2. Строение дыхательной цепи в митохондриях. C I — комплекс I (NADH-дегидрогеназный комплекс); C II — комплекс II (сукцинатдегидрогеназа); C III — комплекс III (цитохром-bc1-комплекс); C IV — комплекс IV (цитохром-с-оксидаза); Cyt C — цитохром C.
При нейродегенеративных заболеваниях нарушения распространяются не на всю дыхательную цепь, а на отдельные ее элементы, снижая эффективность их работы [18]:
- комплекс I и комплекс II затрагиваются при болезнях Паркинсона и Гентингтона;
- комплекс III поражается при болезнях Паркинсона и Альцгеймера;
- комплекс IV перестает нормально работать при болезни Альцгеймера.
Итогом сбоя в одном элементе становится нарушение работы всей цепи.
Заглянуть внутрь батарейки
В настоящее время существует множество способов, которые позволяют оценить работу митохондрий [19]. Все их можно условно поделить на три группы: изучение изолированных митохондрий, изучение митохондрий в целых клетках и изучение синаптосом.
Изучение изолированных митохондрий
Этот метод позволяет прицельно изучить саму органеллу, но при этом мы не можем полностью оценить воздействие цитозольных факторов на функцию митохондрий. Как правило, выделение митохондрий проводят центрифугированием при низких температурах (0–2 градуса по Цельсию) [20]. Функцию митохондрий оценивают по их способности поглощать кислород, по соотношению окисленных и восстановленных метаболитов. Также отдельно можно изучить активность ферментов дыхательной цепи и синтез АТФ в митохондриях. Эти данные дают подробное представление о том, какие метаболические процессы нарушены внутри органелл, и указывают на возможные пути коррекции нарушений функции митохондрий.
Изучение митохондрий в целых клетках
Здесь трудность кроется в том, что часть веществ, необходимых для оценки работы митохондрий, не проникает через мембрану клетки. Частично это ограничение может быть снято при помощи увеличения проницаемости клеточной мембраны, но это повышает риск повреждения клетки. Для оценки митохондриальной функции у живых клеток измеряют концентрацию и парциальное давление кислорода в ткани или культуре клеток, скорость его потребления.
Изучение синаптосом
В каком-то смысле синаптосома занимает промежуточное положение между целой клеткой и отдельной митохондрией. Выделение синаптосом происходит из гомогенизированной ткани мозга, и она представляет собой изолированный участок аксона нервной клетки с пресинаптическим участком. Синаптосома содержит в себе везикулы с нейромедиатором и митохондрии. Также целой остается пресинаптическая мембрана с комплексом ионных каналов и рецепторов. Активная часть постсинаптической мембраны тоже может попасть при выделении в состав синаптосомы (рис. 3).
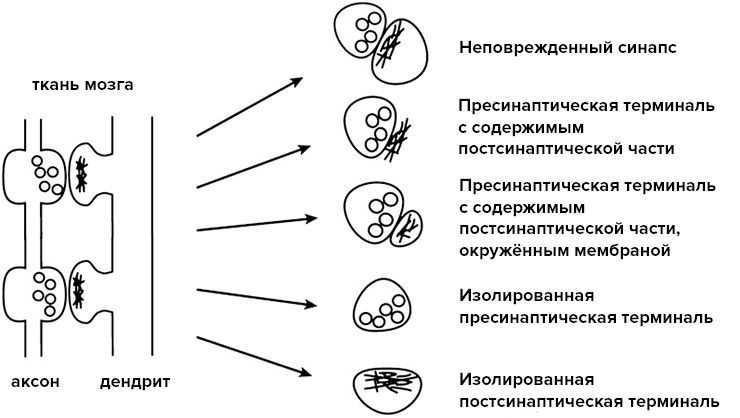
Рисунок 3. Варианты синаптосом, которые могут быть получены в ходе их выделения.
[21], рисунок адаптирован
Синаптосома — это удобный объект для изучения синаптических нарушений при нейродегенеративных заболеваниях. Изучение синаптосом не заменяет другие методы, но дополняет их и уточняет полученные ими данные. Синаптосома — уникальный объект для изучения клеточной функции нейронов и позволяет отдельно оценить роль митохондрий в поддержании работы синапса: при исследовании синаптосом можно оценить концентрацию метаболитов, связанных с активностью митохондрий.
Исследование синаптосом при заболеваниях нервной системы началось в конце 70-х годов XX века [21]. В 1980-х гг. при изучении синаптосом у пациентов с болезнью Альцгеймера был обнаружен дефицит ацетилхолиновой [22], глутаматергической [23] и ГАМК-ергической [24] трансмиссий (передач сигнала). Исследование болезни Альцгеймера оказалось подходящим для разработки основных подходов в изучении синаптосом. Во-первых, количество пациентов, страдающих этим расстройством, велико, что позволяет собрать большое количество материала для исследования. Во-вторых, прогрессирование расстройства в бóльшей степени связывают с нарастающим снижением количества синапсов в мозге [25].
Однако анализ синаптосом может помочь не только в изучении болезни Альцгеймера. При помощи этого метода обнаружили, что мутантный белок HTT при болезни Гентингтона подавляет транспорт митохондрий [26]. Изучение синаптосом приложимо и в случае деменции с тельцами Леви [27].
Все три традиционных метода диагностики метаболической функции митохондрий дают много полезной информации, но при этом обладают рядом недостатков:
- Часто образцы для исследования в ходе самой процедуры разрушаются и становятся не пригодными для повторного исследования.
- Объем исследований ограничен техническими возможностями аппаратуры: нельзя добавлять к исследуемым объектам последовательно несколько реагентов.
- Нельзя быстро исследовать сразу несколько десятков образцов.
Эти сложности подтолкнули индустрию к поискам новых решений.
Тест-драйв митохондрий
Одним из самых перспективных методов для исследования митохондриальной функции является их изучение анализатором внеклеточных потоков (extracellular flux, XF). Такой прибор позволяет оценить показатели митохондриального дыхания и гликолиза в отдельных митохондриях, в синаптосомах и в целых клетках с применением пермеабилизующих (повышающих проницаемость мембраны) реагентов.
Оценка митохондриального дыхания методом XF
Оценку проводят по четырем параметрам:
- базальное дыхание и запасная дыхательная емкость;
- продукция АТФ;
- утечка протонов;
- основное дыхание (немитохондриальное).
Митохондриальное дыхание оценивается по скорости поглощения кислорода (oxygen consumption rate, OCR). Существует представление о стрессовом профиле митохондриального дыхания (рис. 4). Для его формирования в исследуемые образцы поэтапно добавляют вещества-разобщители дыхательной цепи, или митохондриальные ингибиторы (см. врезку). При нормальном функционировании митохондрий они выявят метаболические резервы органелл. Например, добавление ротенона и антимицина нарушает работу комплексов I и III соответственно, заставляя работать другие элементы цепи в полную силу. В этом и есть исследовательская ценность метода XF: мы можем точно узнать, в какой части дыхательной цепи случилась «поломка», проверяя на прочность каждый из участков. Если же ингибиторы дыхания добавлять к образцам, где есть митохондрии, затронутые патологическим процессом, это позволит выявить «слабые» места метаболических реакций. Без дополнительной стимуляции эти нарушения трудно обнаружить, но стресс-тест для митохондрий выявит его. Получаемый при исследованиях тестовых культур профиль сравнивают со стандартным, чтобы получить данные о дефектах клеточного дыхания.
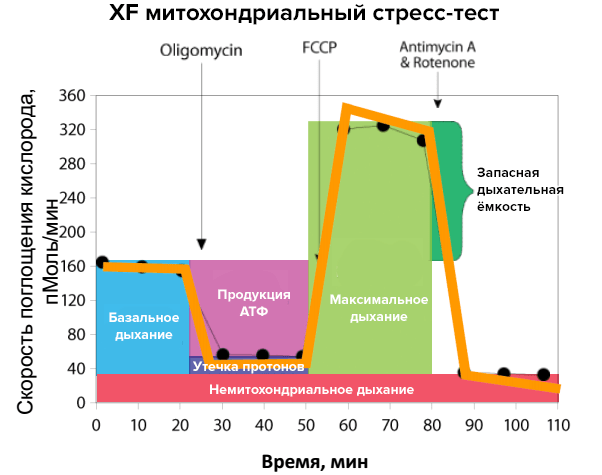
Рисунок 4. Исследование митохондриального дыхания. На рисунке представлен стандартный стрессовый профиль реакции при изучении митохондриального дыхания, которая контролируется по скорости поглощения кислорода. Добавление различных разобщителей дыхательной цепи и метаболически активных веществ в течение опыта позволяет оценить параметры митохондриального дыхания. Желтая линия показывает изменения скорости поглощения кислорода при разных условиях, а цветные столбики являются производными от этих изменений.
Например, добавление карбонилцианид-4-(трифлуорометокси)фенилгидразона (FCCP) нарушает синтез АТФ. За счет «контрабанды» протонов мимо АТФ-синтазы из межмебранного пространства в матрикс электрохимический потенциал исчезает, и синтез АТФ постепенно снижается до нуля. Это разрывает процесс окислительного фосфорилирования, «заставляя» митохондрии работать на полную мощность. Они вынуждены «выталкивать» избыток протонов в межмембранное пространство, что приводит к увеличению потребления кислорода до максимума. Олигомицин нарушает фосфорилирование АДФ и его введение в образец снижает синтез АТФ. На рисунке это отражается как уменьшение скорости поглощения кислорода митохондриями. Запасная дыхательная емкость рассчитывается как разница между максимальным и базальным дыханиями.
рисунок предоставлен компанией «Биохиммак»
Например, при добавлении в исследуемые образцы синаптосом нейронов ингибиторов комплексов I и II (ротенона и 3-нитропропионовой кислоты соответственно) отмечали резкое снижение показателей максимального дыхания, что моделировало болезни Паркинсона и Гентингтона [28]. Следовательно, нарушения в работе этих комплексов являются важным компонентом в развитии указанных нейродегенеративных заболеваний.
Также митохондриальную функцию можно оценивать и у целых клеток. Для создания модели болезни Паркинсона у модельных клеток подавляли продукцию митохондриальной аконитазы (m-аконитазы) [29]. Mитохондриальная аконитаза участвует в цикле Кребса, превращая цитрат в изоцитрат. Кроме этого она ответственна за поставку электронов (в виде NADH) для дыхательной цепи. Снижение функции m-аконитазы приводит к дефициту электронов. Как следствие, кислород не переходит в связанное состояние в комплексе IV, и его потребление снижается. При сравнении двух дыхательных профилей (рис. 5) становится очевидно, что у модельных клеток снижено базальное дыхание (часть графика до добавления олигомицина) и респираторная емкость (часть графика между добавлением FCCP и антимицина А (AA).

Рисунок 5. Тестовое определение базального дыхания и дыхательной емкости у контрольной группы клеток в сравнении с модельными клетками при болезни Паркинсона (пояснения в тексте).
Если мы возьмем клетки реальных пациентов с болезнью Паркинсона, проведем их исследование с добавлением тех же реактивов в том же порядке и получим такие же результаты, то сможем сказать, что нарушения в работе этих нейронов, возможно, связаны с дисфункцией m-аконитазы. Здесь у нас открывается возможность для тестирования препаратов: мы можем исследовать образцы нейронов с потенциальными препаратами, добавляя к ним олигомицин, FCCP и антимицин A. Потенциально успешные препараты будут демонстрировать эффект в виде приближения кривой к нормальным показателям.
Такие эксперименты уже проводят. Например, метод XF позволил оценить нейропротекторный эффект меклизина при его использовании на клеточных моделях болезни Гентингтона [30]. Меклизин относится к противорвотным препаратам с антигистаминовой и антихолинергической активностью. Добавление меклизина к клеточным культурам с мутантным белком, отвечающим за развитие болезни Гентингтона, увеличило выживаемость клеток. При этом эффект реализовывался именно за счет нормализации процессов клеточного дыхания: меклизин может уменьшать образование эндогенных окисленных продуктов [31] и препятствовать высвобождению цитохрома C из митохондрий [32].
Оценка гликолиза методом XF
Кроме оценки митохондриального дыхания, методом XF можно оценить различные показатели гликолиза (рис. 6):
- негликолитическое окисление;
- гликолиз;
- гликолитическуюемкость;
- гликолитический резерв.
Ситуация здесь схожа с той, что обсуждалась при изучении митохондриального дыхания. Гликолитическую активность митохондрий оценивают по скорости внеклеточного закисления (extracellular acidification rate, ECAR).
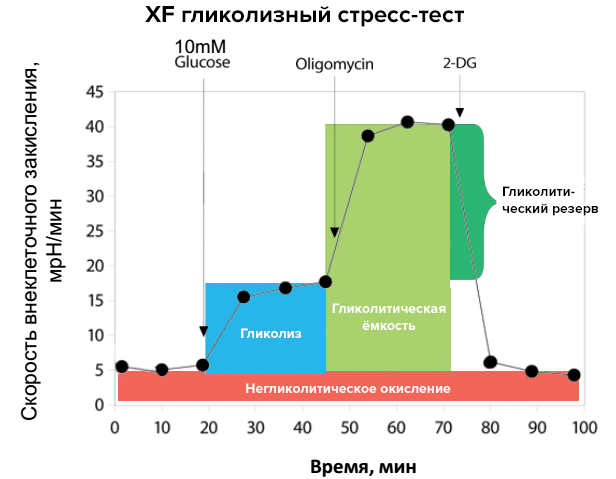
Рисунок 6. Исследование показателей гликолиза (стандартный стрессовый профиль реакции). Гликолиз косвенно оценивают по изменению pH среды. Добавление метаболически активных веществ, как и в случае с митохондриальным дыханием, позволяет изменять интенсивность процесса гликолиза, что и фиксируют при исследовании. Черная кривая с точками демонстрирует эти изменения, а цветные столбики являются производными от них. Добавление к исследуемым образцам 2-дезокси-D-глюкозы (2-DG) подавляет гликолитическую активность, в то время как раствор глюкозы и олигомицин значительно усиливают ее.
рисунок предоставлен компанией «Биохиммак»
Добавление различных субстратов проверяет на прочность метаболическую активность митохондрий, выявляя уязвимые места. Где тонко, там и рвется — метод XF ищет «тонкие» места в метаболизме митохондрий, потенциально указывая на то, что они могут быть усилены при помощи лекарств. Допустим, мы нашли, что при определенной патологии поражается комплекс III дыхательной цепи. Значит, поиск лекарства будет связан с выбором вещества, которое усиливает активность этого компонента и приводит к повышению выживаемости клеток, как это было показано выше в примере с миклезином и болезнью Гентингтона.
Инструмент для мастера
Качественное исследование в молекулярной биологии требует современного оборудования. Метод XF, изобретенный в 2006 году, используется в анализаторах компании Seahorse Bioscience (a part of Agilent Technologies, США). Оборудованием для анализа клеточного метаболизма, которое производит эта компания, пользуются ведущие мировые лаборатории. Счет исследованиям, при проведении которых использовали эти анализаторы, идет на сотни. В анализаторах Seahorse можно изучать параметры гликолиза и клеточного дыхания в 3D-культурах клеток, отдельных клетках, митохондриях и синаптосомах. Кроме того, для анализа могут быть использованы целые инсулярные островки поджелудочной железы.
Процедура исследования автоматизирована: необходимо только поместить изучаемые образцы в специальную планшетку и заполнить отделение для реагентов. Анализ метаболических показателей проводится благодаря твердофазным оптическим сенсорам, которые не повреждают клеточную культуру, и она может быть использована повторно в экспериментах. Те части прибора, которые контактируют с исследуемыми образцами, являются одноразовыми и не требуют отмывки. На саму процедуру анализа прибором уходят минуты, но получаемая информация обладает высокой точностью. Колебания давления кислорода оцениваются с чувствительностью в 0,67 mmHg (миллиметров ртутного столба); также прибор фиксирует изменение содержания ионов водорода на уровне пикомолей. При этом аппарат способен одновременно оценить клеточное дыхание и обмен глюкозы. Клеточное дыхание измеряется по уровню потребления кислорода, а обмен глюкозы — по уровню продукции протонов водорода в изучаемых образцах. Двух этих параметров достаточно, чтобы полноценно оценить метаболическую функцию клетки и ее нарушения.
Благодаря системе автоматических инъекционных портов в ходе измерений может быть добавлено до четырех веществ, влияющих на метаболизм — ингибиторы клеточного дыхания, различные токсины и цитопротекторы. Учитывая то, что в одном планшете одновременно можно тестировать до 96 образцов, исследовательские возможности прибора становятся просто колоссальными. О производительности и качестве приборов говорит и то, что их использовали в Национальной программе США по исследованию токсических веществ, где анализу подвергли более 1300 химических соединений [33].
Если говорить о компонентах для анализа, то готовые реагенты поставляет сама компания Seahorse, в том числе и реагенты для контроля состояния приборов. Расход реагентов при процедуре анализа методом XF ниже, чем при традиционных методах. Это достигается за счет того, что клеток для работы требуется в 10–20 раз меньше.
Если сравнивать XF-анализаторы митохондриального метаболизма с приборами на основе других методов, то можно отметить ряд несомненных преимуществ. Одним из способов измерения концентрации кислорода при исследовании митохондрий является использование электродов Кларка или автоматизированной аппаратуры на их основе — оксиграфов. Главный их недостаток — необходимость большого количества материала для исследования, что исключает изучение синаптосом. Масс-спектрометрия и газовая хроматография дóроги и требуют длительной подготовки анализируемого материала. Это усложняет их применение на практике. Еще одно преимущество XF-анализиторов — это способность одновременно измерять динамику pH и концентрацию кислорода в пробах, что дает исследователю комплексное представление о метаболизме глюкозы и митохондриальном дыхании.
Заключение
Как показывает множество исследований, при нейродегенеративных заболеваниях происходит значительное нарушение функции митохондрий. Может нарушаться их движение внутри нейрона, а также процессы их слияния и разделения. Такие изменения приводят к нарушению метаболических процессов, протекающих внутри этих органелл: клеточного дыхания и гликолиза. Их можно косвенно оценить по колебаниям концентрации кислорода и pH. В этом поможет высокоточный и надежный метод анализа внеклеточных потоков — XF (extracellular flow). Он позволяет изучать как живые клетки, так и отдельные митохондрии и синаптосомы. Исследование метаболической активности митохондрий дает информацию, которая позволяет не только пролить свет на патогенез заболевания, но и выяснить, какие лекарственные средства будут эффективны для их лечения.
Литература
- Болезни и изменения клеточного метаболизма;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Megha Agrawal, Abhijit Biswas. (2015). Molecular diagnostics of neurodegenerative disorders. Front. Mol. Biosci.. 2;
- Michael T. Lin, M. Flint Beal. (2006). Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 443, 787-795;
- Ju Gao, Luwen Wang, Jingyi Liu, Fei Xie, Bo Su, Xinglong Wang. (2017). Abnormalities of Mitochondrial Dynamics in Neurodegenerative Diseases. Antioxidants. 6, 25;
- A. Misko, S. Jiang, I. Wegorzewska, J. Milbrandt, R. H. Baloh. (2010). Mitofusin 2 Is Necessary for Transport of Axonal Mitochondria and Interacts with the Miro/Milton Complex. Journal of Neuroscience. 30, 4232-4240;
- Wenjun Song, Jin Chen, Alejandra Petrilli, Geraldine Liot, Eva Klinglmayr, et. al.. (2011). Mutant huntingtin binds the mitochondrial fission GTPase dynamin-related protein-1 and increases its enzymatic activity. Nat Med. 17, 377-382;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- X. Wang, B. Su, H.-g. Lee, X. Li, G. Perry, et. al.. (2009). Impaired Balance of Mitochondrial Fission and Fusion in Alzheimer's Disease. Journal of Neuroscience. 29, 9090-9103;
- C. A. Hansson Petersen, N. Alikhani, H. Behbahani, B. Wiehager, P. F. Pavlov, et. al.. (2008). The amyloid -peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of the National Academy of Sciences. 105, 13145-13150;
- M. Manczak, P. H. Reddy. (2012). Abnormal interaction between the mitochondrial fission protein Drp1 and hyperphosphorylated tau in Alzheimer's disease neurons: implications for mitochondrial dysfunction and neuronal damage. Human Molecular Genetics. 21, 2538-2547;
- L.-Y. Hao, B. I. Giasson, N. M. Bonini. (2010). DJ-1 is critical for mitochondrial function and rescues PINK1 loss of function. Proceedings of the National Academy of Sciences. 107, 9747-9752;
- Lena F. Burbulla, Pingping Song, Joseph R. Mazzulli, Enrico Zampese, Yvette C. Wong, et. al.. (2017). Dopamine oxidation mediates mitochondrial and lysosomal dysfunction in Parkinson’s disease. Science. 357, 1255-1261;
- Wentao Liu, Toru Yamashita, Fengfeng Tian, Nobutoshi Morimoto, Yoshio Ikeda, et. al.. (2013). Mitochondrial Fusion and Fission Proteins Expression Dynamically Change in a Murine Model of Amyotrophic Lateral Sclerosis. CNR. 10, 222-230;
- Wenzhang Wang, Li Li, Wen-Lang Lin, Dennis W. Dickson, Leonard Petrucelli, et. al.. (2013). The ALS disease-associated mutant TDP-43 impairs mitochondrial dynamics and function in motor neurons. Unknown journal title.. 22, 4706-4719;
- U. P. Shirendeb, M. J. Calkins, M. Manczak, V. Anekonda, B. Dufour, et. al.. (2012). Mutant huntingtin's interaction with mitochondrial protein Drp1 impairs mitochondrial biogenesis and causes defective axonal transport and synaptic degeneration in Huntington's disease. Human Molecular Genetics. 21, 406-420;
- P. C. Keane, M. Kurzawa, P. G. Blain, C. M. Morris. (2011). Mitochondrial Dysfunction in Parkinson's Disease. Parkinson's Disease. 2011, 1-18;
- Heng Du, Shirley ShiDu Yan. (2010). Mitochondrial medicine for neurodegenerative diseases. The International Journal of Biochemistry & Cell Biology. 42, 560-572;
- Фрелих Г.А., Поломеева Н.Ю., Васильев А.С., Удут В.В. (2013). Современные методы оценки функционального состояния митохондрий. Сибирский медицинский журнал. 3, 7–13;
- Егорова М.В. и Афанасьев С.А. (2011). Выделение митохондрий из клеток и тканей животных и человека: современные методические приемы. Сибирский медицинский журнал. 1, 22–28;
- Jia-Fong Jhou, Hwan-Ching Tai. (2017). The Study of Postmortem Human Synaptosomes for Understanding Alzheimer’s Disease and Other Neurological Disorders: A Review. Neurol Ther. 6, 57-68;
- R.J. Rylett, M.J. Ball, E.H. Colhoun. (1983). Evidence for high affinity choline transport in synaptosomes prepared from hippocampus and neocortex of patients with Alzheimer's disease. Brain Research. 289, 169-175;
- John Hardy, Richard Cowburn, Amanda Barton, Gavin Reynolds, Elisabeth Lofdahl, et. al.. (1987). Region-specific loss of glutamate innervation in Alzheimer's disease. Neuroscience Letters. 73, 77-80;
- John Hardy, Richard Cowburn, Amanda Barton, Gavin Reynolds, Peter Dodd, et. al.. (1987). A disorder of cortical GABAergic innervation in Alzheimer's disease. Neuroscience Letters. 73, 192-196;
- Robert D. Terry, Eliezer Masliah, David P. Salmon, Nelson Butters, Richard DeTeresa, et. al.. (1991). Physical basis of cognitive alterations in alzheimer's disease: Synapse loss is the major correlate of cognitive impairment. Ann Neurol.. 30, 572-580;
- Hiroko Yano, Sergei V Baranov, Oxana V Baranova, Jinho Kim, Yanchun Pan, et. al.. (2014). Inhibition of mitochondrial protein import by mutant huntingtin. Nat Neurosci. 17, 822-831;
- Nadia O Postupna, C Dirk Keene, Caitlin Latimer, Emily E Sherfield, Rachel D Van Gelder, et. al.. (2014). Flow cytometry analysis of synaptosomes from post-mortem human brain reveals changes specific to Lewy body and Alzheimer’s disease. Lab Invest. 94, 1161-1172;
- Sung W. Choi, Akos A. Gerencser, David G. Nicholls. (2009). Bioenergetic analysis of isolated cerebrocortical nerve terminals on a microgram scale: spare respiratory capacity and stochastic mitochondrial failure. Unknown journal title.. 109, 1179-1191;
- David Cantu, Ruth E. Fulton, Derek A. Drechsel, Manisha Patel. (2011). Mitochondrial aconitase knockdown attenuates paraquat-induced dopaminergic cell death via decreased cellular metabolism and release of iron and H2O2. Unknown journal title.. 118, 79-92;
- V. M. Gohil, N. Offner, J. A. Walker, S. A. Sheth, E. Fossale, et. al.. (2011). Meclizine is neuroprotective in models of Huntington's disease. Human Molecular Genetics. 20, 294-300;
- Andrea M. Vincent, Eva L. Feldman. (2008). Can Drug Screening Lead to Candidate Therapies for Testing in Diabetic Neuropathy?. Antioxidants & Redox Signaling. 10, 387-394;
- X. Wang, S. Zhu, Z. Pei, M. Drozda, I. G. Stavrovskaya, et. al.. (2008). Inhibitors of Cytochrome c Release with Therapeutic Potential for Huntington's Disease. Journal of Neuroscience. 28, 9473-9485;
- Matias S. Attene-Ramos, Ruili Huang, Srilatha Sakamuru, Kristine L. Witt, Gyda C. Beeson, et. al.. (2013). Systematic Study of Mitochondrial Toxicity of Environmental Chemicals Using Quantitative High Throughput Screening. Chem. Res. Toxicol.. 26, 1323-1332.







