
Дело о BRCA-мутациях: выводим преступников на чистую воду
13 февраля 2021
Дело о BRCA-мутациях: выводим преступников на чистую воду
- 1576
- 0
- 4
Мутации в генах BRCA 1 и 2 чаще всего являются причиной наследственного рака молочной железы
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Ассоциация мутаций в генах BRCA1 и BRCA2 с наследственным раком молочной железы доказана уже давно. Но почему же мутации именно в этих генах возникают наиболее часто, а первичные метастазы чаще всего появляются в тканях молочной железы? На эти вопросы однозначного ответа нет. Давайте попытаемся пролить свет на эти загадки.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Враг нашего времени
С начала XX века медицина, тесно подружившись с наукой и технологиями, стремительно вырвалась вперед: побеждены многие инфекционные заболевания, колоссально сократилась детская смертность, трансплантация становится доступной все в большем количестве клиник, а нанотехнологии стоят на службе у фармацевтики. Так чего же бояться современному человеку, когда, казалось бы, разработаны средства от всех болезней? К сожалению, пока это не так — против многих групп заболеваний современная медицина пока бессильна. Среди них, согласно данным Всемирной организации здравоохранения, лидируют онкологические заболевания, постепенно приближаясь по частоте смертности к сердечно-сосудистым и инфекционным. Сложность борьбы со злокачественными новообразованиями заключается в том, что при поздней диагностике возможность помочь пациенту существенно сокращается [1], [2]. Согласно статистике, средний возраст диагностики онкологических заболеваний среди россиян составляет 64,5 года. Поэтому людям пожилого возраста важно проходить своевременную комплексную диагностику, помогающую выявить рак на ранних стадиях. Особой группой в структуре онкологических заболевания стоят наследственные типы рака [29]. В этом случае, развитие заболевания может начаться намного раньше (<40 лет), так как человек является носителем мутантного аллеля с самого рождения и обладает повышенными рисками появления онкопатологии в случае «поломки» второго здорового аллеля [3].
Рак молочной железы (РМЖ) — наиболее частый тип злокачественных новообразований среди женщин [4]. При этом наследственная форма РМЖ наблюдается приблизительно в 5–10% случаев от общей встречаемости [5], возникая в более раннем возрасте и развиваясь агрессивнее по сравнению со спорадической (ненаследственной) формой. Причиной развития наследственного РМЖ являются мутации в генах, отвечающих за сохранение целостности ДНК [6], [7]. Результаты диагностики указывают на то, что основными виновниками возникновения заболевания являются мутации в генах BRCA1 и BRCA2 (BReast CAncer гены 1 и 2).
Мутации в генах BRCA 1 и 2: составляем фоторобот преступников
Почему именно в генах BRCA 1 и 2 мутации возникают чаще, чем в остальных, кодирующих белки системы репарации ДНК? Чтобы ответить на этот вопрос, начнем с того, что гены BRCA 1 и 2 — огромные по своему размеру: 43 тысячи пар нуклеотидов в BRCA1, 32 тысячи в BRCA2, — и содержат множество полиморфных регионов [8]. Чем не причина быть основной мишенью для мутаций?
Второй причиной возникновения патогенных мутаций могут быть функции белковых продуктов — BRCA1 и BRCA2. Работы у них хватает с лихвой. Эти белки участвуют в репарации двойных разрывов ДНК, инициируя гомологичную рекомбинацию (перераспределение нуклеотидов, во время которого происходит обмен последовательностями между двумя похожими хромосомами) [9]. BRCA 1 и 2 образуют комплекс с белком RAD51, который как одеяло накрывает место разрыва ДНК, сводит две нити вместе, соединяет парные нуклеотиды, а затем производит еще и обмен нуклеотидами между цепями [10]. При этом BRCA2, в отличие от BRCA1, связывается с RAD51 напрямую и регулирует положение этого белка в клетке (рис. 1).
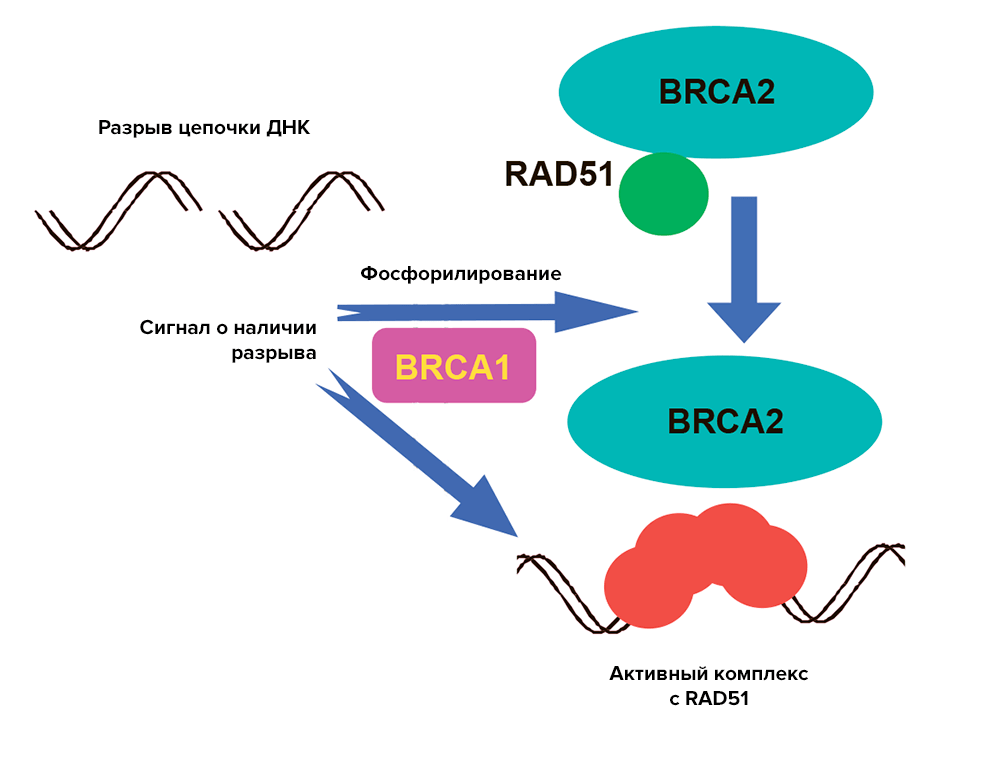
Рисунок 1. Комплекс белков BRCA1 и BRCA2 с RAD51. Схематическое изображение образования комплекса белков для репарации разрыва в нити ДНК.
Зато BRCA1 в большей степени участвует в запуске транскрипционного ответа клетки на повреждение ДНК [8], [12]. Делает он это с помощью прямого или опосредованного взаимодействий с факторами транскрипции, которые будят РНК-полимеразу II [13]. А уж если она проснулась — синтез белков пойдет по полной, так как эта полимераза отвечает за активность транскрипции (рис. 2).
Наконец, гены BRCA нужны для регуляции клеточного цикла. Если в клетке произошел разрыв цепочки ДНК, то этой клетке срочно нужно тормозить деление, чтобы не допустить распространение дефектной ДНК. Притормозить клетка может в определенных точках цикла (чек-поинтах) (рис. 2). Таким образом, найдя у себя фосфорилированный (а, следовательно, активно работающий) белок BRCA1, клетка дожидается починки ДНК в точке G2/M и уходит в митоз только после завершения починки [9].
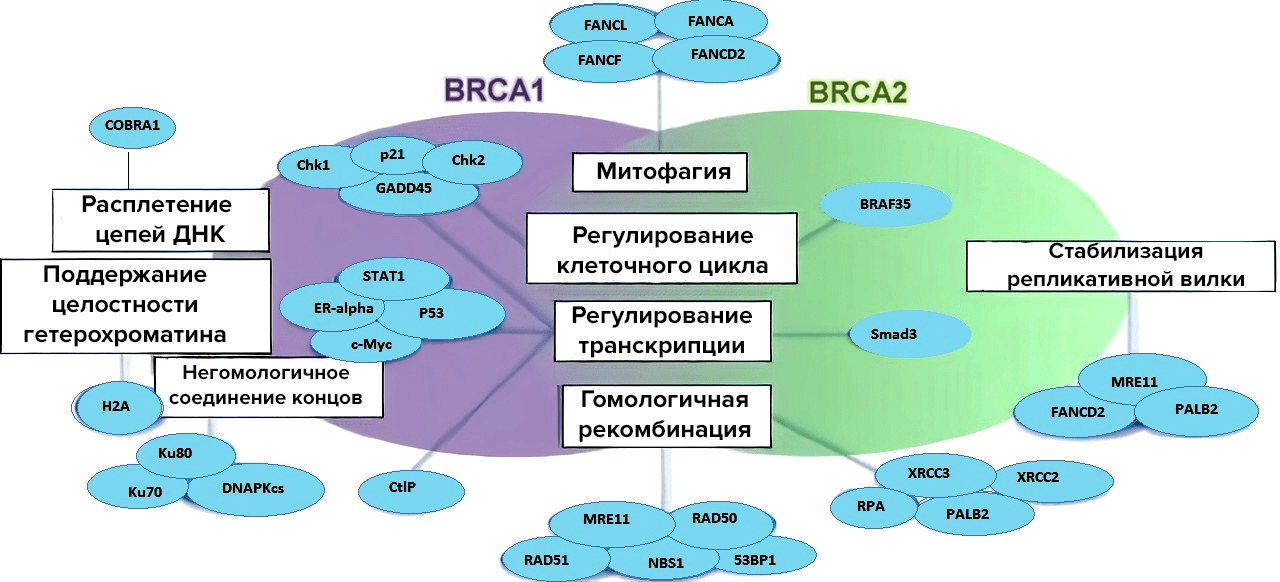
Рисунок 2. BRCA 1 и 2 как регуляторы репарации и клеточного цикла. Белковые продукты генов BRCA 1 и 2 участвуют в важнейших клеточных процессах, связываясь с различными кофакторами.
Получается, что BRCA 1 и 2 являются ключевыми молекулами в репарации, а их поломки способствуют нестабильности генома и приводят к развитию онкопатологии [14]. Тем не менее мутации генов BRCA 1 и 2 — не единственные фигуранты в нашем деле.
В 30% случаев наследственного РМЖ мутации выявляются в других генах, однако в большинстве своем продукты этих генов также участвуют в репарации ДНК, а потому механизм патогенеза будет похож на тот, что наблюдается у носителей BRCA-мутаций [15], [16]. Более того, такие мутации также способствуют формированию фенотипа, клинически похожего на тот, что развивается при носительстве BRCA-мутаций. Такой фенотип называют BRCAness. BRCAness-пациенты являются чувствительными к терапии платиновыми препаратами и ингибитором PARP-полимеразы (полиАДФ-рибозой) [17]. Данные препараты вызывают апоптоз клеток, дефектных в отношении репарации ДНК, при этом подавление активности PARP-полимеразы является более таргетной мерой воздействия, так как в этом случае приводит к гибели именно опухолевых клеток, сохраняя нормальные [18].
Итак, виновность BRCA-мутаций в случае наследственного РМЖ доказана. Однако имеются ли доказательства их участия в спорадической форме рака? Ответ на этот вопрос положительный: мутации в генах BRCA 1 и 2 встречаются и при спорадической форме,.. но достаточно редко [19]. Все-таки для дезактивации генов BRCA 1 и 2 требуется наличие двух мутантных аллелей, а вероятность такого события очень мала, если изначально оба аллеля были без поломок (дикого типа). Тем не менее недавние работы говорят о том, что изменения в генах BRCA 1 и 2 все-таки происходят даже при спорадическом РМЖ [20], [21]. К таким изменениям относится, например, гиперметилирование промоторной области гена, которое не влияет на последовательность нуклеотидов в цепи, однако существенно затрудняет транскрипцию мРНК с гена, поэтому гены начинают работать не в полную силу, и в клетках производится меньше белков BRCA1 и BRCA2 [21].
Первичный очаг заболевания при BRCA-мутациях: идем по следу преступников
Теперь, как принято у настоящих сыщиков, остановимся подробнее на месте и мотиве преступления. С наличием мутаций в генах BRCA 1 и 2 ассоциированы первичные метастазы яичников, фаллопиевых труб, поджелудочной железы, простаты у мужчин, но наиболее часто BRCA-мутации встречаются именно при РМЖ. Почему такая частота наблюдается именно в молочной железе? Для ответа на этот вопрос, давайте кратко вспомним анатомию молочной железы.
Проток молочной железы выстлан двумя слоями клеток: внутренний слой состоит из секреторного люминального эпителия и его клеток-предшественниц, а внешний слой — из стволовых и миоэпителиальных клеток. Эпителий молочной железы имеет уникальное свойство по сравнению с другими тканями, так как он продолжает развиваться после рождения, а именно в период полового созревания, беременности, лактации и менопаузы. Таким образом, деление и рост эпителиальных клеток молочной железы очень чутко реагируют на гормональные изменения. Недавние эпигеномные и транскриптомные исследования молочной железы человека показали, что люминальные клетки имеют в два раза больше гипометилированных энхансеров транскрипции и примерно в четыре раза больше суммарной РНК [22]. А это значит, что транскрипция в этих клетках может протекать очень активно по сравнению с другими тканями. При этом процесс транскрипции сопровождается расплетанием цепей ДНК и синтезом РНК, в результате чего образуются R-петли. Результаты DRIP-seq-анализа носительниц мутаций BRCA и пациенток без этих мутаций также подтверждают, что количество R-петель в люминальных клетках значимо выше по сравнению с другими тканями [23]. Образованию R-петель способствует задержка на том или ином локусе NELF-зависимой РНК-полимеразы II (Negative Elongation Factor (NELF) mediated Pol II) [23]. В тех случаях, когда эта полимераза делает паузу, BRCA1 связывается с различными факторами транскрипции и старается ограничить накопление R-петель на концах промоторов, как бы сгоняя засидевшуюся на месте РНК-полимеразу II. Таким образом, при пониженной экспрессии BRCA1 или нефункциональной форме белка происходит чрезмерное накопление R-петель, что в конечном итоге приводит к геномной нестабильности и способствует онкогенезу (рис. 3).
Независимая от нуклеотидных последовательностей технология, использующая структурно-специфические антитела для иммунопреципитации ДНК—РНК.
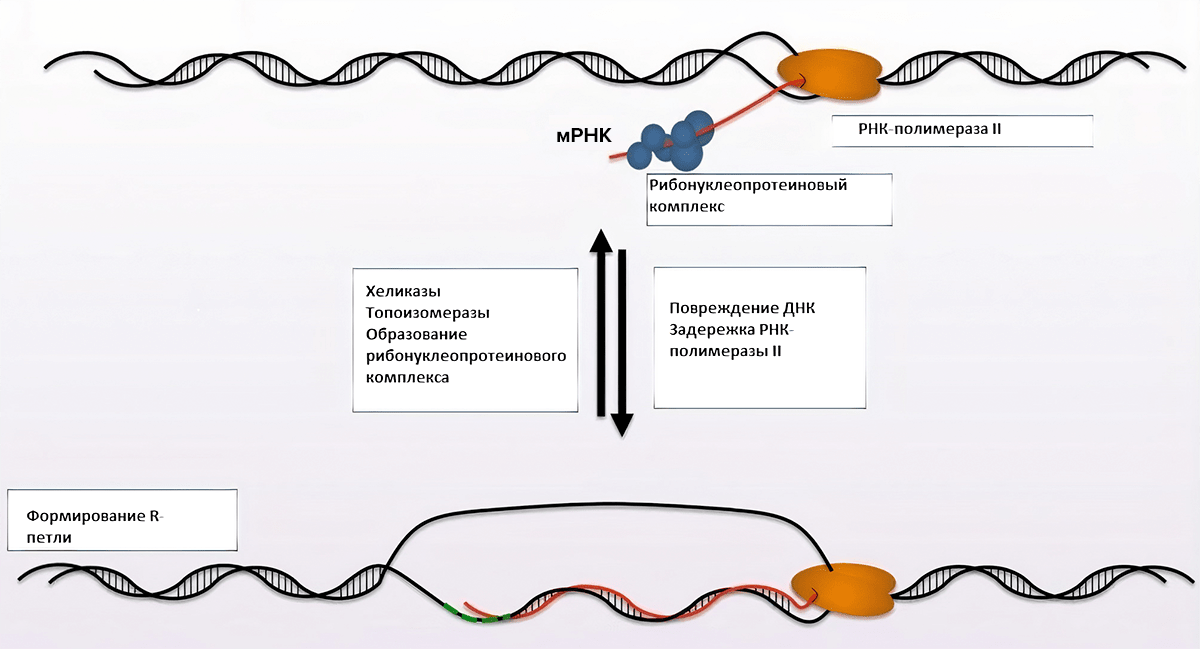
Рисунок 3. Механизм образования R-петель. На участках ДНК, богатых GC-основаниями, РНК-полимераза II делает задержку, в результате чего образуются R-петли.
Есть определенные сложности в исследовании возникающих транскриптов из-за длительной подготовки библиотек для RNA-seq из тканей и малого количества отсортированных первичных клеток, однако гипотеза о связи R-петель и BRCA-мутаций с развитием злокачественных новообразований не встречает существенных противоречий [24]. Более того, эта гипотеза также является справедливой не только для РМЖ, но и для других типов рака, при условии, что пациент является носителем мутаций в генах BRCA 1 и 2.
Найти и обезвредить
Мы с вами рассмотрели влияние мутаций в генах BRCA1 и BRCA2, а также их связь с количеством R-петель и малигнизацией тканей молочной железы. Детальное знание молекулярных механизмов, лежащих в основе патологий, помогает выбрать оптимальную диагностику и терапию заболевания. К сожалению, при выявлении BRCA-мутаций до сих пор встречаются как ложноположительные, так и ложноотрицательные результаты. Последние представлены особенно часто, потому что, как правило, в клинических лабораториях определяются наиболее частые мутации и не учитываются менее распространенные мутации в генах BRCA1, BRCA2 и других генах системы репарации. Здесь еще важно упомянуть, что у этнически различных популяций спектр и частота мутаций в BRCA-генах также различаются: частые мутации, присущие, например, северно-европейским популяциям, не будут встречаться у представителей азиатских популяций [5], [26]. Перечисленные проблемы помогает решить секвенирование нового поколения (next generation sequencing, NGS), метод, который в последнее время набирает все большую популярность в клиническом тестировании [27], [30]. С помощью NGS стало возможным проанализировать полную последовательность генов BRCA 1 и 2, а также других генов, участвующих в репарации ДНК. Однако с решением проблемы ложноотрицательных заключений на смену пришли ошибки, связанные с ложноположительными результатами. Зачастую найденные нуклеотидные варианты, отличающиеся от контрольной последовательности, не приводят к существенной деформации белков BRCA1 или BRCA2. Включение таких доброкачественных вариантов в заключение может привести к роковым ошибкам в терапии. Поэтому в последнее время появляются руководства по интерпретации найденных вариантов в генах BRCA 1 и 2 [28], а также базы данных brcaexchange.org и oncobrca.ru, где можно идентифицировать вариант и определить его патогенность.
В знаменитом трактате «Искусство войны» говорится: «знай своего врага, знай самого себя, и победа будет неизбежна». Поэтому хочется надеяться, что победа над BRCA-ассоциированными онкологическими заболеваниями становится чуть ближе с каждой работой, посвященной этой проблеме.
Литература
- A. A. Ponomaryova, E. Yu. Rykova, N. V. Cherdyntseva, E. L. Choinzonov, P. P. Laktionov, V. V. Vlassov. (2011). Molecular genetic markers in diagnosis of lung cancer. Mol Biol. 45, 175-189;
- Oren Caspi, Doron Aronson. (2019). Surviving Cancer without a Broken Heart. Rambam Maimonides Med J. 10, e0012;
- P. Kenemans, R.A. Verstraeten, R.H.M. Verheijen. (2004). Oncogenic pathways in hereditary and sporadic breast cancer. Maturitas. 49, 34-43;
- Имянитов Е.Н. (2010). Наследственный рак молочной железы. «Практическая онкология». 11, 258–266;
- James D. Fackenthal, Olufunmilayo I. Olopade. (2007). Breast cancer risk associated with BRCA1 and BRCA2 in diverse populations. Nat Rev Cancer. 7, 937-948;
- Dai X., Li T., Bai Z., Yang Y., Liu X., Zhan J., Shi B. (2015). Breast cancer intrinsic subtype classification, clinical use and future trends. Am. J. Cancer. Res. 5, 2929–2943;
- Любченко Л.Н. Наследственный рак молочной железы и/или яичников: ДНК-диагностика, индивидуальный прогноз, лечение и профилактика: дис. ... д-ра мед. наук. — Москва, 2009;
- Rohini Roy, Jarin Chun, Simon N. Powell. (2012). BRCA1 and BRCA2: different roles in a common pathway of genome protection. Nat Rev Cancer. 12, 68-78;
- Jennifer D Davis. (2011). DNA damage and breast cancer. WJCO. 2, 329;
- Kiyotsugu Yoshida, Yoshio Miki. (2004). Role of BRCA1 and BRCA2 as regulators of DNA repair, transcription, and cell cycle in response to DNA damage. Cancer Science. 95, 866-871;
- Venkitaraman A.R. (2001). Functions of BRCA1 and BRCA2 in the biological response to DNA damage. J. Cell Sci. 114, 3591–3598;
- Ielizaveta Gorodetska, Iryna Kozeretska, Anna Dubrovska. (2019). BRCA Genes: The Role in Genome Stability, Cancer Stemness and Therapy Resistance. J. Cancer. 10, 2109-2127;
- Serena L. Clark, Ana M. Rodriguez, Russell R. Snyder, Gary D.V. Hankins, Darren Boehning. (2012). STRUCTURE-FUNCTION OF THE TUMOR SUPPRESSOR BRCA1. Computational and Structural Biotechnology Journal. 1, e201204005;
- Philip Jonsson, Chaitanya Bandlamudi, Michael L. Cheng, Preethi Srinivasan, Shweta S. Chavan, et. al.. (2019). Tumour lineage shapes BRCA-mediated phenotypes. Nature. 571, 576-579;
- Christopher J. Lord, Alan Ashworth. (2016). BRCAness revisited. Nat Rev Cancer. 16, 110-120;
- Jennifer Scalia-Wilbur, Bradley L. Colins, Richard T. Penson, Don S. Dizon. (2016). Breast Cancer Risk Assessment: Moving Beyond BRCA 1 and 2. Seminars in Radiation Oncology. 26, 3-8;
- Hirokazu Tanino, Yoshimasa Kosaka, Hiroshi Nishimiya, Youko Tanaka, Naoko Minatani, et. al.. (2016). BRCAness and Prognosis in Triple-Negative Breast Cancer Patients Treated with Neoadjuvant Chemotherapy. PLoS ONE. 11, e0165721;
- Rios J. and Puhalla S. (2011). PARP inhibitors in breast cancer: BRCA and beyond. Oncol. Williston Park N. 25, 1014–1025;
- Nicholas Turner, Andrew Tutt, Alan Ashworth. (2004). Hallmarks of 'BRCAness' in sporadic cancers. Nat Rev Cancer. 4, 814-819;
- Dobrovic A. and Simpfendorfer D. (1997). Methylation of the BRCA1 gene in sporadic breast cancer. Cancer Res. 57, 3347–3350;
- Dominik Glodzik, Ana Bosch, Johan Hartman, Mattias Aine, Johan Vallon-Christersson, et. al.. (2020). Comprehensive molecular comparison of BRCA1 hypermethylated and BRCA1 mutated triple negative breast cancers. Nat Commun. 11;
- Huai-Chin Chiang, Xiaowen Zhang, Jingwei Li, Xiayan Zhao, Jerry Chen, et. al.. (2019). BRCA1-associated R-loop affects transcription and differentiation in breast luminal epithelial cells. Nucleic Acids Research. 47, 5086-5099;
- Xiaowen Zhang, Huai-Chin Chiang, Yao Wang, Chi Zhang, Sabrina Smith, et. al.. (2017). Attenuation of RNA polymerase II pausing mitigates BRCA1-associated R-loop accumulation and tumorigenesis. Nat Commun. 8;
- Elodie Hatchi, Konstantina Skourti-Stathaki, Steffen Ventz, Luca Pinello, Angela Yen, et. al.. (2015). BRCA1 Recruitment to Transcriptional Pause Sites Is Required for R-Loop-Driven DNA Damage Repair. Molecular Cell. 57, 636-647;
- David F Allison, Gang Greg Wang. (2019). R-loops: formation, function, and relevance to cell stress. CST. 3, 38-46;
- Olga I. Brovkina, Leila Shigapova, Daria A. Chudakova, Marat G. Gordiev, Rafael F. Enikeev, et. al.. (2018). The Ethnic-Specific Spectrum of Germline Nucleotide Variants in DNA Damage Response and Repair Genes in Hereditary Breast and Ovarian Cancer Patients of Tatar Descent. Front. Oncol.. 8;
- Arianna Nicolussi, Francesca Belardinilli, Yasaman Mahdavian, Valeria Colicchia, Sonia D’Inzeo, et. al.. (2019). Next-generation sequencing of BRCA1 and BRCA2 genes for rapid detection of germline mutations in hereditary breast/ovarian cancer. PeerJ. 7, e6661;
- Michael T. Parsons, Emma Tudini, Hongyan Li, Eric Hahnen, Barbara Wappenschmidt, et. al.. (2019). Large scale multifactorial likelihood quantitative analysis of BRCA1 and BRCA2 variants: An ENIGMA resource to support clinical variant classification. Human Mutation. 40, 1557-1578;
- Рак молочной железы с семейной историей;
- 12 методов в картинках: секвенирование нуклеиновых кислот.







