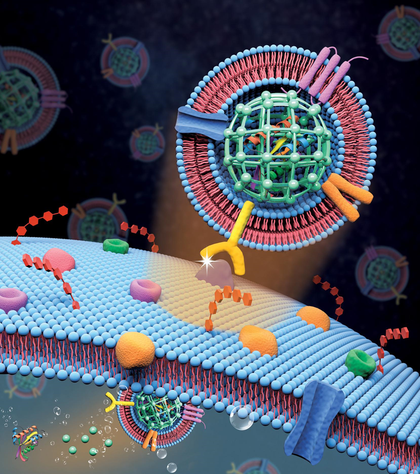
Биомиметические наночастицы: как природа помогает доставлять лекарства
25 февраля 2025
Биомиметические наночастицы: как природа помогает доставлять лекарства
- 251
- 0
- 4
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Биомиметические наночастицы — это удивительное изобретение науки, вдохновленное клетками нашего организма. Эти наночастицы не только умеют доставлять лекарства прямо к нужным клеткам, но и делают это с высокой биосовместимостью, оставаясь «невидимыми» для иммунной системы. В статье подробно рассказывается, как из живых клеток и наноматериалов создаются эти уникальные «курьеры», какие барьеры организма они помогают преодолевать, какие преимущества открывают для медицины и с какими вызовами сталкиваются ученые на этом пути.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Большинство из нас воспринимают лекарства как что-то само собой разумеющееся: мы принимаем таблетку — и она помогает. Но что, если речь идет о доставке не привычного лекарства, а чего-то более сложного, например, молекул РНК или белков? Эти молекулы обладают огромным потенциалом для лечения самых различных заболеваний.
Примеры? Представьте, что ученые создают молекулу, которая способна «обучить» наш иммунитет распознавать и уничтожать раковые клетки. Или лекарство, которое может исправить ошибку в ДНК, вызывающую редкое генетическое заболевание — словно редактор текста, исправляющий опечатки. Например, лечение таких болезней, как муковисцидоз или спинальная мышечная атрофия, уже становится возможным благодаря современным технологиям доставки чрезвычайно хрупких молекул. А как насчет терапии, которая помогает предотвратить разрушение суставов при ревматоидном артрите, или препаратов, способных доставить молекулы прямо в мозг для борьбы с болезнью Альцгеймера?
Но есть одна проблема: наш организм устроен так, чтобы препятствовать проникновению всего чужеродного. В крови и тканях много ферментов, способных «нарезать» как белки, так и нуклеиновые кислоты, делая их бесполезными. А если нам еще нужно доставить терапевтические молекулы в строго определенное место, например, в конкретный тип клеток?
Для решения этих задач нам необходимо использовать специальных «курьеров» — или, если говорить научным языком, векторы. Они защищают наши терапевтические молекулы от не очень-то дружелюбной среды организма и доставляют вещества туда, куда нам необходимо.
Традиционные системы доставки и их проблемы
Для таких сложных «доставок» ученые обычно используют наночастицы. Эти крошечные структуры умеют проникать через барьеры организма, например, через стенки сосудов или защиту мозга — гематоэнцефалический барьер (ГЭБ). Они также легче «впускаются» клетками, которые словно открывают двери для них, как для долгожданных гостей. В отличие от более крупных частиц микроразмера, наночастицы не застревают на «входе», словно громоздкая посылка, не проходящая через узкий дверной проем [1].
Ниже рассмотрим основные виды наночастиц, которые активно применяются в медицине и биологии (рис. 1).
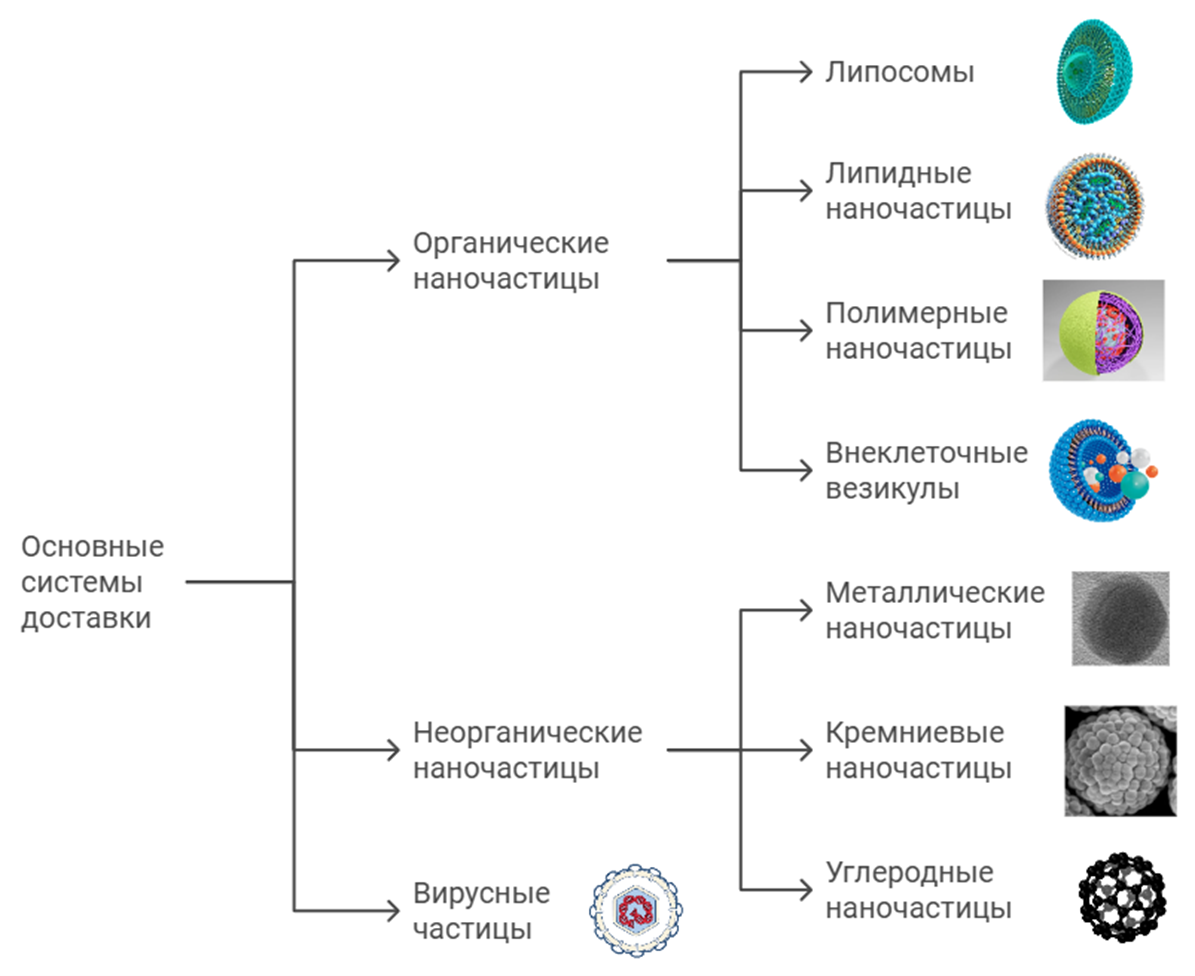
Рисунок 1. Основные виды наночастиц для доставки веществ.
Липосомы
Липосомы — одни из первых наночастиц, которые нашли широкое применение в медицине и биологии. Представьте их как крошечные замкнутые пузырьки, сделанные из двух слоев липидов (жира). Они часто используются для доставки химиотерапии в лечении опухолевых заболеваний, направляя лекарство к опухоли и минимизируя повреждения других тканей.
Липидные наночастицы
Липидные наночастицы — усовершенствованные липосомы, которые обладают большей стабильностью и способностью эффективно проникать в целевые клетки. Они сыграли ключевую роль в создании мРНК-вакцин от COVID-19, например, вакцины Pfizer и Moderna. Без этих наночастиц мРНК, которая «обучает» клетки производить защитные белки, просто разрушилась бы еще до того, как достигла своей цели.
Полимерные наночастицы
Представьте, что вы создаете наночастицу из материалов, которые сами могут «растворяться» и не оставлять следов. Полимерные наночастицы сделаны из биоразлагаемых полимеров и могут высвобождать лекарства с контролируемой скоростью. Подобный подход позволяет выпускать лекарство «дозированно», словно песок в песочных часах, обеспечивая равномерное действие.
Внеклеточные везикулы
Это «натуральные» частицы, секретируемые всеми типами клеток во внеклеточное пространство, поэтому так и называются — внеклеточные везикулы. Они переносят различные биомолекулы, включая белки, липиды, ДНК и разные виды РНК, играя важную роль в межклеточной коммуникации.
Неорганические наночастицы
Все упомянутые ранее типы относятся к органическим наночастицам, однако существуют и неорганические наночастицы. Их делают из металлов, например, золота, серебра или железа, а иногда и из неметаллов, таких как кремний или углерод. У таких частиц есть удивительные физические свойства, которых нет у органических наночастиц. Например, металлические наночастицы могут обладать магнетизмом. А что это значит для нас? Представьте, что с помощью магнитов можно управлять частицами в организме, будто вы играете в видеоигру и направляете их туда, где они больше всего нужны.
Вирусные частицы
Вирусы — это инструменты природы, которые ученые используют как средства доставки генетической информации. Они способны проникать в клетки и передавать туда ДНК или РНК, помогая изменить работу клетки. Это особенно важно, если нужно исправить поврежденные гены или заставить клетку производить полезные вещества, например, для лечения болезней.
Но здесь возникает закономерный вопрос: если уже существует множество систем доставки, часть из которых мы перечислили, зачем нам так много разных вариантов? Ведь повсюду звучат кликбейтные заголовки: «С помощью липосом вылечили рак», «Липидные наночастицы доставили ген, и заболевание исчезло как по волшебству». Зачем нам так много систем доставки и почему нет одного идеального вектора для всех случаев?
Ответ прост: все дело в разнообразии задач. Одно дело — доставить маленькую молекулу лекарства, а другое — крупный белок или сложный инструмент, например, систему, которая может перепрограммировать гены.
Давайте представим, какой была бы наша «идеальная» система доставки (рис. 2):
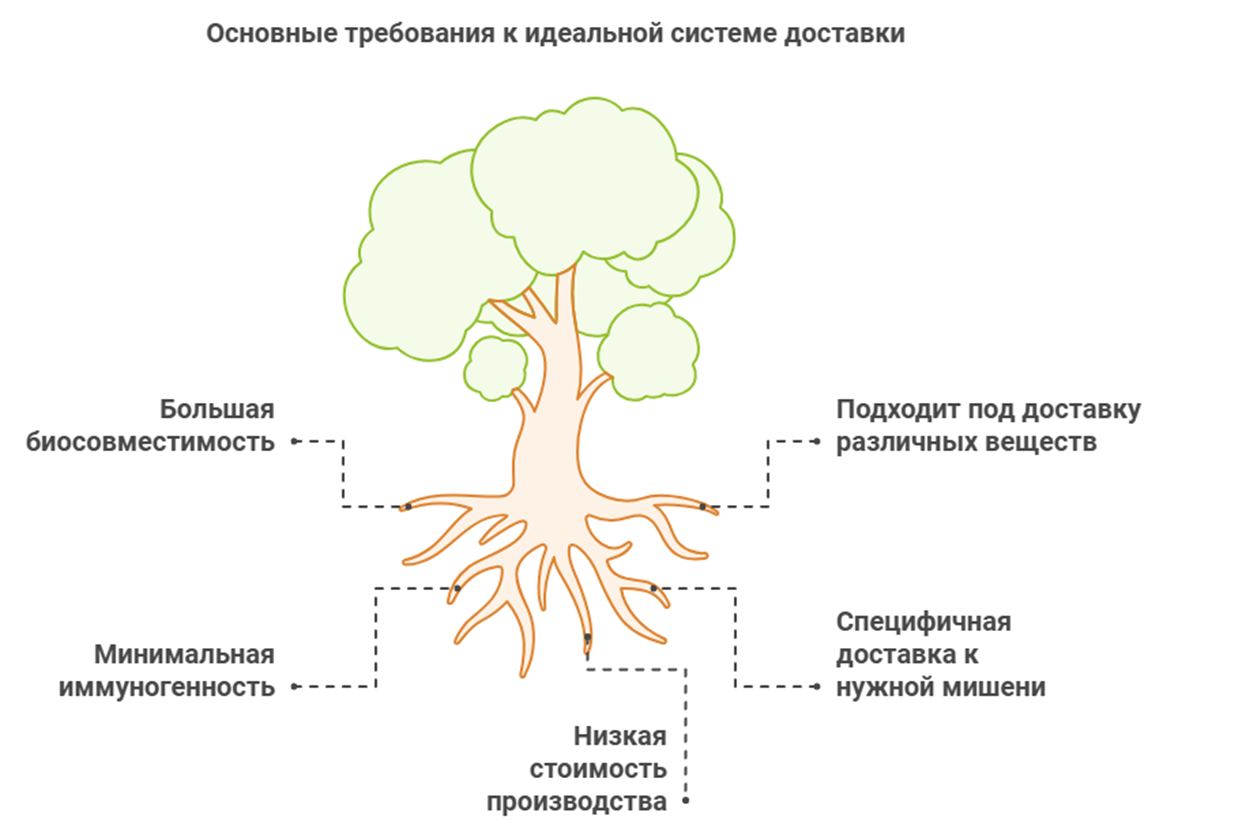
Рисунок 2. Основные требования к «идеальной» системе доставки.
- Имела бы большую биосовместимость и не вызывала бы иммунного ответа in vivo, т.е. внутри живого организма (либо минимальный ответ).
- Обеспечивала бы хорошую специфичную доставку к нужным тканям и клеткам, проходя биологические барьеры организма.
- Была бы достаточно дешевой в производстве. Ведь зачем нам идеальная система, которую практически никто не сможет использовать из-за завышенной стоимости? [2]
Однако пока ни одна система не соответствует всем этим требованиям. Даже самые современные технологии, такие как липидные наночастицы, которые использовались в мРНК-вакцинах от COVID-19, имеют свои недостатки. Например, липидные наночастицы не всегда могли избежать побочных эффектов, таких как воспаление в месте инъекции, повышение температуры или усталость. Это происходит потому, что иммунная система может воспринять частицы как угрозу и начать на них реагировать.
Кроме того, липидные наночастицы отлично справляются с переносом некоторых веществ, таких как нуклеиновые кислоты, но гораздо хуже работают с другими веществами, например, с белками или гидрофильными лекарствами — это те, которые хорошо растворяются в воде. Еще одна проблема: липидные наночастицы пока в основном доставляют лекарства в печень и плохо справляются с доставкой в другие органы [3].
Как природа подсказывает новые методы доставки лекарств
Много гениальных идей человек позаимствовал у природы. Можно вспомнить:
Антибиотик пенициллин, спасший миллионы жизней от различных инфекционных заболеваний, был открыт благодаря плесени Penicillium rubens.
Зеленый флуоресцентный белок (GFP), который был найден у медуз Aequorea victoria, повсеместно использующийся в лабораториях. Ученые берут ген этого белка и добавляют его в клетки. Благодаря этому гену клетки начинают светиться, как лампочки, что помогает нам в отслеживании процессов в живых клетках и организмах.
Идея застежки-липучки появилась после прогулки с собакой, когда хозяину пришлось снимать с ее шерсти головки репейника (того самого, который мы в детстве пытались снять с одежды после игр на свежем воздухе).
Неудивительно, что и системы доставки лекарств мы стремимся «подсмотреть» у природы. Использовать подход заимствования для конструирования систем доставки звучит логично: куда сложнее построить идеальную систему синтетически, когда можно найти похожий вариант в природе, применить его и получить все основные «плюшки».
Пример? Вирусы. Эти природные «курьеры» эволюционировали миллионы лет, чтобы идеально проникать в клетки. Вирусы кажутся отличными вариантами, потому что существует их огромное разнообразие. Хотите доставку к нервной ткани? Выбирайте вирусы с тропностью (т.е. предпочтением) к нервным клеткам. Нужна большая «посылка» в геном? Есть вирусы, способные переносить длинные гены.
Но у вирусов есть серьезный недостаток: они чужеродны для организма. Например, аденоассоциированные вирусы (сокращенно ААВ) — одни из самых популярных «курьеров» для доставки генетического материала. Однако у каждого второго человека в организме уже есть специальные антитела, которые распознают и обезвреживают ААВ, словно сторож, который сразу выгоняет незваного гостя [4]. Для вирусной терапии это большая проблема — это как пытаться открыть замок ключом, который дверь отказывается принимать.
В такой ситуации кажется логичным поискать что-то более «родное», и природа предлагает нам отличное решение — натуральные наночастицы, т.е внеклеточные везикулы (ВВ). На первый взгляд, это отличные кандидаты для доставки терапевтических молекул, ведь они естественным образом встречаются в организме и обладают высокой биосовместимостью. Но, как и всегда, дьявол кроется в деталях.
В чем недостатки «натуральных» наночастиц?
Во-первых, количество. Клетки производят очень мало ВВ. Но это еще не все: сами ВВ загрязнены «мусором» — остатками нуклеиновых кислот, белков, а также углеводами. Увы, идеального 100%-ного выхода при очистке не добиться, поэтому с какой-то частью наночастиц нужно будет навсегда попрощаться. Стандартный метод их выделения — дифференциальное ультрацентрифугирование (при котором пробирка с клеточной жидкостью вращается на огромной скорости, чтобы более тяжелые частицы осели на дно, а легкие остались наверху) — дает всего 109—1011 ВВ из одного литра культуральной среды [5]. Этого едва хватает на один эксперимент на мыши! А для человека потребуется целых 1013 ВВ на одну дозу терапии [6].
Во-вторых, разнообразие. Природа создала множество типов ВВ, каждый из которых обладает своими уникальными функциями. Например, экзосомы — это лишь одна из разновидностей ВВ. Но современные технологии не позволяют выбирать только нужные типы. Этот процесс можно сравнить с поиском конкретного ключа в связке — пока что наука не предоставляет инструментов для точного выбора.
И наконец, срок службы. После попадания в организм ВВ достаточно быстро разрушаются, поэтому они просто не успевают доставить лекарство к цели. Ученые называют это коротким «периодом полувыведения». Если проще, то это время, за которое половина частиц исчезает из крови. Чем дольше частицы остаются в кровотоке, тем выше шансы, что они дойдут до нужного места. Но у натуральных ВВ пока с этим проблемы [7].
Что такое биомиметические наночастицы?
Не будем сразу оперировать сложными терминами. Представьте себе, что природа — это величайший инженер, чьи решения совершенствовались миллиарды лет. Биомиметические наночастицы — это наша попытка не только подсмотреть эти «чертежи», но и адаптировать их для современных технологий.
Принципы биомиметики заключаются в заимствовании и адаптации природных механизмов. Например, мы используем идеи природы, чтобы создать наночастицы, которые могут избегать иммунного ответа и доставлять активные вещества прямо к цели, проникать через сложные барьеры организма.
Если говорить проще, биомиметические наночастицы — это крошечные «курьеры», которые не просто доставляют груз, но и делают это с мастерством, которым может похвастаться сама природа. И неважно, модифицируем ли мы вирусы, ВВ или создаем полностью искусственные структуры, — всё это примеры биомиметики.
Однако чаще всего, говоря о биомиметических наночастицах, мы имеем в виду специфические частицы, которые сочетают элементы природы и синтетических технологий. Именно об этих частицах по большей части и пойдет речь дальше.
Основные виды биомиметических наночастиц
Наночастицы, покрытые клеточными мембранами (НПКМ)
Перейдем к конкретным примерам. Говорить о терминах можно долго, но лучше разобраться на практике. Начнем с одной из наиболее популярных технологий биомиметики — покрытия наночастиц клеточными мембранами.
Наночастицы, покрытые клеточными мембранами (далее НПКМ), представляют собой гибрид биологического и синтетического материалов. Покрытие наночастиц клеточными мембранами делает их «невидимыми» для иммунной системы, поскольку организм распознает их как свои. Такое свойство позволяет частицам дольше оставаться в кровотоке и достигать нужных тканей.
Но как технически создается такой «микс»?
Как получить НПКМ: пошаговый процесс
1 — Создание «ядра» НПКМ
Начнем с основы. Представьте, что синтетические наночастицы — это строительные блоки, которые дальше нужно покрыть мембранами. Они могут быть изготовлены из различных материалов (например, липидов, полимеров или металлов). Обычно их заказывают или производят стандартными методами, например, с помощью испарения растворителя, когда молекулы липидов формируют пузырьки, или химического осаждения, где частицы металла собираются из раствора. Эти методы позволяют получить основу, готовую для дальнейшей модификации.
2 — Получение клеточных мембран
Далее мы берем клетки, мембраны которых будут служить основой для покрытия. Здесь всё зависит от задачи. Требуется, чтобы наночастицы дольше оставались в кровотоке? Используйте мембраны эритроцитов. Нужна точная доставка к микроокружению опухоли? Тогда подойдут мембраны опухолевых клеток. А если требуется сочетание свойств нескольких клеток, можно создать гибридные мембраны [8].
Чтобы выделить мембраны, чаще всего применяют метод лизиса (т.е. разрушения) клеток в гипотоническом растворе. Его суть в том, что клетки помещают в раствор с очень низкой концентрацией солей, что вызывает приток воды внутрь клеток, так как вода идет по градиенту концентрации туда, где ее меньше. Клетка набухает и в итоге разрывается, высвобождая свои компоненты, включая мембраны. Это позволяет аккуратно собрать их для дальнейшего использования с помощью ультрацентрифуги.
На этом этапе мембраны можно модифицировать, добавляя им различные свойства. Например, чтобы усилить их специфическое связывание с опухолевыми клетками, можно прикрепить антитела, которые будут «узнавать» определенные белки на поверхности опухоли. Можно интегрировать молекулы, способные повышать стабильность мембран в кровотоке, чтобы они дольше оставались активными. Кроме того, в мембраны можно встраивать молекулы, повышающие тропность к определенным тканям, например, пептиды, которые будут направлять наночастицы к клеткам мозга или сердечной ткани. Такие модификации значительно расширяют возможности использования мембран в биомедицине.
3 — Образование везикул из клеточных мембран
Мембраны перерабатываются в небольшие пузырьки, называемые везикулами. Это нужно, чтобы создать гибкое покрытие, которое можно «натянуть» на синтетическую основу.
4 — Соединение мембран с наночастицами
Для соединения чаще всего используется метод экструзии. В этом процессе мембранные везикулы и наночастицы пропускают через мелкие поры под высоким давлением. Мембраны разрываются, а затем сливаются вокруг наночастиц, формируя плотное покрытие.
Что происходит на молекулярном уровне?
Всё это звучит довольно просто, но на уровне молекул картина сложнее и гораздо интереснее [9].
- Сначала везикулы «прилипают» к наночастицам благодаря силам адсорбции.
- Затем механическое воздействие (например, давление при экструзии) разрушает их структуру, создавая мембранные «заплатки».
- Наконец, эти «заплатки» сливаются, образуя сплошное покрытие.
Интересно, что мембраны могут ориентироваться наружу или внутрь [10]. Правильная ориентация (наружу) сохраняет ключевые свойства поверхности клеток, допустим, расположение гликопротеинов. Эти молекулы работают как сигнал, позволяющий частицам «узнавать» нужные клетки и взаимодействовать с ними. Если ориентация мембраны будет неправильной, частицы потеряют эту способность.
Помимо вышеописанного протокола, существуют и более необычные подходы к созданию НПКМ. Один из самых любопытных — использование «живых» клеток в процессе [11].
Как это работает? Всё начинается с концентрации клеток в определенном слое плотности. Для этого в пробирку добавляют раствор сахарозы, который помогает распределить клетки на нужной высоте. Затем сверху добавляют наночастицы, например, кремниевые. После этого ультрацентрифугирование обеспечивает механическое проникновение наночастиц в клетки. Этот процесс заставляет клеточные мембраны обволакивать наночастицы, превращая их в биомиметические структуры (рис. 3) [12].
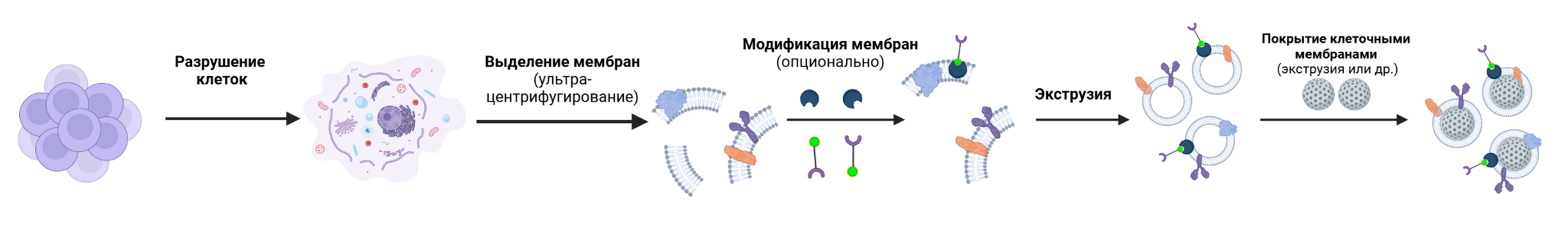
Рисунок 3. Схема получения наночастиц, покрытых клеточными мембранами (НПКМ).
[12], адаптировано с помощью Biorender
Преимущество этого метода состоит в том, что покрытие происходит в максимально естественных условиях. При этом мембраны сохраняют свою функциональность, что повышает эффективность доставки лекарств.
Искусственные везикулы, полученные из клеток
Ученые всегда задаются вопросами: а что, если? Что, если мы проведем экструзию с живыми клетками? Так и сделали: из клеток получили искусственные везикулы, которые по свойствам схожи с ВВ, но их количество будет в сотни раз больше. Это как если бы вы решили заменить редкий природный ресурс, сделав его аналог искусственным, но с похожей эффективностью.
Для начала ученые берут живые клетки, которые являются своего рода «поставщиками» мембран. Подходящими кандидатами могут быть практически любые клетки в зависимости от задачи.
Шаг 1. Концентрация клеток
Первым этапом клетки собирают и концентрируют. Обычно для этого используют центрифугирование.
Шаг 2. Превращение клеток в везикулы
Следующий этап — механическое воздействие на клетки, которое приводит к разрушению их структуры. Чаще всего для этого применяют метод серийной экструзии. Этот метод чем-то похож на процеживание. Клетки пропускают через фильтры с крошечными отверстиями, постепенно уменьшая их размер. Это как проталкивать тесто через сито с разными размерами дырочек. Когда клетка проходит через такие фильтры под большим давлением, ее оболочка разрывается на кусочки, которые сворачиваются в пузырьки — везикулы.
Почему это важно?
Главное преимущество искусственных везикул — их масштабируемость. Если клетки синтезируют ВВ в ограниченных количествах, то искусственные везикулы можно получать практически в неограниченных объемах.
Кроме того, процесс их создания позволяет варьировать их свойства в зависимости от задачи. Например, можно регулировать их размер, заряд или даже добавлять дополнительные функциональные группы, чтобы усилить их взаимодействие с целевыми тканями или клетками.
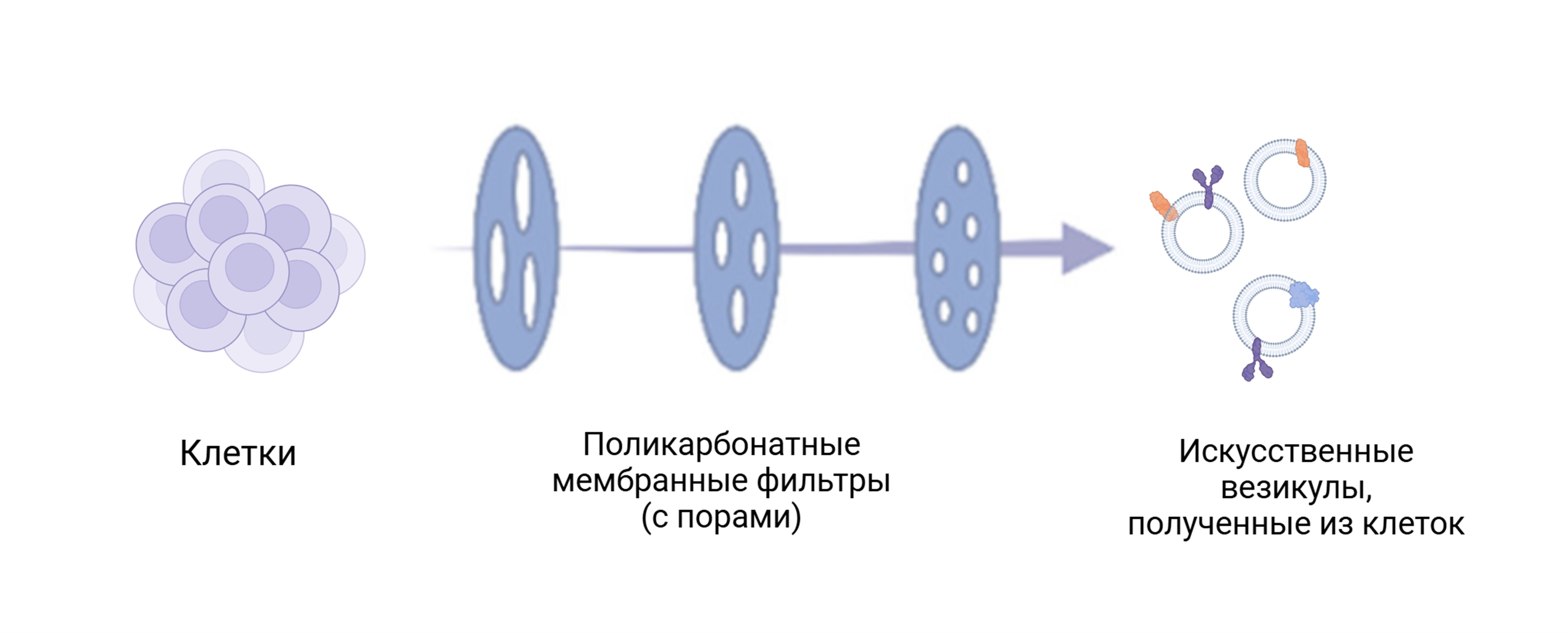
Рисунок 4. Образование искусственных везикул с помощью последовательной экструзии клеток.
[12], адаптировано с помощью Biorender
Биомиметические липосомы
Размышляя о том, как наночастицы могут «замаскироваться» под свои, стоит взглянуть на клеточные мембраны. Что именно в них делает клетки такими «родными» для организма? Одним из ответов на этот вопрос являются белки мембран. Эти молекулы работают как интерфейс между клеткой и ее окружением: они помогают клетке «общаться» с другими клетками, укрепляют ее структуру и, что особенно важно, снижают риск атаки со стороны иммунной системы.
Вдохновленные природой, ученые начали использовать эти свойства для создания биомиметических липосом — липосом, поверхность которых покрыта белками клеточных мембран. Это не просто технология, это природная мимикрия в действии: липосомы, покрытые мембранными белками, обманывают организм, притворяясь родными элементами.
Первыми, кто реализовал эту идею, стали исследователи, которые использовали мембранные белки лейкоцитов [13]. Так появились лейкосомы — липосомы, которые одновременно «притворяются» клетками иммунной системы и заимствуют их уникальные свойства. Но на этом эксперименты не остановились. Вскоре начали применять белки мембран других клеток: опухолевых, эритроцитов и или даже комбинацию из разных типов клеток, чтобы объединять различные свойства [14].
Хорошо, но как заставить белки «прикрепиться» к поверхности липосом? Здесь есть два основных подхода, которые ученые используют в зависимости от специфики исследования [12].
Первый подход — классический, но хорошо зарекомендовавший себя метод, опять-таки, экструзии. После создания синтетических липосом они пропускаются через фильтр с порами под высоким давлением. Белки мембраны закрепляются в липидной оболочке благодаря своим трансмембранным доменам — участкам, которые предпочитают липидную среду. Это помогает белкам клеточных мембран обволакивать липосомы, создавая биомиметическую структуру.
Второй подход — это использование инновационной технологии микрофлюидики. Здесь всё выглядит как настоящая инженерная магия в одном чипе: два потока — один с фосфолипидами в органическом растворителе, а другой — с белками клеточных мембран в водной суспензии — смешиваются в микроканалах, создавая условия для самосборки липосом.
В этом процессе важную роль играет турбулентное смешивание — хаотическое движение жидкостей, создающее мощный поток. Липиды естественным образом формируют липосомы, а белки клеточных мембран закрепляются на их поверхности. Этот метод не только снижает потерю материалов (основной недостаток экструзии), но и обеспечивает более высокую эффективность интеграции белков — около 90% против 63% у метода экструзии [15].
Оба подхода имеют свои преимущества и недостатки, но выбор между ними зависит от задачи. Если требуется массовое производство, экструзия остается более привычным решением. Но для создания липосом с идеальной однородностью или с высокой эффективностью интеграции белков микрофлюидика становится всё более востребованной.
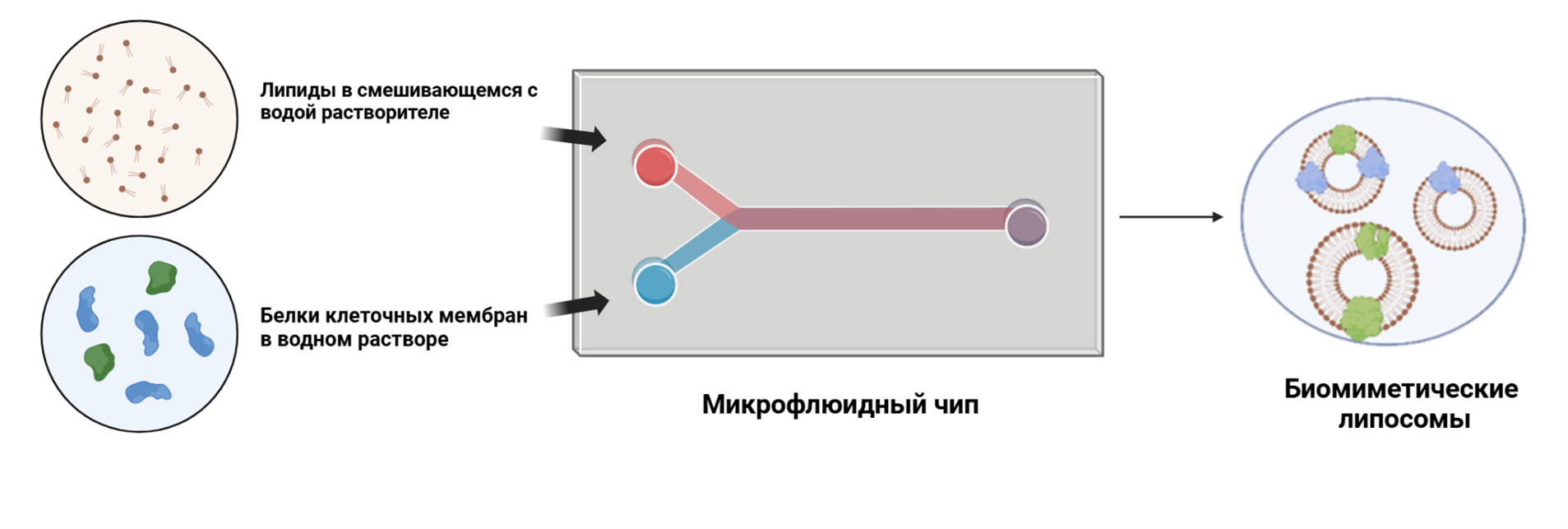
Рисунок 5. Образование биомиметических липосом с интегрированными белками клеточной мембраны с помощью микрофлюидики.
[12], адаптировано с помощью Biorender
Каковы текущие проблемы биомиметических наночастиц?
Каковы текущие проблемы биомиметических наночастиц? Несмотря на огромный потенциал биомиметических наночастиц, на пути к широкому их использованию ученые сталкиваются с техническими и биологическими вызовами, которые нужно преодолеть, чтобы технологии стали безопасными, доступными и эффективными [12]. Давайте разберем эти препятствия и попробуем понять, что с ними делать.
Производство наночастиц: многообещающее, но непростое дело
Производственный процесс вызывает немало сложностей:
Нехватка «строительных материалов»
Представьте, что вы хотите сделать уникальный защитный костюм, используя настоящую кожу. Это сложная задача: нужны материалы высшего качества, а добыть их в достаточном количестве крайне сложно и дорого. Так же обстоят дела с биомиметическими наночастицами: для их производства часто используют мембраны клеток человека, чтобы сделать их «невидимыми» для иммунной системы. Но вот проблема: клеток нужно много, а выращивать их в достаточных количествах дорого и сложно.
Решение: разрабатываются технологии массового культивирования клеток в биореакторах, которые представляют собой устройства, где клетки выращивают в больших объемах в условиях, похожих на идеальную «теплицу». Это помогает снизить затраты и повысить доступность материалов.
Сложности с масштабированием
Представьте, что вы приготовили идеальный торт на своей кухне, но теперь вам нужно испечь тысячи таких тортов в промышленной пекарне. То, что работает в лаборатории, не всегда применимо в масштабах больших производств.
Решение: Модификация старых методов производства или разработка новых помогают воспроизводить лабораторные методы на промышленном уровне.
Долгосрочное хранение.
Частицы могут разрушаться со временем, что затрудняет их транспортировку и хранение.
Решение: ученые разрабатывают методы криоконсервации, то есть замораживания наночастиц при сверхнизких температурах, а также стабилизирующие покрытия и консервирующие растворы, чтобы продлить «жизнь» частиц.
Безопасность: надежность превыше всего
Безопасность — ключевой аспект любой медицинской технологии. Наночастицы должны быть как можно более безопасными для использования в клинике.
- Иммунные реакции. Даже несмотря на большую «природность», организм все равно может распознать наночастицы как чужеродные тела и начать с ними «бороться».
Решение: исследователи совершенствуют покрытия частиц, чтобы они становились еще более незаметными для иммунной системы. - Токсичность. Особенно остра эта проблема, если наночастицы сделаны из мембран опухолевых клеток. Такие материалы могут представлять угрозу, вызывая нежелательные побочные эффекты.
Решение: использование биосовместимых материалов и тщательное тестирование на предклинических моделях, таких как лабораторные животные или искусственные ткани, позволяет минимизировать риск токсичности.
Стандартизация: каждая частица под контроль
Последнее, но не менее важное — это стандарты качества:
Однородность и качество.
Чтобы наночастицы работали эффективно, каждая из них должна быть максимально похожа друг на друга. Однако на практике это пока не всегда достигается. Например, для НПКМ часто наблюдается неполное покрытие клеточными мембранами, что снижает их эффективность. Почему? Без полного покрытия частицы хуже маскируются от иммунной системы организма, что делает их уязвимыми для атак.
Решение: внимательная характеризация мембран и разработка стандартов качества для производства помогут улучшить предсказуемость и эффективность терапии.
Что дальше?
Все эти проблемы — не повод отказываться от использования биомиметических наночастиц. Наоборот, они подчеркивают, насколько важны исследования в этой области. Ученые по всему миру работают над тем, чтобы найти решения, которые сделают эту технологию безопасной, доступной и эффективной. Возможно, уже через несколько лет такие частицы станут основой медицины будущего.
Литература
- Daniel S. Kohane. (2007). Microparticles and nanoparticles for drug delivery. Biotech & Bioengineering. 96, 203-209;
- Zhigang Ju, Wei Sun. (2017). Drug delivery vectors based on filamentous bacteriophages and phage-mimetic nanoparticles. Drug Delivery. 24, 1898-1908;
- P. R. Cullis, P. L. Felgner. (2024). The 60-year evolution of lipid nanoparticles for nucleic acid delivery. Nat Rev Drug Discov. 23, 709-722;
- Vedell Louis Jeune, Jakob A. Joergensen, Roger J. Hajjar, Thomas Weber. (2013). Pre-existing Anti–Adeno-Associated Virus Antibodies as a Challenge in AAV Gene Therapy. Human Gene Therapy Methods. 24, 59-67;
- Shu Wang, Ce Li, Yichao Yuan, Youxiang Xiong, Hangjun Xu, et. al.. (2023). Microvesicles as drug delivery systems: A new frontier for bionic therapeutics in cancer. Journal of Drug Delivery Science and Technology. 79, 104088;
- Paula M. Pincela Lins, Elke Pirlet, Michal Szymonik, Annelies Bronckaers, Inge Nelissen. (2023). Manufacture of extracellular vesicles derived from mesenchymal stromal cells. Trends in Biotechnology. 41, 965-981;
- Sergey Brezgin, Oleg Danilik, Alexandra Yudaeva, Artyom Kachanov, Anastasiya Kostyusheva, et. al.. (2024). Basic Guide for Approaching Drug Delivery with Extracellular Vesicles. IJMS. 25, 10401;
- Diana Dehaini, Xiaoli Wei, Ronnie H. Fang, Sarah Masson, Pavimol Angsantikul, et. al.. (2017). Erythrocyte–Platelet Hybrid Membrane Coating for Enhanced Nanoparticle Functionalization. Advanced Materials. 29;
- Lizhi Liu, Dingyi Pan, Sheng Chen, Maria-Viola Martikainen, Anna Kårlund, et. al.. (2022). Systematic design of cell membrane coating to improve tumor targeting of nanoparticles. Nat Commun. 13;
- Hui Liu, Yu-Yan Su, Xin-Chi Jiang, Jian-Qing Gao. (2023). Cell membrane-coated nanoparticles: a novel multifunctional biomimetic drug delivery system. Drug Deliv. and Transl. Res.. 13, 716-737;
- Ryosuke Mizuta, Eisuke Kanao, Keigo Ukyo, Shusuke Kuwada, Shin-ichi Sawada, et. al.. (2024). A Direct Approach for Living Biomembrane Printing on a Nanoparticle. Nano Lett.;
- Andrey Tikhonov, Artyom Kachanov, Alexandra Yudaeva, Oleg Danilik, Natalia Ponomareva, et. al.. (2024). Biomimetic Nanoparticles for Basic Drug Delivery. Pharmaceutics. 16, 1306;
- R. Molinaro, C. Corbo, J. O. Martinez, F. Taraballi, M. Evangelopoulos, et. al.. (2016). Biomimetic proteolipid vesicles for targeting inflamed tissues. Nature Mater. 15, 1037-1046;
- Kai-Long Zhang, Ying-Jie Wang, Jin Sun, Jie Zhou, Chao Xing, et. al.. (2019). Artificial chimeric exosomes for anti-phagocytosis and targeted cancer therapy. Chem. Sci.. 10, 1555-1561;
- Roberto Molinaro, Michael Evangelopoulos, Jessica R. Hoffman, Claudia Corbo, Francesca Taraballi, et. al.. (2018). Design and Development of Biomimetic Nanovesicles Using a Microfluidic Approach. Advanced Materials. 30.