
Биоконтроль популяций в современном мире
07 февраля 2022
Биоконтроль популяций в современном мире
- 879
- 0
- 3
Рисунок Билла Сандерсона «ДНК во всех живых существах» (DNA in all living things). Здесь художник соединил монументальное, будто закованное в памятник человеческое лицо, с двойной спиралью ДНК и живыми организмами, которым довелось сыграть большую роль в развитии генетики (сверху вниз: дрожжи, арабидопсис, овечка, дрозофила, свинья и нематода), и все это — на фоне многообещающе голубого неба. Не влезая в пространство интерпретаций, скромно заметим, что картина наводит на размышления о том, как связаны человечество, наука и живая природа.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: До недавних пор любые организмы-вредители, паразиты или другие неугодные человечеству создания неизбежно подлежали истреблению тем или иным способом. Однако у таких методов полно недостатков: они плохо управляемые, негуманные, недостаточно эффективные или, наоборот, чересчур радикальные и приводящие к еще большим катастрофам. К счастью, человечество умеет постепенно превращать даже самые грубые системы в изящные и легко управляемые механизмы. Этот обзор посвящен свежим идеям, которые только обсуждаются, а также новым готовым методам в сфере ограничения и контроля опасных или вредных популяций.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022 и заслужила спецприз «Огненный дебют».
Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022 и заслужила спецприз «Огненный дебют».

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вступление
«Ограничение и контроль популяций». Когда мы прикладываем такую словесную рамку к картине, человек вдруг оказывается еще более монументальным, его черты лица становятся жестче, а голубое небо плавно приобретает фальшиво безразличный оттенок, предвещающий затишье перед бурей. Будем честны, от этих, казалось бы, нейтральных рамочных слов веет могильным холодом, ведь мы знаем, что за ними стоит: массовое истребление огромного количества организмов. Бррр, даже думать на эту тему не по себе. Хочется спросить — зачем вообще кого-то уничтожать? Можно ведь жить мирно, ни во что не вмешиваясь, никого не контролируя и не истребляя, и чтобы счастья для всех даром? Увы, статус доминирующего вида на планете априори исключает возможность «не вмешиваться». Конфликты интересов между человечеством и другим видами неизбежны, и приходится придумывать, как их решить.
Для начала, что же это за конфликты?
Дело в том, что определенные популяции несут серьезные угрозы важным для человека сферам жизни. Во-первых, здоровью. К примеру, укус клеща чреват боррелиозом и энцефалитом, а некоторые виды комаров могут заразить вас малярией. Во-вторых, экономике. Совершенно очевидно, что никто не будет рад, если его деньги самым наглым образом съедят мышки, жучки или (особенно!) грибки или протисты. В-третьих, биоразнообразию. Так, некоторые виды — инвазивные — оказавшись в новой среде, ведут себя очень агрессивно и буквально сметают все на своем пути. Они перестраивают трофические сети, нарушают баланс экосистемы, часто становятся причиной вымирания видов и экологических катастроф.
Однако зачастую проблема не ограничивается только одной сферой жизни. Например, борщевик Сосновского (Heracleum sosnowskyi) вытесняет местные растения и изменяет экосистемы, а также наносит человеку серьезные кожные ожоги [1]. Бабочка самшитовая огневка (Cydalima perspectalis) уже чуть не оставила Европу без живых изгородей — гусеницы нещадно их съедали [2] — и все еще может спровоцировать вымирание эндемичных самшитовых лесов [3]. В целом, инвазивные виды часто дорого обходятся не только экосистемам, но и экономике [4].
Грубые способы намеренно контролировать численность таких «вредных» популяций существуют уже довольно давно. Человечество придумало пестициды, крысиный яд, отстрел... Но. Возможно ли поймать и уничтожить миллионы особей, которые в каждом новом поколении произведут еще десятки тысяч потомков? Есть ли смысл отравить абсолютно всю экосистему ради уничтожения одного инвазивного вида? Допустим, вас мало волнует судьба жучков да паучков, однако готовы ли вы перебить всех котиков и собачек в Австралии и Новой Зеландии? Они, между прочим, как следует подъели местную эндемичную фауну!
В общем, существующие способы экологического менеджмента во многих отношениях далеки от идеала, и в биологии возник дискурс: можно ли управлять популяциями по-другому?
С развитием науки способы вмешаться в жизнь популяций стали гораздо точнее, изящнее и, возможно, иногда гуманнее. Появляется все больше биотехнологий, которые позволяют как напрямую сокращать численность (никого не убивая), так и устранять тот самый признак, который делает организмы неугодными человечеству [5]. В рамках биоконтроля все чаще модифицируют геном таргетных организмов, и этот обзор посвящен, в основном, таким методам, разработанным для животных. Но есть и другие перспективные способы управлять популяциями, не затрагивая их генофонд, и несколько особенно выдающихся также в общих чертах обрисованы.
Как сократить численность популяции? (из категории «не повторять в домашних условиях без присмотра взрослых ученых»)
Итак, вместо того, чтобы отбирать жизни, можно так или иначе влиять на процесс появления новых. Чаще всего для этого в лабораториях разводят животных с определенными признаками, а после этого выпускают их в полевые условия. Модифицированные животные спариваются с дикими, и это так или иначе приводит к уменьшению численности популяции (рис. 1). На первых этапах также проводят математическое моделирование возможных сценариев такого вмешательства в дикую природу: подбирают оптимальные параметры, например, количество модифицированных животных, расстояния между участками, частоту выпусков; рассчитывают риски и придумывают «запасные» планы на случай, если что-то пойдет не так. После выпуска наблюдают за произведенным на популяцию эффектом, сравнивают полученные результаты с прогнозами и используют новые данные для улучшения последующих моделей.
Классический метод для биоконтроля известен как метод стерильных насекомых (sterile insect technique; SIT). В этом случае в природу выпускают стерилизованных при помощи облучения самцов, и тогда все самки, решившие спариться с этими самцами, не оставят потомства. Именно на этом принципе основываются многие более сложные методы, адаптированные для других таксонов [5], [6].
Другие способы связаны с прямым воздействием на фертильность самок (поскольку именно их репродуктивный вклад регулирует рост популяции [7]) или изменением соотношения полов. В таких случаях самки бесплодны, не жизнеспособны, либо в принципе не имеют возможности появиться на свет, потому что все яйцеклетки оплодотворяются сперматозоидами, несущими Y-хромосомы [5].

Рисунок 1. Общая схема действия генетических методов сокращения численности популяций. Сюда не впишутся гаплодиплоидные виды (самцы имеют одинарный набор хромосом, самки — двойной; так, к примеру, у ос и муравьев), а также виды, которые легко переходят к партеногенезу.
иллюстрация автора
В целом, все эти способы предполагают периодическое разбавление генофонда дикой популяции и выпуск в природу большого количества лабораторных животных. У этих методов есть ограничения: дорого, логистически сложно и возможно только для узкого круга видов [5], [6]. Например, можно выпустить на участок тучи комаров, но никак не полчища крыс: прежде чем численность популяции пойдет на убыль, последние съедят все живое (и мертвое тоже) в зоне выпуска.
Также есть немаловажное обстоятельство, которое часто упускают из виду. Представьте, что вы — местный житель, изможденный бесконечной борьбой с неким организмом N. Особи N многочисленны, вездесущи, надоедливы и ужасно вам досаждают. В какой-то момент на вашем пороге появляются ученые-биотехнологи, которые заявляют: «Мы избавим вас от этой напасти, для этого будем регулярно выпускать сюда по миллиону-другому трансгенных организмов N!». Поможете ли вы биотехнологам или изо всех сил постараетесь им помешать?
Можно ли автоматизировать процесс и избавиться от выпуска животных?
Заманчиво. И именно с этим вопросом идея биоконтроля выходит на совершенно новый уровень: он становится чем-то более глобальным, чем разбрасывание отравы и постоянные внедрения «тупиковых» пассий. Потенциально биоконтроль может стать силой, способной редактировать генофонд таким образом, чтобы популяция сама себя контролировала.
Эта идея основана на любопытном парадоксальном феномене — генном драйве (gene drive) [7], [8]. При нормальном наследовании по Менделю каждая аллель либо передается в следующее поколение, либо не передается (вероятность — 50%). Однако некоторые аллели в процессе эволюции обзаводятся молекулярными механизмами, которые игнорируют менделевские законы и повышают вероятность собственного наследования. Это и есть генный драйв (рис. 2), и его уже можно создать искусственно.
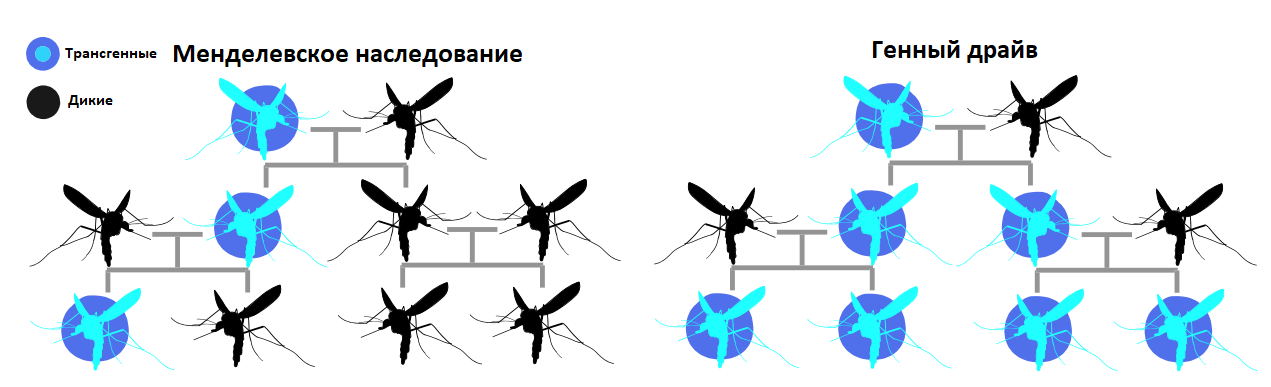
Рисунок 2. Менделевское наследование и генный драйв.
[25], изображение адаптировано (здесь и далее: автором данной статьи)
Парадоксальность генного драйва в следующем: даже если драйв-аллель будет понижать (или не повышать) репродуктивный успех особи, в которой находится, за счет «эгоистичных» генных механизмов она все равно распространится по популяции.
Как редактировать геном?
Есть несколько способов, но самый перспективный и широко известный на сегодняшний день — основанный на CRISPR-Cas системе прокариот. Описанный в 2012 году (совсем недавно!) изящный метод редактирования генома никого не оставил равнодушным, и уже открыл как новые горизонты для исследований, так и слегка запылившиеся на чердаках научной фантастики ящики Пандоры. Теперь в контексте CRISPR-Cas весь мир всерьез обсуждает самые разные амбициозные идеи от борьбы с голодом до избавления человечества от генетических болезней, от бейби-дизайна до «гуманизированных» животных, которые могли бы стать донорами органов для людей [9]. Так почему бы не применить этот мощный инструмент и для биоконтроля?
Почитать подробнее про CRISPR-Cas можно в других статьях «Биомолекулы», например, «Просто о сложном: CRISPR/Cas», «Разнообразие и эволюция систем CRISPR/Cas».
Очень коротко о том, как работают системы, основанные на CRISPR-Cas: в клетку вводят молекулярный комплекс, состоящий из гидовой РНК (gRNA) и белка — эндонуклеазы Cas9. Гидовые РНК ищут таргетную ДНК-последовательность, связываются с ней, «указывая» на нее Cas9. Cas9, в свою очередь, режет обе цепи ДНК в указанном месте (рис. 3).
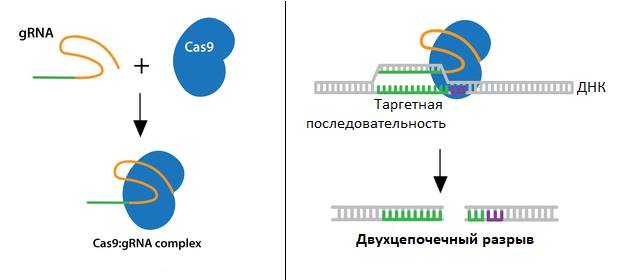
Рисунок 3. Схема действия gRNA+Cas9 комплекса.
[51], адаптировано
Клетка стремится починить поврежденную ДНК, и потенциально у нее есть два способа это сделать: гомологичная рекомбинация (HDR — homology-directed repair) или негомологичное соединение концов (NHEJ — non-homologous end joining). Под этими терминами понимается следующее: в первом случае клетка переписывает другую доступную копию этого же гена, опираясь на гомологичные участки, и этим восполняет удаленный сегмент, а во втором — просто скрепляет два конца вместе, ничем не заполняя пробел.
Таким образом, при HDR происходит хоминг (homing) — успешная замена дикой аллели на драйв-аллель. А при NHEJ последовательность буквально меняется до неузнаваемости — gRNA больше не может ее распознать, следовательно, Cas9 перестает работать, и формируется так называемая резистентная (устойчивая) к драйву аллель (рис. 4). Предпочтительный для задач биоконтроля способ починки — HDRс последующим хомингом, а NHEJ и резистентность часто воспринимаются, как техническая проблема.

Рисунок 4. Два способа починки: HDR, ведущая к хомингу, и NHEJ, ведущая к формированию резистентности. * — события соответствуют таковым на рис. 3.
[6], адаптировано автором
Другой способ, основанный на CRISPR-Cas, полагается не на хоминг, а на так называемые «разрушить-и-спасти» взаимодействия (cleave-and-rescue; ClvR; рис. 5), индуцированные биотехнологами [12]. «Разрушитель» — это комплекс gRNA+Cas9, который разрезает жизненно важный ген. «Спаситель» — это версия того же гена, измененная таким образом, что gRNA его «не видят», а Cas9, соответственно, бездействует. Таким образом, дикие аллели разрушаются, а следующие поколения получают измененную копию. Обычно, когда речь идет о жизненно важных генах, достаточно иметь хотя бы одну копию, чтобы не погибнуть (такие гены — гаплодостаточные), но есть и гаплонедостаточные исключения. «Разрушить-и-спасти» адаптирован для обоих случаев; иногда этот принцип называют toxin-antidote [12], [13].
Можно заметить, что оба способа могут создавать генный драйв: хоминг напрямую создает драйв-аллели и увеличивает их количество, а ClvR — уничтожает дикие аллели и этим косвенно создает драйв-аллели.
Еще один способ связан с половыми хромосомами. В данном случае CRISPR-Cas включается у самцов во время сперматогенеза и устраивает массовую резню Х-хромосом (X-кромсание, X-shredding; рис. 5). Тогда во всех сперматозоидах окажутся только Y-хромосомы, и все потомство неизбежно станет самцами. Можно сказать, в этом случае происходит драйв всей Y-хромосомы [14], [15].
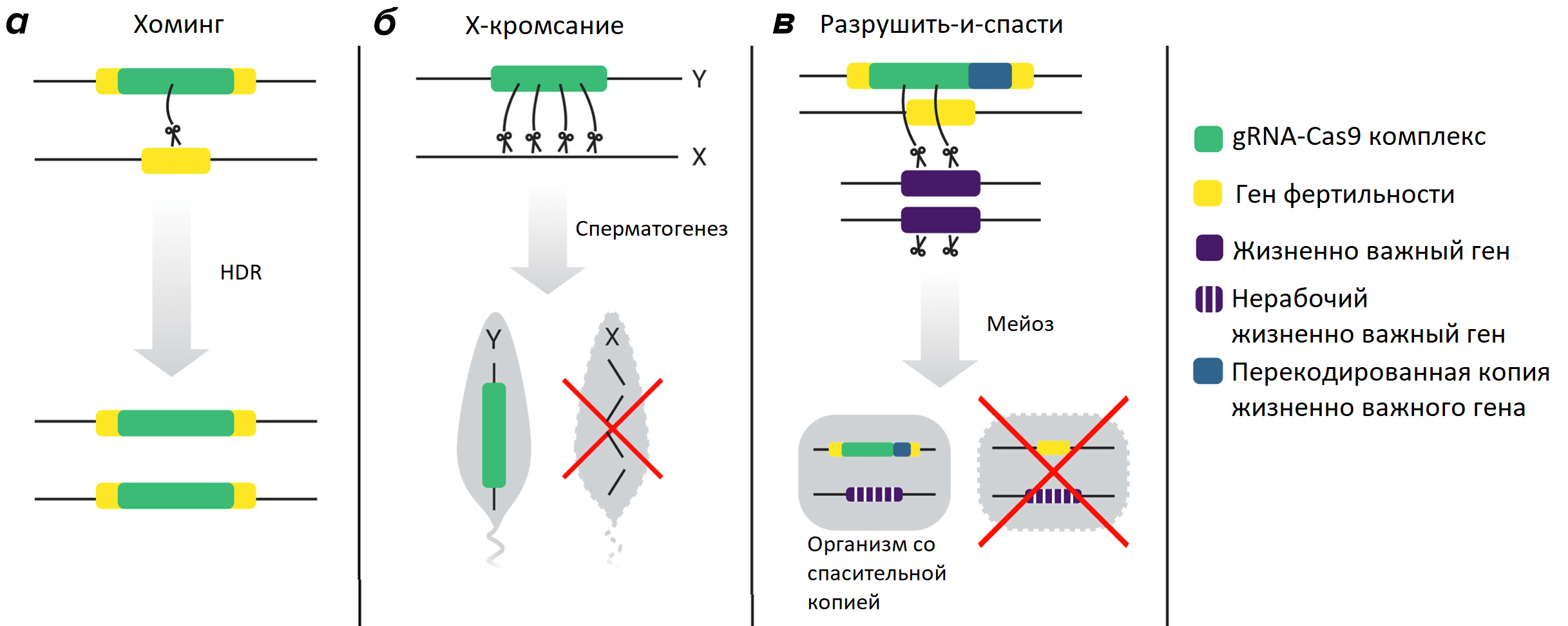
Рисунок 5. Способы редактирования генома, основанные на CRISPR-Cas технологии. а — хоминг, б — «кромсание» Х-хромосомы, в — «разрушить-и-спасти».
[39], адаптировано
В чем заключаются проблемы использования генного драйва для уменьшения численности?
Несмотря на всю его привлекательность, этот феномен ни в коем случае нельзя использовать в «чистом» виде! Концептуальная проблема состоит в том, что при генном драйве вредная аллель может распространяться до бесконечности. То есть, если такая аллель окажется в нецелевых популяциях или в особях другого вида (при успешном межвидовом скрещивании), целые экосистемы будут подвержены огромному риску и процесс нельзя будет остановить [5], [7]. Поэтому прежде чем вводить генный драйв в дикие популяции, необходимо разработать надежные молекулярные барьеры, чтобы распространение элементов драйва по популяции при необходимости можно было ограничить.
Другая проблема — техническая, парадоксально противоположная концептуальной — уже была упомянута выше. Часто во время in vivo экспериментов вместо ожидаемой гомологичной починки происходит NHEJ, и формируется резистентность к генному драйву [16].
Сейчас эти системы (хоминговые, ClvR, связанные с половыми хромосомами и другие) тестируют в лабораторных условиях, и никто пока не готов начать работу в поле [5], [6], [17], [18].
В то же время, если вернуться к начальной цели запуска генного драйва — уменьшению численности популяции, можно заметить еще одну серьезную проблему — реинтродукцию. Действительно, соседние популяции или виды со сходными экологическими потребностями могут быстро занять освободившуюся нишу, и все вернется на круги своя: эндемичные деревья съедят другие вредители, болезни будут переноситься насекомыми из соседней популяции. Таким образом, огромное количество ресурсов, потраченное на освобождение небольшого участка от животных, может оказаться совершенно бесполезным. Поэтому разрабатываются и другие методы, нацеленные на модификацию определенного признака таким образом, чтобы популяция больше не представляла угрозы.
Как модифицировать генофонд популяции, чтобы избавиться от «вредного» признака?
В контексте инвазивных видов вопрос не имеет смысла, потому что их существование — само по себе угроза. Но если, например, переносчики болезней перестанут ими быть… Тем не менее, по сравнению с методами поуменьшению численности, задача «переделать одну популяцию так, чтобы она потеряла способность делать то, что делала на протяжении значительного времени эволюции всего вида» оказывается гораздо более сложной. К тому же, у этих стратегий есть существенное различие. В первом случае репродуктивный успех отдельных особей значительно снижается — они не передают свои гены в следующее поколение. Во втором случае, наоборот, нужно следить за тем, чтобы репродуктивный успех модифицированной особи был достаточно высок (иначе отбор быстро выбракует модификацию), а это делает задачу еще сложнее.
***
Несмотря на то, что все идеи можно скромно разложить на три с половиной полки (воздействие на самок, самцов, их соотношение, либо на что-нибудь еще), разнообразие способов, которыми конечная цель достигается, поражает. К тому же, все чаще исследователи впечатляющим образом комбинируют сразу несколько методов, чтобы достичь результата быстрее и эффективнее.
Следующие две секции этого обзора переходят от общего к частному, и рассказывают про способы борьбы с двумя определенными (очень разными!) животными. Одно из них — насекомое, другое — млекопитающие. Проблемы, которые они создают, кардинально отличаются друг от друга, как идейно, так и масштабно. На первого направлено внимание огромного количества лабораторий по всему миру, на второго — только несколько местных инициатив.
Комары
Почему от них хотят избавиться?
Благодаря способностям кусать человека и переносить целый пул болезней, комары возглавляют всевозможные рейтинги «самых-опасных-в-мире-животных-которые-ежегодно-убивают-очень-много-людей» [19], которые горячо любимы широкой публикой. Однако стоит уточнить, что гематофагия (способность питаться кровью) появилась только у самок и тесно связана с продуцированием яиц; более того, большинство комаров питаются нектаром или соками и экссудатами растений и даже не помышляют о чужой крови, а кровавое эволюционное приобретение относится всего к нескольким родам [20].
Итак, вот и они — счастливые обладательницы способности питаться кровью и распространять болезни. Насекомые из рода Anopheles переносят несколько видов плазмодиев (Plasmodium — одноклеточные эукариоты, которые вызывают у человека малярию), Aedes (рис. 6) — арбовирусы, к которым относятся, например, вирусы Зика, лихорадки денге, желтой лихорадки. Также Culex переносят лихорадку западного Нила, и ряд других родов — слоновую болезнь.

Рисунок 6. Aedes aegypti во время ее кровавой диеты.
Однако кровососущие комары доставляют проблемы не только людям. Представители рода Culex — переносчики птичьей малярии и оспы — приложили свои тонкие длинные лапки к экологической катастрофе на Гавайях [21]. Местные птицы-эндемики эволюционировали, «не зная» ни оспы, ни малярии, ни их переносчиков. В результате, когда на острова завезли инфицированных комаров, птицы, не обладающие иммунитетом к этим болезням, стали легкой мишенью для патогенов. Вкупе с другими факторами это привело к исчезновению многих видов и значительному сокращению биоразнообразия [22]. Несмотря на предпринимаемые меры, малярия остается серьезной проблемой как для гавайских птиц, так и для эндемичной орнитофауны по всему миру [23].
Более того, можно сгустить краски и взглянуть на эту эпидемиологическую проблему сквозь призму климатической повестки дня. Для этого достаточно обратиться к математическим моделям, предсказывающим, как могут повести себя заболевания, которые переносятся насекомыми и другими членистоногими [24]. Прогноз таков: «тропические» болезни будут продвигаться в северные широты или выше в горы. Так что придется готовиться к решению очередных трудных задач по медицинской зоологии и сохранению биоразнообразия!
Итак, как обезвредить комаров? Борьба с ними прошла длинный путь от простых сетей и репеллентов до сложных трансгенных методов. В наши дни существуют самые разные идеи, но в целом, технологии нацелены либо на уменьшение численности комаров, либо на избавление от способности переносить паразитов [25].
Уменьшение численности
Раз уж так много внимания уделяется в этом вопросе полам, почему бы слегка не вмешаться в их становление? Одна из новых идей для борьбы с комарами и насекомыми в целом — генный драйв, обращенный на консервативный ген doublesex (dsx), который как раз участвует в дифференциации полов. Дело в том, что гомозиготные по поврежденной аллели dsx самки не вполне соответствуют своему генетическому полу: у них развиваются самцовые признаки (рис. 7) и появляются нарушения в строении хоботка. Такие «самки» не способны пить кровь и бесплодны.
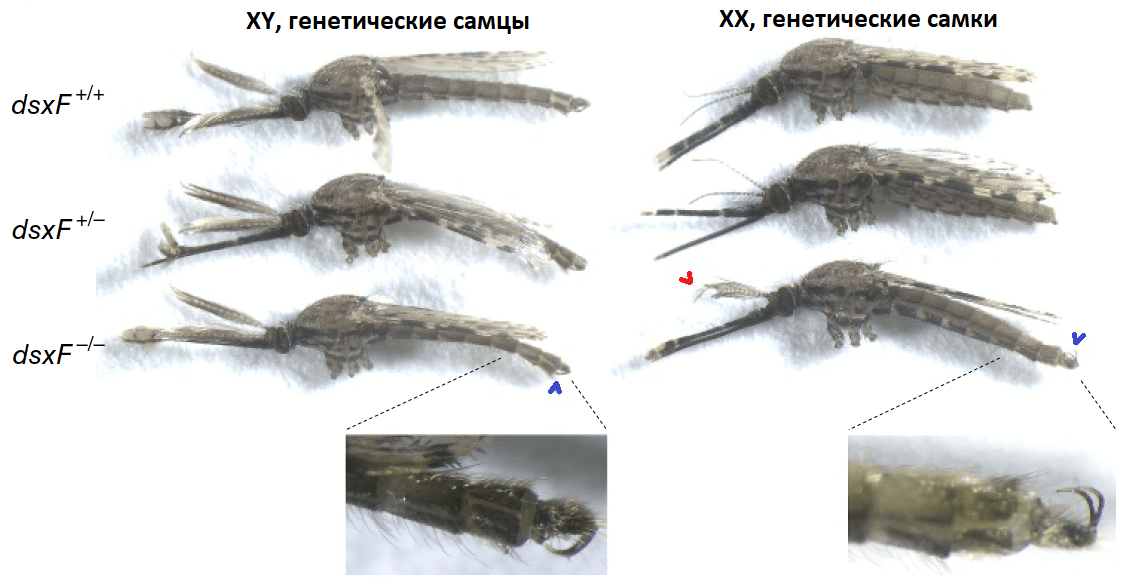
Рисунок 7. Фенотипы комаров. dsxF+ — нормальная аллель, dsxF- — поврежденная. Аномальный фенотип наблюдался только у гомозиготных самок dsxF-/-: у них наблюдались типичные самцовые признаки — перистые антенны (показаны красной стрелкой) и гоностиль — придаток для удержания самок во время копуляции (показан синей стрелкой). Более того, гоностиль таких «самок» был повернут на спинную сторону (справа), в отличие от нормальной брюшной ориентации (слева), которое наблюдается у самцов.
[26], адаптировано
В лабораторных условиях генный драйв запустили в двух небольших популяциях (по 600 комаров в каждой) с начальной частотой поврежденной аллели dsx 12,5%. Уже на 8 и 12 поколении соответственно все самки стали обладателями перистых усиков и гоностилей и не произвели ни одного яйца. Обе популяции вымерли [25]. Есть и обновленная версия этого метода, которая ускоряет процесс за счет дополнительного уменьшения числа самок: в систему генного драйва, основанную на dsx, добавляют крошащие Х-хромосому нуклеазы [15].
О старом добром методе стерильных насекомых (SIT; см. раздел «Как сократить численность популяции?») тоже не забывают: его расширили и улучшили до так называемого точно направляемого метода стерильных насекомых (pgSIT, precision guide SIT), которую пока испробовали только в лабораторных условиях [27], [28]. В данном случае от генного драйва отказываются и настаивают на периодическом пополнении дикой популяции лабораторными животными. Воздействовать предлагают сразу на оба пола: на ген ß-Tubulin 85D, который экспрессируется в семенниках и нужен для сперматогенеза, а также myosin heavy chain, который экспрессируется в куколках самок и определяет их способность летать (рис. 8). Авторы этой методики, в отличие от других, предлагают отправлять в природу не взрослых комаров, а яйца (что технически проще). В результате, из них появятся стерильные самцы, которые спарятся с дикими самками и не оставят потомства, и самки, не способные к полету (а значит, не способные размножаться) [27].

Рисунок 8. Слева: самцы. а — рабочий ген и нормальные сперматозоиды, б — выключенный ген и сперматиды без хвостов (ß-Tubulin 85D в норме участвует в образовании микротрубочек в аксонеме хвоста сперматозоида). Справа: самки. в — рабочий ген и нормальная работа мышц, г - myosin heavy chain выключен, мышцы не могут держать крылья в нужном положении.
[27], адаптировано
Перечисленные трансгенные методы уменьшения численности открывают впечатляющие перспективы для борьбы с болезнями, которые переносят комары. Однако предстоит провести еще много проверок перед использованием этих способов в дикой природе.
Модификация популяции
Чтобы избавить комаров от клейма «переносчик опасных болезней», нужно разработать эволюционно стабильные генные драйвы, связанные с антипатогенными эффекторами.
Так, одна из идей объявляет бунт старательному вырезанию частей генов и построению сложных моделей последующих взаимодействий. Она заключается в том, чтобы экспрессировать вещества, подавляющие плазмодия, в тех органах и тканях комаров, которые задействованы в его жизненном цикле. Этого можно добиться по-разному, но, для того чтобы создать генный драйв, последовательность, кодирующую необходимые антимикробные пептиды, привязывают к органо- или тканеспецифичным генам. В одном из исследований [29] удалось запустить пробный драйв для антимикробного пептида скорпина, привязанного к нескольким генам, которые экспрессируются в средней кишке (мезентероне) самки комара (рис. 9). Такой подход хорош тем, что требует минимум модификаций и запускает неавтономный генный драйв. Однако для оценки потенциала самого скорпина в борьбе с малярией, нужны дальнейшие исследования.
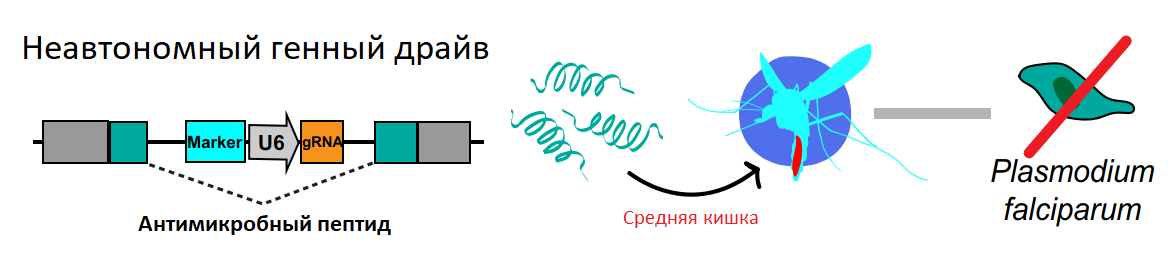
Рисунок 9. Неавтономный генный драйв антимикробного пептида.
[26], адаптировано
Пробуют и другие эффекторные, но не драйвовые способы модификации. Например, усилить экспрессию эндогенных транскрипционных факторов иммунных путей или задействовать малые РНК, которые могут подавлять экспрессию вирусов при помощи РНК-интерференции [25].
Основная проблема эффекторов в том, что они работают только против одной стадии жизненного цикла плазмодия (этот паразит использует несколько органов комара на разных стадиях жизненного цикла) или только против одного вируса. Однако в последнее время пробуют преодолеть и эти сложности. Например, уже есть работы, в которых эффекторы действуют сразу на несколько форм плазмодия [30], нацелены сразу на два вирусных семейства [31] или на несколько генетически различных серотипов лихорадки денге [32].
В целом, самый значительный пробел в знаниях о модификации популяций-переносчиков болезней таков: никто не может предсказать, будут ли любые эффекты, полученные с использованием лабораторных штаммов, воспроизведены в экспериментах с дикими (эволюционирующими!) паразитами, выделенными из крови пациентов. И уж тем более неизвестно, сохранятся ли эти эффекты в полевых условиях, которые сильно отличаются от стандартных лабораторных экспериментов.
Нетрансгенные методы
Очень успешный метод, который не затрагивает геном комара, но позволяет эффективно бороться с малярией — внедрение другого паразита!
Вольбахия (Wolbachia, рис. 10) — бактерия-паразит членистоногих и нематод, которая намного опередила ученых в своих стремлениях контролировать интересующие ее популяции. Она замечена в феминизации хозяина, принуждении к партеногенезу, андроциде (убийстве самцов), преступной цитоплазматической несовместимости [33]. Считается, что «неприязнь» к самцам связана с тем, что эта бактерия не может передаваться от отца к потомству (в мужских гаметах слишком мало цитоплазмы, в которой вольбахии обитают), а потому ей выгодно, чтобы в популяции было больше самок [34].
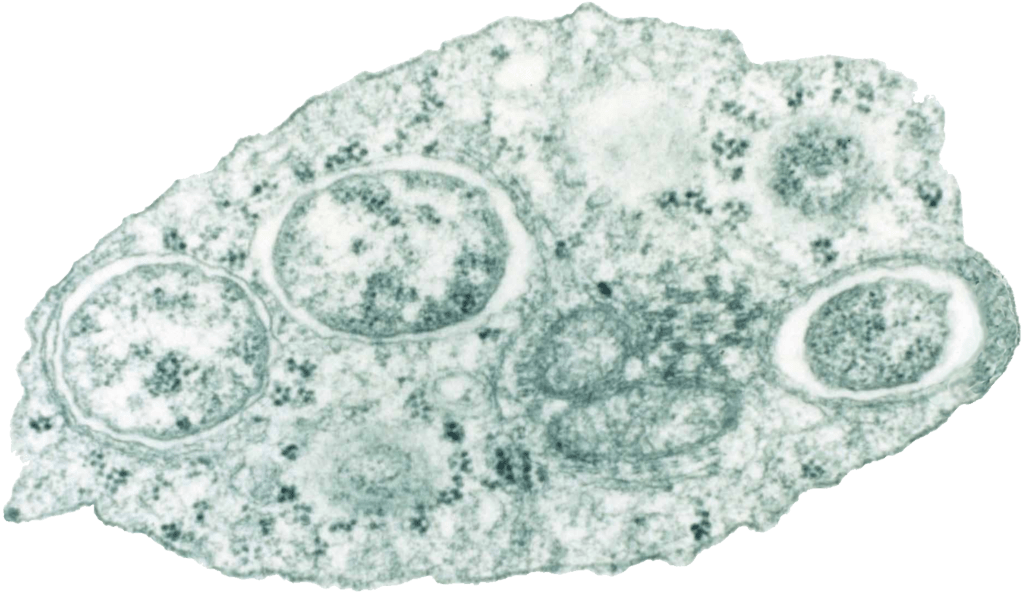
Рисунок 10. Вольбахия. Просвечивающая электронная микроскопия.
Численность комаров можно уменьшить с помощью вольбахии, манипулируя ее штаммами и способностями создавать цитоплазматическую несовместимость (incompatible insect technique, IIT, рис. 11). Когда зараженная самка комара спаривается со здоровым самцом или с самцом, который инфицирован тем же штаммом вольбахии, их потомство выживает. Однако зараженные самцы могут оставить потомство только при спаривании с самкой, инфицированной тем же штаммом вольбахии, а иначе возникает цитоплазматическая несовместимость. Таким образом, если выпустить самцов, инфицированных определенным штаммом вольбахии, все потомство «диких» самок и зараженных самцов будет нежизнеспособно [25].

Рисунок 11. Цитоплазматическая несовместимость, индуцированная вольбахией.
[25], адаптировано
Однако этим способности вольбахии не ограничиваются! Другое ее необычное свойство состоит в том, что комары, зараженные этой бактерией, демонстрируют повышенную устойчивость к арбовирусным инфекциям. А значит, вольбахии могут блокировать трансмиссию болезней, которые вызывают эти патогены. Как ей это удается? Ответ на этот вопрос еще не найден, но есть несколько предположений. Возможно, вольбахия напрямую воздействует на вирусную РНК [35] или же супрессия вирусов есть следствие других процессов, например, действия бактерии на иммунную систему хозяина [36] и/или конкуренции за ресурсы клетки [37].
Какие же проблемы могут возникнуть? Во-первых, если случайно выпустить вместе с самцами несколько лабораторных самок, штамм вольбахии распространится по всей популяции, и план по супрессии с треском провалится. К сожалению, даже при наличии самого нового оборудования для отделения самок от самцов такая ошибка не исключена. В таком случае останется только надеяться, что патоген-блокирующие свойства вольбахии ограничат распространение болезней. Можно было бы на всякий случай стерилизовать выпускаемых комаров (как в SIT), но это может повлиять на вольбахию и ее чудодейственные антипаразитарные свойства.
Использование вольбахии — не самый новый, но, пожалуй, самый успешный биотехнический способ борьбы с комарами, уже опробованный в полевых условиях десятка стран [25]. Однако улучшение этих методов для более тонкого управления популяциями пока затруднено, ведь вся технология основана на естественных свойствах вольбахии, которые мы толком не понимаем.
Серые белки
Кровососущие комары — действительно довольно неприятные насекомые, но белки-то чем провинились?

Рисунок 12. Серая белка недоумевает, что же с ней не так.
Серая или каролинская белка (Sciurus carolinensis, рис. 12) — инвазивный вид, который впервые завезли из Северной Америки на Британские острова в 19 веке. В настоящее время ареал и численность этого вида в Великобритании и Европе стремительно растут, а число и размеры участков обитания местной рыжей белки (Sciurus vulgaris) не менее стремительно уменьшаются. Инвазивная белка крупнее и агрессивнее коренной, а также переносит беличью оспу (squirrelpox), которая летальна для местного вида. К тому же, серая белка, в отличие от рыжей сестры, обожает грызть кору деревьев и иногда переусердствует, в результате чего они гибнут [38].
Местные экологи бьют тревогу: если ничего не предпринять, рыжая белка скоро совсем исчезнет с британских островов [39], а у местных лесов могут быть проблемы с регенерацией [38]. В это же время британские экономисты с ужасом считают убытки от испорченной древесины, а местные жители жалуются на перегрызенные кабели, наглые проникновения в дома и испорченную мебель [40], [41].
Серых белок пробовали отлавливать, травить и отстреливать. Однако у этих животных есть довольно надежная защита — их харизма [42], [43]. А уж кто не кормил белок в парках, не тянул руку изо всех сил и не ждал, пока пушистая белочка возьмет из руки орешек! В общем, публичный резонанс вынудил искать другие способы решить этот неоднозначный конфликт.
Итак, как запретить белкам размножаться?
Нетрансгенный метод
Первый метод — коварное использование поведенческой особенности. Белки с удовольствием посещают кормушки (рис. 13), а значит, их содержимым можно манипулировать. Например, в беличью подкормку можно добавить… оральные контрацептивы.

Рисунок 13. Пристрастие белок к кормушкам.
С точки зрения физиологии регуляция полового размножения есть череда гормональных каскадов. Соответственно, чтобы нарушить эту систему, нужно заблокировать один или несколько важных промежуточных элементов. Разрабатывают два возможных варианта [44] — препараты, связывающее гонадолиберин (другое название — гонадотропин-рилизинг-гормон GnRH) [45] или холестерин [46], [47]. Гонадолиберин в норме стимулирует секрецию гонадотропинов, а холестерин участвует в синтезе стероидных гормонов (тестостерон, прогестерон).
Авторы этих двух методик утверждают, что у небольших исследованных групп белок негативные эффекты от приема оральных контрацептивов не были обнаружены. Однако в дикой природе эти способы еще не применяли [44–47].
Главная сложность — сделать так, чтобы контрацептивы ели только (серые!) белки, и другие виды случайно не сократили свою численность. Для этого авторы методики разрабатывают специальные кормушки, а в качестве приманки собираются использовать что-то вроде ореховой пасты, чтобы ее можно было съесть только на месте. Более того, планируют изучать вкусовую привлекательность такого подкорма для разных видов как в неволе, так и в дикой природе [44].
Генный драйв
В новой работе [39] очень осторожно выдвигают идею контролируемого генного драйва в беличьей популяции. В ней построили модель «призрачного» драйва, который быстро исчезает, если не поддерживать его регулярным выпуском в природу новых трансгенных животных. Эта модель основана на другой более широко известной концепции драйва, который ограничивает сам себя — так называемом дейзичейне (daisychain). В этом случае создается цепочка, где каждый необходимый элемент обеспечивает драйв другого, но не может «драйвить» сам себя. В результате, сначала самый первый элемент (чей драйв не обеспечен) исчезает из популяции, а вслед за ним, по цепочке, все остальные, и генный драйв останавливается [48].
Модель драйва в беличьей популяции используют модификацию дейзичейна: так называемый дейзифилд (daisyfield) [49], [50]. Здесь нет четко выстроенных цепочек взаимодействий, но есть дейзи-элементы, которые способствуют драйву желаемой аллели независимо друг от друга, а сами при этом наследуются по законам Менделя (т.е. без драйва; рис. 2). Таким образом, при спаривании трансгенных особей с дикими в каждом следующем поколении все меньше особей получает «полный комплект» дейзифилда (рис. 14, справа), и драйв сильно ограничивается. Наконец, хоминг становится невозможен, и все элементы драйва отбраковываются отбором.
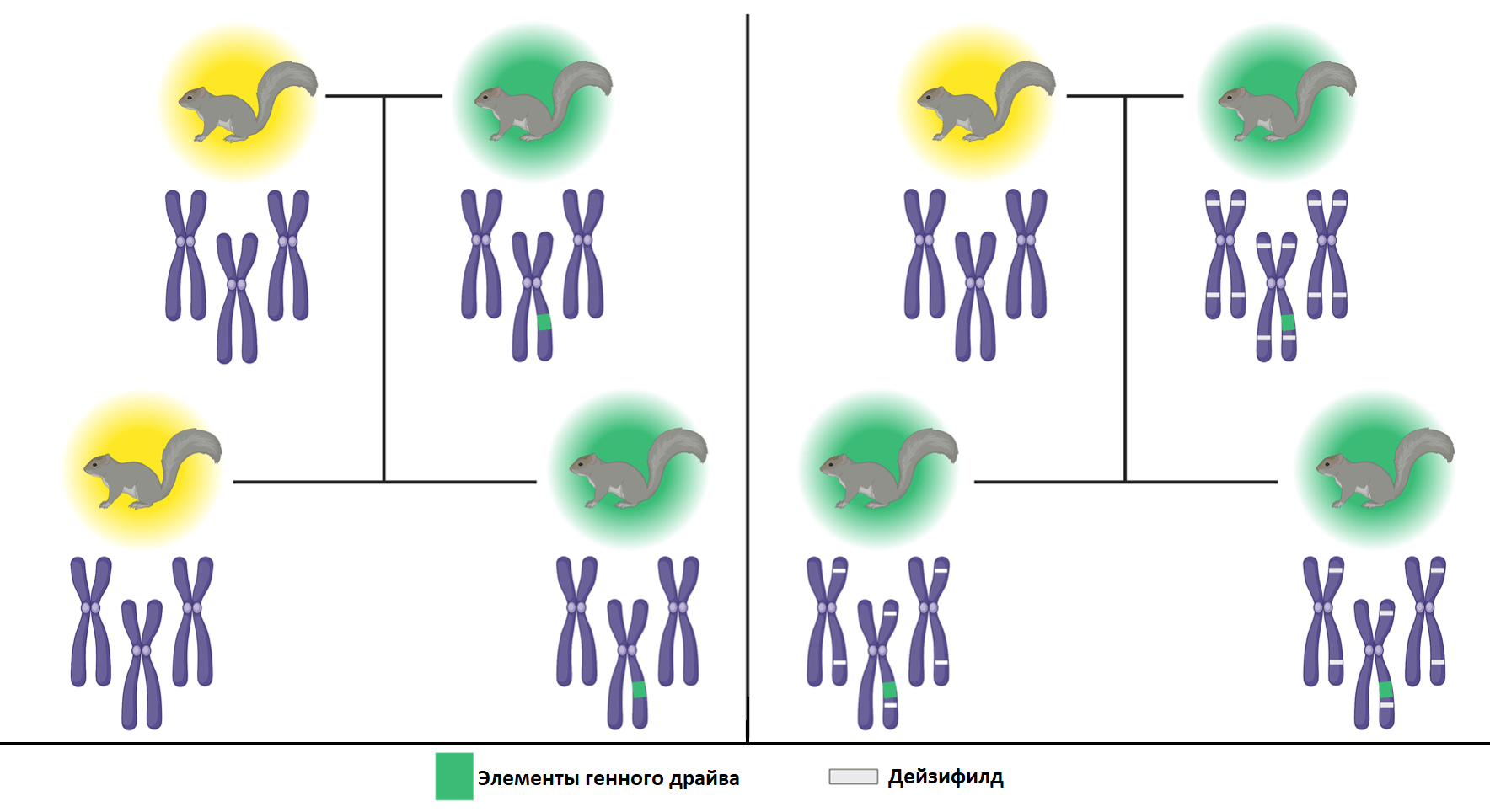
Рисунок 14. Схема скрещивания: слева — только с элементами генного драйва, справа — с дейзифилдом (в каждом следующем поколении количество дейзи-элементов будет уменьшаться вдвое). Желтым цветом отмечены белки с дикими аллелями, зеленым — трансгенные.
[39], адаптировано
Также в этой работе моделируют разные сценарии развития событий для популяции из 3000 белок, в которую «выпускают» по 100 генно-модифицированных белок с дейзифилдом разного размера (рис. 15). Если остановиться на единственном выпуске, численность возвращается к первоначальному состоянию. Если ежегодно добавлять в популяцию 1% (от общей численности в тот момент) дейзи-особей, популяция сокращается и остается на уровне ниже первоначального, а если 10% — популяция всегда вымирает.

Рисунок 15. Изменение численности популяции после интродукции 100 трансгенных белок при разном размере дейзифилда и уровнями пополнения популяции трансгенными белками.
[39], адаптировано
Эта математическая модель предоставляет перспективную теоретическую подоплеку, но упускает много деталей, которые можно откалибровать только при лабораторной и полевой работе. К примеру, необходимо установить оптимальное количество гидовых РНК для хоминга и решить технические сложности, связанные с внедрением дейзифилда в геном; а чтобы рассчитать, сколько трансгенных белок выпускать в дикую среду, нужна очень точная оценка численности и границ популяции.
***
Таким образом, исследователи учатся регулировать механизмы, действующие на самых разных уровнях: ген, организм, популяция. Появляется все больше концепций биоконтроля, некоторые из которых одевают старые идеи в новую современную трактовку, а другие — используют недавние открытия самым неожиданным образом. Эти исследования дают надежду на то, что методы в данной области все-таки станут достаточно гуманными и безопасными, и фраза «ограничение и контроль популяций» будет по-настоящему нейтральной.
Литература
- N.N. Luneva, All-Russian Institute of Plant Protection, G.Yu. Konechnaya, T.N. Smekalova, I.G. Chukhina, et. al.. (2018). On status of Heracleum sosnowskyi Manden. on the territory of Russian Federation. PPN. 10-15;
- Dinka Matošević, Ivan Lukić, Audrey Bras, Nikola Lacković, Milan Pernek, et. al.. (2017). Spatial Distribution, Genetic Diversity and Food Choice of Box Tree Moth (Cydalima perspectalis) in Croatia. SEEFOR. 8;
- Гниненко Ю.И., Сергеева Ю.А., Ширяева Н.В., Лянгузов М.Е. (2016). Самшитовая огневка — опасный вредитель самшита. Лесохоз. информ. : электрон. сетевой журн. 3, 25–35;
- Rafael Dudeque Zenni, Franz Essl, Emili García-Berthou, Shana M. McDermott. (2021). The economic costs of biological invasions around the world. NB. 67, 1-9;
- Tim Harvey-Samuel, Thomas Ant, Luke Alphey. (2017). Towards the genetic control of invasive species. Biol Invasions. 19, 1683-1703;
- John L. Teem, Luke Alphey, Sarah Descamps, Matt P. Edgington, Owain Edwards, et. al.. (2020). Genetic Biocontrol for Invasive Species. Front. Bioeng. Biotechnol.. 8;
- Austin Burt. (2003). Site-specific selfish genes as tools for the control and genetic engineering of natural populations. Proc. R. Soc. Lond. B. 270, 921-928;
- Kevin M Esvelt, Andrea L Smidler, Flaminia Catteruccia, George M Church. (2014). Concerning RNA-guided gene drives for the alteration of wild populations. eLife. 3;
- Даудна, Стернберг: Трещина в мироздании. Редактирование генома: невероятная технология, способная управлять эволюцией. М.: Corpus, 2019. — 384 с.;
- Просто о сложном: CRISPR/Cas;
- Разнообразие и эволюция систем CRISPR/Cas;
- Georg Oberhofer, Tobin Ivy, Bruce A. Hay. (2019). Cleave and Rescue, a novel selfish genetic element and general strategy for gene drive. Proc Natl Acad Sci USA. 116, 6250-6259;
- Jackson Champer, Isabel K. Kim, Samuel E. Champer, Andrew G. Clark, Philipp W. Messer. (2020). Performance analysis of novel toxin-antidote CRISPR gene drive systems. BMC Biol. 18;
- Roberto Galizi, Andrew Hammond, Kyros Kyrou, Chrysanthi Taxiarchi, Federica Bernardini, et. al.. (2016). A CRISPR-Cas9 sex-ratio distortion system for genetic control. Sci Rep. 6;
- Alekos Simoni, Andrew M. Hammond, Andrea K. Beaghton, Roberto Galizi, Chrysanthi Taxiarchi, et. al.. (2020). A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nat Biotechnol. 38, 1054-1060;
- Jackson Champer, Jingxian Liu, Suh Yeon Oh, Riona Reeves, Anisha Luthra, et. al.. (2018). Reducing resistance allele formation in CRISPR gene drive. Proc Natl Acad Sci USA. 115, 5522-5527;
- Gus R. McFarlane, C. Bruce A. Whitelaw, Simon G. Lillico. (2018). CRISPR-Based Gene Drives for Pest Control. Trends in Biotechnology. 36, 130-133;
- John M. Marshall, Omar S. Akbari. (2018). Can CRISPR-Based Gene Drive Be Confined in the Wild? A Question for Molecular and Population Biology. ACS Chem. Biol.. 13, 424-430;
- Т. Вайнгард. Кровососы. Как самые маленькие хищники планеты стали серыми кардиналами нашей истории. М.: «Бомбора», 2019. — 608 с.;
- Daniel A. H. Peach, Gerhard Gries. (2020). Mosquito phytophagy – sources exploited, ecological function, and evolutionary transition to haematophagy. Entomol Exp Appl. 168, 120-136;
- Charles van Riper, Sandra G. van Riper, M. Lee Goff, Marshall Laird. (1986). The Epizootiology and Ecological Significance of Malaria in Hawaiian Land Birds. Ecological Monographs. 56, 327-344;
- Michael D. Samuel, Peter H. F. Hobbelen, Francisco DeCastro, Jorge A. Ahumada, Dennis A. LaPointe, et. al.. (2011). The dynamics, transmission, and population impacts of avian malaria in native Hawaiian birds: a modeling approach. Ecological Applications. 21, 2960-2973;
- Dennis A. LaPointe, Carter T. Atkinson, Michael D. Samuel. (2012). Ecology and conservation biology of avian malaria. Annals of the New York Academy of Sciences. 1249, 211-226;
- Cyril Caminade, K. Marie McIntyre, Anne E. Jones. (2019). Impact of recent and future climate change on vector-borne diseases. Ann. N.Y. Acad. Sci.. 1436, 157-173;
- Guan-Hong Wang, Stephanie Gamez, Robyn R. Raban, John M. Marshall, Luke Alphey, et. al.. (2021). Combating mosquito-borne diseases using genetic control technologies. Nat Commun. 12;
- Kyros Kyrou, Andrew M Hammond, Roberto Galizi, Nace Kranjc, Austin Burt, et. al.. (2018). A CRISPR–Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nat Biotechnol. 36, 1062-1066;
- Ming Li, Ting Yang, Michelle Bui, Stephanie Gamez, Tyler Wise, et. al.. (2021). Suppressing mosquito populations with precision guided sterile males. Nat Commun. 12;
- Nikolay P. Kandul, Junru Liu, Hector M. Sanchez C., Sean L. Wu, John M. Marshall, Omar S. Akbari. (2019). Transforming insect population control with precision guided sterile males with demonstration in flies. Nat Commun. 10;
- Astrid Hoermann, Sofia Tapanelli, Paolo Capriotti, Giuseppe Del Corsano, Ellen KG Masters, et. al.. (2021). Converting endogenous genes of the malaria mosquito into simple non-autonomous gene drives for population replacement. eLife. 10;
- Adriana Adolfi, Valentino M. Gantz, Nijole Jasinskiene, Hsu-Feng Lee, Kristy Hwang, et. al.. (2020). Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nat Commun. 11;
- Yuemei Dong, Maria L. Simões, George Dimopoulos. (2020). Versatile transgenic multistage effector-gene combinations for Plasmodium falciparum suppression in Anopheles. Sci. Adv.. 6;
- Anna Buchman, Stephanie Gamez, Ming Li, Igor Antoshechkin, Hsing-Han Li, et. al.. (2019). Engineered resistance to Zika virus in transgenic Aedes aegypti expressing a polycistronic cluster of synthetic small RNAs. Proc Natl Acad Sci USA. 116, 3656-3661;
- John H. Werren, Laura Baldo, Michael E. Clark. (2008). Wolbachia: master manipulators of invertebrate biology. Nat Rev Microbiol. 6, 741-751;
- Элементы: «Бактерия Wolbachia — “серый кардинал” мира насекомых»;
- Tamanash Bhattacharya, Irene L. G. Newton, Richard W. Hardy. (2020). Viral RNA is a target for Wolbachia-mediated pathogen blocking. PLoS Pathog. 16, e1008513;
- Vincent Geoghegan, Kirsty Stainton, Stephanie M. Rainey, Thomas H. Ant, Adam A. Dowle, et. al.. (2017). Perturbed cholesterol and vesicular trafficking associated with dengue blocking in Wolbachia-infected Aedes aegypti cells. Nat Commun. 8;
- Amelia Lindsey, Tamanash Bhattacharya, Irene Newton, Richard Hardy. (2018). Conflict in the Intracellular Lives of Endosymbionts and Viruses: A Mechanistic Look at Wolbachia-Mediated Pathogen-blocking. Viruses. 10, 141;
- Christopher P. Nichols, Julian A. Drewe, Robin Gill, Nigel Goode, Neville Gregory. (2016). A novel causal mechanism for grey squirrel bark stripping: The Calcium Hypothesis. Forest Ecology and Management. 367, 12-20;
- Nicky R. Faber, Gus R. McFarlane, R. Chris Gaynor, Ivan Pocrnic, C. Bruce A. Whitelaw, Gregor Gorjanc. (2021). Novel combination of CRISPR-based gene drives eliminates resistance and localises spread. Sci Rep. 11;
- Williams F., Eschen R., Harris A., Djeddour D., Pratt C., Shaw R.S., et al. (2010). The economic cost of invasive non-native species on Great Britain. CABI Proj No VM10066, 199;
- Necar W. (2021). Grey squirrels threatening our woodlands to tune of ₤1.1bn. Royal Forestry Society;
- Ross T. Shackleton, David M. Richardson, Charlie M. Shackleton, Brett Bennett, Sarah L. Crowley, et. al.. (2019). Explaining people's perceptions of invasive alien species: A conceptual framework. Journal of Environmental Management. 229, 10-26;
- Mike Dunn, Mariella Marzano, Jack Forster. (2021). The red zone: Attitudes towards squirrels and their management where it matters most. Biological Conservation. 253, 108869;
- Grey squirrel fertility control research — frequently asked questions. (2021). UK Squirrel Accord;
- Murali Pai, R Bruner, Donald H. Schlafer, Greg K. Yarrow, Christi A. Yoder, Lowell A. Miller. (2011). Immunocontraception in Eastern Gray Squirrels (Sciurus carolinensis): Morphologic Changes in Reproductive Organs. Journal of Zoo and Wildlife Medicine. 42, 718-722;
- Christi A. YODER, Brenda A. MAYLE, Carol A. FURCOLOW, David P. COWAN, Kathleen A. FAGERSTONE. (2011). Feeding of grey squirrels (Sciurus carolinensis) with the contraceptive agent DiazaCon™: effect on cholesterol, hematology, and blood chemistry. Integrative Zoology. 6, 409-419;
- Brenda A Mayle, Mark Ferryman, Andrew Peace, Christi A Yoder, Lowell Miller, David Cowan. (2013). The use of DiazaCon™ to limit fertility by reducing serum cholesterol in female grey squirrels, Sciurus carolinensis. Pest. Manag. Sci.. 69, 414-424;
- Charleston Noble, John Min, Jason Olejarz, Joanna Buchthal, Alejandro Chavez, et. al.. (2019). Daisy-chain gene drives for the alteration of local populations. Proc Natl Acad Sci USA. 116, 8275-8282;
- Esvelt K. (2017). Daisy drive: A local, open, and community-responsive approach to solving ecological problems. MIT Media Lab;
- Min J., Noble C., Najjar D., & Esvelt K. M. (2017). Daisyfield gene drive systems harness repeated genomic elements as a generational clock to limit spread. BioRxiv, 104877;
- CRISPR Guide. (2019). Addgene.







