Антитело: лучший способ распознать чужого
13 июля 2018
Антитело: лучший способ распознать чужого
- 18854
- 5
- 27
Универсальная структура антитела позволяет распознавать не только чужеродные, но и собственные молекулы организма, а также передавать различные сигналы между клетками
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Процесс связывания антигена с антителом состоит из множества этапов. Организму нужно создать разнообразные антитела, научить их отличать свои антигены от чужих, отобрать лучшие варианты и заставить клетки их массово производить... И это только начало иммунного ответа: связывание с антигеном влечет за собой длинную цепь молекулярных и клеточных взаимодействий, приводящих к уничтожению врага. Мы попробуем описать сложную жизнь антител в организме, поговорим о разных видах антител (не только у человека) и о том, как люди научились использовать оба свойства антител — узнавать чужого и запускать иммунный ответ — в научных и медицинских целях. Эта статья — вторая в цикле работ, посвященных терапевтическим антителам.
Терапевтические антитела

Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Эта статья — вторая в цикле работ о терапевтических антителах. Первый текст был посвящен истории изучения антител и введения их в медицинскую практику [1]. По результатам сотни лет исследований мы знаем, что антитела — это молекулы, которые производятся В-лимфоцитами (В-клетками). Они обладают постоянной (константной) и изменяющейся (вариабельной) частями и умеют, с одной стороны, распознавать антиген, а с другой — активировать клетки иммунной системы и запускать иммунный ответ. Попробуем подробнее разобраться, откуда появляются антитела и как они живут в организме до и после встречи с антигеном.
Как узнать чужого
Иммунная система — это система охраны организма от внешних вторжений, например, паразитов (о том, как она работает, подробно рассказано в статье «Иммунитет: борьба с чужими и... своими» [2]). Для того, чтобы быстро обнаружить нарушителя порядка, необходимы дозорные — молекулы, которые смогут его распознать и отличить от собственных клеток. Если у группы паразитов есть какой-нибудь общий и неизменный отличительный признак, это существенно упрощает задачу. Примером могут служить бактерии, чьи жгутики по строению принципиально отличаются от эукариотических: они состоят из белка флагеллина, который в нашем организме не встречается. В таком случае нам достаточно иметь всего одну молекулу, распознающую флагеллин, и она будет сигнализировать о присутствии любой бактерии со жгутиком.
Молекулы-отличительные признаки, подобные флагеллину, называют РАМР — pathogen-associated molecular patterns, что на русский часто переводят как «образ патогенности». Для них в организме человека существуют отдельные рецепторы (TLR (Toll-подобные рецепторы), лектины и т.д.), плавающие в крови или расположенные на клетках иммунной системы. Распознавание РАМР можно отнести к реакциям врожденного иммунитета — оно у всех людей одинаково и не требует дополнительного регулирования .
Значения терминов, выделенных полужирным шрифтом, можно посмотреть в «Словарике» в конце статьи.
Иммунная система человека делится на две большие ветви — врожденный и приобретенный (адаптивный) иммунитеты, — за изучение которых в 2011 году была вручена Нобелевская премия [3]. Врожденный иммунитет способен защищать организм сразу же, как только в того проник патоген. Приобретенный же иммунный ответ разворачивается намного дольше, однако действует более изощренно и, кроме того, быстро активируется при повторном контакте с врагом. Врожденный иммунитет можно сравнить со стремительным авангардом, который в случае серьезной угрозы зовет на помощь основные силы организма — приобретенный иммунитет. — Ред.
Но что делать, если в организм попал паразит без РАМР? Или даже не весь паразит целиком, а отдельные его части или продукты обмена? Нужно создать систему, которая не будет заточена на узнавание набора молекул, а сможет точечно опознать практически любую незнакомую молекулу и запустить иммунные реакции. Такую молекулу, которая может вызвать в организме иммунный ответ, называют антигеном.
Антигеном может стать далеко не любая молекула. Для того чтобы иммунитет на нее отреагировал, должны выполняться два важных условия. Первое — чужеродность. Молекула должна быть незнакомой, то есть непохожей на собственные молекулы организма. Пусть у нас есть белок — последовательность аминокислот. В опухолевой клетке белок мутирует, и аминокислоты заменяются на другие. Чем больше таких аминокислотных отличий от исходной молекулы, тем сильнее иммунный ответ, который вызовет такой белок. А если это не собственный белок, а чужой, не имеющий аналогов в организме, то ответ будет максимальным.
Аминокислоты, распознаваемые антителом, могут находиться как друг за другом, так и в разных участках белка. Последовательно расположенные аминокислоты образуют линейный антиген. Если же аминокислоты расположены далеко, то они могут сближаться, так как белки находятся, как правило, в свернутом состоянии (так называемые вторичная и третичная структуры). При этом возникает конформационный антиген (рис. 1).
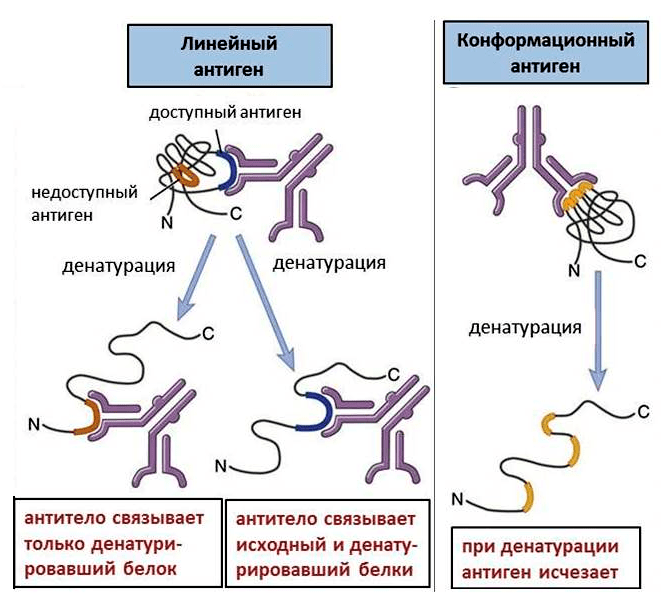
Рисунок 1. Линейные и конформационные антигены. Конформационные антигены доступны для связывания только в интактном белке; при денатурации они исчезают. Линейные антигены присутствуют в любом белке, но денатурация делает некоторые из них доступными.
Чужеродность зависит еще и от того, с какими собственными молекулами иммунная система встречалась раньше [2]. Если, например, какой-нибудь белок находится в глазном яблоке, где нет кровеносных сосудов, то у иммунной системы нет возможности с ним познакомиться и узнать, что он свой. При повреждении глазного яблока белок может попасть в кровоток, и тогда иммунная система распознает его как чужой. Собственные антигены организма называют аутоантигенами в противоположность чужим — аллоантигенам. Когда иммунная система реагирует на аутоантигены, развиваются аутоиммунные заболевания (На «Биомолекуле» есть спецпроект, посвященный тому, почему такие заболевания возникают, и как их лечить).
Второе условие, необходимое, чтобы молекула стала антигеном, — иммуногенность (рис. 2). Иными словами — иммунная система должна иметь возможность встретиться с молекулой и ее распознать. Поэтому, например, антигенами не могут быть мел или масло — они просто не растворяются в воде. Еще антигеном не может быть очень маленькая молекула, например, отдельно взятая аминокислота — ее сложно уловить в растворе, она не свяжется прочно с антителом. Поэтому, например, для белков минимальный размер антигена — от 7 аминокислот. Но многие вещества (например, отдельные металлы) могут стать антигенами, если связаны с белком. В таком случае белок называют носителем: он «отвечает» за то, чтобы иммунная система смогла встретиться с новым веществом, а сам антиген — гаптеном: он «отвечает» за специфичность связывания. Используя носители, можно вызвать иммунный ответ на самые разные вещества, например, анилин [4] или никель [5].
Напротив, большие молекулы хорошо вызывают иммунный ответ: чем длиннее молекула, тем больше в ней участков, которые можно узнать — эпитопов. Также иммуногенность зависит от жесткости структуры — если молекула будет постоянно изменять структуру, то не получится уловить конкретный эпитоп. Поэтому, например, желатин (длинные нити) практически не вызывает иммунный ответ, если его искусственно не стабилизировать. Наконец, чтобы обладать иммуногенностью, антиген должен напоминать по структуре собственные молекулы организма. Это связано с тем, что клетки иммунной системы периодически поглощают антигены, расщепляют их и «демонстрируют» друг другу (см. ниже). А чтобы антиген было легко переварить, он должен быть похож по структуре на собственные молекулы или на молекулы, которыми питается организм, — для них в клетках есть расщепляющие ферменты. Таким образом, в большинстве случаев антигены — это белки или углеводы, в то время как остальные молекулы (например, полиэтилен или другие небиологические полимеры) вызывают иммунный ответ реже и слабее.
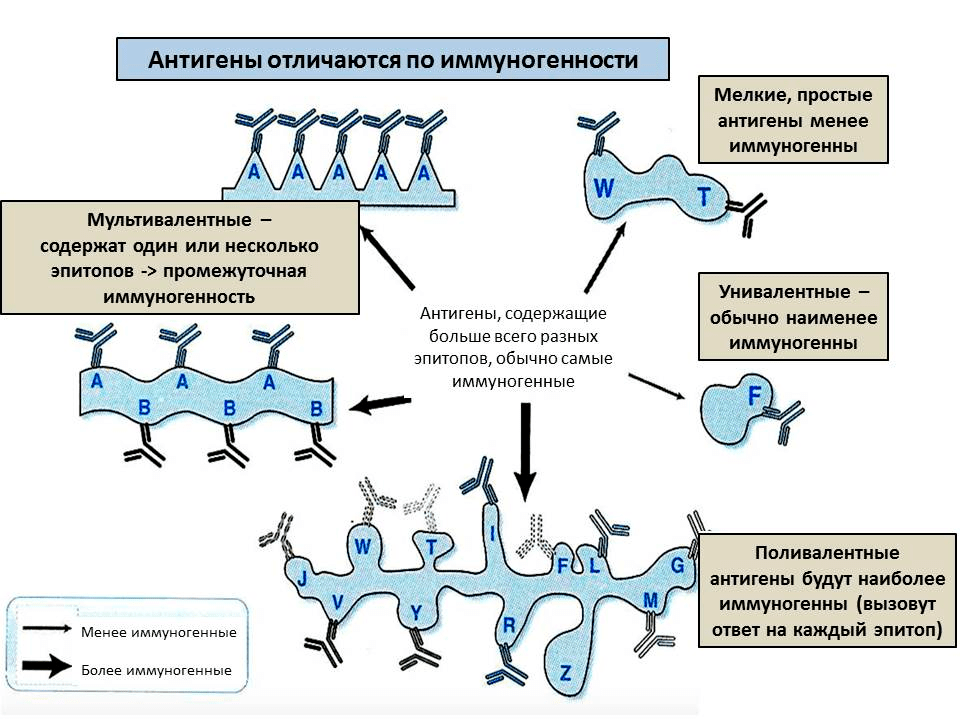
Рисунок 2. От чего зависит иммуногенность антигена? Каждое антитело специфично к одному эпитопу и может реагировать на близкие к нему по строению эпитопы. Чем больше эпитопов на молекуле и чем выше их разнообразие, тем сильнее иммунный ответ на антиген.
Итак, чтобы сигнализировать о патогене, необходима молекула, распознающая небольшие отличия в белках и углеводах и активирующая клетки иммунной системы. Такими молекулами служат антитела, или иммуноглобулины (Ig).
Как устроено антитело
Антитела — это растворимые белки, которые производят В-лимфоциты. У незрелых или покоящихся В-клеток на мембране закреплен предшественник антитела — В-клеточный рецептор, посредством которого В-клетка определяет присутствие антигена. И антитела, и В-клеточные рецепторы построены по одному принципу (рис. 3). Это белки, которые состоят из четырех аминокислотных последовательностей (цепей): двух тяжелых (H-цепи) и двух легких (L-цепи), прочно соединенных дисульфидными связями попарно и между парами. Два конца тяжелых цепей образуют константную часть; она не создает разнообразия и бывает всего нескольких типов. Антитела с одинаковой константной частью составляют один изотип или класс. Самые распространенные изотипы: IgG, IgM, IgD, IgA и IgE. Константная часть определяет, как антитело будет взаимодействовать с клетками или другими антителами:
- IgM образует пентамеры (пять антител, соединенных константными частями); может уловить сразу несколько одинаковых молекул антигена и нейтрализовать их, поэтому его больше всего на ранних стадиях иммунного ответа;
- IgG не образует пентамеров; он производится на поздних стадиях иммунного ответа, обладает бóльшей специфичностью к антигену и активирует другие иммунные клетки;
- IgD — его функция до сих пор не до конца ясна; он входит в состав В-клеточного рецептора;
- IgA преобладает в слизистых оболочках, иногда образует димеры (два соединенных антитела);
- IgE активирует клетки в стенках сосудов, вызывая отеки; его обычно упоминают в связи с аллергическими реакциями.
С другого конца антител находится вариабельная часть, обеспечивающая их разнообразие. Концы легких и тяжелых цепей образуют две одинаковые ямки — антигенсвязывающие участки. Антитела, несущие одинаковые вариабельные части, составляют один идиотип (и могут связывать один и тот же антиген). Антитела разных идиотипов связывают разные антигены благодаря различию в форме и зарядах антигенсвязывающих участков. Можно представить себе антитело как туфельку, которая должна найти свою Золушку. Собственно отверстие туфельки — это антигенсвязывающий участок, куда помещается нога (антиген) претендентки, а константная часть — каблук, за который ее может ухватить принц (иммунная клетка).

Рисунок 3. Строение и типы антител. 1. Схема строения антитела. Две тяжелые цепи находятся внутри молекулы, две легкие — снаружи. Все они сшиты друг с другом дисульфидными мостиками (S-S). 2. Изотипы антител. Они определяются типом константной части. Некоторые изотипы могут образовывать димеры (IgA) и пентамеры (IgM) с помощью соединительной цепи (joining chain).
иллюстрация Елены Беловой по материалам Университета Остина Пии и сайта NextDoorLab
Антитела производят В-лимфоциты (или В-клетки). Каждый В-лимфоцит синтезирует свой идиотип антитела. Всего в нашем организме существует около миллиона типов В-клеток. У каждого человека этот миллион немного разный: это зависит не только от отличий в генах иммуноглобулинов, но и от того, как антитело формируется и какие антитела отбирает для себя организм (подробнее об этом можно прочитать в статье «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [6]). Откуда берется такое разнообразие антител, учитывая, что ДНК во всех клетках организма изначально одинаковая, а генов иммуноглобулинов — ограниченное количество?
Как добиться разнообразия
В геноме человека содержится несколько кластеров генов, кодирующих иммуноглобулины, — по одному кластеру для каждой цепи (тяжелой и легкой). Цепи состоят из следующих частей: константная (неизменная), вариабельная (V — variable) и связывающая их (J — joining). В тяжелой цепи между участками V и J есть дополнительная, «разнообразная» часть (D — diversity). Кластер генов содержит множество сегментов — вариантов V, D и J-частей. Из них каждая молодая В-клетка случайным образом отбирает себе по одному, создавая уникальную последовательность антигенсвязывающих участков. Этот процесс называют рекомбинацией генов иммуноглобулинов, или V(D)J-рекомбинацией (рис. 4).
Происходит это следующим образом. Все сегменты окружены специальными сигнальными последовательностями нуклеотидов (recombination signal sequences, RSS). Между каждыми двумя V-сегментами расположен набор из 7, 23 и 9 нуклеотидов. Между каждыми двумя J-сегментами — из 9, 12 и 7. Рекомбинация происходит с участием ферментов RAG: они связываются случайным образом с одной из RSS между V-сегментами и с другой — между J-сегментами. Последовательности из 7 и 9 нуклеотидов комплементарны друг другу, поэтому образуется шпилька, в середине которой — все промежуточные, ненужные V- и J-сегменты. Ферменты катализируют образование разрывов в ДНК, вырезая шпильку. При этом два сегмента до и после шпильки соединяются. Таким образом, клетка отрезает «ненужные» части от своей ДНК, оставляя последовательность иммуноглобулина из константной части и по одному V-, D- (в тяжелой цепи) и J-сегменту. Это первый этап, на котором возникает разнообразие. Учитывая, что V- и J-сегментов содержится в геноме по нескольку десятков (а в тяжелой цепи добавляется еще и около десяти D-сегментов), в результате рекомбинации можно образовать тысячи вариантов цепей.
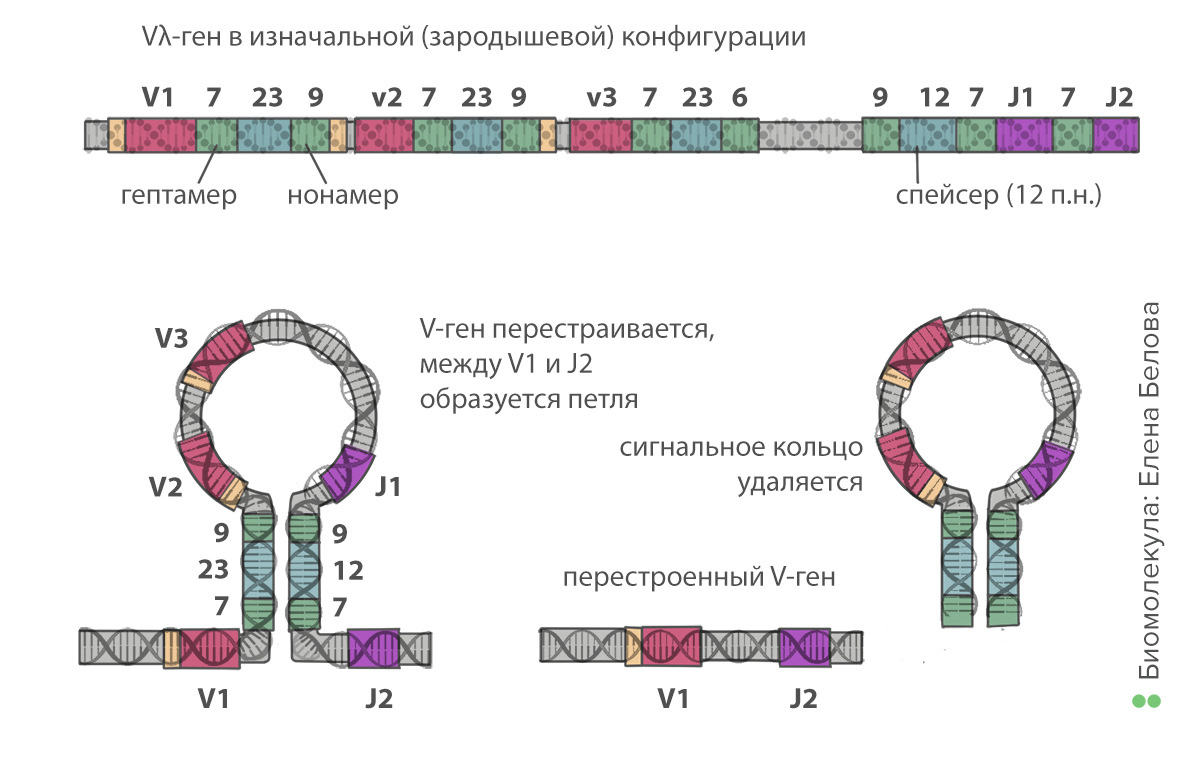
Рисунок 4. Рекомбинация генов иммуноглобулинов, первый этап. Сегменты в каждой группе обозначены цифрами — V1, V2, V3, J1, J2 и так далее. Нонамер (9 нуклеотидов) и гептамер (7 нуклеотидов) — сигнальные последовательности нуклеотидов, комплементарные друг другу. Их связывание друг с другом позволяет образовать кольцо. Таким образом остаются соединены только один из V- и один из J-сегментов.
иллюстрация Елены Беловой по книге Ярилина А.А. Иммунология («ГЭОТАР-Медиа», 2010)
Второй этап — «неаккуратное» разрезание цепей. Когда ферменты вырезают лишние сегменты, они режут цепи ДНК в случайных местах и неравномерно. Поэтому между сегментами оказывается случайное количество нуклеотидов. Наконец, третий этап — встраивание «лишних» нуклеотидов. Фермент TdT (терминальная дезоксинуклеотидтрансфераза) присоединяет случайные нуклеотиды на конец разрыва. Только после этого сегменты соединяются друг с другом. В результате этих случайных перестроек возможное количество антител достигает 1012—1017.
В-клетка может переключаться с одного изотипа антитела на другой, меняя его константную часть. Происходит это с помощью механизма, похожего на рекомбинацию. Гены, кодирующие константную часть, расположены друг за другом (M, D, G, A, E) и разделены S-последовательностями (от switch — переключение). Следовательно, можно соединить две S-последовательности с образованием шпильки и вырезать то, что между ними. Таким образом, переключение изотипов оказывается необратимым: если один раз вырезать участок, кодирующий, например, константную цепь типа G, вернуть его обратно не получится.
У развивающейся В-клетки иммуноглобулин изначально относится к классу М и прикреплен к мембране в составе B-клеточного рецептора (BCR). Этот рецептор нужен, чтобы сортировать В-клетки и избирательно активировать только те, чье антитело подходит для борьбы с конкретным патогеном. Только после активации клетка начинает производить антитело и выбрасывать его в окружающую среду. Таким образом, каждая В-клетка может производить и антитела, и В-клеточные рецепторы одинаковой специфичности. Это две молекулы, очень похожие по строению, но разные по функциям, которые не стоит путать. Кроме того, в организме человека есть и еще одна молекула, похожая по строению на антитело — Т-клеточный рецептор. Она находится на поверхности Т-лимфоцитов и тоже нужна для распознавания антигена. Но это уже совсем другая история — о взаимодействии Т-лимфоцитов с клетками организма [7].
Как работает антитело
Допустим, перед нами уже активированная В-клетка, которая производит и выделяет антитела. Куда им отправиться на поиски антигена? Здесь возможно несколько вариантов.
Растворимые антигены можно встретить свободно плавающими в крови. Это могут быть частички покровов патогена, продукты его обмена веществ или испорченные белки собственного организма — например, мутировавшие, как в случае раковых клеток, или неправильно свернутые. Последствия встречи антитела с растворимым антигеном могут быть разными.
- Антитело может заблокировать антиген. Например, если это какой-нибудь токсин, антитело может связаться с его активным центром и помешать ему наносить повреждения организму. Это происходит с токсинами возбудителей разных заболеваний — дифтерии, ботулизма, столбняка.
- Комплекс антиген—антитело (иммунный комплекс) запускает работу системы комплемента. Это группа белков, которая вступает в каскад реакций с образованием сигнальных молекул. А они, в свою очередь, расширяют сосуды и привлекают лейкоциты. Поэтому там, где антитело «поймало» антиген, могут развиться отек и воспаление. Если же иммунный комплекс окажется на клетке, то белки комплемента продырявят ее мембрану. Когда комплексов антитело—антиген в организме много, и они плохо выводятся почками, возникает болезнь иммунных комплексов — они скапливаются в мелких сосудах (например, в коже) и вызывают локальные очаги воспаления.
- Антитело работает как «черная метка»: большинство клеток иммунной системы умеют узнавать константные части антител. При этом некоторые клетки захватывают (фагоцитируют) иммунные комплексы, а другие — выделяют провоспалительные вещества, привлекая и активируя еще больше клеток. Научное название для такой черной метки — опсонин. Он может подавать сигнал и обычным клеткам. Например, если антитело налипнет на вирусную частицу, а потом эта частица проникнет внутрь клетки организма, внутриклеточные рецепторы распознáют метку. Такая частица будет переварена, и заражения клетки, возможно, удастся избежать.
Поверхностные антигены ждут антитела на мембранах клеток. Это могут быть клетки бактерий или собственные клетки человека, например, пораженные вирусом. В случае бактерий антитела тоже могут блокировать работу антигена (например, если прилипнут к белкам бактериального жгутика, — тогда бактерия не сможет передвигаться) или служить опсонином. На антитело, связанное с клеткой, снова реагирует комплемент — в результате каскада реакций в мембране образуются сквозные каналы, и клетку буквально превращают в решето. Кроме того, «черная метка» служит сигналом для иммунных клеток, запуская фагоцитоз или выделение токсичных веществ (рис. 5) [8].
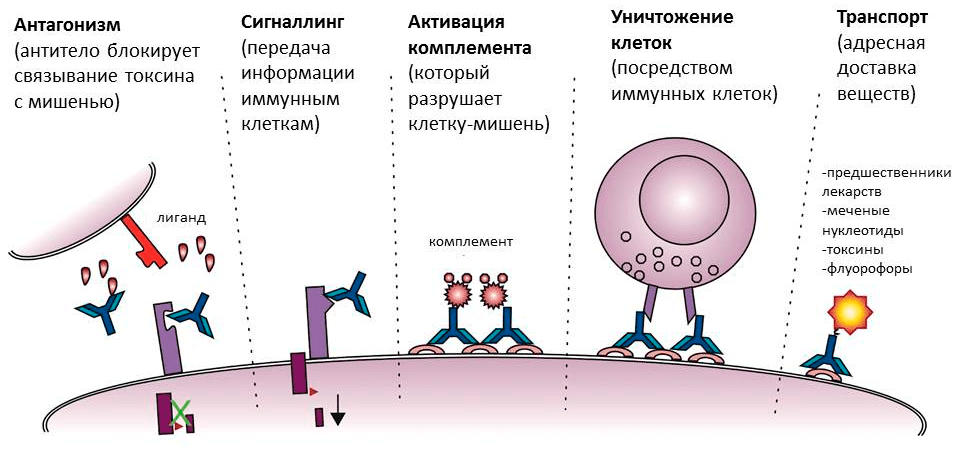
Рисунок 5. Разнообразие функций антител. Помимо прямой — связывания с мишенью, — антитела обладают также набором других функций. Они активируют комплемент и иммунные клетки, направляя их действие на мишень, а в медицине и молекулярной биологии могут использоваться как специфические транспортеры веществ.
Жизнь антител в организме
Теперь соберем весь пазл вместе. Проследим за жизнью В-лимфоцитов и их антител с самого начала. Молодые В-клетки развиваются в красном костном мозге. Там, под действием окружающих клеток соединительной ткани, каждой В-клетке предстоит сформировать свое собственное антитело.
Как мы уже писали выше, В-клетки умеют создавать множество уникальных генов иммуноглобулинов. Но не все эти гены будут рабочими — где-то возникнут поломки из-за многочисленных разрезов и перестроек, где-то итоговый белок не сможет принять правильную структуру. Следующая веха в жизни В-клетки — проверка профпригодности антител. Сначала В-клетка перестраивает ген тяжелой цепи на одной из двух хромосом. Потом синтезирует соответствующие белковые цепи, собирает из них псевдоантитело (вместо легких цепей в нем суррогатные цепи) и выставляет его на мембрану. Если все прошло успешно, то антитело с поверхности клетки посылает сигнал, блокирующий дальнейшую перестройку тяжелой цепи и программу апоптоза — механизма клеточного самоубийства, при котором клетка расщепляет себя изнутри. Если псевдоантитело по каким-то причинам собрать не удалось, запускается перестройка генов на второй хромосоме. Если и со второй попытки не удается сделать рабочую цепь, включается программа апоптоза, и клетка гибнет. Если же тяжелая цепь собрана правильно, у клетки есть две попытки сформировать работающую легкую цепь. Как только иммуноглобулин полностью собран, он появляется на мембране В-лимфоцита, и перестройка генов заканчивается. Теперь у клетки появилось свое уникальное антитело и своя специфичность.
После того, как В-лимфоцит собрал свое антитело, он проходит через строгий отбор (селекцию). Цель его — уничтожить клетки, которые реагируют на собственные антигены организма и могут вызвать аутоиммунную реакцию. А таких среди молодых В-лимфоцитов до 75%! Селекция устроена следующим образом: вокруг В-клеток в красном костном мозге сидят поддерживающие клетки, каждая из которых «показывает» В-клеточному рецептору свои антигены. Каждое связывание В-клеточного рецептора с антигеном посылает в клетку сигнал, стимулирующий апоптоз. В то же время, на поверхности В-клеток есть рецепторы к белкам BAFF и APRIL, которые тоже находятся на поддерживающих клетках. Через рецепторы к BAFF и APRIL поступает сигнал, запрещающий апоптоз. Но этих рецепторов довольно мало. Поэтому, если В-клетка хорошо связывает антигены на окружающих клетках, то проапоптотических сигналов становится больше, чем противоапоптотических, и клетка погибает. А если она связывает антигены плохо или не связывает вообще, то сигналов от BAFF и APRIL рецепторов достаточно для ее выживания. При условии, что селекция работает нормально, из всего разнообразия В-клеток и их антител выживают только те, которые узнают что-то, отличное от собственных молекул организма (рис. 7).
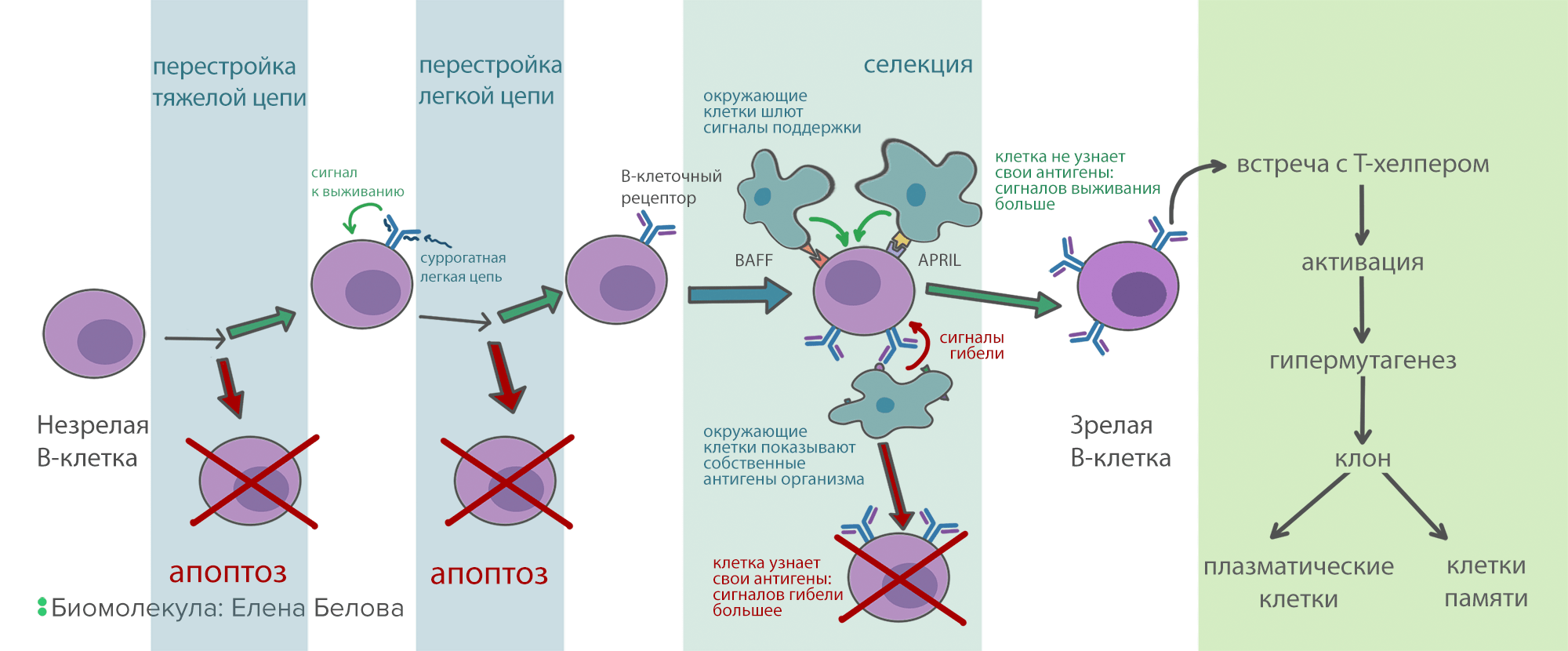
Рисунок 7. Схема развития В-клеток. Прежде чем зрелая В-клетка будет готова синтезировать антитела, она проходит многоэтапную селекцию. Это нужно, чтобы отсеять нерабочие и опасные для организма варианты антител.
иллюстрация Елены Беловой
Молодая В-клетка плавает с током крови по организму до тех пор, пока не встретит свой антиген. В-клеточный рецептор (BCR) связывается с антигеном, но этого недостаточно для активации. Нужно, чтобы иммунная система официально подтвердила — да, этот антиген действительно опасен. Поэтому В-клетка поглощает комплекс ВCR—антиген, разрезает антиген на части и выставляет их на поверхность в составе комплекса МНС-II. Тем самым она сигнализирует о том, что может создать антитело к вот такому антигену.
В это же время по организму путешествуют Т-хелперные лимфоциты, клетки-помощники. У них есть Т-клеточный рецептор, тоже специфичный к конкретному антигену. Для выполнения своих функций Т-хелперам надо активироваться. Это происходит при встрече с антигенпрезентирующей клеткой, несущей в составе MHC-II антиген, подходящий к Т-клеточному рецептору. Антигенпрезентирующими клетками могут быть как «профессионалы» (дендритные клетки), так и сами В-клетки. Проконтактировав с ними, Т-хелпер получает сигнал тревоги и активируется. Теперь он «знает», что в организме есть такой антиген, и способен активировать В-клетку, если они встретятся. Почему Т-хелпер не может сразу в ответ активировать В-лимфоцит, если он сам выступает в роли антигенпрезентирующей клетки? Контакт с антигенпрезентирующей клеткой протекает очень быстро, а Т-хелперу требуется время, чтобы синтезировать необходимые для активации вещества, поэтому он просто не успевает это сделать и уходит в поисках других подходящих В-клеток. Долгожданная встреча обычно происходит в лимфатических узлах или более крупных лимфоидных органах — красном костном мозге и селезенке. В-клетка показывает с помощью МНС-II антиген, который она способна узнать. Т-хелпер связывается с этим антигеном, «подтверждая», что это тот самый опасный антиген, который уже встречался в организме, и активирует В-клетку (рис. 8) [10].
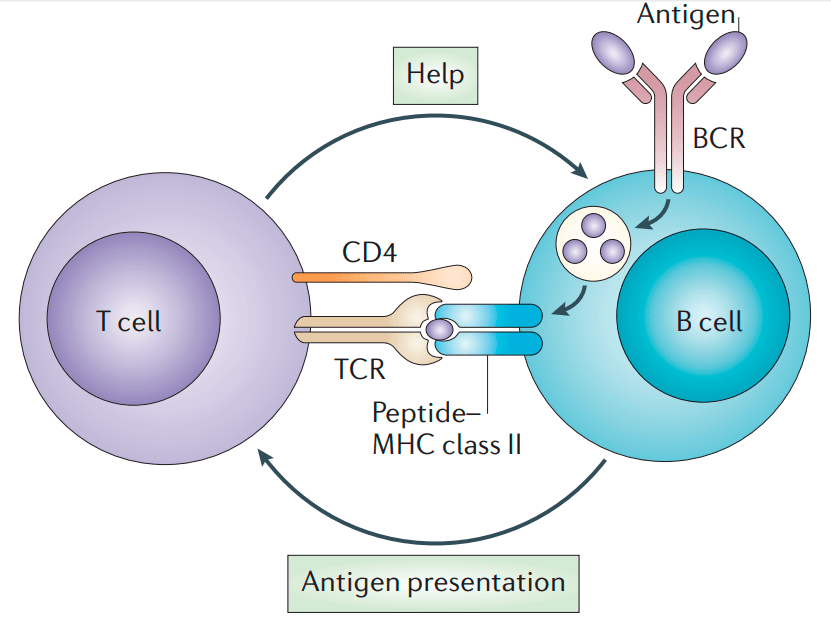
Рисунок 8. Схема встречи В-клетки и активированного Т-хелпера. В-клетка связывает антиген с помощью рецептора (BCR), поглощает его и выставляет в составе МНС-II. Активированный Т-хелпер связывается с МНС с помощью молекулы CD4 и узнаёт антиген своим Т-клеточным рецептором (TCR). Затем Т-хелпер выделяет интерлейкины (IL2/4/5), которые связываются с соответствующими рецепторами (ILR) на В-клетке и активируют ее.
Затем происходит процесс усовершенствования антител — соматический гипермутагенез. В-лимфоцит делится, образуя клон — группу клеток, производящих одинаковые антитела. Клетки клона получают шанс сделать антитело, которое еще лучше связывается с их антигеном, чем предыдущая его версия. При этом клетки случайным образом заменяют нуклеотиды в вариабельных частях гена иммуноглобулина, создавая разнообразные вариации на тему исходного антитела, точнее, его антигенсвязывающей части. Те из них, которые будут распознавать антиген лучше всего, получат сигнал к делению, и образуют окончательный В-клеточный клон. Все клетки клона способны производить один и тот же идиотип (с одинаковой вариабельной частью), но могут переключаться между изотипами (изменять константные части) в зависимости от условий. Большинство из клеток клона превращаются в плазматические клетки. Они перестают производить В-клеточный рецептор и начинают выделять полноценные растворимые антитела. Антитела попадают в кровь, разносятся по организму и связываются с антигеном. Где-то они просто его обезвреживают и в составе иммунных комплексов выводятся из организма. Где-то они работают опсонинами («черными метками») и активируют другие клетки иммунной системы.
После успешного иммунного ответа польза антител для организма не заканчивается. Часть клеток клона становится клетками памяти, они не участвуют в первичном иммунном ответе. Зато при повторной встрече с антигеном они помогут развить вторичный иммунный ответ. Им уже не понадобится искать «своего» Т-хелпера: при первой же встрече с антигеном они начинают производить антитела. Поэтому вторичный иммунный ответ развивается быстрее первичного и работает эффективнее. На этом основан эффект вакцинации — мы знакомим организм с новыми антигенами. Их можно вводить в составе убитого или ослабленного возбудителя заболевания или в виде отдельных молекул. Но принцип остается одним — мы вводим в организм антиген, он запускает иммунный ответ. Первичный ответ, как правило, будет слабым, так как антигена немного и он не вредит организму, но при этом формируется пул клеток памяти. И если через какое-то время приходится иметь дело с настоящим живым патогеном, то развивается вторичный ответ.
На измерении количества (титра) антител в крови основана диагностика многих заболеваний. Например, если мы хотим выяснить, есть ли в организме человека какая-нибудь бактерия, можно проверить кровь на антитела к ее ключевым антигенам. По количеству и типу антител мы можем сказать, насколько тяжело протекает заболевание и давно ли оно началось (в первичном ответе сначала участвуют IgM, потом IgG, во вторичном — в основном IgG, и их гораздо больше).
Какие еще бывают антитела
Можно представить себе антитело как конструктор: изменяя отдельные части молекулы, мы можем влиять на ее функцию. Изменится вариабельная часть — она станет специфична к другому антигену, изменится константная — ее станут узнавать другие иммунные клетки, и она сможет работать в других условиях (например, IgA — в слизистой оболочке). Этот принцип работает у всех позвоночных животных [11], и некоторые из них даже разработали полезные дополнения к этому конструктору, которые стоит взять на заметку [12].
У птиц репертуар антител менее разнообразен, чем у нас. В частности, у них нет отдельно взятых антител класса G и Е, зато есть промежуточный класс, сочетающий свойства и тех и других — IgY (Y — от yolk, «желток», поскольку этих антител много в яичном желтке). Молекулы IgY чуть тяжелее, чем наши IgG, и более жесткие. Зато их константную часть могут распознавать рецепторы и к IgG, и к IgЕ [13]. Если мы научимся создавать вакцины на основе куриных антител, то они будут лучше стимулировать иммунный ответ. И использовать их будет просто: берем курицу, заражаем ее каким-то патогеном (или просто его антигеном), а она откладывает нам яйца, богатые IgY, специфичным к этому патогену. Этот метод предполагают использовать для лечения разных воспалительных процессов, в том числе бактериальных инфекций. На данный момент он проходит клинические испытания, но конкретные препараты пока не разработаны.
Коровы пошли по пути удлинения антител. В их желудке обнаружены иммуноглобулины М со своеобразной «ручкой» — дополнительным отделом вариабельной части. Каждая «ручка» специфична к своему вирусному антигену. Полагают, что это уникальное изобретение жвачных для защиты пищеварительной системы. В их желудке пища задерживается надолго для переваривания желудочной микрофлорой. И для защиты этой микрофлоры от патогенов сформировались антитела с ручкой, которые могут дотянуться до эпитопов, спрятанных глубоко внутри молекулы антигена. Можно предположить, что, пришивая такую ручку к нашим иммуноглобулинам, мы сможем повысить их разнообразие, и они начнут связываться с эпитопами, до которых раньше не доставали. Но это пока теоретические размышления, до практических применений должно пройти еще немало времени.
А вот верблюды, сумчатые млекопитающие и хрящевые рыбы используют обратную стратегию — уменьшение антител (рис. 9). Среди их иммуноглобулинов есть фракция молекул, лишенных легких цепей, — их назвали HCAb (heavy chain antibody). Антигенсвязывающий участок у них образован только тяжелой цепью. Это легкое антитело оказалось очень выгодным, не зря оно появлялось в эволюции позвоночных несколько раз независимо. С одной стороны, оно легче, поэтому лучше путешествует по организму и выводится почками. С другой стороны, антигенсвязывающий участок меньше, поэтому может проникать, например, в активные центры ферментов. При этом антитело не только опсонизирует фермент, но и блокирует его работу. Это свойство ученые собираются использовать для борьбы против онкологических заболеваний. Можно от антитела верблюда отрезать константную часть, оставив только вариабельную — получится совсем маленькое нанотело. С помощью него можно, например, избирательно блокировать факторы роста раковых клеток [14], [15].
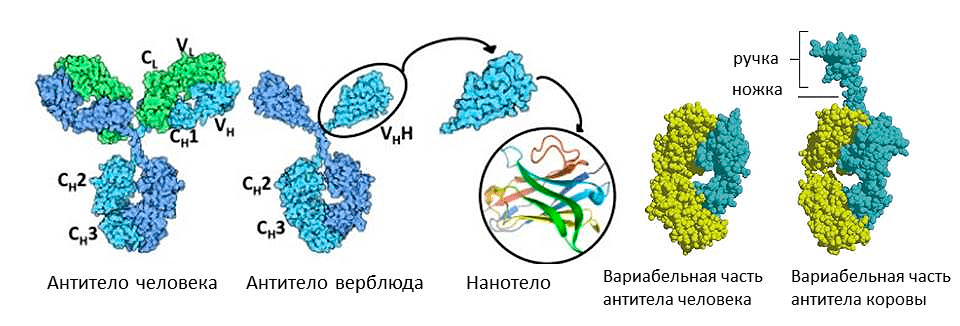
Рисунок 9. Необычные антитела у животных. Иммуноглобулины верблюда состоят из одних лишь тяжелых цепей (слева) а иммуноглобулин коровы несет дополнительную «ручку» на вариабельной цепи (справа).
Что мы можем сделать с антителами
Современные ученые не отстают от наших младших позвоночных братьев и тоже разрабатывают модифицированные антитела. Можно выделить два крупных направления работы с антителами. Первое — молекулярно-биологическое. Коль скоро антитела умеют специфично связываться с антигенами, можно использовать их как метку. Об этом мы подробно рассказывали в статье, посвященной иммунологическим методам [16]. Например, можно пришить к антителам светящиеся метки и окрашивать ими гистологические препараты: там, где мы увидим свечение, находится интересующее нас вещество.
Второе направление — медицинское [1]. С помощью антител можно не только иммунизировать человека, но и адресно доставлять в его организм вещества. Например, можно взять антитело, специфичное к белку опухоли, и пришить к нему (конъюгировать) токсичное вещество. Таким образом лекарство будет избирательно накапливаться в опухоли.
Антитела, безусловно, являются очень многообещающим конструктором. Однако для того, чтобы их широко применять, нужно научиться их производить в больших количествах. А для того чтобы ими лечить — убедиться в специфичности их действия и отсутствии побочных эффектов. О том, как лаборатории справляются с разработкой и производством антител, читайте в следующих статьях нашего цикла.
Литература
- Краткая история открытия и применения антител;
- Иммунитет: борьба с чужими и… своими;
- Иммунологическая Нобелевская премия (2011);
- Landsteiner K. The specificity of serological reactions. Courier Corporation, 1990. — 348 p.;
- Nanette B. Silverberg, Jonah Licht, Suzanne Friedler, Shika Sethi, Teresita A. Laude. (2002). Nickel Contact Hypersensitivity in Children. Pediatr Dermatol. 19, 110-113;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Т-лимфоциты: путешественники и домоседы;
- Andreas Lutterotti, Roland Martin. (2008). Getting specific: monoclonal antibodies in multiple sclerosis. The Lancet Neurology. 7, 538-547;
- Koichi S. Kobayashi, Peter J. van den Elsen. (2012). NLRC5: a key regulator of MHC class I-dependent immune responses. Nat Rev Immunol. 12, 813-820;
- Jonathan C. W. Edwards, Geraldine Cambridge. (2006). B-cell targeting in rheumatoid arthritis and other autoimmune diseases. Nat Rev Immunol. 6, 394-403;
- Martin F. Flajnik. (2018). A cold-blooded view of adaptive immunity. Nat Rev Immunol. 18, 438-453;
- Необычные животные: иммунологические сказки;
- Edzard Spillner, Ingke Braren, Kerstin Greunke, Henning Seismann, Simon Blank, Dion du Plessis. (2012). Avian IgY antibodies and their recombinant equivalents in research, diagnostics and therapy. Biologicals. 40, 313-322;
- Melissa L Vadnais, Vaughn V Smider. (2016). Bos taurus ultralong CDR H3 antibodies. Current Opinion in Structural Biology. 38, 62-67;
- От рака вылечит... верблюд!;
- 12 методов в картинках: иммунологические технологии.