Akkermansia muciniphila — мал золотник, да дорог
14 ноября 2018
Akkermansia muciniphila — мал золотник, да дорог
- 17719
- 0
- 7
Akkermansia muciniphila: «Почему нас не замечают?»
Darmbacterie Akkermansia remt obesitas, рисунок с изменениями
-
Авторы
-
Редакторы
Статья на конкурс «био/мол/текст»: Привет, читатель! Ты наверняка понял, о чём пойдет речь, едва завидев название и биноминальную номенклатуру в нём. Бинго! О микробах. Бессмысленно отрицать, что эти одноклеточные организмы — неотъемлемая часть нас самих: существовать изолированно от них мы не можем. При этом каждый, даже самый маленький организм, вносит свой весомый вклад в функционирование общей биосистемы человека и животных. И сегодня мы поговорим о том, насколько же важна для нормальной жизнедеятельности нашего организма такая на первый взгляд неприметная бактерия, как Akkermansia muciniphila.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Для тебя не секрет, что в организме взрослого человека в среднем содержится 1,5 кг микроорганизмов. Причем их клеток в твоем организме в несколько раз больше, чем человеческих: по некоторым оценкам — на целый порядок. В одном только кишечнике ты носишь 1014 сожителей, и большинство из них — бактерии [1]. Если мать-природа дала прокариотам такое пристанище, очевидно, сделала она это неспроста. Пищеварительная система стала домом более чем для 1000 видов бактерий. Причем многие из них доблестно сражаются на поле битвы за твой иммунитет [2]. «Вместе мы — сила», — звучит из уст каждой, и слаженная работа твоих бактерий превращается в мощное оборонительное оружие под названием колонизационная резистентность.
Несмотря на всё разнообразие микроорганизмов, пренебрегать ни одним из них не стόит. Очень ярким примером, о котором не слышал только ленивый, может служить Helicobacter pylori. Значимость этого нашего микроскопического соседа недооценивалась в течение ста лет, а ведь его теперь считают главным этиологическим агентом некоторых заболеваний ЖКТ, в том числе и опухолевых [3]. Но мы можем учиться на своих ошибках и рассматривать каждого микроба как «зачем-то нужного»: наверняка существуют и другие виды, о которых мы знаем очень мало (примерно как микробиологи начала прошлого века о H. pylori), но роль которых в нашей жизни исключительно велика. Одним из таких видов может быть Akkermansia muciniphila (A. muciniphila), о которой мы с вами и поговорим.
Муцин-деградирующие бактерии: кто они такие и что они едят?
Кишечник человека служит домом для огромного числа разнообразных организмов, объединяемых понятием кишечный микробиом . Согласитесь, было бы странно, если бы дом не имел стен, а бактерии, протисты и прочие его обитатели жили только в просвете органа. И ведь верно: многие из них скапливаются именно в пристеночном слизистом слое. Слизь, или мукус, — это своеобразный суп из высокомолекулярных гликопротеинов, вязкий и приправленный молекулами самого разного назначения. Гликопротеины слизи называют мукопротеинами или муцинами. Белковая их часть представлена доменами, богатыми треонином и серином, простетическая же группа содержит четыре разных сахара: N-ацетилглюкозамин, N-ацетилгалактозамин, галактозу или фукозу (рис. 1). Эти сложные молекулы формируют гелеобразную среду, которая защищает клетки ЖКТ от разнородных агрессоров и в которой микробам вполне уютно: тепло, темно и мухи не кусают.
Прямо на нашем сайте можно прочитать в деталях, что представляет собой кишечный микробиом, как он формируется и как влияет на наше здоровье и даже поведение: «Микробиом кишечника: мир внутри нас» [4], «Зоопарк в моем животе» [5], «Клетчатка на пользу потомкам» [6], «Чего от нас хотят микробы?» [7]. — Ред.
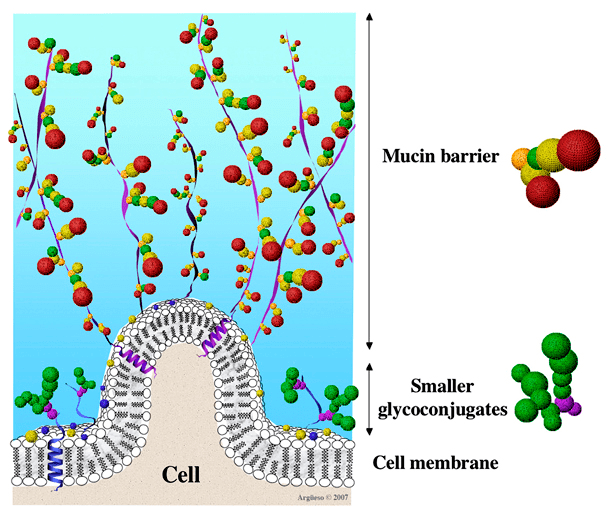
Рисунок 1. Ворсинка кишечника и ее пристеночный муциновый слой. Видно, как волокна полимера радиально устремляются в просвет органа. Их разветвленное строение помогает задерживать непереваренные частички пищи, обеспечивая ростовым субстратом жителей кишечника.
Правда, встречаются и неженки — условно-патогенные бактерии, которые начинают себя отлично чувствовать и вредить кишечнику лишь при сбоях в работе иммунной системы хозяина.
Но есть в ЖКТ и другие неоднозначные постояльцы — муцин-деградирующие бактерии. С одной стороны — и это понятно из их названия, — эти бактерии потихоньку подъедают стены собственного дома (и портят нам защитный барьер). С другой же стороны, их объедки — олиго- и мономеры — служат пищей для тех микроорганизмов, которые сами не могут усваивать крупные молекулы, зато формируют необходимую нам колонизационную резистентность. Кроме того, разложение муцинового слоя стимулирует синтез его компонентов клетками кишечника.
Муцин-деградирующих бактерий в нашем ЖКТ не так уж и много: в самой густонаселенной, толстой, кишке насчитывают всего несколько процентов бактерий, способных своими ферментами одолеть олигосахариды муцинов. В экспериментах in vitro относительно полную деградацию (более 90%) муциновых молекул представители родов Ruminococcus, Bacteroides, Bifidobacterium и Clostridium осуществляли только в смешанном коллективе. Чистые культуры справлялись с подобной задачей менее эффективно, поэтому, вероятно, in vivo деградация муцина представляет собой результат корпоративного труда представителей нескольких видов [8]. К этой же группе обитателей кишечника относится и наша героиня, A. muciniphila. И вот она-то уж точно не сачкует — благодаря богатому набору муколитических ферментов «полный цикл» переработки муцинов осиливает даже в одиночку.
По сиквенсам встречают, по морфологии провожают
Открытие A. muciniphila и обособление ее в отдельную филогенетическую группу произошло в 2004 году благодаря стараниям группы микробиологов из Вагенингенского университета (Нидерланды) [8].
Изучение муцин-деградирующих бактерий началось в конце 90-х годов прошлого века.
Тогда на помощь исследователям пришли молекулярные методы, позволившие наконец заглянуть в микробные экосистемы, где большинство представителей принадлежит к разряду некультивируемых (пока). К таким непознанным мирам относился и кишечный микробиом. Но новые техники, основанные на анализе 16S рРНК, заметно изменили ситуацию.
Упомянутая группа голландских микробиологов, возглавляемая Виллемом де Восом, изучала разнообразие бактерий в человеческих фекалиях с помощью денатурирующего и температурного градиентных электрофорезов (ДГГЭ и ТГГЭ) фрагментов генов 16S рРНК [9]. Однажды коллектив сосредоточил свое внимание на конкретной группе кишечных бактерий — муцин-деградирующей. С помощью особых техник культивирования и ДГГЭ-профилирования 16S рДНК удалось выделить чистую культуру бактерии, которая численно превосходила прочих муциновых деструкторов в фекалиях и быстрее всех росла в муциновой среде [8].
Далее нужно было узнать, что представляет собой этот штамм-чемпион, предварительно названный MucT: знаком ли он уже биологам или это темная лошадка? Если последнее, то кому он приходится родственником? Секвенирование 16S рДНК MucT показало, что из всех описанных бактерий ему наиболее близка Verrucomicrobium spinosum. На построенном по последовательностям 16S рДНК филогенетическом древе MucT образовал собственную ветвь в типе Verrucomicrobia (рис. 2). Стало ясно, что новый штамм следует выделить не только в отдельный вид, но и в отдельный новый род в пределах порядка Verrucomicrobiales. Для этого, как полагается, описали все его морфологические, физиологические и культуральные характеристики, ну и конечно, дали имя. Родовое название — Akkermansia — бактерия получила в честь голландского микробиолога Антона Аккерманса (ориг. Antoon Akkermans). Ну а видовое — muciniphila — согласно пищевым пристрастиям.

Рисунок 2. Филогенетическое дерево, иллюстрирующее положение муцинового деструктора A. muciniphila (штамм MucT) в типе Verrucomicrobia. Цифрами 1–5 обозначены основные филогенетические линии в пределах типа. Ближайшие родственники MucT — некультивируемые кишечные клоны HuCA18, HuCC13 и L10-6 (99% идентичности), дальние — представители родов Verrucomicrobium (92% подобия с V. spinosum) и Prosthecobacter.
Муцин может служить для этой бактерии единственным источником углерода, азота и энергии, в дополнительных витаминах она тоже не нуждается. (Кстати, продукты переработки муцинов — короткоцепочечные жирные кислоты (SCFA) — известны благотворным влиянием на клетки кишечника и иммунитет.) В муциновой среде клетки A. muciniphila, видимо, склонны группироваться и образовывать капсулу. Как и родственные Verrucomicrobium и Prosthecobacter, Akkermansia грамотрицательна и неподвижна, но имеет овальную, а не веретеновидную форму клетки (рис. 3), и терпит кислород только в наномолярных концентрациях.
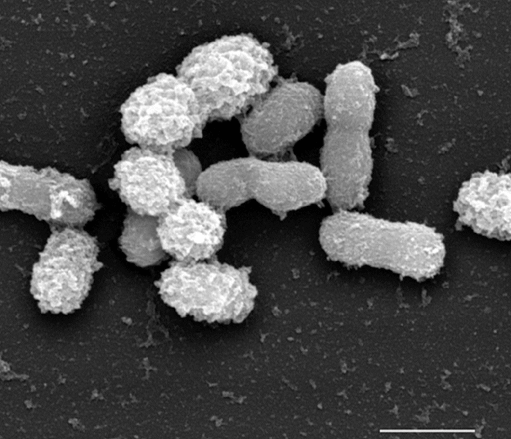
Рисунок 3. Сканирующая электронная микроскопия A. muciniphila
Позже выяснилось, что помимо A. muciniphila в кишечнике человека обитает еще как минимум восемь видов рода Akkermansia. Более того, аккермансии и близкородственные бактерии встречаются не только у человека, но и многих других представителей животного мира [10].
Маленькие мыши творят большие дела
Аккермансия оказалась первопроходцем: это первая бактерия из отдела Verrucomicrobia, которую обнаружили в кишечнике и первая бактерия, которую признали эффективным деструктором муцина в монокультуре [8]. При этом мало кто представлял, зачем кому-то в кишечнике перерабатывать муцин. Однако спустя шесть лет после открытия этой бактерии интерес к ней возрос с невероятной силой.
Определить, что A. muciniphila больше всего по душе толстая кишка, оказалось не проблемой (рис. 4). Зато возникла другая. Датчане, финны, китайцы — все наперегонки исследовали аккермансию, причем всем почему-то хотелось установить корреляцию ее количества в ЖКТ с возрастом человека [11]. Правда, результаты выходили странными: кто-то говорил, что A. muciniphila преобладает у детей, кто-то утверждал, что ее количество увеличивается с возрастом, а кто-то — что больше всего ее у молодых людей.
И лишь любимые мыши смогли приоткрыть завесу тайны. В ходе «мышиных» экспериментов динамику численности аккермансии связали с целым рядом важных метаболических и воспалительных показателей [12], [13]. Например, количество этой бактерии негативно коррелирует у ожиревших мышей с уровнем лептина: когда много A. muciniphila в кишечнике, тогда меньше лептина в крови (при ожирении его слишком много) и ниже риск развития лептинорезистентности (когда невозможно насытиться даже при избытке калорий). Более того, удалось установить связь представленности этой бактерии в кишечном микробиоме с несколькими серьезными патологиями. В частности, сниженное количество аккермансий в просвете ЖКТ ассоциировали с развитием воспалительных заболеваний кишечника (ВЗК), сахарного диабета II типа и рака толстой кишки. Давайте поговорим об этом подробнее.
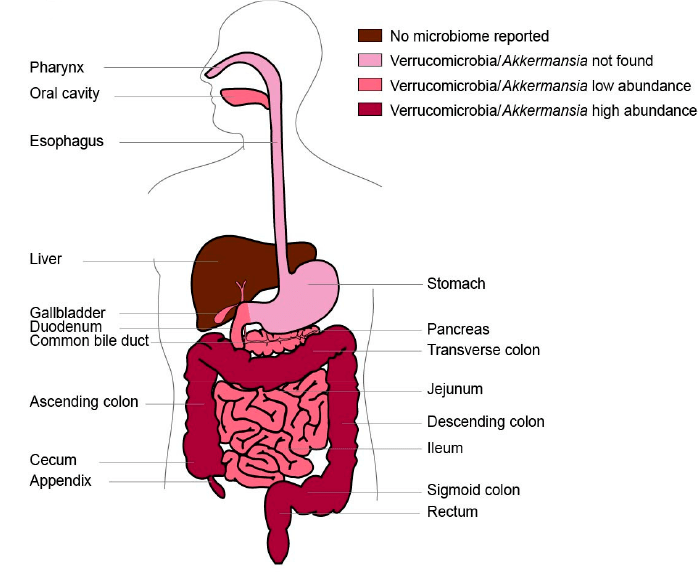
Рисунок 4. Распределение бактерий Verrucomicrobia/Akkermansia в ЖКТ человека. Печень, в отличие от желчных протоков и камней в них, лишена микробиоты. ДНК аккермансии и ее родственников не находят в пищеводе и желудке; в других отделах ЖКТ она встречается в разных количествах: чем насыщеннее цвет на рисунке, тем больше бактерий. В поджелудочную железу Verrucomicrobia попадают лишь в патологических условиях. Зато в норме часто встречаются в грудном молоке.
С любимыми не расставайтесь
A. muciniphila впервые связали с воспалительными заболеваниями кишечника в 2010 году, когда ученые из Университета Квинсленда (Австралия) представили в Nature результаты анализа муколитических бактерий у пациентов с ВЗК — болезнью Крона и язвенным колитом. Ученые с помощью ПЦР в реальном времени исследовали динамику численности пяти видов муколитических бактерий, среди которых была и наша любимая аккермансия: Ruminococcus gnavus, R. torques, Bacteroides vulgatus, Bifidobacterium bifidum, A. muciniphila. В невоспаленных участках кишки больных ВЗК численность муколитических бактерий была гораздо выше, чем у здоровых участников эксперимента («контролей»). Особенно сильно при ВЗК росло количество руминококков. И только численность A. muciniphila, наоборот, в разы снижалась — это при том, что в контрольной группе аккермансия была преобладающим муколитиком. Исследование обнажило сложные взаимоотношения в муколитическом сообществе кишечника и возможную регуляторную роль в них аккермансии. Кроме того, появился повод оценить возможные защитные и противовоспалительные свойства этой бактерии [14–16].
В 2016 году было показано, что численность аккермансии снижается даже на фоне слабого воспаления в кишечнике, еще не проявляющегося характерными симптомами. Эту корреляцию можно использовать в диагностике ВЗК и даже сахарного диабета II типа на доклиническом этапе [17].
Подобную негативную корреляцию численности аккермансии выявили и с интенсивностью аппендицита [16].
Без бактерий можно... ожиреть?
Раз уж интерес к A. muciniphila возрос, то и открытий стало многим больше [11]. В 2012 году ее отсутствие в кишечном микробиоме связали с развитием ожирения у детей, а впоследствии и у взрослых. Открытие ознаменовалось появлением статьи с говорящим названием (помните, как фамилии у Н.В. Гоголя в «Мертвых душах»?) — «Ожирение» (Obesity) [18]. Правда, другие данные такую связь совершенно не подтверждали [15].
Два года ученые метались, пока крупное европейское исследование не поставило точку в этом вопросе: A. muciniphila — бактерия «здоровая». Иными словами, чем ее в кишечнике больше, тем для здоровья лучше. У страдающих ожирением ее связывают с лучшими метаболическим статусом и клиническим прогнозом при переходе на низкокалорийное питание: более низкими уровнями глюкозы и триглицеридов в крови, меньшим диаметром адипоцитов, быстрым восстановлением чувствительности к инсулину [19].
A. muciniphila считается противовоспалительным агентом и ассоциируется с противовоспалительным цитокиновым профилем. Ее недостаток связан с гипертрофией адипоцитов, а такие клетки склонны выделять больше провоспалительных цитокинов. В дальнейшем адипоциты, как и другие клетки, приобретают инсулинорезитентность — так развивается сахарный диабет II типа [17–21].
И последняя вещь, которую стоит здесь отметить: в организме спортсменов намного больше A. muciniphila, чем у нетренирующихся людей [22], [23]. А значит, чем больше бактерий, тем стройнее фигура!
А что же дальше?
А дальше всё просто — исследовать! Сюда, дорогой читатель, тебя завело твое любопытство, тяга к познанию чего-то нового и неизвестного. И мы сегодня слегка приоткрыли завесу тайны, которая до сих пор покрывает A. muciniphila. А ведь сколько пользы еще только предстоит извлечь из знакомства с аккермансией… Особое внимание сейчас уделяют изучению роли этой бактерии в предотвращении онкологических заболеваний и модуляции эффективности терапии опухолей [24]. А еще на основе веществ, которые производит аккермансия, ученые пытаются разрабатывать пребиотики [25]. И возможно, именно ты в следующей статье окажешься одним из процитированных авторов.
Литература
- Gillian M. Barlow, Allen Yu, Ruchi Mathur. (2015). Role of the Gut Microbiome in Obesity and Diabetes Mellitus. Nutr Clin Pract. 30, 787-797;
- Иммуностимулирующие филаментные бактерии: наконец-то они приручены!;
- Osama Siddique, Anais Ovalle, Ayesha S. Siddique, Steven F. Moss. (2018). Helicobacter pylori Infection: An Update for the Internist in the Age of Increasing Global Antibiotic Resistance. The American Journal of Medicine. 131, 473-479;
- Микробиом кишечника: мир внутри нас;
- Зоопарк в моем животе;
- Клетчатка на пользу потомкам;
- Чего от нас хотят микробы?;
- M. Derrien. (2004). Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. INTERNATIONAL JOURNAL OF SYSTEMATIC AND EVOLUTIONARY MICROBIOLOGY. 54, 1469-1476;
- Zoetendal E.G., Akkermans A.D., De Vos W.M. (1998). Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria. Appl. Environ. Microbiol. 64 (10), 3854–3859;
- Clara Belzer, Willem M de Vos. (2012). Microbes inside—from diversity to function: the case of Akkermansia. ISME J. 6, 1449-1458;
- Sharon Geerlings, Ioannis Kostopoulos, Willem de Vos, Clara Belzer. (2018). Akkermansia muciniphila in the Human Gastrointestinal Tract: When, Where, and How?. Microorganisms. 6, 75;
- Marc Schneeberger, Amandine Everard, Alicia G. Gómez-Valadés, Sébastien Matamoros, Sara Ramírez, et. al.. (2015). Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci Rep. 5;
- R. J. Mulders, K. C. G. de Git, E. Schéle, S. L. Dickson, Y. Sanz, R. A. H. Adan. (2018). Microbiota in obesity: interactions with enteroendocrine, immune and central nervous systems. Obesity Reviews. 19, 435-451;
- Chin Wen Png, Sara K Lindén, Kristen S Gilshenan, Erwin G Zoetendal, Chris S McSweeney, et. al.. (2010). Mucolytic Bacteria With Increased Prevalence in IBD Mucosa Augment In Vitro Utilization of Mucin by Other Bacteria. Am J Gastroenterol. 105, 2420-2428;
- Mirjana Rajilić-Stojanović, Fergus Shanahan, Francisco Guarner, Willem M. de Vos. (2013). Phylogenetic Analysis of Dysbiosis in Ulcerative Colitis During Remission. Inflammatory Bowel Diseases. 19, 481-488;
- A. Swidsinski, Y. Dorffel, V. Loening-Baucke, F. Theissig, J. C. Ruckert, et. al.. (2011). Acute appendicitis is characterised by local invasion with Fusobacterium nucleatum/necrophorum. Gut. 60, 34-40;
- Moran Yassour, Mi Young Lim, Hyun Sun Yun, Timothy L. Tickle, Joohon Sung, et. al.. (2016). Sub-clinical detection of gut microbial biomarkers of obesity and type 2 diabetes. Genome Med. 8;
- Caroline L.J. Karlsson, Jenny Önnerfält, Jie Xu, Göran Molin, Siv Ahrné, Kristina Thorngren-Jerneck. (2012). The Microbiota of the Gut in Preschool Children With Normal and Excessive Body Weight. Obesity. 20, 2257-2261;
- Maria Carlota Dao, Amandine Everard, Judith Aron-Wisnewsky, Nataliya Sokolovska, Edi Prifti, et. al.. (2016). Akkermansia muciniphilaand improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut. 65, 426-436;
- Xiuying Zhang, Dongqian Shen, Zhiwei Fang, Zhuye Jie, Xinmin Qiu, et. al.. (2013). Human Gut Microbiota Changes Reveal the Progression of Glucose Intolerance. PLoS ONE. 8, e71108;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Siobhan F Clarke, Eileen F Murphy, Orla O'Sullivan, Alice J Lucey, Margaret Humphreys, et. al.. (2014). Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 63, 1913-1920;
- Wiley Barton, Nicholas C Penney, Owen Cronin, Isabel Garcia-Perez, Michael G Molloy, et. al.. (2017). The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level. Gut. gutjnl-2016-313627;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- Muriel Derrien, Clara Belzer, Willem M. de Vos. (2017). Akkermansia muciniphila and its role in regulating host functions. Microbial Pathogenesis. 106, 171-181.