
Абиогенез и естественный отбор
15 января 2021
Абиогенез и естественный отбор
- 996
- 0
- 4
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: После возникновения Земля представляла собой знойную и горячую сферу без жизни. Спустя же 4,5 миллиарда лет природа оказалась представлена многочисленными формами ныне живущих организмов. В этой работе мы попытаемся проникнуть через тектонические плиты истории, слой за слоем углубимся к первоначальным химическим реакциям и ответим на вопрос: «Где и из чего возникли сложные органические молекулы, прошедшие долгий путь эволюции в живые существа?». Чтобы «заглянуть за забор к создателю», понадобится прочный фундамент теории для дальнейшей логики рассуждений.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Пролог: структура нуклеиновых кислот
Прежде чем перейти к химическим реакциям получения органических соединений, мы изучим молекулы, условия абиогенного синтеза которых будем искать большую часть статьи.
Нуклеиновые кислоты делятся на дезоксирибонуклеиновые (ДНК) — находятся в хромосомах, митохондриях, хлоропластах, нуклеоидах, — и рибонуклеиновые (РНК) — транспортируют генетическую информацию, обеспечивают синтез белка, регуляцию генов и сплайсинг. При построении нуклеиновых кислот рибоза или дезоксирибоза связывается с одним азотистым основанием (табл. 1), образуя молекулу нуклеозида. Такое соединение вместе с фосфатными группами образует уже молекулу нуклеотида (рис. 1). Из них и строятся нуклеиновые кислоты присоединением новых нуклеотидов, где две фосфатные группы отделяются, а третья входит в состав цепи.
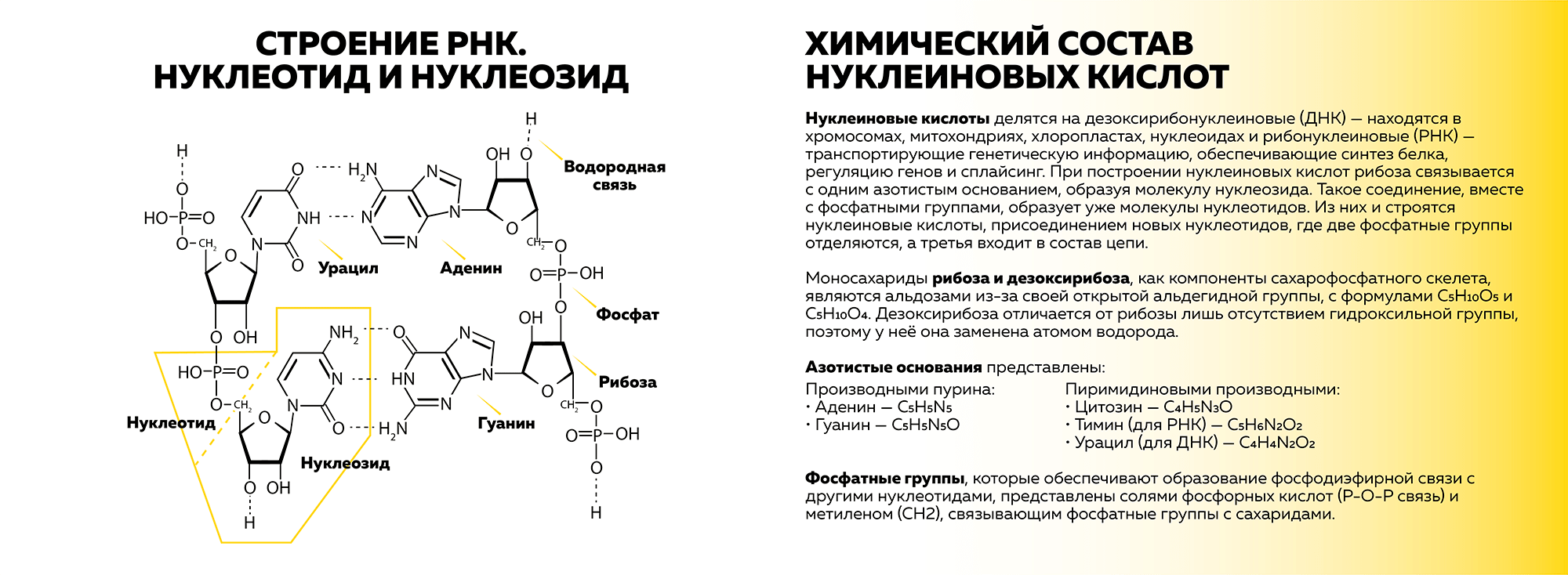
Рисунок 1. Строение РНК и химический состав нуклеиновых кислот
иллюстрация автора статьи на основе [1]
| Производные пурина | Производные пиримидина |
|---|---|
| Аденин — C5H5N5 Гуанин — C5H5N5O |
Цитозин — C4H5N3O Тимин (для ДНК) — C5H6N2O2 Урацил (для РНК) — C4H4N2O2 |
Моносахариды рибоза и дезоксирибоза, как компоненты сахарофосфатного скелета, являются альдозами из-за своей открытой альдегидной группы, с формулами C5H10O5 и C5H10O4. Дезоксирибоза отличается от рибозы лишь отсутствием гидроксильной группы, которая у нее заменена атомом водорода.
Фосфатные группы, которые обеспечивают образование фосфодиэфирной связи с другими нуклеотидами, представлены солями фосфорных кислот (P–O–P связь) и метиленом (CH2), связывающим фосфатные группы с сахаридами.
Введение: древний мир
В начале своего формирования, около четырех миллиардов лет назад, атмосфера планеты пополнялась лишь газами, исходящими из падающих астероидов и расплавленных геологических структур. При движении магмы в ядре магнитное поле благоприятствовало осаждению карбонатов и сдерживало целостность атмосферы. Барьер из озона, образовавшийся в процессе реакции под действием ультрафиолета (фотолиза), создал нужный тепловой баланс к концу архейского эона [1], [2]. В этот период, в атмосфере содержались:
- Водород (H2).
- Метан (CH4).
- Аммиак (NH3).
- Азот (N2).
- Диоксид углерода (CO2).
- Монооксид углерода (CO).
- Вода (H2O).
- Сероводород (H2S).
- Диоксид серы (SO2).
В атмосфере соединения серы неустойчивы, но при поступлении из глубин, содержание сохраняется.
Введение: первые опыты — первые проблемы
В начале XX века А. Опарин и Д. Холдейн работали над концепцией коацервата. Их интересовало, каким образом синтезируется сложная органика при разрядах молний, воздействии ультрафиолета и извержений вулканов [3]. Идею частично подтвердили Г. Юри и С. Миллер. Смесь соединений, имитирующих древнюю атмосферу, запаивали в замкнутой установке и через колбу с водой пропускали электрический ток. Спустя две недели, на протяжении которых им периодически приходилось наблюдать за реакциями через стекло, они вскрыли колбу и выяснили, что теперь в ней присутствовали аминокислоты, сахара и органические кислоты [4]. Эксперимент показал реальность синтеза сложной органики из более простых химических веществ.
CO2 → CO + [O] (атомарный кислород)
CH4 + 2[O] → CH2O (формальдегид) + H2O
CH4 + NH3 → HCN (синильная кислота) + 3H2
Полученные в вышеописанных реакциях соединения формальдегида, синильной кислоты и аммиака, синтезируют аминокислоты в процессе реакции Штрекера, а вода и формальдегид — рибозу, в процессе реакции Бутлерова. Последующие эксперименты синтезировали производные пурина (табл. 1) и расширили список получаемых аминокислот. Казалось бы, нужно ликовать — вот он, переход от химической эволюции к биологической! Но как это бывает зачастую, бронежилет теории не выдерживает обстрела реальности — концепция коацервата имела серьезные недостатки. Реакция соединения аминокислот в белок или нуклеотиды происходит с выделением воды, и длинные молекулы подвержены распаду [1]. Еще одной проблемой стал способ размещения связей вокруг атома углерода, которые являются взаимно-зеркальными — хиральными. Аминокислоты чаще представлены левыми изомерами, а рибозы — правыми. Такая характеристика нуклеотидов придает спиральную структуру ДНК и РНК, но в синтезе из простых соединений получается равное количество изомеров, поэтому белки такой смеси не способны функционировать.
Теория условий: гидротермальные источники
Высокое содержание железа, цинка, марганца и меди — особенность живых клеток. Если железа много в неживой природе, то меди с марганцем и цинком не особенно. Парадоксально, но все они содержатся в клетках в намного большей концентрации, чем во внешней среде. Перечисленные металлы характерны в обильном количестве для гидротермальных источников, с которых мы начнем поиск условий для абиогенного синтеза органических соединений.
Воды источников имеют черный цвет благодаря сульфидам, сероводороду и другим взвесям [5]. После контакта с океаном, гидротермальные воды охлаждаются, а соединения железа, меди и никеля выпадают в осадок. При дальнейшем остывании вод сульфиды цинка и марганца осаждаются на уже сформированный рельеф.
Сульфиды цинка способны к фотохимическому восстановлению, поглощая ультрафиолет и фосфоресцируя. В таком состоянии возбужденный электрон восстанавливает соединения диоксида углерода до муравьиной и других органических кислот, а при ультрафиолете восстанавливает азот до аммиака. При этом он защищает органические молекулы от ультрафиолета эффективней слоя воды в десятки метров. Именно поэтому первые организмы могли укрываться в минеральных осадках, имея доступ к продуктам фотохимических реакций [1].
Осадки образуются из мелких частиц и имеют много пор. Подобные условия являются удобными для репликации органики из-за относительной изоляции. Откладывающиеся сульфидные минералы становятся катализаторами химических реакций для синтеза органических соединений [6]. При этом градиенты температур разделяют хиральные формы соединений. В таких условиях термодиффузии РНК и белки накапливаются в одной локации, например — в вышеупомянутых порах, где происходит концентрация в миллиарды раз [7].
Теория условий: синтез в грязевых котлах
Важным веществом клетки является фосфор, содержащийся в фосфорилированных органических молекулах, входящих в состав нуклеиновых кислот, аденозинтрифосфатов и др. Источниками достаточного количества этого вещества являются вулканы и горячие геотермальные источники. Они содержат фосфиты, пирофосфаты или оксиды фосфора. При растворении эти соединения дают молекулы в пригодной для сахарофосфатов и нуклеотидов форме. При кипении минеральных вод растворенные соединения разделяются, поэтому часть испаряется с водой и выходит в грязевых котлах. При подобной сепарации металлов поднимающийся пар магмы содержит бораты, калий, натрий и соли молибдена в концентрации, такой же как в органической клетке.
Проводились исследования при участии солей бора, где образуются комплексы 5/6-углеродных сахаров, выпадающие в осадок, и происходит накопление молекул с двумя соседними гидроксильными группами. При добавлении гидроксиапатита в такую смесь на его поверхности откладывается рибоза [8], [9], а соли молибдена превращают разветвленные сахара в линейные, увеличивая синтез. Почувствуйте, как густые и горячие знания стекают вам на шею, ведь грязевые котлы обогащены всеми вышеописанными ранее элементами [10], потому и представляются одними из самых вероятных мест появления жизни, имея несколько преимуществ сразу:
- Условия, богатые необходимыми микроэлементами.
- Источник тепла с постоянными условиями.
- Пористые минеральные осадки, работающие в качестве катализаторов, и локации для репликации органических соединений.
- Испарение на местах при концентрации веществ, солей и кислот, где происходит образование цепочек РНК.
- Несколько путей получения органических молекул.
- Фотохимические реакции и расположенные рядом защищенные поры.
- Нагрев пор, где накапливаются нуклеотиды и РНК в высоких концентрациях.
Теория условий: роль метана и лаборатория Манчестера
В 2008 году вышло исследование об обнаруженных на дне океана колонн из светлого известняка высотой до 60 метров. Из их недр исходила вода температурой около 80 °С и содержала гидроксид магния, выпадающий в осадок. Нагрев происходил за счет реакций в глубине твердых пород, поэтому метан и кислоты этих вод образуются абиогенно, а изотопный состав углерода в них такой же, как в углекислом газе [11]. В атмосфере древнего мира метан реагировал с азотом, водой и углекислым газом, образуя формальдегид. Соединения фотолиза метана не накапливались, а выпадали с дождем (рис. 2). Синильная кислота и формальдегид растворимы в воде, поэтому они вымывались и на поверхность поступали формальдегид, цианамид и цианид — являющиеся прекурсорами для азотистых оснований и РНК [12].
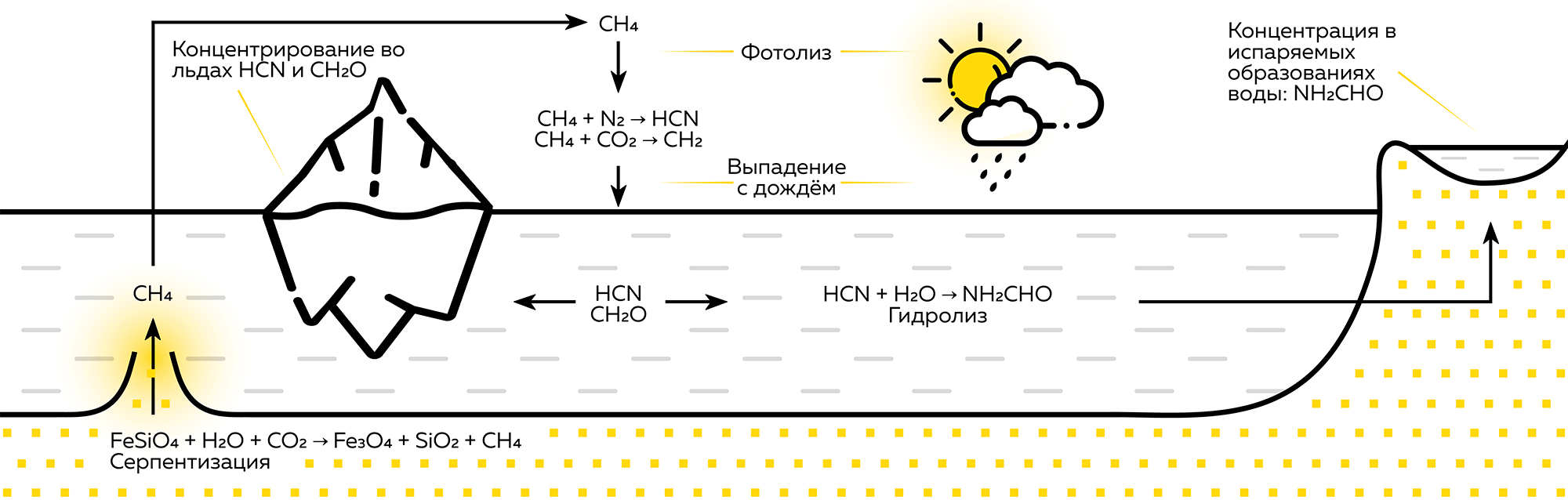
Рисунок 2. Источники и превращения метана (CH4)
иллюстрация автора статьи на основе [1]
Это была бы вкусная шутка, но реакция получения нуклеотидов с помощью таких соединений была получена в 2009 году в Манчестере во время работы Д. Сазерленда и его коллег [13]. Они синтезировали пиримидиновые нуклеотиды путем смешения в одной установке предшественников сахаров и нуклеотидов с фосфатами (рис. 3).
Приготовьтесь, сейчас придется немного похрустеть коркой головного мозга. Чтобы было проще, обратимся к рисунку 3 ниже, который будет иллюстрировать ход реакций. Как можем видеть, первоначальные соединения представлены: цианоацетиленом, цианамидом, глицеральдегидом и гликольальдегидом.
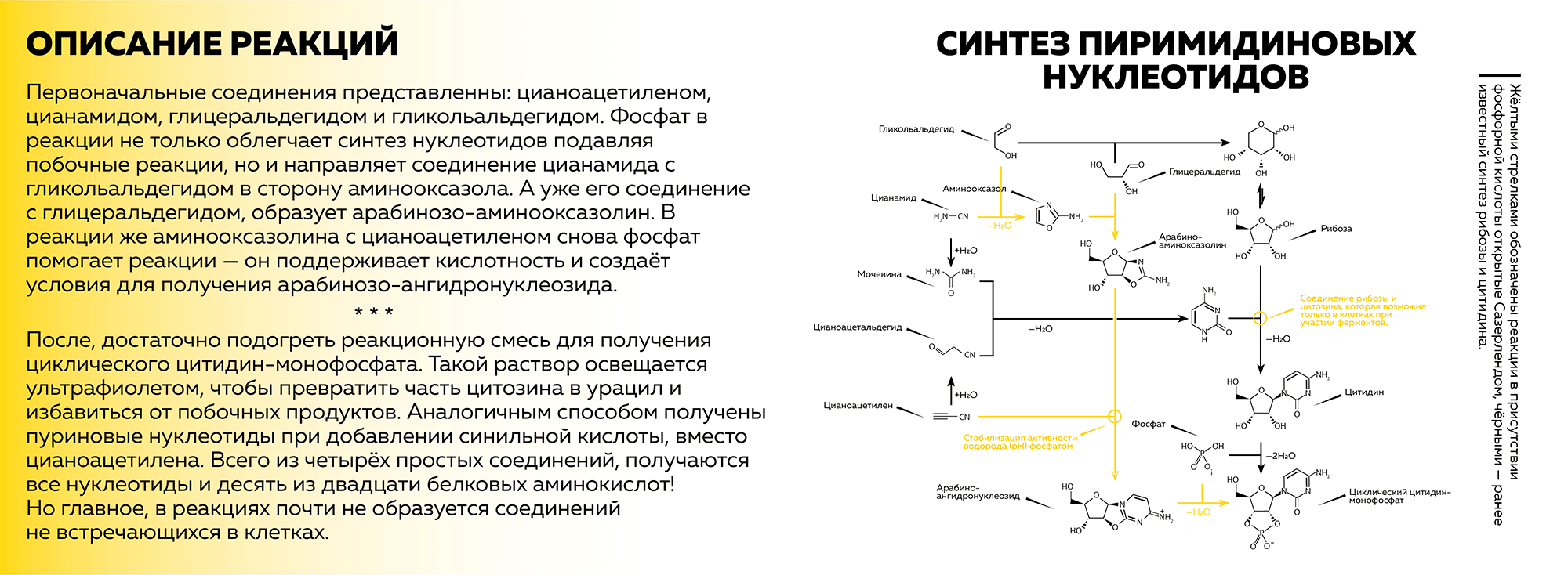
Рисунок 3. Описание синтеза пиримидиновых нуклеотидов
иллюстрация автора статьи на основе [1]
Фосфат в реакции не только облегчает синтез нуклеотидов, подавляя побочные реакции, но и направляет соединение цианамида с гликольальдегидом в сторону аминооксазола. А уже его соединение с глицеральдегидом образует арабинозо-аминооксазолин. В реакции же аминооксазолина с цианоацетиленом снова фосфат помогает реакции — он поддерживает кислотность и создает условия для получения арабинозо-ангидронуклеозида.
После достаточно подогреть реакционную смесь для получения циклического цитидин-монофосфата. Такой раствор освещается ультрафиолетом, чтобы превратить часть цитозина в урацил и избавиться от побочных продуктов. Аналогичным способом получены пуриновые нуклеотиды при добавлении синильной кислоты, вместо цианоацетилена. Всего из четырех простых соединений, получаются все нуклеотиды и десять из двадцати белковых аминокислот! Но главное, в реакциях почти не образуется соединений, не встречающихся в клетках. Пусть этот момент станет сюжетной пружиной моего повествования.
РНК: решение в виде репликаторов
В конце XX века произошло открытие рибозимов. До того времени РНК считалась только связующим элементом ДНК и белков, но последующие исследования показали способность РНК заменять белки в качестве катализаторов реакций, а также их ключевое значение в организации синтеза белка. Появилась гипотеза «РНК мира». Согласно этой теории, реплицирующиеся рибозимы стали первыми органическими соединениями начавшими эволюцию. Спустя поколения, репликаторы предоставили каталитические функции белкам, а хранение генома практически полностью — ДНК [14]. Это стало величайшим прыжком мысли через синаптическую щель, однако без клеточных систем получение полноценных белков в водной среде невозможно. Вопрос решается нахождением условий, где участие воды в реакции снижено или у нее отсутствуют химически свободные молекулы — благо, примеры таких локаций мы уже с вами рассмотрели в предыдущих главах.
РНК: естественный отбор палиндромов
Двигаемся дальше. В условиях липидно-нуклеотидного раствора уже рассмотренных грязевых котлов, образуются последовательности РНК в 50–100 нуклеотидов. Липиды, к которым мы вернемся позже, при высыхании образуют слои и длинные цилиндры, где последовательности РНК упорядоченно накапливаются и сохраняют подвижность. При естественном отборе преимущество получают те последовательности, которые служат фрагментами для создания собственных копий — палиндромные цепи РНК [15]. Эта идея А. Маркова превращает необходимость фрагментов в фактор естественного отбора, который может привести к образованию рибозима среди длинных палиндромных молекул. Киньте в грудь мне раскаленных углей, если это не подтверждает геноцентричный взгляд на эволюцию Ричарда Докинза [16], ведь палиндромный способ упаковки молекул наблюдается и в последовательностях соединений нынешних транспортных РНК.
Устойчивость к ультрафиолету тоже может быть признаком отбора, при котором выживали более длинные цепи. В таких молекулах защита соседних соединений осуществлялась за счет параллельных связей азотистых оснований — стэкинг-взаимодействия, похожего на «слоеный пирог» [17]. Важно то, что увеличение количества собственных копий способствует не только копированию, но и превращению простых органических веществ в нуклеотиды. В совокупности это знаменует появление обмена веществ, где реакции происходят при контроле ферментов.
РНК: вещественный обмен
Обмен веществ у первых органических структур развивался гетеротрофно, от сложных исходных соединений, как рибоза и азотистые основания, к более простым [1]. На начальных этапах РНК были доступны многие активные одноуглеродные соединения:
- Муравьиная кислота образуется при фотосинтезе на сульфиде цинка и выносится геотермальными источниками после реакций воды с базальтами.
- Формальдегид опадает с дождями, возникая при фотолизе метана.
- Угарный газ выделяется в составе газов вулкана.
Все три случая рассмотрены ранее и внимательный читатель вспомнит их, но именно диоксид углерода стал конечным нужным соединением. Хотя его восстановление без качественных катализаторов медленное, мы помним, что при абиогенном восстановлении реакция происходит под действием ультрафиолета или температуры. Выбор между способами использования углерода в обмене веществ зависит от среды. Рибулозо-монофосфатный цикл, питаемый формальдегидом [18] похож на древнейший синтез сахаров, а участие муравьиной кислоты в синтезе пуринов (табл. 1) предполагает формирование этой реакции до появления ферментов фиксации диоксида углерода.
РНК: энергия липидной мембраны
Возвратимся к теме липидов. Электроны связей молекулы воды смещены из-за большей электроотрицательности кислорода. Вследствие этого одна сторона молекулы несет положительный заряд, а другая — отрицательный. Поэтому вещества с полярными молекулами (гидрофильные) притягиваются и смешиваются с водой, а неполярные молекулы (гидрофобные) — нет [19]. В живых организмах клетки окружены мембраной из двух слоев липидов, при смешивании их молекул в воде получается эмульсионная взвесь, а не растворение. Наружная сторона мембраны несет положительный заряд, а внутренняя — отрицательный. Такой электрический потенциал используется при передаче и хранении энергии, а также транспорта веществ вместе с протонами для компенсации заряда мембраны [20].
Вероятно, протоклетки имели примитивные оболочки из липидов, которые пропускали протоны и ионы металлов, но задерживали белки и РНК, поэтому выход из геотермальных водоемов в среду с высоким содержанием натрия потребовал создания клетками способа его «откачки» [21]. Появления натриевых насосов, использующих энергию реакций, и освоение новых кислых сред подтверждает образование мембран в тот период, когда аденозинтрифосфаты уже были в наличии.
Эволюция РНК: вирусы
Вы спросите, каким же все-таки образом ДНК забрала себе функцию РНК в хранении генетической информации? Я отвечу, что реакция превращения рибозы в дезоксирибозу связана с образованием опасных радикалов, поэтому рибозимы не могут ее осуществлять. Реакцию проводят ферменты — большие белки, для кодирования которых нужны минимум тысячи нуклеотидов. Между теперешним способом хранения нуклеиновых кислот и миром РНК были промежуточные формы более простые в получении, чем ДНК, но стабильнее РНК [14]. Эволюция предковых образований клеток тесно связана с вирусами. Так, П. Фортер считает главной стадией жизни вируса — ее активную часть в зараженной клетке [22]. Вирусы образуют кластеры, сочетающие клеточные и вирусные белки, где клетки синтезируют копии вируса под контролем вирусного генома.
На этом этапе видно, что задача хранения генетической информации осуществляется разными вариациями соединений, но естественным отбором избраны содержащиеся в нынешних клетках. К слову, синтетическая биология достигла больших результатов, создавая альтернативные нуклеотиды. В 2014 году, «нуклеотидный алфавит» был расширен до шести букв за счет включения нескольких синтетических пар гидрофобных нуклеиновых оснований [23].
Переход РНК к ДНК снижает частоту нарушений копирования, но ошибки в момент перехода возрастают. При этом, смена геномного материала сопровождается преобразованием фермента отвечающего за копирование — полимеразы. Согласно идее П. Фортера, эти реакции происходили в вирусах, а выгодой стало прохождение защитных систем клетки [24].
Эволюция РНК: увеличение масштаба генома
С появлением белкового синтеза в результате отбора, РНК-полимераза сняла с рибозимов обязанность репликации и позволила увеличить количество генетической информации. Белки стали промежуточным звеном построения липидной оболочки, а эволюция плоских структур РНК превратила их в трехмерные скопления, покрытые мембраной [25]. Независимость от сульфида цинка была еще невозможна, но появились пузыревидные структуры напоминающие вирусы не только механизмами репликации, но и размерами геномов.
В ходе естественного отбора вирусы и плоские первоначальные организмы, создавали новые типы нуклеиновых кислот: метил-РНК, урацил-ДНК и современную ДНК с тимином [1]. Эти кислоты использовали протоклетки, позволяющие увеличивать размер и стабильность генома. Изобретение ДНК и совершенствование ее копирования во множестве линий вирусов привело к обильному разнообразию ферментов, работающих с ней. Углубляясь в опыт прошлых глав, можно подытожить — надежная репликация ДНК знаменует скорое объединение генетических элементов в большие геномы, и последующий исход из источников возникновения не заставит себя ждать.
Дальнейшая эволюция: происхождение эукариот
Остался неразрешенный вопрос перехода количества в качество — о структуре клетки. Форму эукариота поддерживает цитоскелет из тонких и толстых белковых трубочек, а моторные белки перемещают компоненты клетки и обеспечивают ее подвижность. Деление и слияние мембран регулируется специальными белками. Благодаря этому большинство эукариот способны к фагоцитозу — поглощению частиц внешней среды.
Еще одними важными органеллами являются митохондрии, которые имеют собственную генетическую систему. Их сходство с аэробными бактериями и пластидами стало первым этапом понимания происхождения эукариот. Пластиды и митохондрии образуются только в процессе деления, указывающего на происхождение от бактериальных симбионтов, попавших в цитоплазму [26].
В 2015 году найдены археи, близкие к эукариотам во множестве компонентов (рис. 4). Экспедиция, изучавшая геотермальные поля в Северной Атлантике, после сбора осадков, населенных бактериями и археями, провела анализ их ДНК. Он показал преобладание в той локации вида архей, относящегося к некультивируемой группе глубоководных архей (deep-sea Archaea group) [27]. После сбора и прочтения генома средствами вычислительной биологии установленный вид оказался ближе к эукариотам, чем все известные ранее. Вид обладает большим набором сигнальных белков, которые в эукариотах регулируют: перестроение цитоскелета, сигналы между мембраной, цитоплазмой и ядром, деление клеток и другие функции.
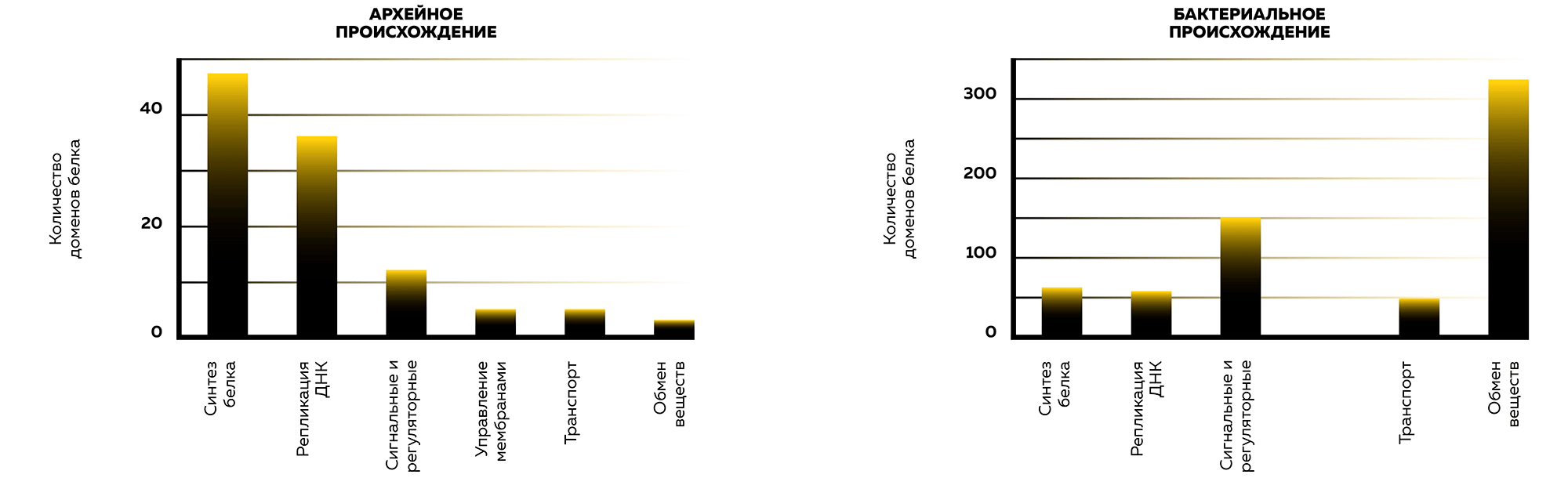
Рисунок 4. Происхождение функций белковых доменов в клетках эукариот
иллюстрация автора статьи на основе [1]
В ходе эволюции эукариотам пришлось подчинить себе внутриклеточные симбиотические бактерии, вслед за тем появился новый биохимический путь. После симбиоза с митохондриями аэробное дыхание повысило эффективность использования пищи. Десятки кластеров глубоководных организмов независимо друг от друга приручили бактерии, окисляющие сероводород или метан [1]. Благодаря этому эукариоты приобрели функции фиксации азота, разложения целлюлозы, синтеза витаминов и пр. Но не надо захлебываться серотониновой пеной, ведь такой вектор эволюции кажется эгоистичным. Сложно сказать, существуют ли живые организмы только для пользы репликации генома или нет. Но в сравнении с короткой жизнью всего организма, часть информации нуклеиновых кислот существует невероятно продолжительное время, передаваясь при размножении и создавая новую структуру носителя [16].
Заключение
Нами были описаны места возможного возникновения абиогенного синтеза органических соединений с содержанием нужных для этого веществ. А также на молекулярном уровне разобраны реакции получения органических соединений из простых микроэлементов на примерах работ А. Опарина и Д. Сазерленда. Дальнейшую же эволюцию полученных биомолекул объясняют рассмотренные теории А. Маркова и П. Фортера, которые позже подтверждаются исследованиями в геотермальных полях Северной Атлантики. На протяжении всего текста можно было наблюдать уникальную биохимическую эволюцию, закономерности которой описываются лишь свойствами химических веществ.
Закончу статью словами эволюционного биолога Ричарда Докинза: «Все живое эволюционирует в результате дифференциального выживания реплицирующихся единиц».
Литература
- Никитин М. Происхождение жизни. От туманности до клетки. М.: «Альпина нон-фикшн», 2020. — 542 с.;
- Хейзен Р. История Земли. М.: «Альпина нон-фикшн», 2018. — 458 с.;
- Опарин А. Возникновение жизни на земле. М.: «Издательство Академии Наук СССР», 1957. — 460 с.;
- S. L. Miller, H. C. Urey. (1959). Organic Compound Synthes on the Primitive Eart: Several questions about the origin of life have been answered, but much remains to be studied. Science. 130, 245-251;
- C. Huber, G. Wachtershauser. (2006). -Hydroxy and -Amino Acids Under Possible Hadean, Volcanic Origin-of-Life Conditions. Science. 314, 630-632;
- Armen Y Mulkidjanian. (2009). On the origin of life in the Zinc world: 1. Photosynthesizing, porous edifices built of hydrothermally precipitated zinc sulfide as cradles of life on Earth. Biology Direct. 4, 26;
- Barry Herschy, Alexandra Whicher, Eloi Camprubi, Cameron Watson, Lewis Dartnell, et. al.. (2014). An Origin-of-Life Reactor to Simulate Alkaline Hydrothermal Vents. J Mol Evol. 79, 213-227;
- Элементы: «Новое в теории появления жизни»;
- Элементы: «Химикам удалось стабилизировать абиогенный синтез сахаров»;
- A. Y. Mulkidjanian, A. Y. Bychkov, D. V. Dibrova, M. Y. Galperin, E. V. Koonin. (2012). Origin of first cells at terrestrial, anoxic geothermal fields. Proceedings of the National Academy of Sciences. 109, E821-E830;
- Грамм В. (2008). Газ никогда не кончится. «Газета.ру»;
- Марков А. Рождение сложности. М.: Corpus, 2014. — 528 с.;
- Matthew W. Powner, Béatrice Gerland, John D. Sutherland. (2009). Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature. 459, 239-242;
- Кунин Е. Логика случая. О природе и происхождении биологической эволюции. М.: «Центрполиграф», 2018. — 527 с.;
- Элементы: «В поисках начала эволюции»;
- Докинз Р. Эгоистичный ген. М.: Corpus, 2013. — 512 с.;
- Armen Y. Mulkidjanian, Michael Y. Galperin. (2007). Physico-Chemical and Evolutionary Constraints for the Formation and Selection of First Biopolymers: Towards the Consensus Paradigm of the Abiogenic Origin of Life. C&B. 4, 2003-2015;
- Пармон В. (2004). Естественный отбор среди молекул. «Наука из первых рук». 1, 33–40;
- Липидный фундамент жизни;
- Эшкрофт Ф. Искра жизни. Электричество в теле человека. М.: «Альпина нон-фикшн», 2016. — 394 с.;
- Диброва Д.В., Гальперин М.Ю., Кунин Е.В., Мулкиджанян А.Я. (2015). Древние системы натрий-калиевого гомеостаза клетки как предшественники мембранной биоэнергетики. «Биохимия». 5, 590–611;
- Patrick Forterre, David Prangishvili. (2009). The origin of viruses. Research in Microbiology. 160, 466-472;
- Denis A. Malyshev, Kirandeep Dhami, Thomas Lavergne, Tingjian Chen, Nan Dai, et. al.. (2014). A semi-synthetic organism with an expanded genetic alphabet. Nature. 509, 385-388;
- Patrick Forterre. (2005). The two ages of the RNA world, and the transition to the DNA world: a story of viruses and cells. Biochimie. 87, 793-803;
- Никитин М. (2018). Происхождение жизни: от РНК-мира до последнего общего предка всего живого. «ПостНаука»;
- Anja Spang, Jimmy H. Saw, Steffen L. Jørgensen, Katarzyna Zaremba-Niedzwiedzka, Joran Martijn, et. al.. (2015). Complex archaea that bridge the gap between prokaryotes and eukaryotes. Nature. 521, 173-179;
- Katarzyna Zaremba-Niedzwiedzka, Eva F. Caceres, Jimmy H. Saw, Disa Bäckström, Lina Juzokaite, et. al.. (2017). Asgard archaea illuminate the origin of eukaryotic cellular complexity. Nature. 541, 353-358.







