А или Г: невидимое преимущество
09 марта 2021
А или Г: невидимое преимущество
- 1171
- 1
- 4
иллюстрация Вячеслава Федорова
-
Авторы
-
Редактор
Статья на конкурс «Био/Мол/Текст»: Все люди разные. Но что формирует нашу генетическую индивидуальность? И кто такие контроллеры ВИЧ? В этой статье мы расскажем о том, как секвенирование геномов десятков тысяч людей выявляет тех, кто сильнее прочих подвержен тяжелому течению распространенных инфекций и на кого медикам всего мира нужно обращать особое внимание; и тех, кто обладает преимуществом перед остальными.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
На школьных уроках биологии мы узнавали, что мутации — это изменения, дающие потомству не только новый цвет волос или глаз, но неизлечимые болезни. Но оказывается, что в реальной жизни каждый человек, помимо наследования генетического материала родителей, рождается с, примерно, 70 новыми мутациями [1]. В большинстве случаев это не является для него чем-то фатальным, а просто делает отличным от другого, даже самого близкого родственника.
Зачастую мутациями называют лишь часть всех изменений — только те, что приводят к очевидному отличию фенотипа (например болезням). Однако есть существенный процент мутаций, которые в норме присутствуют у более чем 1% популяции, но не заметны невооруженным секвенатором глазом.
В основе этих вариаций лежат единичные замены, выпадения или вставки нуклеотидов. Такие изменения на уровне одного нуклеотида составляют около 85% всех генетических отличий одного человека от другого [2]. Несколько альтернативных нуклеотидных вариантов в одной и той же позиции могут одновременно присутствовать в популяционном геноме, при этом их проявления незаметны глазу, не мешают продолжению рода и вообще незначительны по сравнению с тем, что мы (надеемся, это не будет относиться к читателям «Биомолекулы» после прочтения нашей статьи) привыкли называть мутациями.
Такие единичные вариации в геномах называются однонуклеотидными полиморфизмами, или SNP (от single nucleotide polymorphism). В речи их попросту зовут снипами. Нетрудно догадаться, что число таких снипов зашкаливает, благодаря монструозности нашего генома и огромному числу людей на планете. Вместе с единичными вариациями встречаются и более крупные мутации, уже не однонуклеотидные. Часто встречаются двух-, пяти-, тридцатинуклеотидные делеции, инсерции, инделы (инсерция и делеция одновременно) и другие вариации. С точки зрения генома, все перечисленные разновидности имеют незначительно малый размер, поэтому нет ничего удивительного в том, что их объединяют в единые со снипами базы данных и рассматривают вместе. Во избежание путаницы: дальнейшее использование термина «снип», или SNP, в первую очередь будет указывать на принадлежность к упомянутым базам данных, таким как на рисунке 2. Вполне возможно, что какой-нибудь упомянутый полиморфизм вовсе и не однонуклеотидный, но его нахождение в базах данных SNP для нас, как исследователей, — важнее.
Здесь вы можете задать вполне закономерный вопрос: чем же могут быть примечательны снипы, которые являются обыденным и широко распространенным явлением? «Ну что ж, — отвечу я, — это нехитрое явление не только интересно, но и потенциально важно». В нескольних статьях на «Биомолекуле» уже упоминались полиморфизмы в контексте популяционной генеалогии, но вернемся к нашей области.
Полиморфизмы встречаются повсюду в геноме. От их расположения можно ожидать разного воздействия: снипы в промоторной зоне гена могут иногда приводить к изменению уровня экспрессии этого гена, SNP в транслируемых участках генома могут несколько модифицировать строение или эффективность синтеза как РНК, так и белка, влияние SNP в сайте сплайсинга может быть более значительным, чем просто в транслируемой части. Почти у каждого гена найден целый ряд полиморфизмов, которые потенциально могут влиять на его работу в клетке.
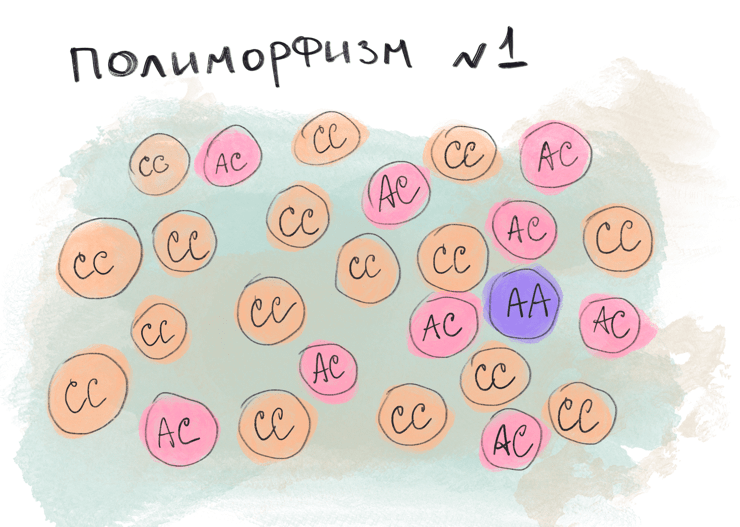
Рисунок 1. Визуальный пример однонуклеотидных полиморфизмов в популяции. Кружок — диплоидный организм, например, человек. Соответственно, рассматривая один полиморфизм, мы имеем дело с двумя аллелями. На рисунке видно, что аллель С > A.
иллюстрация Вячеслава Федорова
Находят полиморфизмы посредством анализа результатов больших проектов по секвенированию популяций. Благодаря ним у нас есть более-менее точная статистика встречаемости огромного количества снипов в разных группах человеческих особей (рис. 1). Стоит отметить, что многие относительно замкнутые малые сообщества могут нести в себе доселе не найденные и, уж тем более, не описанные полиморфизмы, но, в целом, можно вполне смело говорить о том, что сухих данных (которые можно описывать и исследовать на предмет зависимостей) у ученых уже очень много. Доступ к этим находкам есть у каждого, кто знает, как искать (рис. 2).
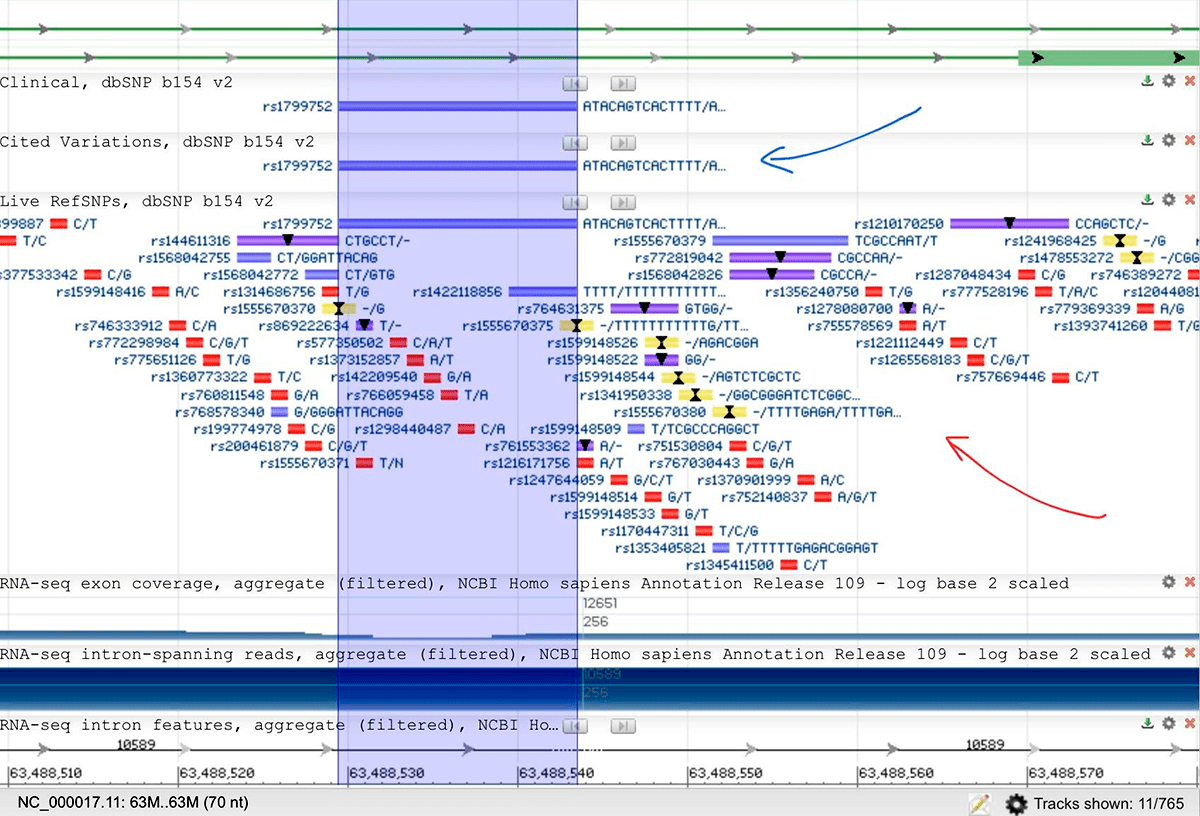
Рисунок 2. Небольшой участок человеческого генома, в районе гена ACE1 (ангиотензинпревращающего фермента 1). Синяя стрелка — база данных полиморфизмов описанных в литературе (cited variations); над ней — база данных полиморфизмов с доказанным клиническим значением (clinical). Красная стрелка — база данных всех найденных снипов (live RefSNPs). Обратите внимание, полиморфизмы окрашены в разные цвета в зависимости от их типа: красные — SNV/SNP (однонуклеотидные вариации); желтые — инсерции; фиолетовые — делеции; синие — indel (инсерция+делеция).
Проявления снипов чрезвычайно разнообразны, например, доказано, что они влияют на частоту суицидального и агрессивного поведения [3], заболеваемость серповидно-клеточной анемией (но полиморфизмом, то есть вариантом нормы, такую мутацию можно назвать только для тех популяций, которые еще недавно были подвержены постоянной опасности малярии) [4], [5], склонность к развитию мужского бесплодия [6], восприимчивость к инфекциям и характер их протекания.
Полиморфизмы имеют единую кодировку (рис. 3):

Рисунок 3. Кодировка полиморфизмов. rs — reference sequence (референсный сиквенс).
иллюстрация Вячеслава Федорова
Часто можно встретить рядом с названием полиморфизма такое обозначение: rs0000 G>A. Оно призвано показать что G — мажорный аллель, а A — минорный (встречается в популяции реже). Может также встречаться такая форма: G/A, в таком случае указания на минорность нет, а порядок не имеет значения. Стоит обратить внимание на то, что обозначение G>A равнозначно обозначению C>T, и в контексте одного полиморфизма могут встречаться обе формы записи. Происходит так потому, что секвенирование может проходить как по плюс-цепи ДНК (кодирующей цепи), так и по минус-цепи (комплементарной кодирующей). Так, у одних исследователей в определенном месте генома будет встречаться A/G, а у других — T/C.
Интерфероны да интерлейкины (минутка иммунологии)
Цитокины играют важную роль в воспалительных и инфекционных процессах. Влияя на регуляцию экспрессии соответствующих генов, снипы могут влиять на протекание инфекционного процесса.
Цитокины — небольшие молекулы, которые передают сигналы между клетками. Их можно разделить на несколько групп: интерфероны, интерлейкины, хемокины, лимфокины и факторы некроза опухоли.
Интерфероны (IFN, от англ. interferon) — белки, выделяемые в ответ на попадание в организм вирусов, бактерий и некоторых химических соединений. IFN делятся на три типа. К первому типу относят IFN-α, IFN-β и IFN-ω, ко второму — IFN-γ, к третьему — IFN-λ. Нас будут интересовать IFN первого и третьего типов, так как они вырабатываются в ответ на вторжение в организм вирусов.
Когда в организм попадает вирус, его гликопротеины или, например, РНК распознаются рецепторами опознавания паттерна, к которым относятся знаменитые Toll-подобные рецепторы, после чего начинается синтез IFN. Далее зараженная клетка выпускает IFN, которые взаимодействуют со своими специфичными рецепторами на других клетках, что приводит к синтезу различных белков, таких как протеинкиназа R и олигоаденилатсинтетаза (РНКаза L), которые теми или иными способами препятствуют размножению вируса.
Интерлейкины (IL, от англ. interleukin) — довольно большая группа цитокинов. Различные IL регулируют рост, дифференцировку и подвижность клеток. Мы же рассмотрим некоторые IL, которые вырабатываются в ответ на вирусную инфекцию:
- IL-12 участвует в защите человека от внутриклеточных патогенов, таких как вирус кори и ВИЧ-1.
- IL-15секретируется фагоцитами после инфицирования вирусами (например, вирусом герпеса). Этот цитокин индуцирует пролиферацию T-клеток и NK-клеток, которые уничтожают инфицированные вирусом клетки.
- IL-28 активирует уже знакомую нам олигоаденилатсинтетазу.
Полиморфизмы и инфекционные болезни (не ковид, честно)
Вирусом гриппа ежегодно заражается около 7% взрослых людей, и до 25% детей до 5 лет [7]. Хотя большинство людей восстанавливается после инфекции в течение недели, небольшой процент все же страдает от тяжелого респираторного дистресс-синдрома или других редких осложнений.
Оказывается, некоторые снипы могут повышать вероятность возникновения осложнений течения болезни. Например, rs12252-G/G A>G интерферон-индуцируемого трансмембранного белка 3 (IFITM3) вызывает более быстрое прогрессирование инфекции и более высокую летальность [8]. Возможно, из-за полиморфизма в гене этого белка происходит альтернативный сплайсинг транскрипта, что приводит к укорачиванию и изменению мембранной локализации IFITM3. Ген белка IFITM3 содержит два экзона и может кодировать два варианта белка, которые различаются наличием 21 аминокислоты на N-конце. У значительного числа пациентов с осложнениями был минорный (то есть редко встречающийся) генотип, изменяющий акцепторный сайт сплайсинга, без которого выполнить правильный сплайсинг невозможно. Также минорный генотип уменьшал рестрикцию вируса клеточными системами in vitro [9].
Хотя данный SNP и снижает противовирусную активность по отношению к гриппу, относительно ретровирусов она повышается, что может быть объяснением распространенности этого снипа в человеческой популяции [10].
Также было выяснено, что некоторые SNP в генах, кодирующих белки легочного сурфактанта (англ. SFTPs), включая SFTPA и SFTPB, ассоциированы с тяжелым протеканием гриппа [11].
Другим, менее знаменитым вирусом, а именно вирусом Эпштейна—Барр (Epstein—Barr virus, EBV), было когда-либо заражено более 90% общемировой популяции людей [12]. Хотя обычно инфекция проходит мягко или бессимптомно, EBV способен вызывать острый инфекционный мононуклеоз и различные виды онкологических заболеваний, в частности, лимфому [12]. Снипы влияют на противовирусный иммунный ответ, а также на реактивацию EBV, посредством изменения генов цитокинов, вызывающих воспаление, а также способных контролировать EBV. Например, высокие уровни продукции IL-10 защищают от первичной и хронической инфекции EBV [13]. Так, три полиморфных сайта в промоторной зоне гена, кодирующего IL-10, влияют на уровень продукции интерлейкина. Генотип, в котором представлены все три SNP (rs1800871 A>G, rs1800872 T>G и rs1800896 G>A), связан с устойчивостью к EBV [14], [15].

Рисунок 4. «Контроллер ВИЧ»
иллюстрация Вячеслава Федорова
Следующий вирус, который мы рассмотрим, именуется вирусом иммунодефицита человека, или же ВИЧ. Он был открыт более 30 лет назад, и с тех пор многие исследования ясно показали, что разные люди имеют разную восприимчивость к ВИЧ первого типа (ВИЧ-1). Небольшая группа зараженных ВИЧ-1 людей, названных элитными контроллерами ВИЧ-1, не подвержена виремии даже без получения антиретровирусной терапии, и СПИД у них не развивается (рис. 4). Множественные генетические исследования контроллеров показали, что у них есть небольшая (размером в 32 п.н. (пары нуклеотидов)) делеция (rs333) в гене CCR5, кодирующем нефункциональный корецептор ВИЧ-1 [16–18]. Корецептор CCR5 располагается преимущественно на мембране некоторых лейкоцитов, которые и являются «жертвами» ВИЧ. Эта делеция приводит к тому, что ВИЧ не может присоединиться к T-клетке. Гетерозиготность по этой мутации приводит к уменьшению шанса инфицирования клетки ВИЧ, гомозиготность же приводит к полной резистентности клеток к ВИЧ [18].
Инфекция респираторно-синцитиальным вирусом (англ. RSV) может приводить к разным клиническим исходам — от легкой простуды до тяжелого бронхиолита, пневмонии или астмы. Примерно у 1–2% инфицированных детей развивается заболевание, требующее госпитализации [19], [20]. Генетические исследования здоровых по отношению к другим болезням детей выявили SNP в генах, участвующих в иммунной защите, которые чрезмерно представлены у пациентов, госпитализированных с RSV.
Уже знакомые нам SFTPs могут, как и в случае с вирусом гриппа, влиять на инфекцию RSV напрямую, ограничивая инфицирование эпителия легких RSV и регулируя иммунный ответ на вирус. Полиморфизмы в генах SFTPA2 и SFTPD были ассоциированы с тяжелой инфекцией RSV в группах пациентов из Финляндии и США [21–23]. Несколько исследований также продемонстрировали связь между полиморфизмом стартового кодона гена рецептора витамина D (который кодирует и внутриклеточный рецептор, и фактор транскрипции, что тоже примечательно) и тяжестью вызванного RSV-инфекцией бронхиолита [24–26]. Этот полиморфизм усугубляет патогенез RSV, потому что из-за него кодируется неправильный рецептор витамина D, который не может поддерживать противовирусные цитокиновые реакции, опосредованные STAT1 (STAT1 — фактор транскрипции, который участвует в положительной регуляции генов за счет сигналов интерферонов) [27].
А завершает наш парад (но не обзор) вирус, которым инфицировано более 2% населения Земли [28], вирус, от которого, по данным Всемирной организации здравоохранения, в 2016 году погибло 399 000 человек [29], вирус, который может вызывать цирроз или рак печени. Да, как вы уже догадались, это вирус гепатита C (ВГC).
Известно, что у 10–15% больных хроническим вирусным гепатитом C (ХВГC) есть риск развития цирроза печени в течение 20–30 лет от момента инфицирования, но в то же время у значительной части больных цирроз печени не формируется на протяжении всей жизни [28]. Более того, известно, что у представителей европеоидной расы чаще наблюдается спонтанное выздоровление и устойчивый ответ на противовирусную терапию, чем у афроамериканцев [30], но реже, чем у представителей монголоидной расы [31]. Все это наталкивает на мысль, что в развитии болезни немалую роль играют генетические факторы. И действительно, было обнаружено, что пятинуклеотидная делеция в промоторе гена интерферон-индуцируемого хемоаттрактанта T-клеток (CXCL11) чаще встречается у больных ХВГC, чем у контрольной группы [32]. Эта делеция приводит к уменьшению активности промотора гена CXCL11 в присутствии реплицирующегося ВГС in vitro и ослаблению миграции T-лимфоцитов in vivo. Также был идентифицирован SNP гена IL-28B, который связан с устойчивым ответом на терапию интерфероном у европейцев [33] и японцев [34]. Этот снип располагается в 8900 п.н. от участка конца транскрипции IL-28B в регионе между генами IL-28A и IL-28B. Было показано, что аллель G, в отличие от аллеля T, ассоциирован с низким уровнем ответа на противовирусную терапию. Так, у пациентов, гомозиготных по аллелю G, спонтанное выздоровление и устойчивый ответ на терапию наблюдался в два раза реже, чем у пациентов, гомозиготных по аллелю T [35].
Рубрика ковида
Недавно ворвавшаяся в жизнь всей планеты инфекция SARS-CoV-2 сразу притянула к себе внимание биоинженеров, вирусологов, биоинформатиков и вообще всех. А пристальное внимание ученых в совокупности с возросшим финансированием дает свои плоды. Статей уже, буквально за год, по запросу coronavirus на PubMed вышло 39 300 штук. Такой объем данных трудновато даже просмотреть, но мы постарались взглянуть на этот массив с точки зрения именно полиморфизмов. В первую очередь стоит понять в каком направлении копают ученые, какие гены притягивают внимание.
Разумеется, на ум сразу приходит ген белка ACE2 (ангиотензинпревращающего фермента 2), через который вирус проникает в клетку. И действительно, есть ряд работ тем или иным методом предсказывающих или показывающих влияние вариаций ACE2 на течение болезни. Так, было показано, что упрощающие проникновение вируса в клетку гемизиготные варианты ACE2 приводят к повышенной смертности у мужчин [36], в то время как некоторые редкие полиморфизмы того же гена улучшают клиническую картину и облегчают протекание болезни.
Гемизиготность — генетическое состояние клетки или организма, при котором отсутствует одна хромосома из пары или отсутствует участок одной хромосомы из пары. Например, гены Х-хромосомы в мужском кариотипе, или линии раковых клеток, у которых отсутствуют целые участки хромосом.
Другой часто исследуемый ген — белка IFITM3 (интерферон-индуцируемого трансмембранного белка 3). Важен он тем, что в ответ на интерфероновый сигнал блокирует вход вирусов в цитоплазму, а также может инактивировать уже образующиеся в клетке вирусные частицы. Для него уже выявлены полиморфизмы, влияющие на протекание ковида. Например rs12252 A>G: в случае гомозиготного G-аллеля вероятность тяжелого протекания и летального исхода выше [37].
Вирус входит в клетку не только через ACE2, ему также нужна помощь в протеолитической активации spike-белка. На роль такой протеазы-помощницы лучше всего подходит TMPRSS2 (мембранно-связанная сериновая протеаза). В работе [38] выявлена, помимо прочих, зависимость встречаемости нескольких снипов гена TMPRSS2 и склонности к заражению.
Забавное наблюдение
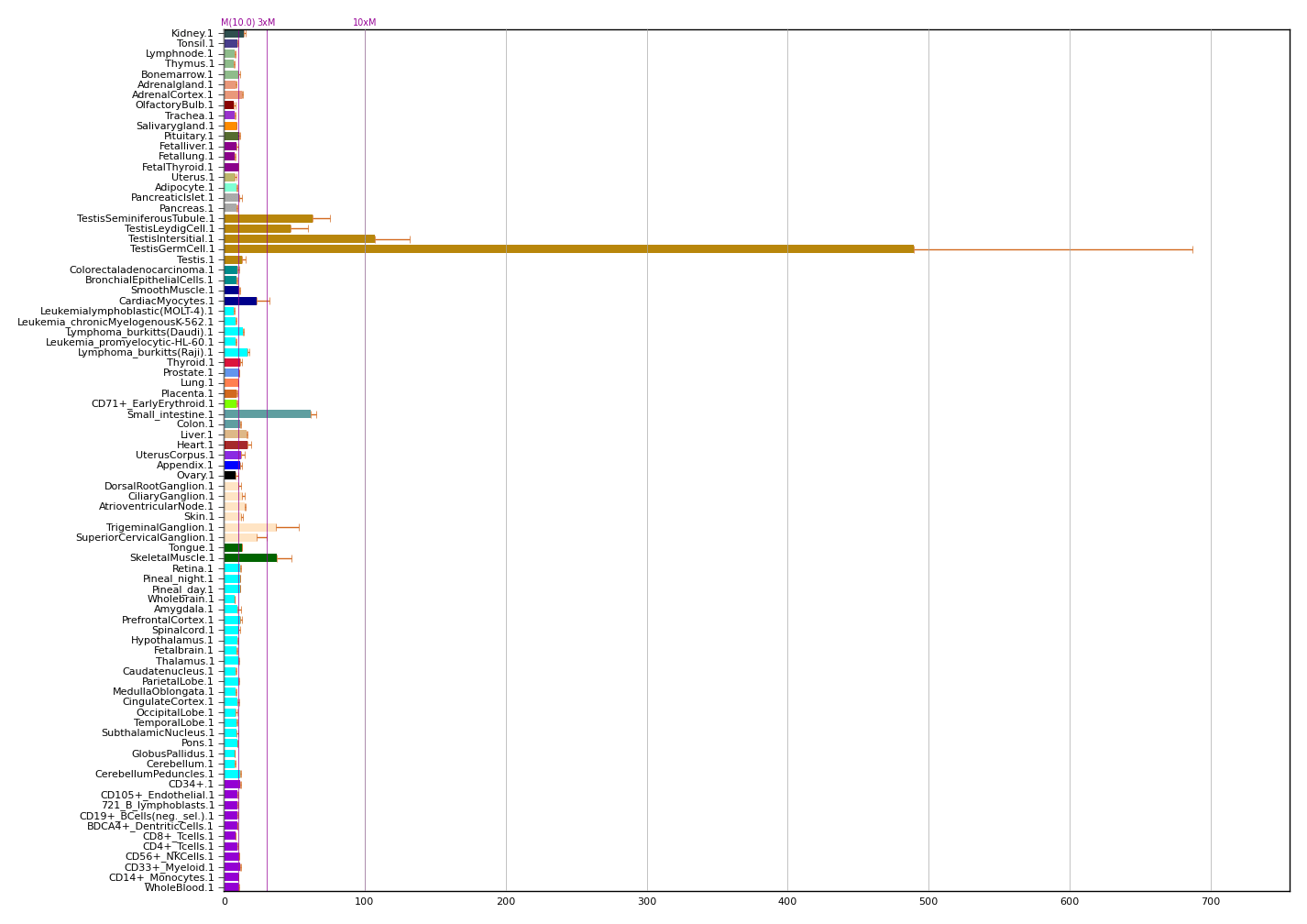
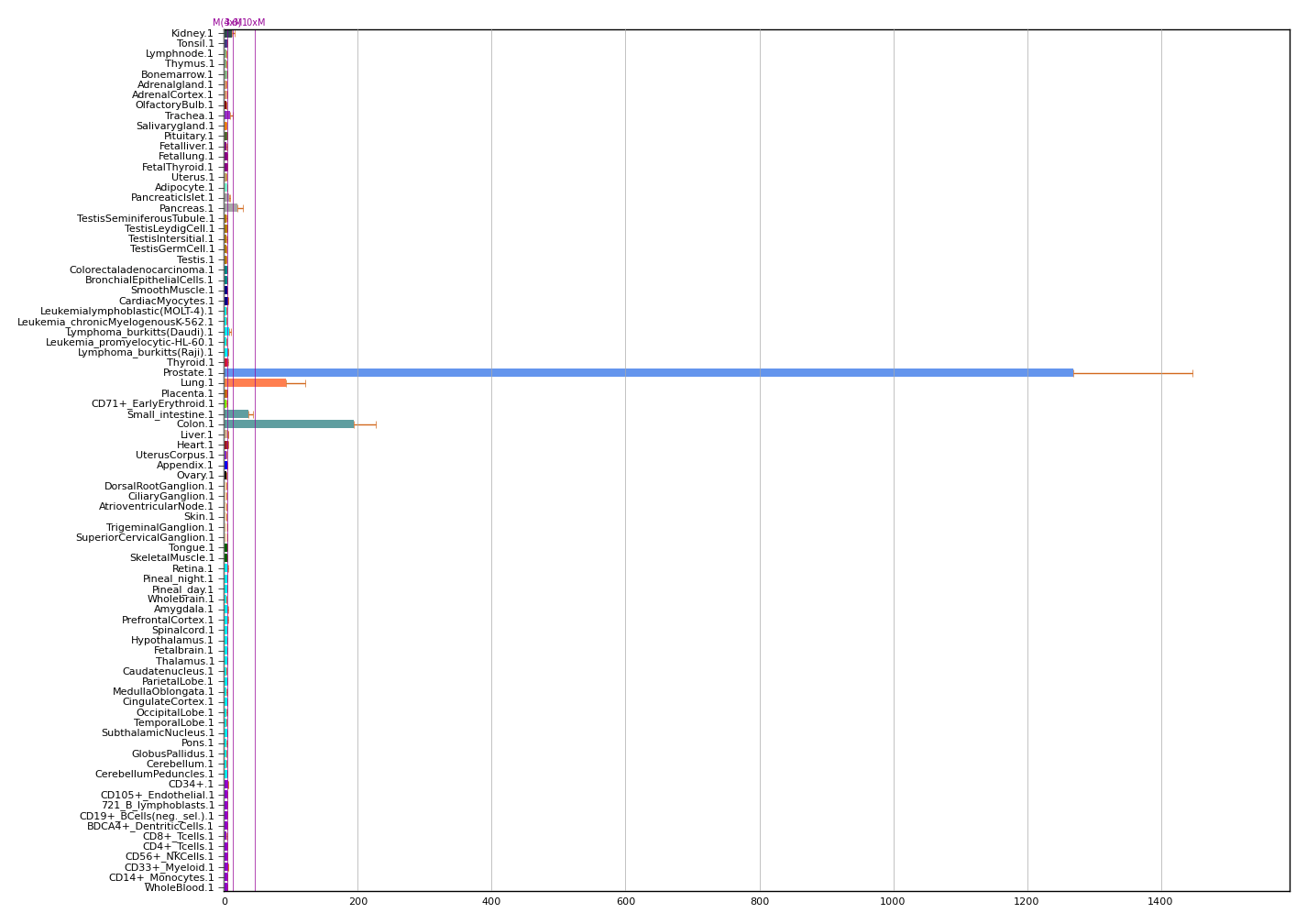
Мы выделили ферменты ACE2 и TMPRSS2, как ключевые клеточные белки, нужные для проникновения SARS-CoV-2 в клетку. А теперь давайте посмотрим на РНК-профили экспрессии этих генов (рис. 5). Видите, где максимальный уровень экспрессии?
Дам несколько секунд на разглядывание...
Правильно, ACE2 — в яичках, а TMPRSS2 — в простате. Хочу также напомнить, что гораздо более склонны к тяжелому протеканию COVID-19 (с необходимостью подключения к ИВЛ и отказом целых систем органов) именно мужчины.
Это вовсе не новость, но было забавно в процессе написания этой статьи наткнуться на представленные выше данные, и хотелось поделиться. Но вернемся к полиморфизмам.
Попытка обобщения
Влияние однонуклеотидных полиморфизмов на восприимчивость к инфекциям и течение инфекционного процесса определяется, как мы уже выяснили, локализацией снипов, и проявляется в нескольких плоскостях:
- В комплексе клеточных элементов, вовлеченных в цикл «проникновение-репликация вируса», например, при формировании резистентности к ВИЧ.
- На уровне иммунного ответа организма на вирусную инфекцию, например, в виде регуляции продукции IL-10 при инфицировании вирусом Эпштейна—Барр.
- На этапе лечения, например, повышением восприимчивости к терапии при гепатите C.
Заключение
Полезно понимать, что человечество генетически неоднородно. Даже в одной популяции присутствует бесчисленное множество небольших отличий, по-разному проявляющих себя в контексте инфекционных заболеваний, на которых мы сегодня заострили внимание.
Какова же практическая значимость этих научных знаний, и как они могут изменить жизнь в недалеком будущем?
С постоянным удешевлением технологий секвенирования, в том числе цельногеномного секвенирования, можно представить, как получение информации о полном геноме человека станет частью медицинской страховки. Тогда ученым и медикам станут доступны такие вещи, как персонализированное лечение и выделение наиболее уязвимых групп населения для, например, приоритетной вакцинации. Для всех перечисленных возможных практик совершенно необходимо ясное понимание влияния даже самых малых вариаций генома человека на все аспекты его физиологии.
Разумеется, однонуклеотидные полиморфизмы не отвечают напрямую на вопрос «заболею ли я той или иной инфекцией?», равно как не объясняют на 100% разные истории из жизни, в которых переболела вся семья, но один остался незатронутым болезнью. Однако мы надеемся, что этот небольшой экскурс в мир однонуклеотидных полиморфизмов оказался для вас познавательным и интересным!
Литература
- Thomas A Sasani, Brent S Pedersen, Ziyue Gao, Lisa Baird, Molly Przeworski, et. al.. (2019). Large, three-generation human families reveal post-zygotic mosaicism and variability in germline mutation accumulation. eLife. 8;
- V. Pereira, L. Gusmão. (2013). X-Chromosome Markers. Encyclopedia of Forensic Sciences. 257-263;
- Ina Giegling, Annette M. Hartmann, Hans-Jürgen Möller, Dan Rujescu. (2006). Anger- and aggression-related traits are associated with polymorphisms in the 5-HT-2A gene. Journal of Affective Disorders. 96, 75-81;
- V. M. INGRAM. (1956). A Specific Chemical Difference Between the Globins of Normal Human and Sickle-Cell Anæmia Hæmoglobin. Nature. 178, 792-794;
- V. M. INGRAM. (1957). Gene Mutations in Human Hæmoglobin: the Chemical Difference Between Normal and Sickle Cell Hæmoglobin. Nature. 180, 326-328;
- Guixiang Ji, Yan Long, Yong Zhou, Cong Huang, Aihua Gu, Xinru Wang. (2012). Common variants in mismatch repair genes associated with increased risk of sperm DNA damage and male infertility. BMC Med. 10;
- Noelle-Angelique M. Molinari, Ismael R. Ortega-Sanchez, Mark L. Messonnier, William W. Thompson, Pascale M. Wortley, et. al.. (2007). The annual impact of seasonal influenza in the US: Measuring disease burden and costs. Vaccine. 25, 5086-5096;
- Z. Wang, A. Zhang, Y. Wan, X. Liu, C. Qiu, et. al.. (2014). Early hypercytokinemia is associated with interferon-induced transmembrane protein-3 dysfunction and predictive of fatal H7N9 infection. Proceedings of the National Academy of Sciences. 111, 769-774;
- Aaron R. Everitt, The GenISIS Investigators, Simon Clare, Thomas Pertel, Sinu P. John, et. al.. (2012). IFITM3 restricts the morbidity and mortality associated with influenza. Nature. 484, 519-523;
- Yong-Hong Zhang, Yan Zhao, Ning Li, Yan-Chun Peng, Eleni Giannoulatou, et. al.. (2013). Interferon-induced transmembrane protein-3 genetic variant rs12252-C is associated with severe influenza in Chinese individuals. Nat Commun. 4;
- Estefanía Herrera-Ramos, Marta López-Rodríguez, José Ruíz-Hernández, Juan Horcajada, Luis Borderías, et. al.. (2014). Surfactant protein A genetic variants associate with severe respiratory insufficiency in pandemic influenza A virus infection. Critical Care. 18, R127;
- Jeffrey I. Cohen. (2000). Epstein–Barr Virus Infection. N Engl J Med. 343, 481-492;
- Merja Helminen, Nina Lahdenpohja, Mikko Hurme. (1999). Polymorphism of the Interleukin‐10 Gene Is Associated with Susceptibility to Epstein‐Barr Virus Infection. J INFECT DIS. 180, 496-499;
- Merja E. Helminen, Sanna Kilpinen, Miia Virta, Mikko Hurme. (2001). Susceptibility to Primary Epstein‐Barr Virus Infection Is Associated with Interleukin‐10 Gene Promoter Polymorphism. J INFECT DIS. 184, 777-780;
- Saeed Mohammadi, Marie Saghaeian Jazi, Mojtaba Zare Ebrahimabad, Farnaz Eghbalpour, Nafiseh Abdolahi, et. al.. (2019). Interleukin 10 gene promoter polymorphisms (rs1800896, rs1800871 and rs1800872) and haplotypes are associated with the activity of systemic lupus erythematosus and IL10 levels in an Iranian population. Int J Immunogenet. 46, 20-30;
- M. Dean, M. Carrington, C. Winkler, G. A. Huttley, M. W. Smith, et. al.. (1996). Genetic Restriction of HIV-1 Infection and Progression to AIDS by a Deletion Allele of the CKR5 Structural Gene. Science. 273, 1856-1862;
- Rong Liu, William A Paxton, Sunny Choe, Daniel Ceradini, Scott R Martin, et. al.. (1996). Homozygous Defect in HIV-1 Coreceptor Accounts for Resistance of Some Multiply-Exposed Individuals to HIV-1 Infection. Cell. 86, 367-377;
- Michel Samson, Frédérick Libert, Benjamin J. Doranz, Joseph Rucker, Corinne Liesnard, et. al.. (1996). Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 382, 722-725;
- Harish Nair, D James Nokes, Bradford D Gessner, Mukesh Dherani, Shabir A Madhi, et. al.. (2010). Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. The Lancet. 375, 1545-1555;
- Yan Sun, Carolina B. López. (2017). The innate immune response to RSV: Advances in our understanding of critical viral and host factors. Vaccine. 35, 481-488;
- Meri Lahti, Johan Löfgren, Riitta Marttila, Marjo Renko, Tuula Klaavuniemi, et. al.. (2002). Surfactant Protein D Gene Polymorphism Associated with Severe Respiratory Syncytial Virus Infection. Pediatr Res. 51, 696-699;
- Johan Löfgren, Mika Rämet, Marjo Renko, Riitta Marttila, Mikko Hallman. (2002). Association between Surfactant Protein A Gene Locus and Severe Respiratory Syncytial Virus Infection in Infants. J INFECT DIS. 185, 283-289;
- Neal J Thomas, Susan Diangelo, Joseph C Hess, Ruzong Fan, Margaret W Ball, et. al.. (2009). Transmission of Surfactant Protein Variants and Haplotypes in Children Hospitalized With Respiratory Syncytial Virus. Pediatr Res. 66, 70-73;
- Riny Janssen, Louis Bont, Christine L. E. Siezen, Hennie M. Hodemaekers, Marieke J. Ermers, et. al.. (2007). Genetic Susceptibility to Respiratory Syncytial Virus Bronchiolitis Is Predominantly Associated with Innate Immune Genes. J INFECT DIS. 196, 826-834;
- T.L. Kresfelder, R. Janssen, L. Bont, M. Venter. (2011). Confirmation of an association between single nucleotide polymorphisms in the VDR gene with respiratory syncytial virus related disease in South African Children. J. Med. Virol.. 83, 1834-1840;
- J. Dayre McNally, Margaret Sampson, Loren A. Matheson, Brian Hutton, Julian Little. (2014). Vitamin D receptor (VDR) polymorphisms and severe RSV bronchiolitis: A systematic review and meta-analysis. Pediatr Pulmonol.. 49, 790-799;
- Arie Jan Stoppelenburg, Johannes Hendrick von Hegedus, Ron Huis in't Veld, Louis Bont, Marianne Boes. (2014). Defective control of vitamin D receptor-mediated epithelial STAT1 signalling predisposes to severe respiratory syncytial virus bronchiolitis. J. Pathol.. 232, 57-64;
- Harvey J. Alter, Leonard B. Seeff. (2000). Recovery, Persistence, and Sequelae in Hepatitis C Virus Infection: A Perspective on Long-Term Outcome. Semin Liver Dis. Volume 20, 0017-0036;
- Гепатит С. (2020). ВОЗ;
- Souvik Sarkar, Zhen Jiang, Donna M. Evon, Abdus S. Wahed, Jay H. Hoofnagle. (2012). Fatigue before, during and after antiviral therapy of chronic hepatitis C: Results from the Virahep-C study. Journal of Hepatology. 57, 946-952;
- Anouk T. Dev, Rhonda McCaw, Vijaya Sundararajan, Scott Bowden, William Sievert. (2002). Southeast Asian patients with chronic hepatitis C: The impact of novel genotypes and race on treatment outcome. Hepatology. 36, 1259-1265;
- K.J. Helbig, J. George, M.R. Beard. (2005). A novel I-TAC promoter polymorphic variant is functional in the presence of replicating HCV in vitro. Journal of Clinical Virology. 32, 137-143;
- Vijayaprakash Suppiah, for the Hepatitis C Study, Max Moldovan, Golo Ahlenstiel, Thomas Berg, et. al.. (2009). IL28B is associated with response to chronic hepatitis C interferon-α and ribavirin therapy. Nat Genet. 41, 1100-1104;
- Yasuhito Tanaka, Nao Nishida, Masaya Sugiyama, Masayuki Kurosaki, Kentaro Matsuura, et. al.. (2009). Genome-wide association of IL28B with response to pegylated interferon-α and ribavirin therapy for chronic hepatitis C. Nat Genet. 41, 1105-1109;
- Andri Rauch, Zoltán Kutalik, Patrick Descombes, Tao Cai, Julia Di Iulio, et. al.. (2010). Genetic Variation in IL28B Is Associated With Chronic Hepatitis C and Treatment Failure: A Genome-Wide Association Study. Gastroenterology. 138, 1338-1345.e7;
- Behrooz Darbani. (2020). The Expression and Polymorphism of Entry Machinery for COVID-19 in Human: Juxtaposing Population Groups, Gender, and Different Tissues. IJERPH. 17, 3433;
- Yonghong Zhang, Ling Qin, Yan Zhao, Ping Zhang, Bin Xu, et. al.. (2020). Interferon-Induced Transmembrane Protein 3 Genetic Variant rs12252-C Associated With Disease Severity in Coronavirus Disease 2019. The Journal of Infectious Diseases. 222, 34-37;
- Andrea Latini, Emanuele Agolini, Antonio Novelli, Paola Borgiani, Rosalinda Giannini, et. al.. (2020). COVID-19 and Genetic Variants of Protein Involved in the SARS-CoV-2 Entry into the Host Cells. Genes. 11, 1010.