
Нейроинтерфейсы: как наука ставит людей на ноги
16 февраля 2021
Нейроинтерфейсы: как наука ставит людей на ноги
- 12204
- 0
- 1
Роботизированный экзоскелет, управляемый нейроинтерфейсом.
Рисунок в полном размере.
фото с сайта Clinatec
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В СМИ часто можно услышать о проектах, которые помогают парализованным людям взаимодействовать с окружающим миром. Но в этой статье мы поговорим о не менее интересной, но более обойдённой вниманием теме — о нейроинтерфейсах, помогающих людям с параличом конечностей восстанавливать самостоятельную двигательную активность.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Партнер номинации — Российский научный фонд.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Более 5 миллионов человек в мире страдают от разной формы параличей, основные причины которых — инсульт (34%) и повреждение спинного мозга (24%).
Инсульт в настоящее время является одной из основных причин инвалидизации населения. В России ежегодно регистрируется более 450 000 инсультов, и инвалидами становятся 70–80% выживших после инсульта, причём примерно 20–30% из них нуждаются в постоянном постороннем уходе.
За последние 70 лет количество больных с травмой спинного мозга возросло в 200 раз, и в России подобные повреждения ежегодно получают более 8 000 человек. Чаще всего это приводит к неспособности больного самостоятельно передвигаться и обеспечивать свои основные потребности. В результате использования инвалидной коляски уменьшается физическая активность, что провоцирует развитие ряда заболеваний: болезни сердца, остеопороз, пролежни. Поэтому идет активный поиск альтернативных методов восстановления способности двигаться. Одной из самых новых разработок в этом направлении является нейроинтерфейс.
Нейроинтерфейс (он же интерфейс «мозг-компьютер», ИМК) — система, позволяющая передавать сигналы мозга напрямую на внешнее устройство (это может быть инвалидная коляска, экзоскелет, компьютер и др.), фактически управлять «силой мысли» (рис. 1).
В «Биомолекуле» можно более подробно прочитать про историю развития нейрокомпьютерных технологий, а также про современный проект Neuralink Илона Маска [1], [2].
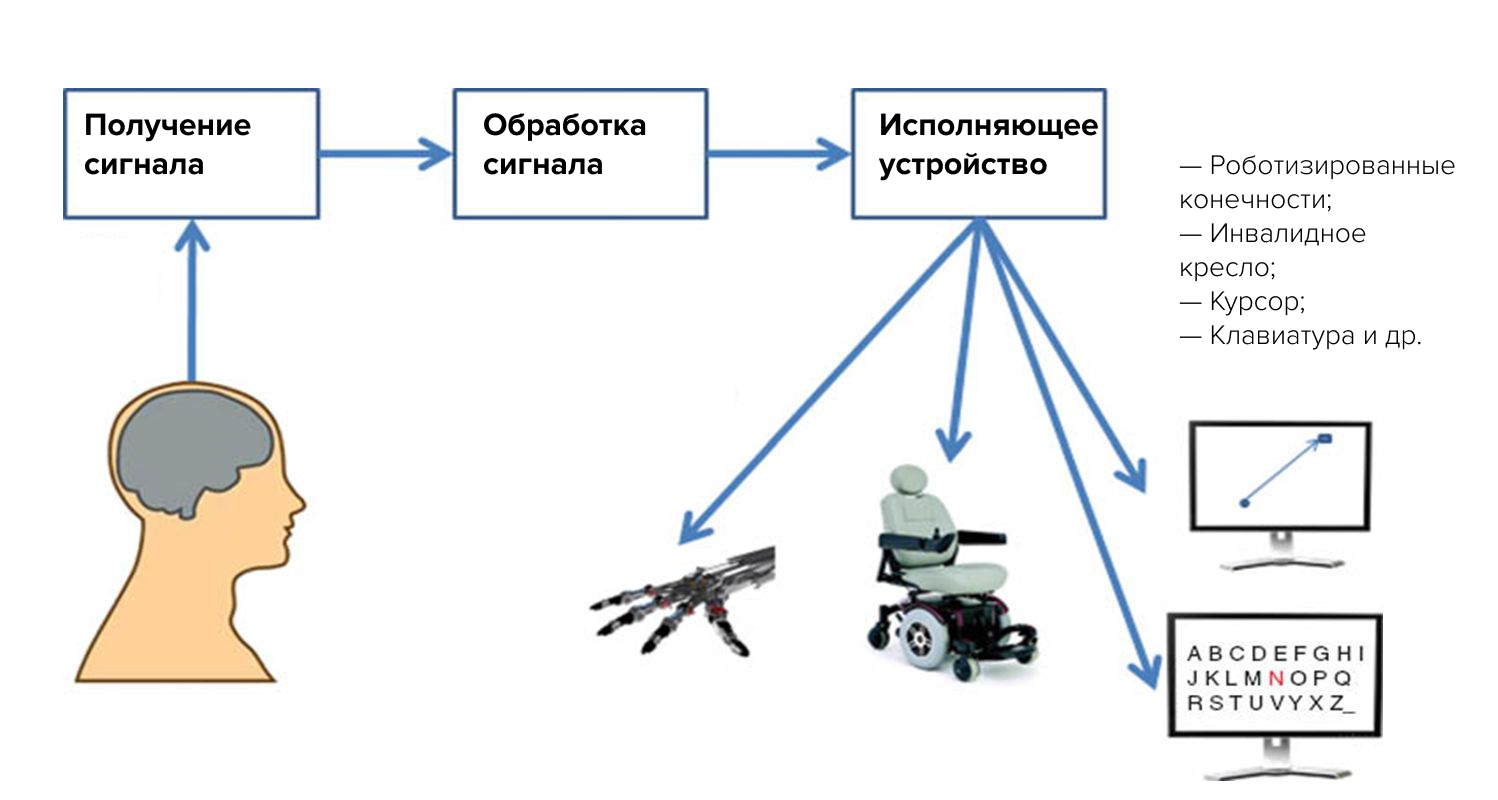
Рисунок 1. Схема работы ИМК.
адаптировано по материалам сайта Tritriwulansari
Методы регистрации сигналов мозга
Первое звено в схеме работы ИМК — это получение сигнала от мозга. Для этого используют следующие методы:
- электроэнцефалография (ЭЭГ), регистрирующая электрические сигналы мозга;
- магнитоэнцефалография (МЭГ), регистрирующая магнитные поля, возникающие вследствие электрической активности мозга;
- спектрометрия ближнего инфракрасного диапазона (БИКС), измеряющая насыщенность крови гемоглобином (чем активнее группа нейронов, тем больше она использует кислорода, переносимого оксигемоглобином);
- функциональная магнитно-резонансная томография (фМРТ), основанная на измерении притока крови к разным областям мозга (чем активнее группа нейронов, тем бóльший приток крови к ней).
Сейчас в ИМК для получения информации об электрической активности мозга наиболее часто применяют ЭЭГ, так как она имеет высокое временное разрешение (электроды позволяют считывать немедленную активность отдельных участков мозга), относительно дешева, портативна и не представляет риска для пользователей. ИМК, основанные на ЭЭГ, состоят из набора сенсоров, улавливающих ЭЭГ-сигналы от различных областей мозга. Однако качество сигналов ЭЭГ ухудшается из-за того, что сигнал проходит через скальп, череп, а также множество других слоев, что создает шум.
Для уменьшения шума и улучшения качества записи прибегают к инвазивным способам — имплантированию внутрь черепа набора микроэлектродов [3]. Это подразумевает значительный риск для здоровья, из-за чего их редко задействуют в экспериментальной практике. В исследованиях ИМК существуют два инвазивных подхода: электрокортикография (ЭКоГ), при которой электроды располагаются на поверхности коры головного мозга, и интракортикальная запись нейронной активности — когда датчики имплантируют в кору (рис. 2). Такие решения в настоящее время применяют крайне редко, только в исключительных случаях: либо когда пациенту и так предстоит операция на мозге, либо когда это единственный шанс на возвращение возможности взаимодействовать с окружающим миром.
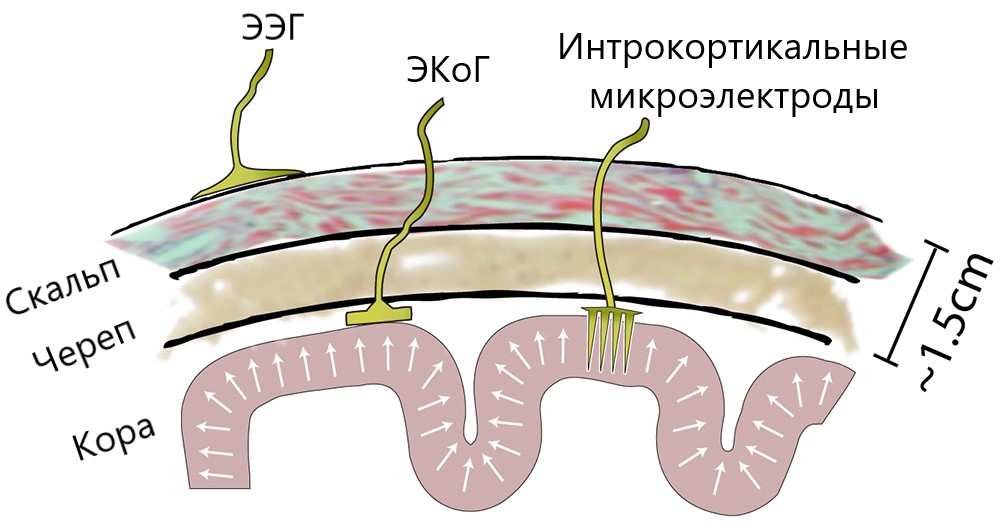
Рисунок 2. Схема расположения электродов для ЭЭГ, ЭКоГ и интракортикальных микроэлектродов.
адаптировано из [3]
Сенсомоторный ритм и моторная кора
Как мы уже говорили, цель ИМК — улавливание намерения пользователя посредством регистрации его мозговой активности. При регистрации мозговой активности с помощью ЭЭГ мы получаем графическое изображение сложного колебательного электрического процесса, в котором можно выделить ряд определённых ритмов, которые отличаются между собой по амплитуде и частоте: альфа, бета, дельта, мю и другие. Сейчас нас интересует мю-ритм, так как именно на его основе работают нейроинтерфейсы, используемые в нейрореабилитации движений.
Мю-ритм, или сенсомоторный ритм (СМР), имеет частоту 8–13 Гц и регистрируется над моторной областью коры головного мозга, расположенной в задней части прецентральной извилины (рис. 3). Подавление мю-ритма происходит тогда, когда человек совершает какое-либо движение или воображает выполнение движения — это называется десинхронизацией, связанной с событием (event-related desynchronization, ERD). Это происходит потому, что нейроны, которые до этого возбуждались синхронно, приобретают индивидуальные, не похожие друг на друга паттерны возбуждения. При этом человек может тренироваться в воображении движений, и со временем подавление мю-ритма при этом становится всё более выраженным, что используют при обучении управлению ИМК.
Для моторной коры характерна топическая организация. Это значит, что каждому участку коры соответствует определённый участок тела, который она контролирует. На рисунке 3 изображен гомункулус Пенфилда, части тела которого пропорциональны зонам мозга, в которых они представлены. Как видно из рисунка, представительства верхних и нижних конечностей находятся достаточно далеко друг от друга, благодаря чему возможно раздельное распознавание нейроинтерфейсом воображения движений рук и ног.
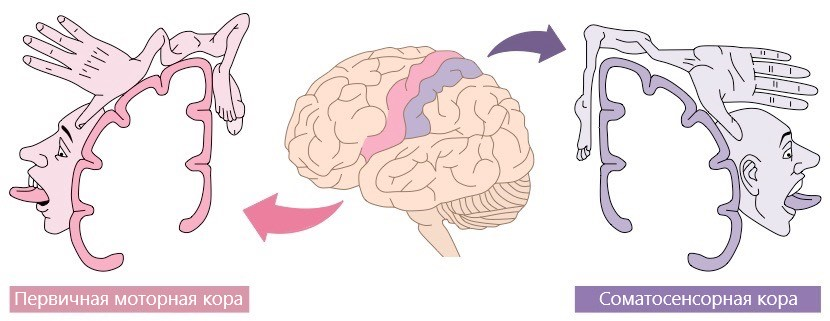
Рисунок 3. Соматосенсорный и моторный гомункулус.
адаптировано по материалам сайта BioNinja
Обратите внимание, что представительство нижних конечностей в моторной коре значительно меньше представительства верхних. Это легко объяснимо наличием мелкой моторики рук: мозгу нужно контролировать множество отдельных мышц пальцев. У ног же, наоборот, мало мышц, которыми нужно управлять, и они более крупные. К тому же видно, что представительство нижних конечностей попадает в межполушарную щель, что затрудняет распознавание сигналов ЭЭГ, генерируемых при воображении движений разных групп мышц ног. Поэтому использование ИМК для ног вызывает определённые сложности, и большинство существующих научных работ по нейрореабилитации с помощью ИМК посвящено именно верхним конечностям, так как с их воображением проще работать. В лаборатории физиологии движений Института физиологии им. И.П. Павлова РАН, где работает автор, проводят исследования, направленные на изучение процессов реабилитации нижних конечностей, а также на возможность применения при этом чрескожной электростимуляции спинного мозга (ЧЭССМ) и специальных практик, помогающих увеличить эффективность управления ИМК [4].
Как эффективно воображать движения
Известны следующие особенности воображения движений, которые повышают его эффективность:
- Кинестетическое (с обращением внимания на ощущения от мышц и суставов) представление, а не зрительное [5];
- Представление от первого лица, а не от третьего [6];
- Воображение движений после реально осуществлённого действия [7];
- Использование обратной связи (когда человеку показывают, насколько хорошо он справляется с заданием) [8]. Высокую эффективность показала обратная связь в виде виртуальной реальности: при воображении движений ног аватар, которым управляет испытуемый, идет вперёд, а при прекращении воображения — останавливается. Задача испытуемого — идти вперёд и останавливаться в определенных точках виртуального пространства [9–12];
- Одновременный просмотр видео, в котором выполняется соответствующее движение, помогает усилить десинхронизацию мю-ритма за счет работы зеркальных нейронов [13];
- Применение медитативных практик, в частности, медитации осознанности (mindfulness meditation) [14].
Кроме того, нами было показано, что эффективность воображения движений зависит от личностных характеристик человека [15].
Для эксперимента было набрано 44 человека с ведущей правой рукой. Все они проходили тестирование по опроснику Кеттелла, который определяет 16 основных индивидуальных особенностей. Далее испытуемые управляли ИМК, основанном на воображении движений рук. Оказалось, что при воображении движений правой руки успешнее экспрессивные чувствительные экстраверты, а при воображении движений левой руки — практичные, сдержанные, скептичные и не очень общительные люди.
Мы предполагаем, что это можно объяснить разным уровнем содержания дофамина в правом и левом полушариях, а также разницей в способах кодирования информации о движениях [16]. Более подробно об этом можно прочитать в статье, опубликованной автором и коллегами в журнале «Доклады Академии наук» [15]. Знание личных психологических параметров пользователя ИМК может помочь в разработке индивидуальных тренингов и методов подготовки перед управлением нейроинтерфейсами.
Зачем же нужно воображение движений и работа с нейроинтерфейсами? Как это может помочь людям с нарушениями движений? Разберём эти вопросы на примере двух самых распространенных причин двигательных расстройств — инсульта и травмы спинного мозга.
Механизмы нейропластичности
При инсульте происходит острое нарушение кровоснабжения головного мозга (либо в результате закупоривания сосуда тромбом — ишемический инсульт, либо в результате кровоизлияния — геморрагический). Так как вместе с кровью к нейронам перестаёт поступать всё, что необходимо им для жизнедеятельности, участки мозга, где остановилось кровообращение, отмирают. И если это зоны, отвечающие за двигательную активность — например, моторная область коры, то у больного возникает гемипарез, снижение силы мышц одной стороны тела, или гемиплегия, полный паралич половины тела.
Восстановление двигательной функции осуществляется в основном за счет механизмов нейропластичности — способности мозга изменяться под действием опыта: устанавливать новые связи между нейронами, разрушать старые и ненужные, восстанавливать утраченные после повреждения. В данных процессах принимают участие не только нейроны, но и клетки нейроглии, а также сосудистая система [17]. Также изменяется активность синапсов и их количество [18]. Для активации данных механизмов в медицине применяется двигательная реабилитация. Однако у пациентов с параличом или высокой степенью пареза осуществление реальных движений невозможно, поэтому прибегают к тренировкам с ИМК, основанном на воображении движений. При представлении движений активируются те же зоны мозга, которые также участвуют в подготовке реального действия и в его совершении, вследствие чего такая нейрореабилитация становится реальной [19].
Благодаря таким реабилитационным тренировкам происходит перестройка нейронов вокруг повреждённой области: увеличивается объём серого вещества в двигательной зоне мозга, а соседние участки берут на себя утраченные функции [20]. Двигательные области неповреждённого полушария также участвуют в этом процессе.
Эффективность этих занятий может быть повышена за счёт использования биологической обратной связи — зрительной или тактильной — когда пациент видит на экране монитора, насколько хорошо он справляется с заданием (воображением движения конечности), или когда он чувствует вибрацию от специального прибора при успешном выполнении задачи.
Также существуют системы, дающие двигательную обратную связь: например, когда человек воображает движение правой ноги, приводя её в движение специальным механизмом. По такому принципу работает система «Биокин» (ООО «Косима»), разработанная под руководством Герасименко Ю.П. (Институт физиологии им. И.П. Павлова РАН) (рис. 4) [21]. Она включает в себя обратную связь, функциональную электростимуляцию (ФЭС) и чрескожную электростимуляцию спинного мозга (ЧЭССМ), что делает её высокоэффективным инструментом в области нейрореабилитации нижних конечностей [22].

Рисунок 4. Биокин. Комплекс для нейрореабилитации нижних конечностей, основанный на применении ИМК с обратной связью, ФЭС (функциональной электростимуляции) и ЧЭССМ (чрескожной электростимуляции спинного мозга).
сайт «Биокин»
Такие системы позволяют замкнуть сенсомоторную петлю: от посылаемого мозгом эфферентного (исходящего) сигнала двигательной активности к афферентному (приходящему) сигналу о сенсорной обратной связи (рис. 5) [23].
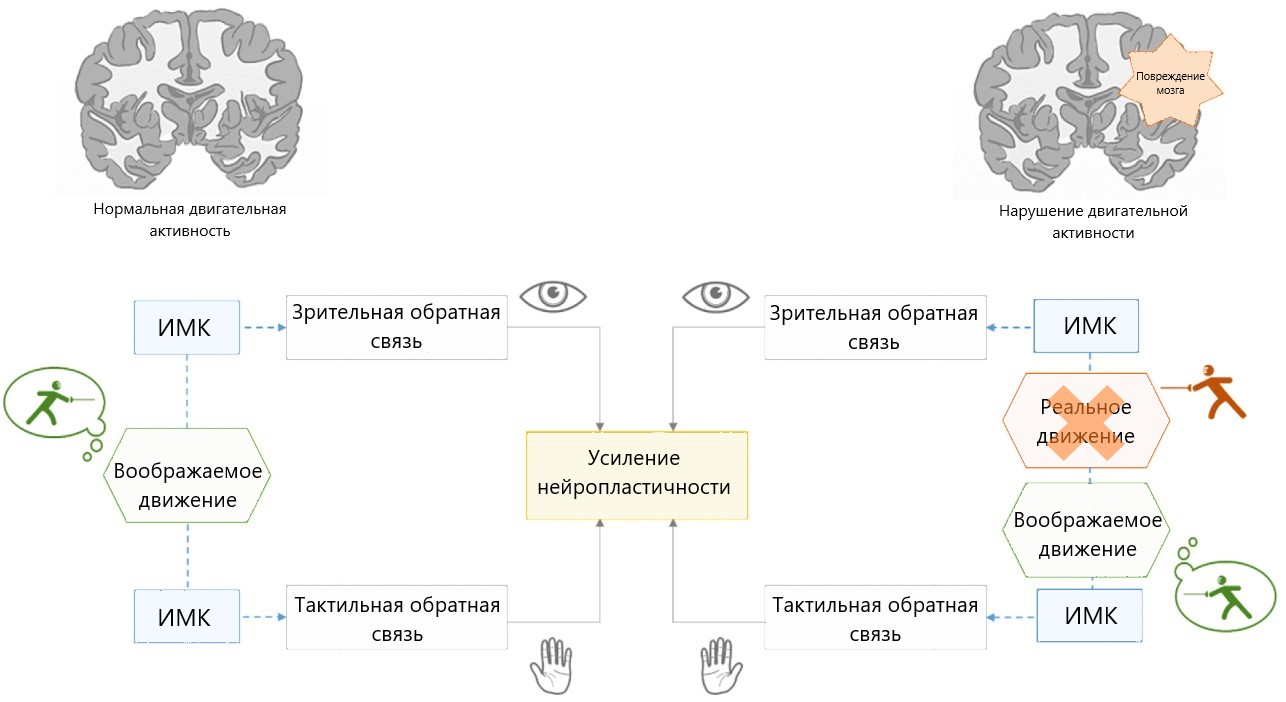
Рисунок 5. Нейропластичность, вызываемая использованием ИМК, основанном на воображении движений. При повреждении моторных областей коры реальное движение становится невыполнимым, поэтому для активации процессов нейропластичности остаётся только возможность воображения движений. Использование ИМК со зрительной и тактильной обратной связью обеспечивает усиление этих процессов.
адаптировано из [23]
Данный механизм реабилитации может объяснить концепция пластичности Хебба: при одновременной активации двух связанных друг с другом нейронов усиливается их синаптическое взаимодействие, что приводит к более надёжному контакту между ними (рис. 6). Если предположить, что передача сигнала от моторной коры головного мозга к мышцам конечностей была нарушена из-за инсульта или травмы, то одновременная активация сенсорной и моторной коры может усиливать ранее неактивные контакты между нейронами за счет пластичности и таким образом вести к восстановлению двигательной функции конечностей [24].
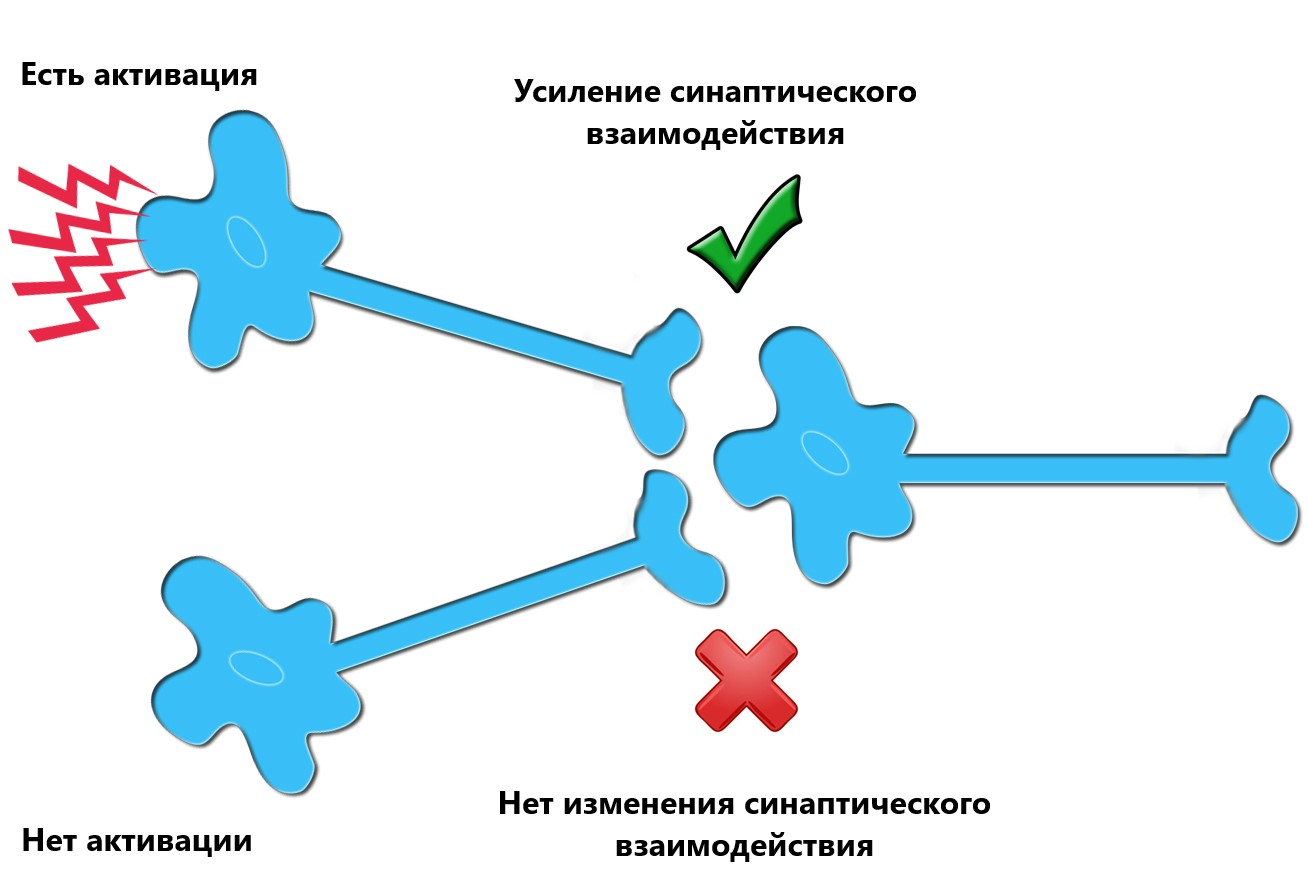
Рисунок 6. Механизм пластичности Хебба. Усиление синаптического взаимодействия между двумя нейронами происходит из-за повторяющейся стимуляции постсинаптической клетки пресинаптической клеткой.
адаптировано из «Википедии»
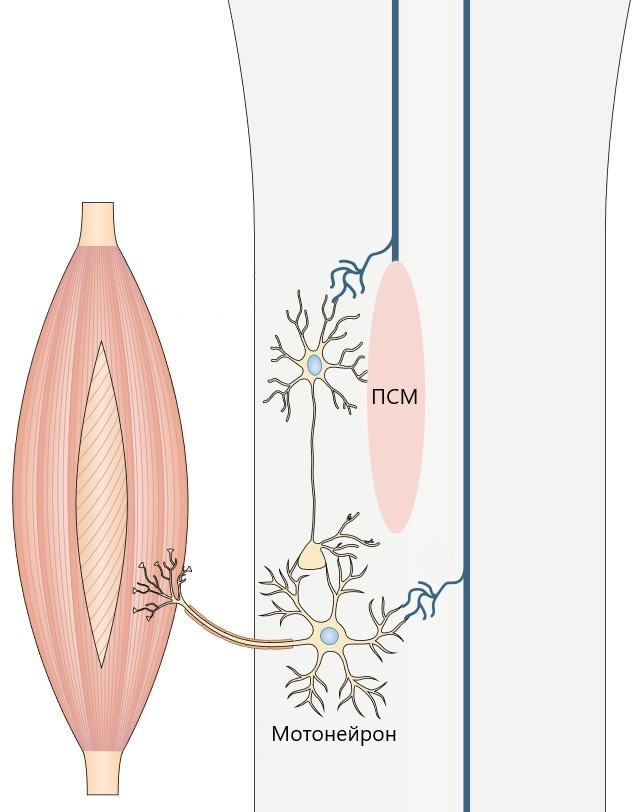
Рисунок 7. Образование новый нейронных связей в области повреждения спинного мозга (ПСМ).
адаптировано из [25]
При восстановлении двигательной функции после травмы спинного мозга задействованы те же механизмы нейропластичности. При таком повреждении часть нервных волокон, в том числе двигательных, оказывается прервана, что вызывает паралич конечностей, а часть сохраняет свою целостность. Благодаря этому при проведении нейрореабилитации существует возможность активации процессов нейропластичности: неповреждённые волокна образуют синаптические связи с двигательными нейронами (мотонейронами), которые, в свою очередь, передают сигнал мышцам (рис. 7) [25].
Для увеличения эффективности нейрореабилитации при помощи ИМК часто дополнительно используют функциональную электростимуляцию мышц (ФЭС). Она обеспечивает сокращение мышцы в тот момент, когда пользователь воображает движение с участием этой мышцы (рис. 8) [26]. Это приводит к усилению нейропластичности по механизму Хебба: происходит одновременная активация моторных областей головного мозга, передающих сигнал мотонейронам спинного мозга, и чувствительных нейронов, активируемых сокращающейся под влиянием ФЭС мышцей, что замыкает сенсомоторную петлю.
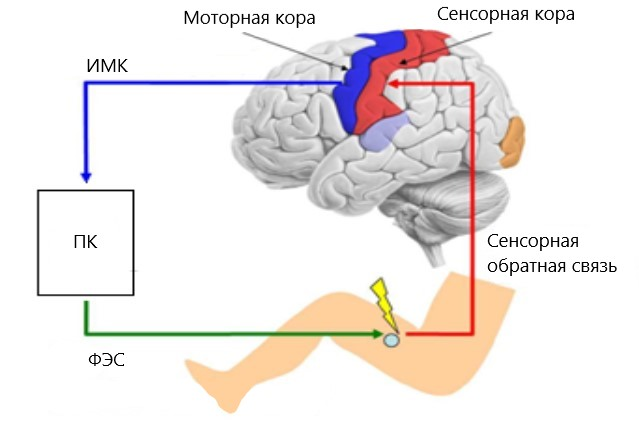
Рисунок 8. Система ИМК-ФЭС. При воображении движений сигнал из моторной коры обрабатывается компьютером (ПК) и передаётся к прибору функциональной электростимуляции (ФЭС), который вызывает сокращение соответствующей мышцы. Далее сигнал от мышцы передается в сенсорную кору, обеспечивая обратную связь.
адаптировано из [26]
Электростимуляция спинного мозга
В последние годы большую эффективность в нейрореабилитации после повреждения спинного мозга показала его электростимуляция (ЭССМ). Спинной мозг имеет два утолщения: в области шеи и поясницы, что соответствует месту выхода из них корешков двигательных нейронов верхних и нижних конечностей. В поясничном утолщении спинного мозга находятся специализированные нейронные сети, обеспечивающие автоматический процесс шагания (генераторы шагательных движений, ГШД). Иными словами, если наложить на твердую оболочку спинного мозга в месте поясничного утолщения электроды, подающие ток определенной амплитуды и частоты, можно вызвать непроизвольные шагательные движения даже у людей с параличом нижних конечностей [27]. Однако такой способ требует хирургического вмешательства, так что существует риск развития послеоперационных осложнений.
В настоящее время наиболее безопасной и безболезненной считается чрескожная электростимуляция спинного мозга (ЧЭССМ). На видео 1 (Edgerton Lab, University of California) можно видеть, как вызываются непроизвольные шагательные движения ног при облегченном положении больного, с подвешенными на рамах-качелях ногами [28].
Видео 1. Непроизвольная ходьба при чрескожной электростимуляции спинного мозга.
При использовании ЧЭССМ появляется вопрос правильного расположения стимулирующих электродов. Если при установке инвазивных электродов во время операции хорошо различимы сегменты и корешки спинного мозга, то при установке накожных электродов могут возникнуть затруднения с нахождением нужного участка. Данную задачу решают с помощью подачи одиночных импульсов на электрод и регистрации рефлекторных мышечных ответов — ведь каждому сегменту спинного мозга соответствуют строго определённые группы мышц.
Также существует проблема недостаточной амплитуды посылаемых импульсов — из-за дегенеративных процессов при повреждении спинного мозга требуется большая амплитуда стимуляции для получения нужного ответа. Однако это чревато получением ожогов. В нашей лаборатории было создано оптимальное устройство для неинвазивной электрической стимуляции спинного мозга [29].
Кроме того, была разработана система, детектирующая фазы шагательного цикла в онлайн-режиме и стимулирующая спинной мозг согласно этим фазам [30]. Во время ходьбы в разные моменты напрягаются разные мышцы, и под определёнными углами сгибаются суставы, что можно регистрировать специальными приборами — акселерометрами и гироскопами. Обе ноги движутся скоординировано, и на основании положения одной ноги можно предсказать положение другой. Принцип работы системы следующий: пациенту с гемипарезом на здоровую ногу накладываются датчики движения, которые передают сигнал к прибору для ЧЭССМ. Он, в свою очередь, стимулирует в определённые моменты времени группы мотонейронов спинного мозга, отвечающих за движение мышц-сгибателей и разгибателей ноги, что способствует нормализации ходьбы и восстановлению движения пораженной конечности.
Успехи современной нейрореабилитации
Самым масштабным исследованием в области нейрореабилитации с использованием ИМК, основанного на воображении движений, является работа Donati с соавторами, опубликованная в Nature в 2016 году [31]. В этом исследовании приняли участие восемь человек с параличом нижних конечностей, вызванным повреждением спинного мозга. Для них была разработана специальная система реабилитации, включающая в себя шесть этапов с увеличивающейся сложностью, и с каждым пациентом было проведено около 255 (!) сессий в течение года.
Первый этап включал в себя глубокое погружение в среду виртуальной реальности, во время которого испытуемый управлял перемещением своего аватара (компьютерного персонажа), воображая движение нижних конечностей в положении сидя. Затем пациент делал то же самое, только в положении стоя, с опорой на специальный стол. Во время третьего этапа проходили тренировки на беговой дорожке: испытуемый ходил с использованием прибора, поддерживающего вес тела (Lokomat). На четвёртом этапе осуществлялось движение ног уже в воздухе, а не по беговой дорожке. На пятом этапе пациент тренировался на беговой дорожке с помощью роботизированной системы, поддерживающей конечности и контролируемой ИМК. И на заключительной стадии испытуемый ходил в экзоскелете, управляемом ИМК: экзоскелет делал шаг, когда человек представлял себе движение соответствующей ноги. Во время всех тренингов испытуемые получали тактильную обратную связь — вибрацию, которая подавалась на предплечье, когда виртуальная или роботизированная нога с той же стороны касалась земли. Схему эксперимента вы можете увидеть на рисунке 9, а сам процесс реабилитации — на видео 2.
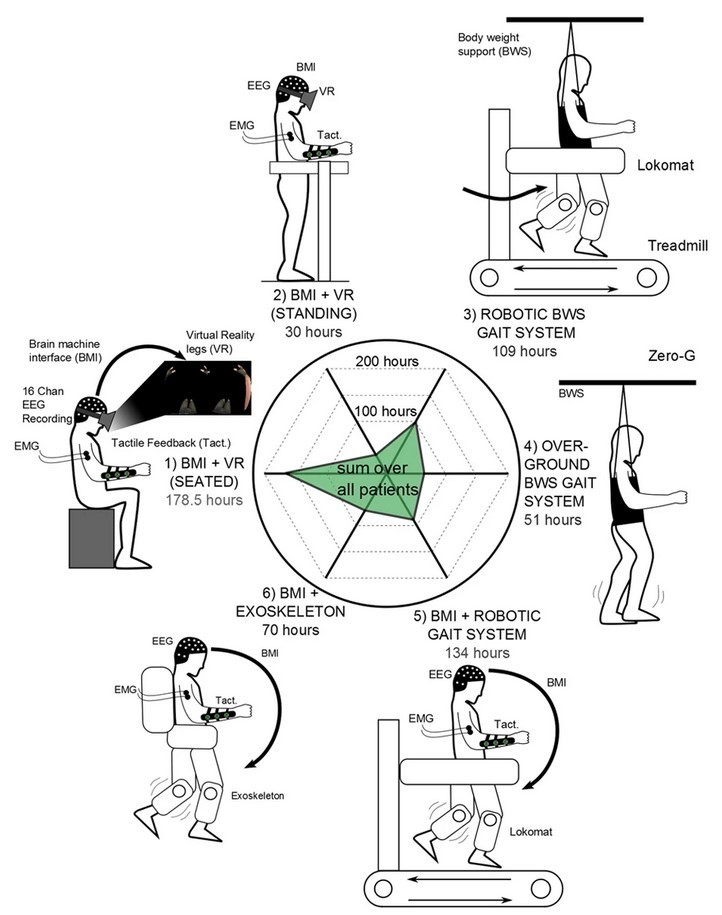
Рисунок 9. Схема эксперимента, включающая в себя шесть этапов: 1 — ИМК + виртуальная реальность (ВР) в положении сидя; 2 — ИМК + ВР в положении стоя; 3 — ходьба по беговой дорожке с поддержанием веса тела; 4 — движение ног в воздухе; 5 — ходьба по беговой дорожке с помощью роботизированной системы, контролируемой ИМК; 6 — ходьба в экзоскелете, управляемом ИМК. Обозначения: ЭЭГ — электроэнцефалография; ЭМГ — электромиография, регистрирующая активность мышц; Такт. — тактильная обратная связь.
Видео 2. Процесс проведения эксперимента.
Через 12 месяцев тренировок по этой системе у всех восьми пациентов повысились показатели по тактильным ощущениям, а также восстановился свободный контроль ключевых мышц нижних конечностей. В результате был виден заметный прогресс в их способности ходить. Многие пациенты смогли ходить при помощи вспомогательных приборов. Кроме этого, у всех пациентов было отмечено значительное повышение эмоциональной стабильности и оценки качества жизни, а также снизился уровень депрессивности и увеличилась самооценка. Улучшились состояние кожи и функция пищеварительной системы, что связано, по-видимому, с нормализацией активности симпатической и парасимпатической систем. Дело в том, что вдоль позвоночника расположены узлы вегетативной нервной системы, которая регулирует работу внутренних органов. Они повреждаются при травмировании спинного мозга, что вызывает нарушение деятельности пищеварительной системы, которая в свою очередь влияет на состояние кожи посредством выделения сигнальных молекул, в том числе и провоспалительных [32], [33].
Неврологическое восстановление было связано с механизмами пластичности как на уровне спинного мозга, так и на уровне сенсомоторной коры. Кортикальная и спинномозговая пластичность изменяет нейронные связи в сохранившейся области спинного мозга при помощи моторных и сенсорных связей (рис. 10).
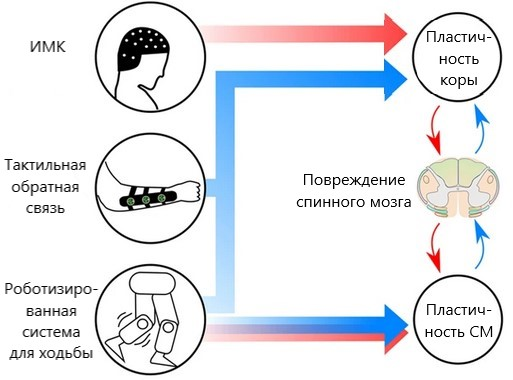
Рисунок 10. Пластичность спинного мозга (СМ) и коры головного мозга, осуществляющаяся с помощью моторных (красных) и сенсорных (синих) связей.
адаптировано из [31]
Заключение
Современная наука в области нейрореабилитации стремительно развивается и достигает удивительных результатов — в буквальном смысле ставит на ноги людей, ранее прикованных к кровати или инвалидной коляске. Появляются новые, более эффективные способы регистрации сигналов мозга; использование ИМК дополняется использованием обратной связи, ФЭС и ЧЭССМ; углубляются знания о механизмах нейропластичности; проводятся масштабные исследования в области разработки техник нейрореабилитации. Однако остается проблема доступности данных методов. Они очень дорогостоящие и доступны только в определённых клиниках; далеко не каждый может себе их позволить. В нашей лаборатории ведётся разработка нейрореабилитационных систем, которые просты в применении и по цене доступны для закупок в государственных бюджетных больницах.
Благодарности
Автор выражает благодарность своему научному руководителю Бобровой Елене Вадимовне, заведующему лабораторией Герасименко Юрию Петровичу и безвременно покинувшему нас в прошлом году Александру Алексеевичу Фролову (01.11.1943–10.06.2020) — одному из ведущих российских исследователей в области ИМК.
Литература
- Киборги сегодня: нейрокомпьютерные технологии становятся неотъемлемой частью нашей жизни;
- Нейротехнологии Илона Маска;
- Kai J. Miller, Dora Hermes, Nathan P. Staff. (2020). The current state of electrocorticography-based brain–computer interfaces. Neurosurgical Focus. 49, E2;
- Е.В. Боброва, А. А. Фролов, В. В. Решетникова. (2017). МЕТОДЫ И ПОДХОДЫ ДЛЯ ОПТИМИЗАЦИИ УПРАВЛЕНИЯ СИСТЕМОЙ «ИНТЕРФЕЙС МОЗГ-КОМПЬЮТЕР» ЗДОРОВЫМИ ПОЛЬЗОВАТЕЛЯМИ И ПАЦИЕНТАМИ С НАРУШЕНИЯМИ ДВИЖЕНИЙ, "Журнал высшей нервной деятельности им. И.П. Павлова". Журнал высшей нервной деятельности им И П Павлова. 377-393;
- Christa Neuper, Reinhold Scherer, Miriam Reiner, Gert Pfurtscheller. (2005). Imagery of motor actions: Differential effects of kinesthetic and visual–motor mode of imagery in single-trial EEG. Cognitive Brain Research. 25, 668-677;
- Britta Lorey, Matthias Bischoff, Sebastian Pilgramm, Rudolf Stark, Jörn Munzert, Karen Zentgraf. (2009). The embodied nature of motor imagery: the influence of posture and perspective. Exp Brain Res. 194, 233-243;
- Corina Schuster, Roger Hilfiker, Oliver Amft, Anne Scheidhauer, Brian Andrews, et. al.. (2011). Best practice for motor imagery: a systematic literature review on motor imagery training elements in five different disciplines. BMC Med. 9;
- Fabien Lotte, Florian Larrue, Christian Mühl. (2013). Flaws in current human training protocols for spontaneous Brain-Computer Interfaces: lessons learned from instructional design. Front. Hum. Neurosci.. 7;
- Wang P.T., King C.E., Chui L.A., Nenadic Z., Do A.H. BCI controlled walking simulator for a BCI driven FES device. RESNA Annual Conference. Las Vegas, Nevada, 2010. P. 26–30.;
- Christine E King, Po T Wang, Luis A Chui, An H Do, Zoran Nenadic. (2013). Operation of a brain-computer interface walking simulator for individuals with spinal cord injury. Journal of NeuroEngineering and Rehabilitation. 10, 77;
- Christine E. King, Po T. Wang, Colin M. McCrimmon, Cathy C. Y. Chou, An H. Do, Zoran Nenadic. (2014). Brain-computer interface driven functional electrical stimulation system for overground walking in spinal cord injury participant. 2014 36th Annual International Conference of the IEEE Engineering in Medicine and Biology Society;
- Christine E. King, Po T. Wang, Colin M. McCrimmon, Cathy CY Chou, An H. Do, Zoran Nenadic. (2015). The feasibility of a brain-computer interface functional electrical stimulation system for the restoration of overground walking after paraplegia. J NeuroEngineering Rehabil. 12;
- Peter Boord, Ashley Craig, Yvonne Tran, Hung Nguyen. (2010). Discrimination of left and right leg motor imagery for brain–computer interfaces. Med Biol Eng Comput. 48, 343-350;
- Babak Mahmoudi, Abbas Erfanian. (2006). Electro-encephalogram based brain–computer interface: improved performance by mental practice and concentration skills. Med Bio Eng Comput. 44, 959-969;
- Е. В. Боброва, В. В. Решетникова, Е. А. Вершинина, А. А. Гришин, А. А. Фролов, Ю.П. Герасименко. (2020). МЕЖПОЛУШАРНАЯ АСИММЕТРИЯ И ЛИЧНОСТНЫЕ ХАРАКТЕРИСТИКИ ПОЛЬЗОВАТЕЛЯ МОЗГ-КОМПЬЮТЕРНОГО ИНТЕРФЕЙСА ПРИ ВООБРАЖЕНИИ ДВИЖЕНИЙ РУК. Доклады Российской академии наук. Науки о жизни. 495, 558-561;
- Дофаминовые болезни;
- Почему помощники нейронов «ползают» и «прыгают»?;
- Кадыков А.С., Черникова Л.А., Шахпаронова Н.В. Реабилитация неврологических больных. Москва: МЕДпресс-информ, 2014. — 564 с.;
- Alberto Filgueiras, Erick Francisco Quintas Conde, Craig R. Hall. (2018). The neural basis of kinesthetic and visual imagery in sports: an ALE meta − analysis. Brain Imaging and Behavior. 12, 1513-1523;
- Nagako Murase, Julie Duque, Riccardo Mazzocchio, Leonardo G. Cohen. (2004). Influence of interhemispheric interactions on motor function in chronic stroke. Ann Neurol.. 55, 400-409;
- A. A. Grishin, T. R. Moshonkina, E. V. Bobrova, Yu. P. Gerasimenko. (2019). A Device for the Rehabilitation Therapy of Patients with Motor Pathology Using Mechanotherapy, Transcutaneous Electrical Stimulation of the Spinal Cord, and Biological Feedback. Biomed Eng. 53, 227-230;
- Гришин А.А., Солопова И.А., Селионов В.А., Мошонкина Т.Р., Титова Е.Ю., Цветков Д.С., Герасименко Ю.П. Аппаратно-программный комплекс «Биокин» для реабилитации двигательных нарушений центрального генеза. Материалы VI Российской с международным участием конференции по управлению движением. Казань, 2016. С. 54.;
- Camille Jeunet, Bertrand Glize, Aileen McGonigal, Jean-Marie Batail, Jean-Arthur Micoulaud-Franchi. (2019). Using EEG-based brain computer interface and neurofeedback targeting sensorimotor rhythms to improve motor skills: Theoretical background, applications and prospects. Neurophysiologie Clinique. 49, 125-136;
- Timothy H. Murphy, Dale Corbett. (2009). Plasticity during stroke recovery: from synapse to behaviour. Nat Rev Neurosci. 10, 861-872;
- Thomas H. Hutson, Simone Di Giovanni. (2019). The translational landscape in spinal cord injury: focus on neuroplasticity and regeneration. Nat Rev Neurol. 15, 732-745;
- Aizan Masdar, B.S. K. K. Ibrahim, M. Mahadi Abdul Jamil. (2012). Development of wireless-based low-cost current controlled stimulator for patients with spinal cord injuries. 2012 IEEE-EMBS Conference on Biomedical Engineering and Sciences;
- MILAN R. DIMITRIJEVIC, YURI GERASIMENKO, MICHAELA M. PINTER. (1998). Evidence for a Spinal Central Pattern Generator in Humansa. Annals NY Acad Sci. 860, 360-376;
- Yury P. Gerasimenko, Daniel C. Lu, Morteza Modaber, Sharon Zdunowski, Parag Gad, et. al.. (2015). Noninvasive Reactivation of Motor Descending Control after Paralysis. Journal of Neurotrauma. 32, 1968-1980;
- Герасименко Ю.П., Гришин А.А., Мошонкина Т.Р. Устройство для неинвазивной электрической стимуляции спинного мозга. Патент RU 2627359 C2. 2017.;
- Гришин А.А., Боброва Е.В., Решетникова В.В., Мошонкина Т.Р., Герасименко Ю.П. Система детектирования фаз шагательного цикла и стимуляция спинного мозга как инструмент управления локомоцией человека. Медицинская техника, . 5 (323), 2020. С.10–14.;
- Ana R. C. Donati, Solaiman Shokur, Edgard Morya, Debora S. F. Campos, Renan C. Moioli, et. al.. (2016). Long-Term Training with a Brain-Machine Interface-Based Gait Protocol Induces Partial Neurological Recovery in Paraplegic Patients. Sci Rep. 6;
- Gregory M. Holmes, Emily N. Blanke. (2019). Gastrointestinal dysfunction after spinal cord injury. Experimental Neurology. 320, 113009;
- Catherine A. O'Neill, Giovanni Monteleone, John T. McLaughlin, Ralf Paus. (2016). The gut-skin axis in health and disease: A paradigm with therapeutic implications. BioEssays. 38, 1167-1176.







