
Магнитоуправляемая перестройка цитоскелета: история о том, как ученые крутили клетки на магнитах
07 февраля 2023
Магнитоуправляемая перестройка цитоскелета: история о том, как ученые крутили клетки на магнитах
- 624
- 0
- 0
Маленькая кошкоклеточка съела наночастицы, и теперь они тянут ее за цитоскелет прямо к магниту через всю чашку Петри!
Рисунок в полном размере.
рисунок авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Наши с вами клетки содержат особые динамические структуры, называемые цитоскелетом. Цитоскелет представлен многочисленными нитями, переплетенными друг с другом и формирующими каркас клеток. Он помогает клетке сохранять форму, перемещаться и даже делиться. Однако в последнее время внимание ученых обращено на менее очевидную роль цитоскелета, но, быть может, гораздо более перспективную для использования в биотехнологии и медицине: цитоскелет также позволяет клетке получать информацию об окружающей среде, в том числе, о ее механических свойствах. Ощущая твердость или мягкость своего окружения через цитоскелет и некоторые белки мембраны или клеточных контактов, наши клетки определяют свое поведение и развитие. Для ученых это открывает возможность управления клеточными процессами через механическое воздействие на клетку в целом или на цитоскелет в частности. В этой статье мы расскажем о том, как разрабатывается технология, позволяющая контролируемо перестраивать цитоскелет в клетке.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания «Хеликон»: — один из ведущих российских поставщиков продукции и услуг для молекулярно-биологических и клеточных лабораторий.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного о цитоскелете
Цитоскелет — главный герой нашего рассказа, так начнем же знакомство с ним. Цитоскелетом называют систему белковых нитей (филаментов), взаимодействующих между собой и находящихся в цитоплазме клетки. Разнообразие и сложность поведения цитоскелета обеспечивается тем, что он включает в себя разные типы филаментов (рис. 1) [1]:
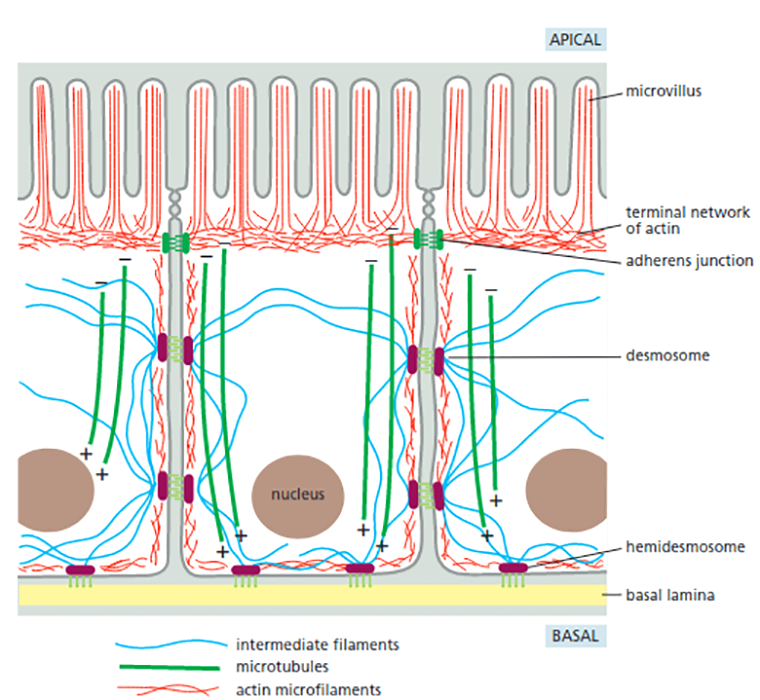
Рисунок 1. Организация цитоскелета и связь с клеточными контактами.
- Микротрубочки — филаменты, состоящие из белка тубулина. Это довольно большие в диаметре (около 25 нм) полые трубочки, поддерживающие форму клетки, а также участвующие во внутриклеточном транспорте. Их можно сравнить с магистралями, по которым перемещаются моторные белки (например, динеин и кинезин), тянущие за собой грузы: внутриклеточные везикулы, гранулы РНК и даже митохондрии [2]. Очень советуем посмотреть 8-минутную анимацию The Inner Life of the Cell, в которой наглядно показана транспортная роль микротрубочек.
- Актиновые филаменты — представляют собой полимеризованный белок актин и находятся преимущественно у периферии клетки. Сеть актиновых филаментов помогает клетке изменять форму поверхности, формировать подвижные выросты.
- Промежуточные филаменты — неоднородная группа цитоскелетных филаментов, объединенная по характерному диаметру филамента, а не по его составу. К промежуточным филаментам относят, например, нити виментина и кератина. Промежуточные филаменты также участвуют в миграции клетки, помогают клетке поддерживать форму и образовывать межклеточные контакты.
Стоит отметить, что, в отличие от человеческого скелета, цитоскелет — структура, способная быстро меняться благодаря непрерывной и одновременной сборке и разборке. При этом существуют разнообразные модификации цитоскелета, влияющие на полимеризацию и деполимеризацию. Наиболее важными и влиятельными модификациями являются:
- Ацетилирование. Для актина присоединение ацильного остатка способствует полимеризации, поэтому эта модификация может влиять на сборку цитоскелета и подвижность клетки (например, через ацетилтрансферазу NAA80 [3]). Для микротрубочек, наоборот, ацетилирование ведет к ингибированию полимеризации, потому что ацетильная группа при присоединении к остаткам лизина в составе тубулина снижает избыточный положительный заряд и этим позволяет микротрубочке принять положение, в котором она менее доступна для мономерного тубулина, находящегося в цитоплазме [4].
- Фосфорилирование. Связывание с фосфатной группой влияет на растворимость и сборку кератиновых промежуточных филаментов. Кроме того, эта модификация обеспечивает их способность связываться с белками семейства 14-3-3, которые взаимодействуют со многими сигнальными белками, что особенно важно в контексте связки клеточной сигнализации и цитоскелета [5].
Модификации цитоскелета регулируют его перестройки и позволяют клеткам адаптироваться к окружающей среде через изменение формы и движение. Таким функциям и особенностям цитоскелета, которые мы упомянули выше, посвящено немало текстов как в учебниках, так и в рецензируемых журналах; отдельно стоит почитать статьи на «Биомолекуле» о трогоцитозе [6] и о том, как цитоскелет связывает митохондрии и внеклеточный матрикс [7]. Мы же уделим внимание относительно новой и малоизученной роли цитоскелета в жизни клетки — механочувствительности.
Как клетка ориентируется на ощупь
Механочувствительностью называется способность клетки воспринимать механические стимулы. Клетки растягиваются, сдавливаются, держатся друг за друга, ощущают «твердость» окружающей среды. В нашем организме все клетки в определенной степени способны чувствовать механические свойства своего окружения, ведь межклеточное взаимодействие — необходимый этап формирования тканей и органов. Но есть и настоящие мастера механорецепции — это, например, волосковые клетки во внутреннем ухе и шванновские клетки [8]. Структурами, задействованными в первичном восприятии механических стимулов, являются особые ионные каналы в плазматической мембране, некоторые рецепторы, клеточные контакты и, конечно же, цитоскелет.
Разные структуры необходимы для восприятия разных типов стимулов. Например, ионные каналы отвечают на растяжение клеточной мембраны. Кстати, за изучение подобных механочувствительных ионных каналов, называемых Piezo, была присуждена Нобелевская премия 2021 года (об этом можно прочитать на «Биомолекуле» [9]). Клеточные контакты за счет белков интегринов и кадгеринов регулируют состояние цитоскелета и связывают его с белками внешней среды или другой клетки, таким образом позволяя клетке отвечать на перемещение относительно внешней среды изменением механических свойств. Цитоскелет же участвует в механочувствительности не только как объект воздействия белков клеточных контактов: он сам может при своей перестройке запускать сигнальные каскады (сигналинг), которые влияют на клеточные процессы и, собственно, обеспечивают изменение поведения клетки в ответ на механические стимулы.
Когда на клетку действует сила, смещающая ее относительно внешней среды (внеклеточного матрикса или другой клетки), возникает механическое напряжение на контактах типа «клетка—клетка» или «клетка—матрикс», внутри которых актиновый цитоскелет заякорен с помощью белков интегринов или кадгеринов. Под действием внешней силы количество белков, задействованных в формировании контакта, увеличивается, потому что геометрическая перестройка клеточного контакта обнажает новые сайты связывания, закрытые в отсутствие натяжения. Далее с адгезионного контакта механическое напряжение передается на связанный с ним актиновый цитоскелет, и сила, действующая на контакт, определяет активность миозина II типа и полимеризации/деполимеризации F-актина. Актомиозиновые сети, связанные с цитоплазматической мембраной клетки адгезионными контактами, в свою очередь, меняют форму клетки и передают напряжение другим соседям [10]. Механическое напряжение на контакте приводит к перестройке актинового цитоскелета, а перестройки влияют на систему цитоплазматических белков YAP/TAZ. Эти белки являются коактиваторами транскрипции и отвечают за пролиферацию, рост ткани, дифференцировку клеток и ответ на внешние механические сигналы. С точки зрения механочувствительности, комплекс YAP/TAZ важен как медиатор биологических эффектов, регулируемых распластыванием клеток и жесткостью внеклеточного матрикса. Он находится в ядре в распластывающихся клетках или в клетках на твердом субстрате, но становится преимущественно цитоплазматическим на более мягких субстратах и в менее распластывающихся клетках [11], [12]. Распластывание клеток сопровождается активацией малой ГТФазы Rho, которая, в свою очередь, регулирует образование актиновых пучков, стрессовых волокон и растяжимых актомиозиновых структур [13]. Следовательно, чувствительность YAP и TAZ к внеклеточному матриксу может быть связана с их реакцией на напряжение актомиозинового цитоскелета.
Система YAP/TAZ задействована далеко не только в механочувствительности. Она является своеобразным перекрестком путей внутриклеточного сигналинга и может запустить самые неожиданные изменения в жизни клетки (рис. 2) [14].
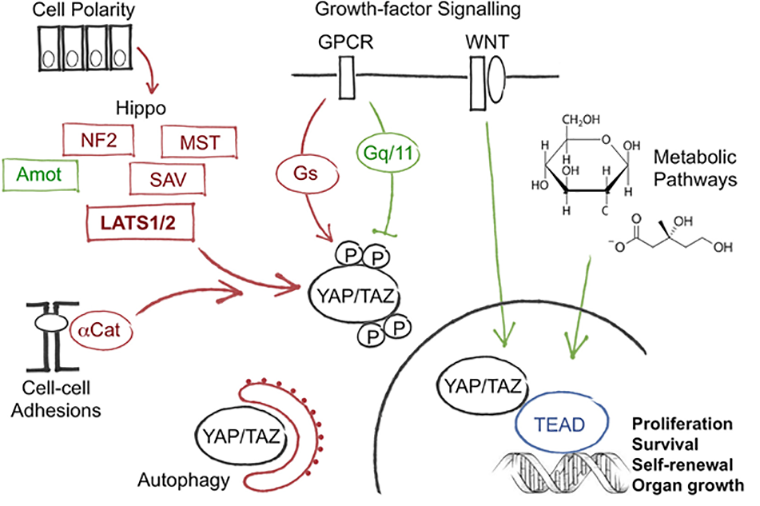
Рисунок 2. Схема регуляции активности системы YAP/TAZ.
К примеру, исследования показали, что актиновый цитоскелет через YAP/TAZ-систему влияет на состояние гепатоцитов и регулирует размер печени. Например, если инактивировать белок CAPZ, кэпирующий F-актин, то это ограничит динамику актиновых филаментов и повысит жесткость печени. Это активирует YAP и путь Hippo, что, в свою очередь, вызывает обширную пролиферацию гепатоцитов и разрастание органа [15]. Один этот пример позволяет представить, какие возможности может открыть дальнейшее изучение механочувствительности, ассоциированной с цитоскелетом!
Существует много различных подходов, позволяющих давить, растягивать клетки, но все эти изменения происходят во всем объеме клетки. До сегодняшнего дня не было возможности «потянуть» за отдельный компонент клетки и посмотреть, как это повлияет на механочувствительность и экспрессию генов.
Шевеление с помощью магнитного поля
В одних случаях исследователям интересен цитоскелет сам по себе, как каркас, и тогда удобно изучать его под воздействием веществ, контролирующих сборку и разборку цитоскелета. Например, на «Биомолекуле» можно прочитать о веществах, которые влияют на состояние микротрубочек [16]. К сожалению, такие вещества трудно использовать без вреда для клетки, так же как трудно воздействовать ими ограниченное время: обычно, если реагент такого рода связывается с цитоскелетом, то крепко-накрепко блокирует его нормальную динамику, что, в свою очередь, вызывает апоптоз. Когда речь заходит об изучении сигналинга, сопряженного с перестройками цитоскелета, приходится использовать иные методы. Чтобы рассматривать механочувствительный сигналинг, в первую очередь необходимо сохранять клетку живой, а также приводить в движение компоненты цитоскелета по отдельности. Такое возможно, например, при использовании магнитных наночастиц (рис. 3). Магнитные наночастицы бывают разного размера и состава, получаются путем химического синтеза и в нашем случае нужны для того, чтобы проникнуть внутрь клетки, связаться с ее определенными компонентами и при воздействии внешнего магнитного поля механически потянуть компоненты за собой.
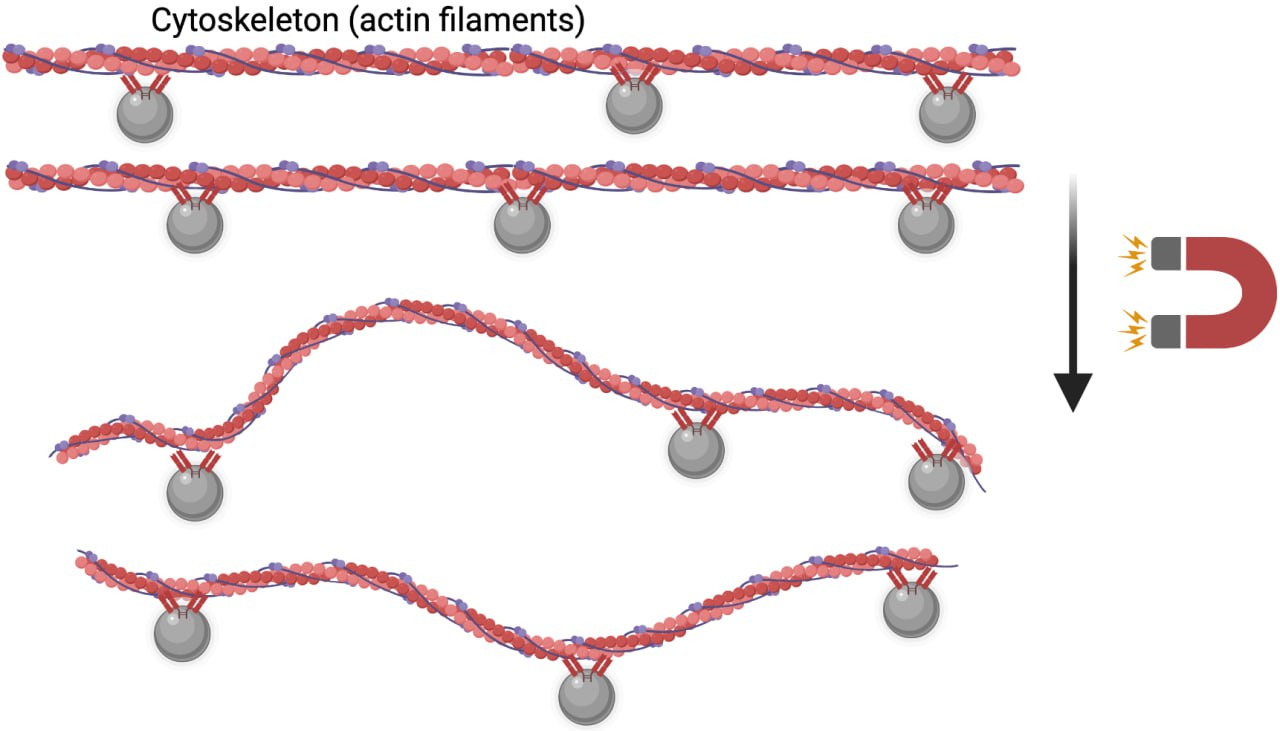
Рисунок 3. Наночастицы, сшитые с антителами, специфичными к F-актину, двигаются под действием магнитного поля и тянут актиновые филаменты за собой.
рисунок авторов статьи
Рассмотрим весь процесс подробнее. Сперва необходимо химически синтезированные магнитные наночастицы снабдить способностью связываться только с нужными компонентами цитоскелета, например, с микротрубочками. Благо, человечеству известны антитела — белки, специфически связывающиеся с определенными молекулами. Про разработку антител можно почитать на «Биомолекуле» [17]. Когда мы модифицируем наночастицу антителами к тубулину, то она сможет прикрепиться к микротрубочке, минуя остальные молекулы в клетке. Модифицированную частицу необходимо доставить внутрь клетки так, чтобы она оказалась в цитоплазме. Беда в том, что клетка способна поглощать наночастицы как посторонние объекты и заключать их в эндосомы. А из эндосомы наночастица не может достать до цитоскелета; более того, эндосома может стать лизосомой и разрушить антитела, прикрепленные к наночастице. Эта проблема решается «протаскиванием» наночастиц в клетку магнитным полем: наночастица тянется быстро и сильно, проходя через мембрану клетки, а та не успевает окружить ее эндосомой. Последнее действие — подождать, пока наночастицы свяжутся с компонентами цитоскелета, а затем создать внешнее магнитное поле (например, поднеся сильный постоянный магнит). Наночастицы потянутся вдоль линий магнитного поля, выстраивая часть цитоскелета за собой, то есть вызывая его контролируемые перестройки, не приводящие к апоптозу.
Нужно отметить, что магнитное управление состоянием цитоскелета уже осуществляли in vitro: несколько научных групп работали с модифицированными, а затем искусственно полимеризованными актиновыми филаментами и микротрубочками [18–20]. Это подтвердило, что магнитное манипулирование вообще имеет место быть, то есть жесткость цитоскелета не настолько велика, чтобы мы не могли его тянуть или перестраивать. Однако отдельные филаменты в пробирке и цитоскелет в клетке всё же сильно отличаются: в клетке филаменты разных типов пересекаются, соединяются друг с другом, находятся в белковом окружении в вязкой цитоплазме. Всё это повышает величину сил, необходимых для преодоления сопротивления, и сил упругости, и несколько усложняет задачу перестройки цитоскелета внутри клетки (и, следовательно, в живом организме), — и это вдобавок к возможному попаданию частицы в эндосому или разрушению антител!
Словом, до получения каких-либо результатов изучения перестроек цитоскелета, нам нужно было создать технологию, работающую в клетке. Мы работаем с культурами клеток в чашках Петри, поэтому сперва сконструировали магнитные системы для протаскивания частиц в клетки (с вертикальным полем) и для перестроек цитоскелета (с боковым полем), на которые можно ставить чашки (рис. 4). Еще одним важным этапом работы была разработка протокола сшивки антител с наночастицами. Наши суперпарамагнитные наночастицы покрыты карбоксильными группами или аминогруппами, к которым и пришиваются антитела, образуя пептидную связь под действием реагентов в определенных условиях.
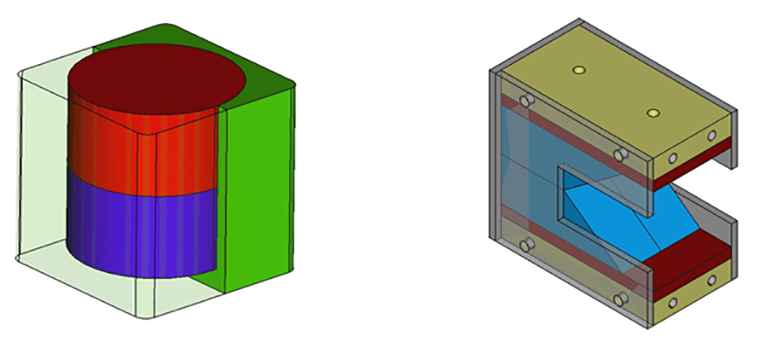
Рисунок 4. Слева изображен макет магнитной системы, создающей вертикальное магнитное поле, справа — горизонтальное.
макет авторов статьи
Крутим цитоскелет в клетке!
Когда есть и магниты, и наночастицы с антителами, можно начинать эксперименты на клетках. Сперва мы убедились, что наночастицы попадают в клетки после протаскивания на магните с вертикальным полем, то есть, теоретически, они могли оседать на поверхности клетки. Но нам повезло, и, как показала микроскопия, наночастицы прекрасно входят в цитоплазму клетки (рис. 5).

Рисунок 5. Световая микроскопия монослоя клеток с магнитными наночастицами в цитоплазме, выстроившимися по линиям магнитного поля.
фото авторов статьи
Читатель, знакомый с болезнями накопления, мог уже задаться вопросом о цитотоксичности нашей технологии — тут мы спешим заверить, что наночастицы не оказывают серьезного влияния на самочувствие клеток, что подтвердилось резазуриновым анализом жизнеспособности (рис. 6).
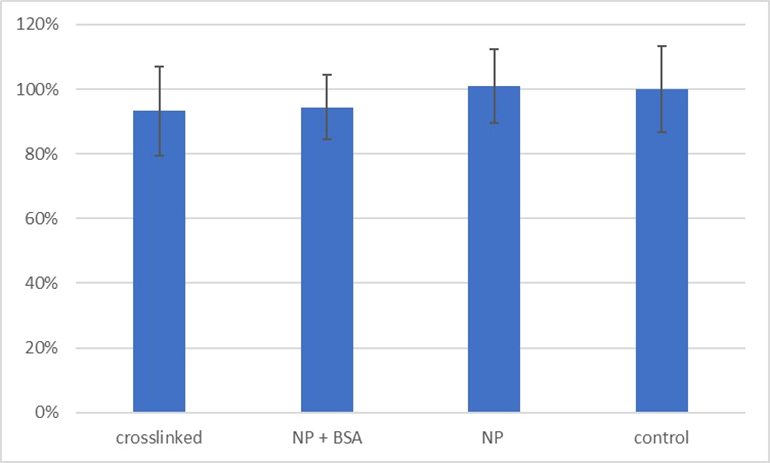
Рисунок 6. Анализ жизнеспособности: crosslinked — наночастицы, сшитые с БСА, NP+BSA — смесь наночастиц и БСА без сшивки, NP — наночастицы в буфере.
график авторов статьи
Вооружившись магнитами, протоколами и наночастицами, можно, наконец, шевелить отдельные компоненты цитоскелета, например, в раковых клетках, живущих в культуре. Мы начали с виментиновых филаментов, так как виментин в клетке более стабилен по сравнению с микротрубочками и F-актином, реже и меньше перестраивается, и это позволило бы нам получить данные с меньшей дисперсией. А если виментин еще и светится, то результаты перестроек цитоскелета видны в флуоресцентный микроскоп. Итак, мы протаскиваем наночастицы в клетки, ставим чашку на магнит с боковым полем и, затаив дыхание, смотрим на экран микроскопа, — и получаем долгожданные перестройки цитоскелета вдоль линий магнитного поля (рис. 7).
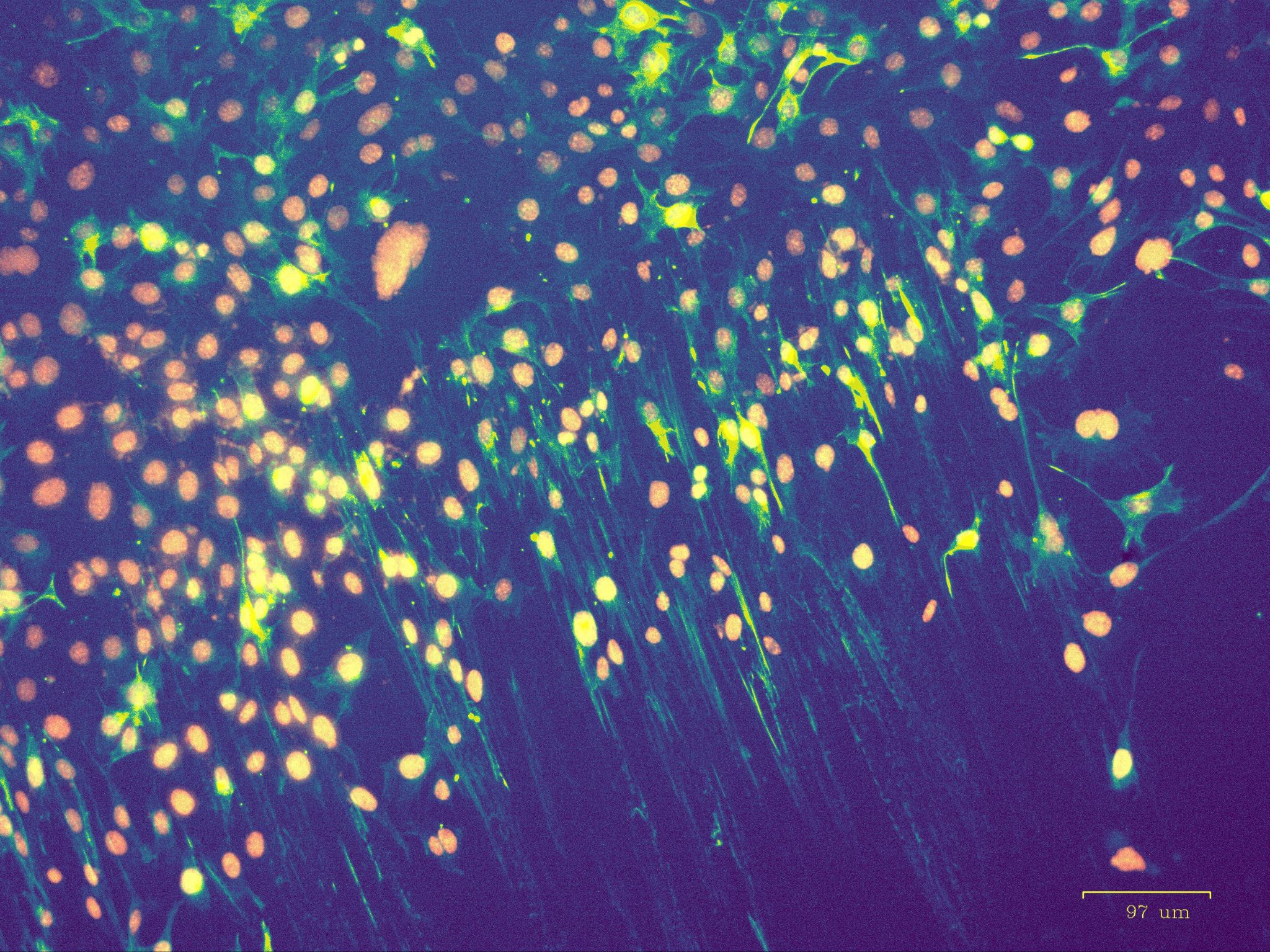
Рисунок 7. Флуоресцентная микроскопия. Снимок клеток с наночастицами, сшитыми с антителами к виментину, при воздействии постоянного магнита в правом нижнем углу. Наблюдается выстраивание промежуточных филаментов виментина (зеленые) вдоль линий магнитного поля.
фото авторов статьи
Перспективы
Магнитоуправляемые перестройки имитируют механическое воздействие на клетку, но такое, что воспринять его может только цитоскелет — то есть позволяют нам рассмотреть вклад отдельных элементов цитоскелета в механочувствительный сигналинг. Кроме того, мы уже упоминали выше, что клеточный сигналинг — сложная система пересекающихся последовательностей реакций, и механическая стимуляция может привести к совершенно неожиданным изменениям в процессах, казалось бы, совсем не связанных с цитоскелетом. Еще более непредсказуемым может оказаться результат перестроек цитоскелета в раковых клетках, ведь в них сигналинг отличается от такового в здоровых клетках. В целом, это может приводить к разрастанию и метастазированию опухоли, или, наоборот, к угнетению роста. Это открывает возможности, например, в прогнозировании развития рака у пациентов через предсказание подвижности клеток или их способности к метастазированию.
Более конкретное и просто реализуемое применение технологии магнитоуправляемых перестроек — определение генов, чья экспрессия связана с каждым из компонентов цитоскелета. Можно, например, сравнить транскриптом клетки в обычном состоянии и при механической перестройке микротрубочек, а затем сопоставить результаты эксперимента со здоровыми и раковыми клетками. Таким образом, мы (помимо ответа на многие фундаментальные вопросы онкогенеза и цитоскелет-ассоциированного сигналинга) можем впоследствии получить новые варианты терапии рака.
Однако описанная технология перестроек цитоскелета с помощью магнитного поля применима во многих случаях работы с клеточными культурами, но вряд ли осуществима в тканях и целых организмах. Попытки «протащить» наночастицы в цитоплазму клеток, находящихся под слоями клеток выше, приведут к повреждениям тканей: представьте, ведь наночастицами придется пробивать клетки насквозь. Да и доставка по кровеносным сосудам неэффективна: многие наночастицы останутся в печени и почках, и только единичные дойдут до целевых клеток.
Ограничения технологии могут быть преодолены путем внутриклеточного синтеза магнитных наночастиц — биоминерализации магнитных наночастиц железа. Представьте, если бы была возможность внести в геном животной клетки гены, дающие ей возможность самостоятельно синтезировать магнитные наночастицы. Одним из возможных примеров в природе является формирование специальных магнитных структур некоторых бактерий, позволяющих им ориентироваться в магнитном поле Земли — магнитосом. Об этих бактериях можно почитать на «Биомолекуле» [21]. Исследования уже показали, что синтез магнитосомоподобных частиц возможен в мезенхимальных стволовых клетках [22], [23] — и результат впечатляющий, ведь авторам удалось добиться синтеза этих частиц с помощью вставки в геном всего одного гена Mms6. Белок Mms6 в этом отношении очень интересен: если его поместить in vitro в раствор, содержащий соли железа, то он будет производить «железную пыль». Стоит, однако, отметить, что магнитосомоподобные частицы нельзя назвать магнитосомами. Настоящие магнитосомы бактерий представляют собой однодоменные кристаллы магнетита, способные выстраиваться вдоль линий даже такого слабого магнитного поля, как земное. В мезенхимальных стволовых клетках пока была получена скорее «пыль» оксидов железа, обладающая, конечно, менее впечатляющими магнитными свойствами. Для того, чтобы начать использовать внутриклеточный синтез магнитных наночастиц, ученым предстоит еще долго и упорно совершенствовать как магнитные частицы (например, расширяя набор генов, переносимых из бактерии в модифицируемую клетку), так и системы, создающие внешнее магнитное поле.
И все-таки, на наш взгляд, игра стоит свеч. Выше мы уже писали о потенциале магнитоуправляемых перестроек цитоскелета в прогнозировании развития рака. Однако магнитное поле не обязательно применять для воздействия на цитоскелет: варьируя набор антител, сшитых с наночастицами, мы можем варьировать и мишени технологии. Например, было бы возможно воздействовать на мембранные рецепторы клетки, активировать ионные каналы (вспомним о механочувствительных каналах Piezo) для разного рода регуляций клеточной активности — внимательный читатель уже мог заметить, что эта технология в своих возможностях очень похожа на оптогенетику (на «Биомолекуле» есть статьи, например, об управлении ионными каналами с помощью света [24]). Разве что для оптогенетики пока существует ограничение на глубину воздействия: обычно живые ткани довольно слабо пропускают свет, а вот магнитное поле почти не встречает препятствий. В итоге магнитное поле в сочетании с внутриклеточными наночастицами предлагает действительно неинвазивный метод управления клеточными процессами в толще ткани и даже внутри организма. Осмелимся пофантазировать — и вот уже технология может быть полезна, к примеру, для лечения диабета I типа: внедрив в пациента модифицированные инсулин-продуцирующие клетки, мы сможем включать и выключать синтез инсулина, просто поднося очень сильный магнит, не прибегая к множеству инъекций.
Спускаясь с небес на землю, мы признаем, что над нашей технологией еще стоит поработать. Пока мы умеем перестраивать лишь один тип филаментов цитоскелета, но, к счастью, работа идет дальше. Мы уже можем изучать сигналинг, ассоциированный с виментином (почему бы нам не присмотреться к уже знакомым YAP и TAZ?), но в планах стоит научиться перестраивать актиновые филаменты и микротрубочки. Надеемся, что эта статья положит начало большой серии, посвященной перестройкам цитоскелета!
Авторы выражают благодарность Артему Минину и другим сотрудникам Лаборатории прикладного магнетизма ИФМ УрО РАН за предоставленные магнитные системы и наночастицы, а также за помощь и советы в процессе разработки технологии.
Представленное исследование финансировалось грантом Российского научного фонда № 22-74-10041.
Литература
- Alberts B., Heald R., Johnson A., Morgan D., Raff M., Roberts K., Walter P. Molecular biology of the cell. Seventh edition. New York: W. W. Norton & Company, 2022. — 1552 p.;
- Ossama Moujaber, Ursula Stochaj. (2020). The Cytoskeleton as Regulator of Cell Signaling Pathways. Trends in Biochemical Sciences. 45, 96-107;
- Adrian Drazic, Henriette Aksnes, Michaël Marie, Malgorzata Boczkowska, Sylvia Varland, et. al.. (2018). NAA80 is actin’s N-terminal acetyltransferase and regulates cytoskeleton assembly and cell motility. Proc. Natl. Acad. Sci. U.S.A.. 115, 4399-4404;
- Chih-Wen Chu, Fajian Hou, Junmei Zhang, Lilian Phu, Alex V. Loktev, et. al.. (2011). A novel acetylation of β-tubulin by San modulates microtubule polymerization via down-regulating tubulin incorporation. MBoC. 22, 448-456;
- Sivaraj Sivaramakrishnan, Jaime L. Schneider, Albert Sitikov, Robert D. Goldman, Karen M. Ridge. (2009). Shear Stress Induced Reorganization of the Keratin Intermediate Filament Network Requires Phosphorylation by Protein Kinase C ζ. MBoC. 20, 2755-2765;
- Трогоцитоз: зачем клетки делают «кусь»?;
- Связь клеток — связь времен;
- Gonzalo Rosso, Ivan Liashkovich, Peter Young, Dominik Röhr, Victor Shahin. (2017). Schwann cells and neurite outgrowth from embryonic dorsal root ganglions are highly mechanosensitive. Nanomedicine: Nanotechnology, Biology and Medicine. 13, 493-501;
- Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021);
- Soline Chanet, Adam C. Martin. (2014). Mechanical Force Sensing in Tissues. Progress in Molecular Biology and Translational Science. 317-352;
- Sirio Dupont, Leonardo Morsut, Mariaceleste Aragona, Elena Enzo, Stefano Giulitti, et. al.. (2011). Role of YAP/TAZ in mechanotransduction. Nature. 474, 179-183;
- Sirio Dupont. (2016). Role of YAP/TAZ in cell-matrix adhesion-mediated signalling and mechanotransduction. Experimental Cell Research. 343, 42-53;
- Eric A. Klein, Liqun Yin, Devashish Kothapalli, Paola Castagnino, Fitzroy J. Byfield, et. al.. (2009). Cell-Cycle Control by Physiological Matrix Elasticity and In Vivo Tissue Stiffening. Current Biology. 19, 1511-1518;
- Sirio Dupont. (2016). Role of YAP/TAZ in cell-matrix adhesion-mediated signalling and mechanotransduction. Experimental Cell Research. 343, 42-53;
- Arianna Pocaterra, Giulia Santinon, Patrizia Romani, Irene Brian, Andrea Dimitracopoulos, et. al.. (2019). F-actin dynamics regulates mammalian organ growth and cell fate maintenance. Journal of Hepatology. 71, 130-142;
- «Зоопарк» ингибиторов тубулина;
- Биотехнология антител;
- Benjamin M. Hutchins, Mark Platt, William O. Hancock, Mary Elizabeth Williams. (2007). Directing Transport of CoFe2O4-Functionalized Microtubules with Magnetic Fields. Small. 3, 126-131;
- Harsimran Kaur, Suresh Kumar, Inderpreet Kaur, Kashmir Singh, Lalit M. Bharadwaj. (2010). Low-intensity magnetic fields assisted alignment of actin filaments. International Journal of Biological Macromolecules. 47, 371-374;
- Yun Chen, Stephanie Guzik, James P Sumner, John Moreland, Alan P Koretsky. (2011). Magnetic manipulation of actin orientation, polymerization, and gliding on myosin using superparamagnetic iron oxide particles. Nanotechnology. 22, 065101;
- Живые магниты: применение бактериальных магнетосом;
- Alistair Elfick, Grigore Rischitor, Rabah Mouras, Asim Azfer, Lisa Lungaro, et. al.. (2017). Biosynthesis of magnetic nanoparticles by human mesenchymal stem cells following transfection with the magnetotactic bacterial gene mms6. Sci Rep. 7;
- Zhang X.-Y., Robledo B., Harris S., Hu X. (2014). A bacterial gene, mms6, as a new reporter gene for magnetic resonance imaging of mammalian cells. Mol Imaging. 13, 1–12;
- Создан управляемый светом калиевый канал.







