Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?
21 ноября 2018
Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?
- 3231
- 3
- 7
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Одно из самых распространенных и тяжелых нейродегенеративных заболеваний — болезнь Паркинсона — считается не поддающейся лечению. О том, могут ли маленькие белковые молекулы изменить сложившуюся картину, и каким тернистым путем продвигаются исследователи, чтобы терапия нейротрофическими факторами уже сегодня стала реальностью, и пойдет речь в данной статье.
Конкурс «био/мол/текст»-2018
 Эта работа заняла первое место в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Эта работа заняла первое место в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
Есть в среднем мозге скопление клеток, называемое черной субстанцией (на латыни Substantia nigra, она действительно имеет черный цвет из-за скопления меланина), которая содержит примерно 500 000 специализированных нейронов, производящих дофамин. Эти нейроны посылают свои аксоны в стриатум (также называемый полосатым телом из-за характерной «полосатости» на срезе), формируя нигростриальный дофаминовый путь. Эта короткая (по меркам целого мозга) магистраль обеспечивает контроль движений, и когда в этой налаженной системе что-то идет не так, уровень дофамина снижается, и мы получаем заболевание, известное как болезнь Паркинсона (по имени Джеймса Паркинсона, врача, впервые описавшего ее симптомы) [1]. Тремор (дрожь в руках и ногах), ригидность (повышенный тонус мышц), брадикинезия (замедленные движения) и невозможность поддерживать позу превращают активного человека в развалину. Список симптомов этим не исчерпывается. Когда дефицит дофамина начинают испытывать и структуры лимбической системы, такие как гиппокамп и таламус, начинаются выраженные когнитивные проблемы, нарушение сна, депрессия. Коварство болезни в том, что все вышеуказанные симптомы проявляются, когда погибает 80–85% нейронов черной субстанции, а уровень дофамина падает на 60–80%. Предсказать возникновение болезни очень трудно, ведь наследственная форма встречается только в 5–10% случаев, в остальном это заболевание спорадическое — возникает внезапно и по неизвестной причине. Хотя общепринято, что болезнь Паркинсона (поражающая, к слову, 1% населения Земли) — это заболевание пожилых людей, стоит учитывать, что дофаминовые нейроны умирают не в одночасье — процесс длится годы и, возможно, даже десятилетия. Миллионы людей носят в мозге бомбу с часовым механизмом и даже не подозревают об этом. В числе причин болезни Паркинсона выделяют накопление белка α-синуклеина, дисфункцию митохондрий, воспаление, нарушение хранения белков (протеостаза), когда аккумулируются дефектные белки [2]. Наконец, в самих дофаминовых нейронах изначально заложен «конструктивный дефект». Заключается он в том, что эти нейроны имеют высокую потребность в энергии, вследствие чего процессы окислительного фосфорилирования также очень интенсивны. Вместе с этим накапливаются активные формы кислорода, и постепенно развивается оксидативный стресс. Происходит как бы «износ» системы, и дофаминовые нейроны попросту начинают гибнуть [3].
Причем здесь нейротрофические факторы? Для начала стоит пару слов сказать о самих нейротрофических факторах (для краткости будем обозначать их «НТФ»). Итак, НТФ — это большая и разношерстная группа полипептидов (длиной до 200 аминокислот), которые играют ключевую роль в развитии и сохранении структур как центральной, так и периферической нервных систем, принимают участие в регуляции роста, развития, дифференциации, миграции и выживания клеточных популяций, а также процессах их адаптации к внешним воздействиям. Поскольку этим критериям соответствуют многие неспецифические факторы, Ив-Алан Барде (Yves-Alain Barde) расширил понятие нейротрофических факторов и включил в него следующие критерии [4]:
- НТФ должен быть способен обеспечить выживание специфической популяции развивающихся нейронов.
- НТФ должен быть представлен в биологически активной форме в клетке-мишени, которой достигают аксоны развивающихся нейронов.
- НТФ должен быть секретирован клеткой-мишенью в небольших количествах, так чтобы приближающиеся аксоны конкурировали за него.
Можно еще добавить, что подлинные НТФ активируют рецепторные тирозинкиназы. Таким образом, в дальнейшем мы будем разграничивать собственно НТФ и просто ростовые факторы, которые в чем-то очень схожи с НТФ, но вышеуказанным критериям не отвечают.
В 1981 году доктор Стэнли Аппел (Stanley Appel) выдвинул гипотезу, названную «Единая гипотеза возникновения бокового амиотрофического склероза, паркинсонизма и болезни Альцгеймера» [5], которая постулировала, что каждое из этих заболеваний возникает из-за недостатка особого «гормона», или ростового фактора, который должен в норме секретироваться тканью, иннервируемой пораженными нейронами, захватываться пресинаптическими окончаниями последних и ретроградно (противотоком) транспортироваться к телу нейрона. Через год после публикации гипотезы Аппела был открыт нейротрофический фактор мозга — BDNF (brain-derived neurotrophic factor; заслуга принадлежит как раз Иву-Алану Барде), — после чего начался настоящий нейротрофический бум, когда новые факторы открывали каждый год. Несмотря на то, что обнаружение нейротрофических факторов как таковых относится к началу 50-х годов (работы Риты Леви-Монтальчини, за которые она была удостоена Нобелевской премии в 1986 году [39]), многое в их биологии стало известно как раз в 80–90-е годы.
В 1993 году открыли глиальный нейротрофический фактор — GDNF (glial cell line-derived neurotrophic factor), — и сразу же стало очевидно, что этот белок способствует дифференцировке и выживанию дофаминовых нейронов [6]. Гипотеза Аппела к этому времени набрала популярность, и ее попытались приложить к GDNF, однако все оказалось не однозначно. Мыши с полным нокаутом («выключением») гена Gdnf умирали еще до рождения из-за отсутствия... почек [7], но отнюдь не дофаминовых нейронов, а в недавнем исследовании с комбинацией сразу нескольких методик нокаута гена непосредственно в черной субстанции и на разных этапах развития животных показано, что отсутствие GDNF никак не влияет на количество (и качество) дофаминовых нейронов [8].
Относительно гипотезы Аппела стоит сказать, что сегодня мало для каких нейродегенеративных заболеваний удалось показать значительный вклад НТФ в патогенез. Для клиницистов и нейробиологов, занимающихся трансляционными исследованиями, сегодня важно не столько участие НТФ в развитии болезни, сколько потенциал к ее лечению. Собственно лечение нейродегенеративных заболеваний как таковое отсутствует. Все доступные на сегодня подходы направлены на устранение симптомов, но не причины заболевания. Можно принимать L-DOPA, чтобы восполнить нехватку дофамина, можно усилить действие L-DOPA коктейлем из ингибиторов ферментов деградации дофамина, можно вдобавок принимать агонисты (активаторы) дофаминовых рецепторов, наконец, можно стимулировать электрическим током субталамические ядра [9], но ничто из этого не вернет пациенту уже утраченных нейронов и не поможет остановить гибель тех немногих, что еще остаются «в строю».
Благодаря своей уникальной способности защищать и восстанавливать нейроны, нейротрофические факторы быстро привлекли к себе внимание. В случае с болезнью Паркинсона удобство (если вообще можно так выразиться) заключается в том, что поражен один тип нейронов, собранных в одной компактной популяции. То есть появляется возможность не «бить по площадям», а нанести прицельный удар. О том, как эти удары наносятся паркинсонизму, и пойдет речь дальше.
GDNF — «суперзвезда» в терапии болезни Паркинсона
Этому нейротрофическому фактору нельзя не уделить особое внимание. Из-за своей уникальной способности специфично восстанавливать дофаминовые нейроны GDNF стал одним из самых изученных НТФ и одним из немногих, прошедших клинические испытания на реальных пациентах с болезнью Паркинсона [10]. GDNF, с одной стороны, останавливает патологические процессы в дофаминовых нейронах, a с другой, восстанавливает синтез дофамина и его секрецию, возвращая нейроны в нормальное функциональное состояние.
Итак, сегодня известно, что GDNF возглавляет целое семейство белков, куда, кроме GDNF, входят еще нейртурин (NRTN), артемин и персефин. Каждый из указанных белков связывается со своим собственным рецептором. GDNF, к примеру, связывается с GFRα1. Потом этот комплекс связывается с тирозинкиназой RET и уже с ее помощью посылает сигнал внутрь клетки. Вообще чаще всего комплекс «НТФ—рецептор» погружается (интернализуется) внутрь пресинаптического окончания и с помощью белка динеина, выполняющего роль молекулярного извозчика, перемещается по актиновым микрофиламентам к телу нейрона (это называется ретроградным транспортом). Уже в теле нейрона происходит запуск сигнального каскада, который в конечном итоге изменяет экспрессию определенных генов. Так, GDNF слабо экспрессируется в черной субстанции, зато этого НТФ относительно много в стриатуме (где, вопреки названию, GDNF синтезируют не глиальные клетки, а ГАМК-ергические интернейроны), откуда ретроградным транспортом он и попадает в тела дофаминовых нейронов. Поэтому мы увидим в дальнейшем, что именно стриатум является тем местом, куда исследователи вводят GDNF и другие НТФ с целью восстановить дофаминовые нейроны черной субстанции. У GDNF (как и остальных НТФ) есть один недостаток — из-за своего размера этот белок не может проникнуть через гематоэнцефалический барьер. По этой причине в большинстве исследований GDNF вводится напрямую в мозг.
Чудодейственные эффекты GDNF были многократно продемонстрированы в доклинических исследованиях на животных моделях болезни Паркинсона [11]. Вызвать паркинсонизм у грызуна или примата довольно просто: достаточно ввести в мозг 6-ОНДА (6-гидроксидофамин) или сделать инъекцию МРТР (1-метил-4-фенил-1,2,3,6-тетрагидропиридин). Эти вещества избирательно (а самое главное быстро) разрушают дофаминовые нейроны, вызывая весь спектр классических симптомов паркинсонизма. Используя эти так называемые токсические модели, еще в 90-х годах была оценена эффективность белка GDNF при введении в боковые желудочки мозга грызунов. И эффективность оказалась достаточно высокой — удалось добиться восстановления двигательных функций и усиления обмена дофамина. GDNF, когда был введен перед 6-ОНДА, продемонстрировал еще и нейропротекторный эффект, поскольку защитил дофаминовые нейроны от токсического поражения. Применение GDNF, меченного изотопом йода 125I, показало, что этот белок поразительно широко распространяется в мозге (благо все мозговые желудочки связаны между собой) и после инъекции его можно обнаружить и в стриатуме, и в черной субстанции, а также в коре, таламусе, гиппокампе и даже мозжечке. Чуть позже аналогичные эксперименты провели на мармозетках и макаках резусах, со сходными результатами [12].
Успехи экспериментов на животных были столь воодушевляющими, что не заставили долго ждать и клинические испытания на людях. Первое же исследование, проведенное на 50 добровольцах с болезнью Паркинсона (двойное слепое плацебо-контролируемое)... провалилось [12]. Пациенты получали внутрижелудочковые инъекции белка GDNF с помощью микрокатетера восемь месяцев (для части испытуемых срок увеличили даже до двух лет). Диапазон доз варьировал от 25 микрограммов до значительных 4000 микрограммов, правда, по одной инъекции в месяц. Пациенты по результатам исследования вместо улучшения самочувствия получили потерю веса, анорексию, тошноту, болевой синдром в шейном отделе позвоночника и другие неприятные последствия (например потеря обоняния). Авторы исследования (надо сказать, изрядные оптимисты) нашли во всем этом плюсы — если есть побочные эффекты, значит введенный GDNF биологически активен, заключили они! Ранее уже было сказано, что у животных при введении в желудочек мозга, GDNF распространяется чрезвычайно обширно. Собственно, этот факт и сыграл злую шутку, так как белок проник, вероятно, в область таламуса, по непонятной причине «обойдя стороной» стриатум и черную субстанцию, и вызвал целый веер неспецифических (и вредоносных) реакций.
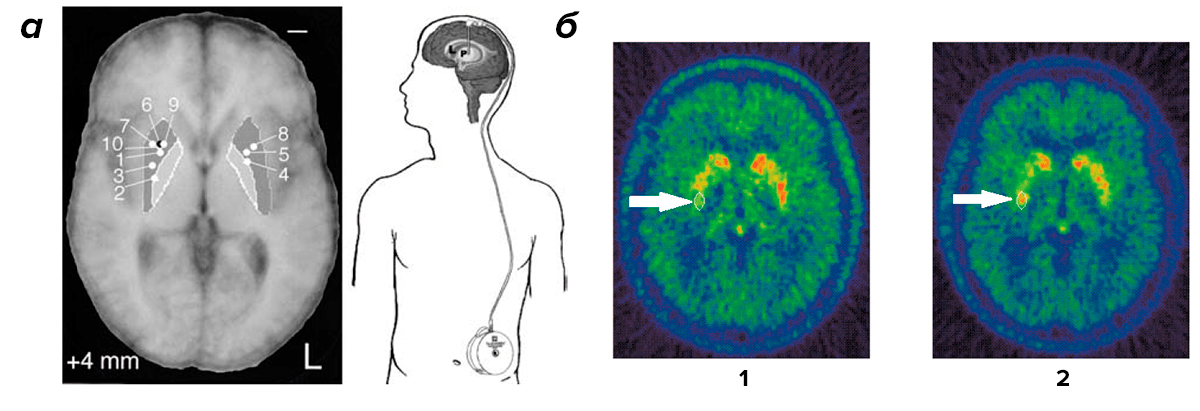
Параллельно проводили другие клинические испытания, в которых исследователи проявили бо́льшую прозорливость. Пяти пациентам в Бристоле (Великобритания) и десяти в Университете Кентукки (США) GDNF вводили с помощью катетера прямо в стриатум. Катетер был соединен с минипомпой, управляемой микрокомпьютером (рис. 1а). Каждый день в течение шести месяцев маленькие объемы растворенного белка поступали в мозг пациентов. Через каждые восемь недель дозу увеличивали (от трех микрограммов в день в начале испытаний до 30 микрограммов к их окончанию). Эффективность лечения проверяли в процессе и после окончания испытаний по специальной шкале UPDRS (unified Parkinson's disease rating scale; унифицированной шкале оценки болезни Паркинсона). Эта шкала в своем общем виде позволяет оценить тяжесть моторных и немоторных симптомов болезни (существуют еще и более специализированные разновидности UPDRS). За четыре месяца удалось добиться более чем 30-процентного улучшения показателей по шкале UPDRS как во время, так и после лечения [13]. В Бристоле пошли дальше и вводили GDNF в течение года. Им удалось добиться почти 40-процентного улучшения моторных функций и на 61% улучшить использование двигательных навыков в повседневной жизни (шкала UPDRS III). Как говориться, аппетит приходит во время еды, так что воодушевленные британские исследователи продлили испытания еще на год. В итоге, через два года введения GDNF моторные функции улучшились на 57%, а по шкале UPDRS III улучшение составило 63% [14]. Но и это еще не все. У тех же бристольских пациентов через 18 месяцев введения GDNF наблюдалось повышение накопления ДОФА (диоксифенилаланина, предшественника дофамина), меченного изотопом 18F, на 28% (рис. 1б). Это свидетельствует о том, что лечение повысило накопление дофамина в стриатуме [15].
Когда испытания окончились, один из пациентов бристольской группы умер от инфаркта (это было никак не связано с лечением), что позволило заглянуть ему в мозг и увидеть результаты лечения на клеточном уровне. Оказалось, что в той половине стриатума которая получала GDNF, плотность аксонов дофаминовых нейронов в пять раз выше [16]. Таких результатов невозможно достичь никакими обычными средствами терапии болезни Паркинсона. Более того, в процессе лечения не наблюдалось побочных эффектов. Вы впечатлены? Исследователи тоже были крайне обрадованы результатами. Хотя при такой маленькой выборке пациентов вероятность ошибочного результата является высокой, что дает основания для резонной критики в адрес исследователей. И вот настала очередь фазы 2 — рандомизированного двойного слепого плацебо-контролируемого исследования.
Исследование проводили на 34 добровольцах в течение полугода, но, ко всеобщему разочарованию, оно не выявило ни убедительного повышения накопления 18F ДОФА, ни тем более улучшения двигательных функций у получавших GDNF [17]. Этот разочаровывающий результат привел к остановке клинических испытаний GDNF на длительное время. Однако к самому исследованию появилось немало вопросов. Почему, например, доза белка была меньше, чем в предыдущих испытаниях (15 миллиграммов в день вместо 30-и)? Почему базовые моторные функции по шкале UPDRS определяли сразу после антипаркинсонической терапии (ясное дело, что после L-DOPA базовые показатели будут лучше)? Почему в выборку попали пациенты с разной тяжестью заболевания? Впрочем, последний вопрос в равной мере можно адресовать всем указанным исследованиям.
В работе Джеффри Кордуэра (Jeffrey Kordower) очень наглядно показано, как разительно отличается состояние дофаминовой системы на разных этапах заболевания [18]. Так уже через пять лет болезни плотность дофаминовых нейронов в большинстве случаев снижается настолько, что восстанавливать почти нечего (рис. 2). Вы можете вводить сколько угодно GDNF в стриатум, но если ваша «транспортная система» полностью уничтожена, до черной субстанции он никак не доберется, а значит, и лечение насмарку.
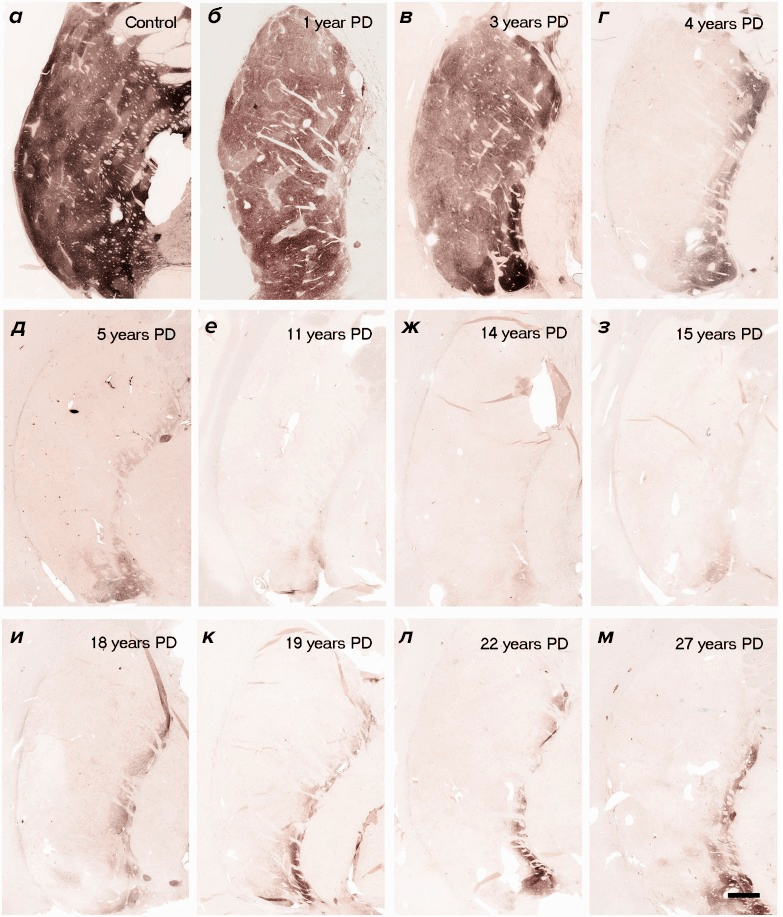
Рисунок 2. Плотность аксонов дофаминовых нейронов на срезе стриатума, иммуногистохимически окрашенных с помощью антител к тирозингидроксилазе. а — здоровый субъект; б–м — срезы стриатума пациентов с болезнью Паркинсона на разных стадиях заболевания.
Однако неудачное исследование фазы 2 побудило провести дополнительное исследование на приматах. На макаках резусах был полностью смоделирован процесс введения GDNF и дозировки, применявшиеся для лечения людей [19]. С повышением дозы GDNF росло число побочных эффектов, и во всей красе проявлялась токсичность белка. Проявились нарушения аппетита, потеря веса, потеря клеток Пуркинье в мозжечке. Даже увеличение числа аксонов (спраутинг) уже казалось каким-то зловеще бесконтрольным. Исследователи заключили, что GDNF вводить на самом деле небезопасно, и это также надолго остановило клинические испытания.
Тем не менее на сайте clinicaltrialsregister.eu можно найти информацию о двух продолжающихся клинических испытаниях GDNF (табл. 1). О результатах пока ничего не известно. Кроме того, что это испытания второй фазы, проводятся они снова в Бристоле и отличаются иным подходом к введению самого белка. Так, теперь инъекция делается билатерально (то есть в обе половины стриатума) и с помощью методики CED (convection-enhanced delivery), или доставки с улучшенной конвекцией. Этот подход заключается в том, что ультратонкий катетер, введенный в стриатум, впрыскивает GDNF под большим напором, что позволяет покрыть гораздо бо́льшую площадь стандартным объемом раствора, сделать это равномерно и не травмируя ткани (рис. 3) [20]. Метод хорошо зарекомендовал себя в экспериментах на макаках [21] и свиньях [22] и, как мы видим, добрался до клинических испытаний. Хочется верить, что все ошибки предыдущих испытаний были учтены и нас ожидают по-настоящему впечатляющие результаты.
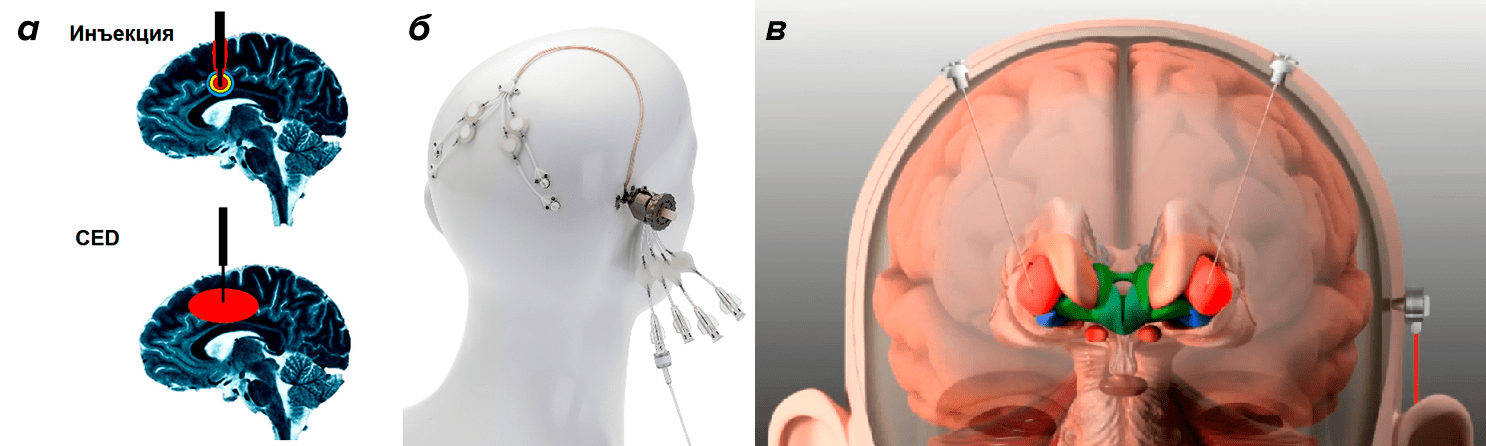
Рисунок 3. Схематичное сравнение (а) обычной инъекции с помощью минипомпы и доставки с улучшенной конвекцией (CED). Система для введения по методу CED, произведенная компанией Renishaw (б), и схема билатеральной инъекции в стриатум, проводимой с ее помощью (в).
На рекомбинантном белке свет клином не сошелся (рис. 4). Другим многообещающим подходом является использование аденоассоциированных вирусных (AAV) векторов для доставки гена GDNF в мозг. По сути, речь идет о генной терапии. Аденоассоциированный вирус исполняет роль «умной упаковки», которая в силу своей природы умеет доставлять сама себя внутрь клетки. Также эти вирусы малозаметны для иммунной системы (что хорошо и для вируса, и для исследователей). В научной фантастике вирусный вектор, как правило, мутирует, неся человечеству зомби-апокалипсис (вспомните хотя бы «Я — легенда» с Уиллом Смитом). В реальности ничего подобного, конечно же, быть не может в принципе. Никакой исследователь (если он в своем уме) не создаст конструкт, обладающий хоть небольшой патогенностью. Из вируса выбрасывается вся его патогенная начинка (ответственная среди прочего за воспроизводство вируса) и замещается тем геном/генами, которые необходимо доставить по адресу. Адресность в данном случае задается специфическим промотором, который позволит геному вируса производить требуемый белковый продукт только в определенных клетках. Преимущество вирусной доставки очевидно — вам достаточно сделать всего одну инъекцию, после которой в целевой области появится множество дополнительных копий необходимого гена (в нашем случае GDNF), и экспрессия возрастет в десятки или сотни раз. Продукция белка после этого будет на высоком уровне постоянно. А что еще нужно для восстановления поврежденных нейронов? В целом, метод вирусной доставки GDNF прекрасно зарекомендовал себя в экспериментах на животных, коих было немало [13], и таки добрался до клинических испытаний на людях. На данный момент в Роквилле (США), уже идет первая фаза испытаний вирусного вектора AAV2-GDNF на пациентах со значительной продолжительностью (более пяти лет) болезни Паркинсона. В этом исследовании также учтены кое-какие подходы из испытаний белка GDNF, в частности вирусные частицы вводятся билатерально в стриатум с применением техники CED.
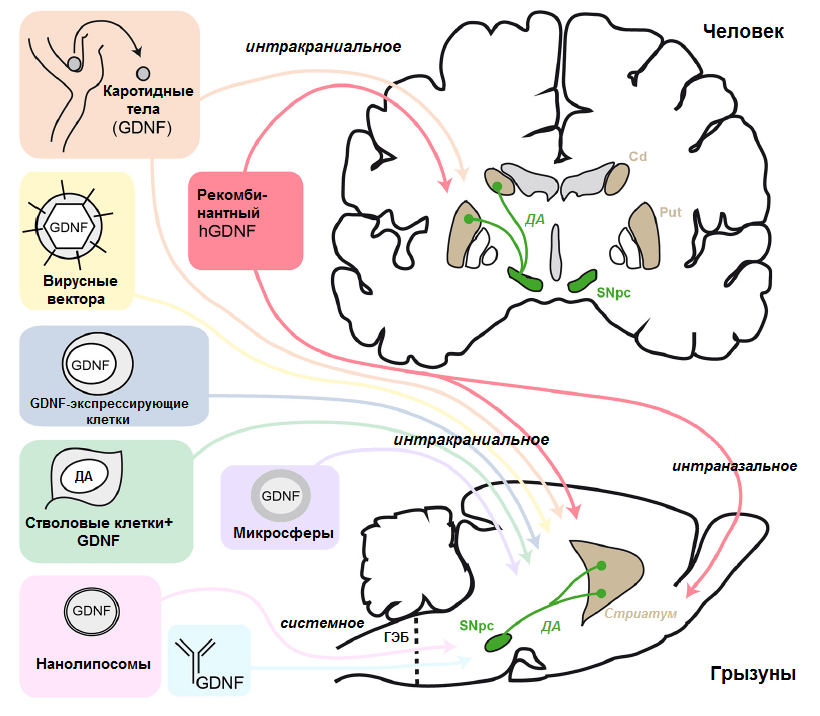
Рисунок 4. Схема различных подходов к доставке GDNF, применяемых в испытаниях на животных и человеке. Сокращения: ГЭБ — гематоэнцефалический барьер; SNpc — компактный слой (pars compacta) черной субстанции (substantia nigra); ДА — дофамин; Cd — хвостатое тело; Put — скорлупа (putamen). Хвостатое тело и скорлупа входят в состав стриатума.
| НТФ | Цель исследования | Группа пациентов | Идентификаторы баз clinicaltrials.gov и clinicaltrialsregister.eu | Фаза испытаний |
|---|---|---|---|---|
| AAV2-GDNF | Испытание четырех различных доз AAV2-GDNF на предмет безопасности при билатеральной внутристриатальной инъекции | 24 пациента со стажем болезни более пяти лет | NCT01621581 | Продолжается фаза 1 |
| Рекомбинантный GDNF | Исследование эффектов после введения различных доз (9–11 mg/ml) c помощью CED | EUCTR2011-003866-34-GB | Продолжается фаза 2 | |
| Рекомбинантный GDNF | Сравнение 9 и 18 месячного режима лечения (схема та же, что и в вышеприведенном триале) | EUCTR2013-001881-40-GB | Продолжается фаза 2 | |
| AAV2-Neurturin (CERE-120) | Испытание безопасности и эффективности CERE-120 при введении в стриатум (фаза 1) или комбинированно в стриатум и черную субстанцию (фаза 2) | 60 пациентов в фазе 1 и примерно 50 в фазе 2 | NCT00985517 | Фаза 1 завершена. Не выявлено осложнений, но и существенного положительного эффекта тоже. Начаты испытания фазы 2 |
| Рекомбинантный PDGF-BB | Двухнедельное испытание различных доз PDGF-BB при введении в желудочек мозга на предмет безопасности | 12 пациентов с умеренной тяжестью заболевания | NCT00866502 | Фаза 1/2 завершена. Показана безопасность и переносимость лечения. Намечены новые испытания |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование эффективности инъекции средней и высокой доз CDNF с помощью CED | 18 пациентов | NCT03295786 | Фаза 1/2, идет набор добровольцев |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование безопасности инъекции CDNF и проверка надежности и безопасности системы введения препаратов по методу CED, а также проверка эффективности CDNF для коррекции моторных и немоторных функций | 18 пациентов со средней тяжестью заболевания | EUCTR2015-004175-73 | Фаза 1/2, продолжается |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование эффективности билатеральной внутристриатальной инъекции CDNF (продолжение проекта EUCTR2015-004175-73), направленное на изучение эффектов после окончания лечения | 18 пациентов со средней тяжестью заболевания | EUCTR2018-000346-19 | Продолжается фаза 2 |
Про GDNF можно сказать еще очень много (он пользуется вполне заслуженным вниманием у исследователей), но, как говорится, «надо и честь знать». Однако прежде чем мы перейдем к другим НТФ, стоит сказать еще немного об иных, альтернативных подходах к использованию GDNF в терапии паркинсонизма (краткий, но емкий разбор их многообразия приведен в еще не потерявшем свежести обзоре Хавьера д'Анлемонта де Тассиньи (Xavier d’Angelmont de Tassigny) [10]) (рис. 4).
Так вот, одним из любопытных способов обойти непроницаемый гематоэнцефалический барьер (ГЭБ), избежать инвазивной операции и не связываться с вирусами, является использование нанолипосом. Эти полые липидные шарики с GDNF внутри, на поверхность которых посажены трансферриновые рецепторы, легко «проскальзывают» через ГЭБ. Несмотря на кажущуюся неспецифичность действия, такой подход позволяет почти полностью восстановить дофаминовые нейроны у мышей. А еще липосомы можно закапать в нос, и до стриатума они доберутся по аксонам обонятельных нервов. Показано, что такие «капли в нос» хорошо защищают дофаминовые нейроны от токсического поражения.
Можно также связать GDNF c молекулой иммуноглобулина (антителом) к клеточным компонентам ГЭБ (правда, такой GDNF-IgG провалился в испытаниях на обезьянах).
Чтобы не вводить GDNF в стриатум ежедневно, был испытан подход, когда вводится биоразлагаемая микросфера, которая медленно секретирует GDNF в течение восьми недель. Позитивный эффект после такого курса сохраняется 24 месяца.
Существуют попытки (достаточно успешные) совместить клеточную терапию и НТФ. В одних случаях в стриатум вводят астроциты, экспрессирующие GDNF, в других случаях это могут быть стволовые клетки, которым GDNF в первую очередь помогает приживаться и выживать. Двум больным паркинсонизмом посчастливилось получить такое необычное лечение с весьма впечатляющими показателями на выходе [24]. Правда, до более масштабных клинических испытаний данный подход еще не добрался в виду ряда нерешенных проблем с приживлением и функционированием трансплантата (и мне сдается, что из-за трудоемкости и рискованности эта процедура все же сильно проигрывает вирусным векторам и введению рекомбинантного белка). Неожиданно, но каротидные тельца (скопления хеморецепторов в месте разветвления сонной артерии на наружнюю и внутреннюю дуги) оказались чрезвычайно богаты GDNF, поэтому эти небольшие кусочки ткани также пересаживали в стриатум, дабы восстановить поврежденные дофаминовые нейроны. Этот метод даже испытали на пациентах. Эффект, однако, оказался не столь долгосрочен, да и разброс среди пациентов был весьма велик [25].
Существует еще множество неинвазивных способов стимулировать экспрессию в мозге пациентов, не прибегая к серьезному медицинскому вмешательству. Практически все самые распространенные антидепрессанты (нередко применяемые для лечения депрессивных симптомов при паркинсонизме) усиливают синтез или секрецию GDNF [26]. Все больше публикуется сообщений о том, что соединения из растительных средств традиционной китайской медицины, такие как эхинакозид, пуерарин, нарингин, эффективно усиливают синтез GDNF и защищают дофаминовые нейроны от токсического повреждения. Усилить производство GDNF может транскраниальная магнитная стимуляция, метод, который все шире применяется в терапии болезни Паркинсона, а также физические упражнения и даже ограничение потребления пищи (или снижение калорийности). Однако какими бы заманчиво простыми не были эти решения, гимнастика, диета и антидепрессанты могут быть лишь дополнением к более серьезной терапии.
Близкий родственник GDNF — нейртурин
Как мы уже упоминали ранее, этот НТФ входит в то же семейство, что и GDNF, и имеет 42% сходства с последним. Благодаря своей способности восстанавливать и защищать дофаминовые нейроны он, так же как и GDNF, быстро привлек к себе внимание. Несмотря на многообещающие результаты экспериментов на животных [27] клинические испытания пошли не так хорошо, как хотелось бы. Исследователи решили не размениваться по мелочам и сразу же приступили к тестированию AAV-вектора для доставки нейртурина (коммерческое название этого средства — CERE-120). В первом испытании участвовали 12 пациентов с большой продолжительностью заболевания. Им сделали билатеральную инъекцию CERE-120 в стриатум и обнаружили безопасность и эффективность процедуры. По крайней мере, через год после инъекции не наблюдалось побочных эффектов, а двигательная активность по шкале UPDRS улучшилась на 36%. Настораживало только отсутствие изменений в метаболизме дофамина у больных [28]. Однако испытания фазы 2 обернулись едва ли не катастрофой. В рандомизированном мультицентровом исследовании с участием 58 пациентов [29] не только не удалось добиться существенного улучшения в течение года, но и у 13 из 38 пациентов, получивших инъекции CERE-120, обнаружились серьезные побочные эффекты. У троих из них даже появились опухоли в мозге. Впрочем, таковые возникли и у двух ложнооперированных пациентов из контрольной группы, так что AAV-вектор вряд ли виноват в этом. Посмертное вскрытие умерших пациентов показало, что аксональный транспорт нейртурина ухудшен, поскольку белок, синтезированный в стриатуме, так и не добрался до черной субстанции.
Но и это не остановило маховик клинических испытаний. Было проведено рандомизированное мультицентровое исследование с 51 пациентом, дабы узнать, сможет ли одновременная инъекция CERE-120 в стриатум и черную субстанцию как-то улучшить дело. Но и в этот раз ничего не вышло. Казалось бы, можно поставить точку, но на сайте clinicaltrials.gov обнаружилась информация, что в США снова проводятся испытания CERE-120. Вероятно, опыт прошлых испытаний будет учтен, и старания исследователей (и надежды пациентов) вознаградятся.
Другие НТФ и ростовые факторы в борьбе с паркинсонизмом
Вообще стоит сказать, что многие НТФ и ростовые факторы могут защищать дофаминовые нейроны, однако когда дело доходит до болезни Паркинсона, нейроны нужно не защищать, а восстанавливать. И тут очень немногие НТФ могут похвастаться эффективностью.
Представители семейства нейротрофинов (NGF, широко известный BDNF, а также NT3 и NT4/5) могут способствовать выживанию дофаминовых нейронов (стриатум, к примеру, приобретает свой конечный размер не в последнюю очередь благодаря BDNF). Разумеется, такие удивительные свойства побудили испытать нейротрофины в борьбе с болезнью Паркинсона, и даже было проведено несколько исследований на животных [27]. Любопытно, но в далеком уже 1991 году одной пациентке с 19-летним стажем болезни Паркинсона трансплантировали в стриатум хромаффинные клетки надпочечника (синтезируют адреналин и норадреналин) и «приправили» их NGF [30]. Процедура не имела значительного успеха, и NGF не спас положение. Но как бы то ни было, у нейротрофинов нет клинического будущего. Дело в том, что структура генов и процессинг белка у них чрезвычайно сложны. Достаточно сказать, что у человека существует 17 вариантов транскриптов одного гена Bdnf, к тому же функциональных, от длины которых зависит, куда в клетке они будут доставлены (короткие, как правило, оказываются в аксонах и дендритах). В процессе «созревания» BDNF проходит через стадию pre-proBDNF, затем proBDNF, и все эти промежуточные формы активны и выполняют диаметрально противоположные функции. Если зрелый BDNF положительно регулирует нейронную пластичность, то его проформы запускают апоптоз (программируемую смерть клетки). Пока что невозможно создать вирусный конструкт, который бы учитывал все эти и многие другие нюансы. А как же сам зрелый белок BDNF, скажете вы? Тогда я скажу, что для связывания того же BDNF, помимо привычного рецептора TrkB, есть широко распространенная усеченная форма (TrkB-T), функции которой, ну вы догадались, совершенно другие [31]. Контролировать всю эту «молекулярную кухню» невозможно, а потому в терапию нейротрофинам путь заказан.
Известно, что белки семейства VEGF (факторы роста эндотелия сосудов) тоже могут восстанавливать дофаминовые нейроны после токсического поражения [32]. Но либо эти эффекты скромны (в случае с VEGF-C), либо недостаточно исследованы (в случае с VEGF-A и B). Есть сходные данные о представителях семейства фактора роста фибробластов (FGF), но опять-таки немногочисленные. На фоне вышеназванных ростовых факторов выгодно выделяется изоформа фактора роста тромбоцитов (PDGF-BB), который, вопреки своему названию, стимулирует восстановление нигростриатной системы после поражения 6-ОНДА. Причем действует он не напрямую, а стимулируя стволовые клетки в «горячих точках» нейрогенеза в мозге (преимущественно в субвентрикулярной зоне) [32]. PDGF-BB уже был испытан в первом исследовании с участием 12 пациентов, которым непродолжительное время этот белок вводили в желудочки мозга. Пока что доказана только безопасность PDGF-BB, но из-за короткого режима испытаний не оценили эффекта на двигательные функции пациентов, хотя и установили повышение в мозге плотности дофаминового траспортера [33].
CDNF и MANF — новые «игроки на поле»
Скромные результаты, которые GDNF и нейртурин показали в ходе клинических испытаний, побудили исследователей искать новые НТФ, потенциально полезные для терапии болезни Паркинсона. В 2003 году был открыт белок, названный мезэнцефалическим астроцитарным нейротрофическим фактором, или MANF (mesencephalic astrocyte-derived neurotrophic factor). Сразу же выявилось, что MANF обеспечивает выживание эмбриональных дофаминовых нейронов in vitro. В 2007 году был обнаружен гомологичный (на 59%) белок CDNF (cerebral dopamine neurotrophic factor). Как вы уже догадались из названия, этот НТФ преуспевает в деле защиты и восстановления дофаминовых нейронов. Примечательно, что уже в первой публикации [34] было показано, что в токсической модели болезни Паркинсона (когда вводится 6-ОНДА, избирательно уничтожающий дофаминовые нейроны) CDNF восстанавливает нейроны эффективней, чем GDNF (рис. 5).
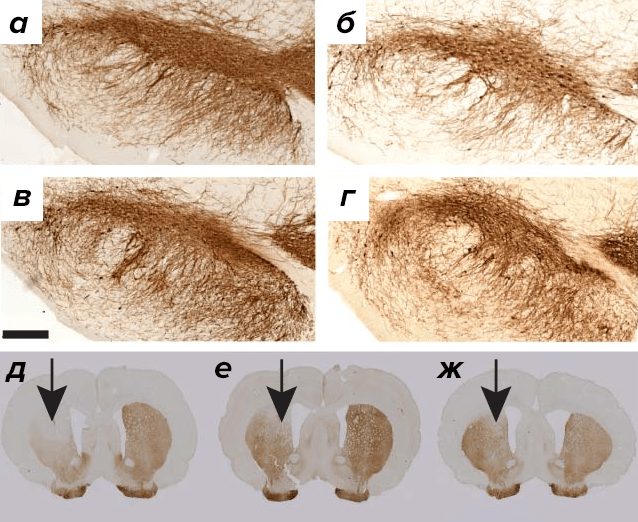
Рисунок 5. Срез черной субстанции здорового животного (а), после введения 6-ОНДА (б), 6-ОНДА+GDNF (в) и 6-ОНДА+CDNF (г). Срез стриатума после одностороннего введения 6-ОНДА (д), 6-ОНДА+GDNF (е) и 6-ОНДА+CDNF (ж).
Самое любопытное, что последовательности аминокислот и трехмерная структура MANF и CDNF разительно отличаются от всех остальных НТФ, так что даже какие-то эволюционные связи провести трудно. В отличие от прочих НТФ, оба фактора локализованы преимущественно в эндоплазматическом ретикулуме (ЭПР) — внутриклеточной системе из полостей, которая окружает ядро и является местом синтеза белка в клетке, — но могут переходить и в секретируемую форму. Вообще для них характерна двойственная активность. Строение N-конца белковой молекулы позволяет им действовать как нейротрофическим факторам, а благодаря строению С-конца они «заякорены» в ЭПР, и этой погруженной частью могут останавливать и обращать вспять так называемый стресс ЭПР. Это состояние развивается чаще всего из-за накопления неправильно свернутых или поврежденных белков (вспомните α-синуклеин) и заканчивается, как правило, апоптозом. Так вот, MANF взаимодействуя с регулятором «ремонтных» белков шаперонов, GRP78, помогает «распутывать» белки с неправильной конформацией, а CDNF, помимо этого, еще способен напрямую взаимодействовать с Bax и каспазой-3 и таким образом останавливать апоптоз. Показано, что CDNF, в отличие от остальных НТФ, может устранять скопления α-синуклеина [35], [36].
Самое интересное в отношении CDNF, то, что он почти инертен в отношении здоровых нейронов и начинает активно действовать лишь при наличии какого-либо патологического процесса. Согласитесь, очень удобное свойство для потенциального терапевтического средства. Благодаря своим малым размерам CDNF чрезвычайно хорошо распространяется от места укола и прекрасно транспортируется от стриатума до черной субстанции (рис. 6) [37]. Здесь «балл» также достается CDNF, а не GDNF, поскольку последний транспортируется достаточно медленно и сразу же «пасует» перед скоплениями α-синуклеина на своем пути. За десяток лет был проведен целый ряд исследований на различных животных от мышей до обезьян [38], в которых многократно был показан мощный защитный/восстанавливающий эффект CDNF, поэтому неудивительно, что уже начались его клинические испытания (на сайтах clinicaltrials.gov и clinicaltrialsregister.eu есть информация о трех клинических испытаниях первой и второй фаз в Финляндии и Швеции).
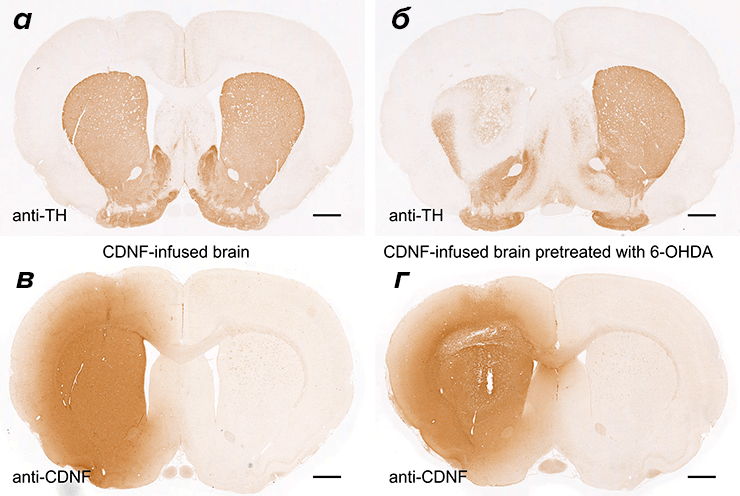
Рисунок 6. Срез стриатума здорового животного (а), окрашенного антителами к тирозингидроксилазе, и после введения 6-ОНДА (б). Окрашивание среза антителами к CDNF после введения последнего здоровому животному (в) и при введении CDNF после 6-ОНДА (г).
Да, в свое время и на GDNF c нейртурином возлагали большие надежды, которые они пока не оправдали, однако уже в испытаниях на животных CDNF показал себя лучше вышеназванных НТФ, стоит ли поэтому ожидать, что испытания провалятся? Думаю, нет. В этот раз на стороне исследователей и пациентов стоит сама природа, создавшая CDNF эффективным и безопасным. Огромный опыт, извлеченный из предыдущих экспериментов и испытаний GDNF, нейртурина или PDGF-BB, также поможет оптимизировать лечение, сделать его безопасным и действенным.
Заключение
Путь, по которому пошли исследователи и клиницисты, взяв на вооружение НТФ, оказался ухабистым, но никто и не обещал, что будет легко, однако награда в конце слишком велика, чтобы повернуть назад, — впервые у медицины появилась возможность вычеркнуть болезнь Паркинсона из разряда неизлечимых. Пессимизм середины–конца прошлого десятилетия сменяется оптимистичными прогнозами.
В 2017 году мне посчастливилось побывать в лаборатории профессора Марта Саарма (Mart Saarma) в Биоцентре при Университете Хельсинки. Руководимая им группа исследователей открыла CDNF и первой показала его эффективность в лечении паркинсонизма. В ожидании лабораторного семинара мы сидели в кабинете профессора, где он рассказал о некоторых исследованиях его лаборатории, в частности о тестировании CDNF на приматах и создании миметиков GDNF (малых молекул-аналогов, проникающих через ГЭБ). Результаты (к слову, очень впечатляющие) говорили сами за себя, но и та страсть, с которой Март рассказывал об исследованиях, ошибках прошлых испытаний и перспективах грядущих, заразили меня оптимизмом в отношении лечения болезни Паркинсона. Мне очень хочется верить, что после прочтения этой статьи немного оптимизма появится и у вас.
Литература
- Дофаминовые болезни;
- Болезнь Паркинсона: что изучать? как изучать?;
- Jaan-Olle Andressoo, Mart Saarma. (2008). Signalling mechanisms underlying development and maintenance of dopamine neurons. Current Opinion in Neurobiology. 18, 297-306;
- Eero Castrén. (2015). Trophic Factors: Neurotrophic Factors. Neuroscience in the 21st Century. 1-34;
- Stanley H. Appel. (1981). A unifying hypothesis for the cause of amyotrophic lateral sclerosis, parkinsonism, and alzheimer disease. Ann Neurol.. 10, 499-505;
- L. Lin, D. Doherty, J. Lile, S Bektesh, F Collins. (1993). GDNF: a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons. Science. 260, 1130-1132;
- Matti S. Airaksinen, Mart Saarma. (2002). The GDNF family: Signalling, biological functions and therapeutic value. Nat Rev Neurosci. 3, 383-394;
- Jaakko Kopra, Carolina Vilenius, Shane Grealish, Mari-Anne Härma, Kärt Varendi, et. al.. (2015). GDNF is not required for catecholaminergic neuron survival in vivo. Nat Neurosci. 18, 319-322;
- Thomas Müller. (2012). Drug therapy in patients with Parkinson’s disease. Transl Neurodegener. 1, 10;
- Xavier d'Anglemont de Tassigny, Alberto Pascual, Jose Lopez-Barneo. (2015). GDNF-based therapies, GDNF-producing interneurons, and trophic support of the dopaminergic nigrostriatal pathway. Implications for Parkinson's disease. Front. Neuroanat.. 9;
- Shelley J. Allen, Judy J. Watson, Deborah K. Shoemark, Neil U. Barua, Nikunj K. Patel. (2013). GDNF, NGF and BDNF as therapeutic options for neurodegeneration. Pharmacology & Therapeutics. 138, 155-175;
- J.G. Nutt, K.J. Burchiel, C.L. Comella, J. Jankovic, A.E. Lang, et. al.. (2003). Randomized, double-blind trial of glial cell line-derived neurotrophic factor (GDNF) in PD. Neurology. 60, 69-73;
- John T. Slevin, Greg A. Gerhardt, Charles D. Smith, Don M. Gash, Richard Kryscio, Byron Young. (2005). Improvement of bilateral motor functions in patients with Parkinson disease through the unilateral intraputaminal infusion of glial cell line—derived neurotrophic factor. Journal of Neurosurgery. 102, 216-222;
- Nikunj K. Patel, Martin Bunnage, Puneet Plaha, Clive N. Svendsen, Peter Heywood, Steven S. Gill. (2005). Intraputamenal infusion of glial cell line-derived neurotrophic factor in PD: A two-year outcome study. Ann Neurol.. 57, 298-302;
- Steven S. Gill, Nikunj K. Patel, Gary R. Hotton, Karen O'Sullivan, Renée McCarter, et. al.. (2003). Direct brain infusion of glial cell line–derived neurotrophic factor in Parkinson disease. Nat Med. 9, 589-595;
- Seth Love, Puneet Plaha, Nikunj K Patel, Gary R Hotton, David J Brooks, Steven S Gill. (2005). Glial cell line–derived neurotrophic factor induces neuronal sprouting in human brain. Nat Med. 11, 703-704;
- Anthony E. Lang, Steven Gill, Nik K. Patel, Andres Lozano, John G. Nutt, et. al.. (2006). Randomized controlled trial of intraputamenal glial cell line-derived neurotrophic factor infusion in Parkinson disease. Ann Neurol.. 59, 459-466;
- Jeffrey H. Kordower, C. Warren Olanow, Hemraj B. Dodiya, Yaping Chu, Thomas G. Beach, et. al.. (2013). Disease duration and the integrity of the nigrostriatal system in Parkinson’s disease. Brain. 136, 2419-2431;
- David N. Hovland, Robert B. Boyd, Mark T. Butt, Jeffery A. Engelhardt, Michael S. Moxness, et. al.. (2007). Reprint: Six-Month Continuous Intraputamenal Infusion Toxicity Study of Recombinant Methionyl Human Glial Cell Line-Derived Neurotrophic Factor (r-metHuGDNF) in Rhesus Monkeys. Toxicol Pathol. 35, 1013-1029;
- M SALVATORE, Y AI, B FISCHER, A ZHANG, R GRONDIN, et. al.. (2006). Point source concentration of GDNF may explain failure of phase II clinical trial. Experimental Neurology. 202, 497-505;
- Francisco Gimenez, Michal T. Krauze, Francisco Valles, Piotr Hadaczek, John Bringas, et. al.. (2011). Image-guided convection-enhanced delivery of GDNF protein into monkey putamen. NeuroImage. 54, S189-S195;
- E. White, M. Woolley, A. Bienemann, D.E. Johnson, M. Wyatt, et. al.. (2011). A robust MRI-compatible system to facilitate highly accurate stereotactic administration of therapeutic agents to targets within the brain of a large animal model. Journal of Neuroscience Methods. 195, 78-87;
- Jeffrey H. Kordower, Anders Bjorklund. (2013). Trophic Factor Gene Therapy for Parkinson's Disease. Mov Disord. 28, 96-109;
- Ivar Mendez, Alain Dagher, Murray Hong, Adam Hebb, Paula Gaudet, et. al.. (2000). Enhancement of survival of stored dopaminergic cells and promotion of graft survival by exposure of human fetal nigral tissue to glial cell line—derived neurotrophic factor in patients with Parkinson's disease. Journal of Neurosurgery. 863-869;
- A. Minguez-Castellanos, F. Escamilla-Sevilla, G. R Hotton, J. J Toledo-Aral, A. Ortega-Moreno, et. al.. (2007). Carotid body autotransplantation in Parkinson disease: a clinical and positron emission tomography study. Journal of Neurology, Neurosurgery & Psychiatry. 78, 825-831;
- Anton S. Tsybko, Tatiana V. Ilchibaeva, Nina K. Popova. (2017). Role of glial cell line-derived neurotrophic factor in the pathogenesis and treatment of mood disorders. Reviews in the Neurosciences. 28;
- Ava Nasrolahi, Javad Mahmoudi, Abolfazl Akbarzadeh, Mohammad Karimipour, Saeed Sadigh-Eteghad, et. al.. (2018). Neurotrophic factors hold promise for the future of Parkinson’s disease treatment: is there a light at the end of the tunnel?. Reviews in the Neurosciences. 29, 475-489;
- William J Marks, Jill L Ostrem, Leonard Verhagen, Philip A Starr, Paul S Larson, et. al.. (2008). Safety and tolerability of intraputaminal delivery of CERE-120 (adeno-associated virus serotype 2–neurturin) to patients with idiopathic Parkinson's disease: an open-label, phase I trial. The Lancet Neurology. 7, 400-408;
- William J Marks, Raymond T Bartus, Joao Siffert, Charles S Davis, Andres Lozano, et. al.. (2010). Gene delivery of AAV2-neurturin for Parkinson's disease: a double-blind, randomised, controlled trial. The Lancet Neurology. 9, 1164-1172;
- Lars Olson. (1991). Intraputaminal Infusion of Nerve Growth Factor to Support Adrenal Medullary Autografts in Parkinson's Disease. Arch Neurol. 48, 373;
- Barbara M. Fenner. (2012). Truncated TrkB: Beyond a dominant negative receptor. Cytokine & Growth Factor Reviews. 23, 15-24;
- Dan Lindholm, Johanna Mäkelä, Valentina Di Liberto, Giuseppa Mudò, Natale Belluardo, et. al.. (2016). Current disease modifying approaches to treat Parkinson’s disease. Cell. Mol. Life Sci.. 73, 1365-1379;
- Gesine Paul, Olof Zachrisson, Andrea Varrone, Per Almqvist, Markus Jerling, et. al.. (2015). Safety and tolerability of intracerebroventricular PDGF-BB in Parkinson’s disease patients. J. Clin. Invest.. 125, 1339-1346;
- Päivi Lindholm, Merja H. Voutilainen, Juha Laurén, Johan Peränen, Veli-Matti Leppänen, et. al.. (2007). Novel neurotrophic factor CDNF protects and rescues midbrain dopamine neurons in vivo. Nature. 448, 73-77;
- Maria Lindahl, Mart Saarma, Päivi Lindholm. (2017). Unconventional neurotrophic factors CDNF and MANF: Structure, physiological functions and therapeutic potential. Neurobiology of Disease. 97, 90-102;
- Merja H. Voutilainen, Urmas Arumäe, Mikko Airavaara, Mart Saarma. (2015). Therapeutic potential of the endoplasmic reticulum located and secreted CDNF/MANF family of neurotrophic factors in Parkinson's disease. FEBS Letters. 589, 3739-3748;
- Kert Mätlik, Helena Vihinen, Ali Bienemann, Jaan Palgi, Merja H. Voutilainen, et. al.. (2017). Intrastriatally Infused Exogenous CDNF Is Endocytosed and Retrogradely Transported to Substantia Nigra. eNeuro. 4, ENEURO.0128-16.2017;
- Tingting Tang, Yong Li, Qian Jiao, Xixun Du, Hong Jiang. (2017). Cerebral Dopamine Neurotrophic Factor: A Potential Therapeutic Agent for Parkinson’s Disease. Neurosci. Bull.. 33, 568-575;
- Повелевающая ростом.