
Биолюминесцентные и симбиотические микроорганизмы
02 марта 2021
Биолюминесцентные и симбиотические микроорганизмы
- 1131
- 0
- 1
Рисунок в полном размере
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Перед вами — небольшой экскурс в мир микроорганизмов. Здесь вы встретите люминесцентных динофитов, которые поражают своим необычным свечением, узнаете, какие микроорганизмы живут в симбиозе с живыми существами и приносят им величайшую пользу. Также в статье рассказывается о микробах, сочетающих в себе обе способности. Биолюминесцентные бактерии Vibrio fischeri находятся в симбиотических отношениях с гавайским кальмаром Euprymna scolopes и за счет специальных молекул могут формировать его организм.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Моря, полные «живых фонариков»
Биолюминесценция всегда вызывала интерес у исследователей. Ученые стремились разгадать феномен свечения живых существ, в том числе и микроорганизмов.
Среди них есть морские люминесцентные представители, например, микроводоросли динофлагелляты.
Динофлагелляты — одноклеточные водоросли, из-за люминесценции которых мы можем наблюдать феерическую картину — завораживающее синее подсвечивание волн на побережьях (рис. 1).

Рисунок 1. Свечение динофитовых водорослей Noctiluca scintillans
Свечение в динофитовых водорослях осуществляется за счет особого окислительного фермента люциферазы [1], заключенного в специальные составляющие цитоплазмы — мембранные емкости, называемые сцинтиллонами [1], [2].
В водорослях содержится связанный с белком субстрат люциферин [1], который способен светиться из-за ряда происходящих химических реакций. Так что именно должно произойти, чтобы возникла вспышка света? А вот что: как раз сейчас в игру вступает вышеупомянутый фермент люцифераза, который окисляет люциферин за счет кислорода. В результате такого превращения в электронно-возбужденном состоянии образуется молекула оксилюциферина. После чего в виде фотона — кванта света — испускается энергия возбуждения электронов [3]. Вот так работает внутренняя биохимия производства света .
Подробнее об этом можно прочитать в статьях «Биомолекулы»: «Биолюминесценция: возрождение» [4] и «Микроскопическое свечение космического масштаба» [5].
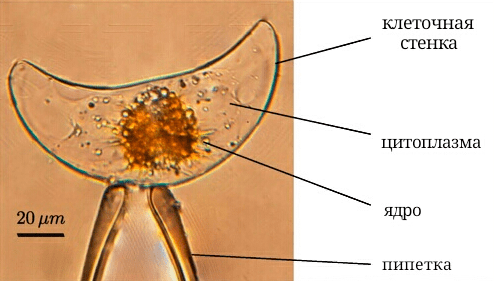
Рисунок 2. Одноклеточный динофлагеллят в виде полумесяца Pyrocystis lunula на стеклянной микропипетке
Команда исследователей из Кембриджского университета в своей статье, опубликованной в журнале Physical Review Letters [6], решила установить, в чем же заключается физическая составляющая механизма данного явления. Они выяснили, что динофлагеллят Pyrocystis lunula (рис. 2) испускает свет тогда, когда оболочка клетки водоросли подвергается деформации из-за воздействия на нее внешних механических сил — ударов волн (рис. 3).
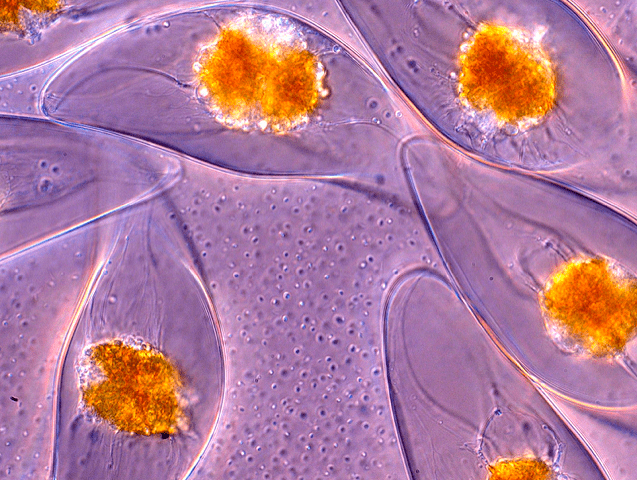
Рисунок 3. Вспышка света динофлагеллятов Pyrocystis lunula при деформации его клеточной стенки. Оранжевые фрагменты — ядра клеток.
Авторы рассказали о связи между производством света и механическим напряжением на уровне отдельно взятой клетки динофлагеллята. Для этого был применен метод высокоскоростной визуализации клеток микроводорослей Pyrocystis lunula. Такой метод представляет собой исследование клеток при помощи покадровой и атомно-силовой микроскопии [6].
Например, с использованием этого метода получилось показать, что свечение динофитов Pyrocystis lunula является ответом на механическое воздействие. Такое поведение клеточной стенки называется вязкоупругим откликом [6], [7].
У Pyrocystis lunula этот механизм связан с транспортными белками — кальциевыми каналами, встроенными в клеточную мембрану [6].
Каналы играют роль тоннеля, который пропускает через мембраны кальций, присутствующий в морской воде. После чего дело остается за биохимией: с помощью работы ионных каналов активируется цепочка химических реакций, которая порождает свет.
Тем не менее динофлагелляты реагируют не на каждый удар. Свечение водорослей запустится при условии, что клетка деформировалась сильно и быстро [6].
Производство света динофитам нужно для того, чтобы отпугивать хищников: водоросли начинают светиться в ответ на сильное внешнее воздействие, напоминающее нападение. В ходе естественного отбора микроорганизмы стали отвечать свечением только на самые сильные и быстрые удары хищников.
Взаимовыгодное сожительство динофлагеллят и кораллов
Важно отметить, что динофлагелляты могут вступать в симбиоз с полипами. Это очень значимые взаимоотношения между организмами, поскольку без водорослей не было бы коралловых рифов [8], [9]!
Ведь динофиты живут в клетках тканей кораллового полипа и играют значительную роль в обеспечении его питания: большее количество пищи полипа приходится на органические вещества, которые образуют водоросли за счет процесса фотосинтеза. А полипы снабжают водоросли биогенными элементами и углекислым газом, а также организовывают им укрытие.
Кораллы очень чувствительны к температуре среды, в которой они обитают. Когда температура воды повышается, происходит нарушение взаимосвязей между организмами: коралловые полипы теряют динофлагеллят, а после обесцвечиваются (рис. 4). Они могут и погибнуть, если неблагоприятные условия затянутся [10].

Рисунок 4. Обесцвечивание кораллов, пострадавших от воздействия высоких температур и потерявших водоросли-симбионты
Вымирание коралловых полипов представляет собой большую экологическую проблему. Эксперты из Университета Мельбурна, работающие в сфере экспериментальной эволюции динофлагеллят, решили разобраться с вопросом обесцвечивания кораллов и провести исследование.
Ученые отобрали микроводоросли вида Cladocopium goreaui и культивировали их в лаборатории, изолировав от кораллов. В ходе экспериментальных работ применялась техника направленной эволюции. Ученые in vitro воздействовали на динофлагеллят температурой в пределах 27 градусов по Цельсию [10].
На протяжении четырех лет одна часть водорослей находилась при постоянной температуре (27 градусов по Цельсию), а вторая часть подвергалась постепенному повышению температур. Со временем водоросли приобрели адаптивные мутации и приспособились к новым температурным условиям. Так, осторожно повышая температуру среды, исследователи вывели штамм динофлагеллят, способный выживать при температуре 31 градус по Цельсию!
После этого осталось проверить, сможет ли новый термоустойчивый штамм динофитов предотвратить обесцвечивание полипов. Ученые разделили планулы на две группы и соединили их и со штаммами водорослей дикой культуры, и термоустойчивыми модифицированными водорослями.
Подводя итог выполненной работе, можно заметить следующее: при температуре 31 градус по Цельсию коралл с водорослями дикой культуры быстро обесцветился, а коралл с модифицированными термоустойчивыми водорослями сохранил окраску. Таким образом, новый штамм динофитовых водорослей способен предотвратить обесцвечивание полипа и спасти его от гибели.
Полученные результаты, по мнению ученых, говорят о дальнейшей возможности использования модифицированных динофлагеллят в качестве защитников коралловых рифов от обесцвечивания [10].
Биолюминесцентные микропомощники: свет в жизни Euprymna scolopes
Перейдем к наиболее маленьким живым излучателям света — люминесцентным бактериям. Такие бактерии можно обнаружить в основном в морских водах, а также на поверхности разлагающихся рыб и даже в кишечнике морских животных.
Существуют как свободноживущие светящиеся бактерии, так и живущие в симбиозе с животными, например, небольшими моллюсками вида Euprymna scolopes (рис. 5, 6) [11].

Рисунок 5. Гавайский бобтейл-кальмар Euprymna scolopes

Рисунок 6. Размер Euprymna scolopes по сравнению с человеческой рукой
Гавайские бобтейл-кальмары — ночные хищники, которые вдобавок обзавелись взаимовыгодным сотрудничеством с люминесцентными бактериями Vibrio fischeri.
Эти бактерии живут в специализированном органе кальмаров — фотофоре, который располагается под мантией (рис. 7а и 7б).
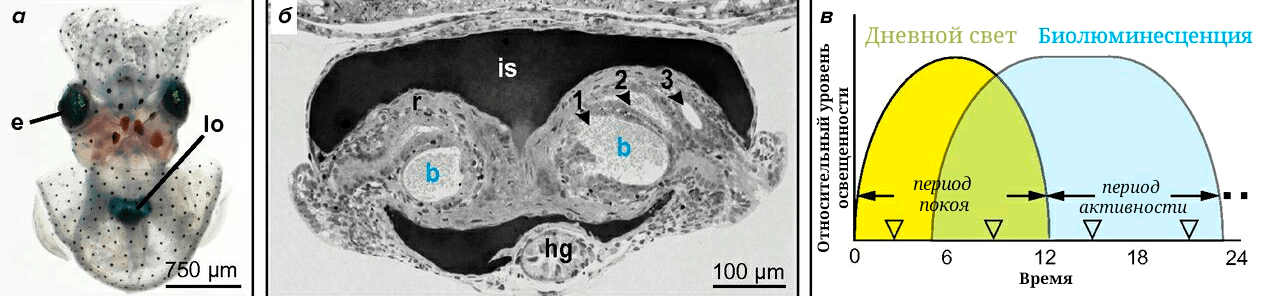
Рисунок 7. а — Молодая особь кальмара E. scolopes. e — глаза; lo — фотофор, видимый через ткань брюшной мантии. б — Световая микрофотография поперечного сечения фотофора. Внутренняя часть органа содержит выстланные эпителием углубления, в которых находятся бактерии (b). Вокруг фотофора находятся чернильный мешок (is) и рефлекторы (r), способные регулировать излучение света из фотофора во внешнюю среду. в — Световые циклы моллюска. В эксперименте кальмар подвергался воздействию внешнего дневного света в период покоя и в период бактериальной люминесценции фотофора ночью, когда животное подвижно.
V. fischeri получает от кальмаров питательные вещества: сахара и аминокислоты, а также условия для размножения и роста. В свою очередь, вибрионы при помощи своего голубого свечения (рис. 8) обеспечивают моллюску маскировку.

Рисунок 8. Кальмар Euprymna scolopes испускает голубой свет, благодаря симбиотическим бактериям Vibrio fischeri
За счет люминесценции микропомощников и устройства фотофора, нижняя часть тела гавайских бобтейл-кальмаров способна излучать необходимое количество света в соответствии с освещенностью обитаемой среды. Это означает, что в лунную ночь бактерии-симбионты испускают голубой свет интенсивнее, чем в пасмурную погоду. Таким образом, из темных глубин океана контур тела моллюска становится незаметным для хищников.
Но на этом роль бактерий-симбионтов не заканчивается. Как установили исследователи из Университета штата Висконсин в Мэдисоне, светящиеся бактерии способны определять работу циркадных ритмов моллюска.
В лаборатории Маргарет Макфолл-Най (Margaret McFall-Ngai) и Эдварда Руби (Edward Ruby) ученые изучают кальмаров Euprymna scolopes на протяжении тридцати лет.
В их научной группе определили, что голубой свет активирует (включает) специальные гены, которые кодируют регуляторные белки — криптохромы (CRY) [12].
Как оказалось, молекулы светочувствительных белков «сообщают» животному, что произошла смена времени суток, этим сохраняя взаимосвязь между природными циклами и жизнью моллюска.
У кальмаров есть два таких гена, escry2 и escry1, кодирующих криптохромы. Один из таких белков активен в голове, ближе к органам чувств и мозгу, потому что у кальмаров белки циркадного ритма синтезируются в области ЦНС.
А другой криптохром синтезируется в области сосредоточения люминесцентных бактерий — фотофоре. Работа гена escry1, кодирующего второй белок, соответствовала периоду бактериальной голубой биолюминесценции, а не смене времени суток, поскольку кальмар светился в ночное время, когда выходит поохотиться.
Излучаемый моллюском свет соответствует суточным ритмам (рис. 7в), которые имеют особенности циркадного ритма, связанные с симбиозом. Максимальное свечение кальмара происходит не днем, когда тот малоподвижен, а ночью, когда моллюск активен и исследует воды в поисках пищи. Получается, испускание голубого света бактериями-симбионтами происходит во время, отличное от времени естественного освещения среды [12].
Это значит, что источник голубого света — бактерии V. fischeri «заставляют» гены работать (рис. 9) и управляют циркадными ритмами кальмаров почти по всему организму, тем самым регулируя подъем моллюска для ночной охоты.
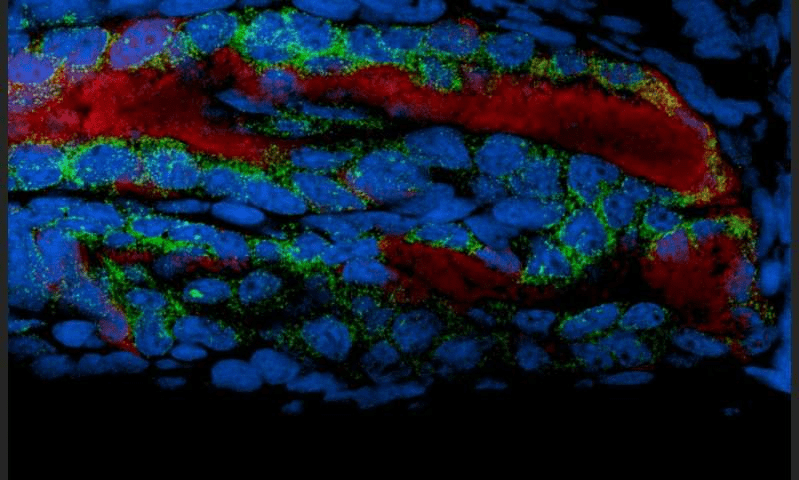
Рисунок 9. Euprymna scolopes под микроскопом. Люминесцентные бактерии (отметка красным цветом) провоцируют экспрессию генов (отметка зеленым цветом) в эпителии фотофора (отметка синим цветом).
Это было подтверждено экспериментальным путем сотрудниками вышеупомянутой лаборатории. В исследовании применялись два штамма этих бактерий. Первый штамм микроорганизмов излучал яркое свечение, а у второго искусственно созданного штамма «дельта-люкс» (Δlux) биолюминесценция отсутствовала [12], [13]. После чего исследователи разделили моллюсков на группы и сравнили активность (экспрессию) их генов.
В первой группе были кальмары, колонизированные ярко светящимися бактериями, во второй — бактериями «дельта-люкс». А световой орган моллюсков третьей группы вовсе не был заселен бактериями-симбионтами. Фотофор моллюска из последней группы не был колонизирован симбионтами для того, чтобы выяснить, как повлияет отсутствие бактериальных партнеров на экспрессию гена криптохрома и работу циркадных ритмов [12].
С наступлением ночи, циркадный ритм гена (escry1) кальмаров из последней группы не заработал. То же самое происходило и с животными из второй группы, заселенными бактериями без свечения: биологические часы отказали [14].
Почему? Бактерии из штамма «дельта-люкс» не способны сохранять симбиотическую связь, а также стимулировать развитие фотофора.
Даже если на фотофор воздействовали искусственным светом, схожим с бактериальной люминесценцией, то ритмическая активность гена должным образом не работала, а синтез криптохрома не происходил [12].
А заселение яркосветящимися симбиотическими бактериями в световой орган кальмаров из первой группы было необходимо для общей сверки показателей со второй и третьей группами.
Ученые пришли к выводу, что такая нормальная симбиотическая люминесценция необходима для максимального изменения экспрессии генов моллюска [13], [15].
Но достаточно ли одного света для активации гена?
Ключевой момент состоит не только в бактериальном свечении, а еще и в особых молекулах, которые способствуют морфогенезу фотофора: пептидокликане (PGN) и липополисахриде (LPS) [16], [17].
Пептидогликан и липополисахарид — главные компоненты в составе клеточной мембраны люминесцентных бактерий, которые относили к PAMP (патоген-ассоциированным молекулярным паттернам [18]) . Именно эти молекулы и оказались главными активаторами гена escry1 [12].
PAMP — особые вещества, которые запускают иммунные реакции животного и являются универсальным сигналом о проникновении инфекций в его организм. Такие молекулярные структуры свойственны микроорганизмам и отсутствуют в клетках животных. И в связи с этим распознавание PAMP определяется иммунной системой животного как сигнал о наличии патогенного микроорганизма [12], [19].
Но V. fischeri не является патогеном, поскольку никакого вреда кальмару не приносит. Поэтому, в настоящее время вместо аббревиатуры PAMP корректнее использовать аббревиатуру MAMP (ассоциированные с микроорганизмами молекулярные паттерны, или микроб-ассоциированные молекулярные паттерны), поскольку сейчас такие соединения не рассматриваются как патологии.
Более того, исследования говорят о том, что воздействие MAMP играет колоссальную роль в развитии органа моллюска.
Получается, ключевыми составляющими для поддержания циклической экспрессии гена криптохрома в фотофоре и симбиотической связи между моллюском и бактериями являются сразу несколько факторов. А именно: наличие липополисахарида, пептидогликана и голубого света [12]. Присутствие такого биолюминесцентного симбионта, который имеет свои MAMP, необходимо для развития кальмара. Симбионт обязательно должен испускать свет [13], в противном случае микроорганизм выбывает из сотрудничества с моллюском, поскольку дефектные по производству света бактерии не могут в должной мере производить свои микробные молекулы [18].
Как происходит заселение фотофора бактериями в естественных условиях
Вылупившийся кальмар (разумеется, еще «стерильный» — не заселенный бактериями) перемещается, закачивая морскую воду в свой организм.
V. fischeri, находящиеся в воде, попадают в полость тела, а также в сам фотофор кальмара. Фотофор настолько чувствителен, что способен реагировать даже на небольшое количество V. fischeri и определять их среди огромного множества других бактерий. Кальмар реагирует обильной слизью с поверхности фотофора на выделяемый микроорганизмами пептидогликан.
Достаточно лишь нескольких касаний клеток кальмара бактериями, чтобы изменить экспрессию многих генов в фотофоре!
Некоторая доля этих генов принимает участие в работе иммунной системы моллюска. Такие гены способны активировать специальные рецепторные белки распознавания паттернов в слизи, чтобы создать среду, благоприятную для размножения и жизни только бактерий V. fischeri [20].
Клетки светового органа считывают и определяют состав попавших в него микроорганизмов за счет работы рецепторов распознавания паттернов (PRR). Одни из наиболее важных представителей рецепторов распознавания паттернов являются Toll-подобные рецепторы (TLR). Эти рецепторы нацелены на распознавание бактериальных пептидогликанов и липополисахаридов, а также ряда других MAMP [18], [21].
Когда биолюминесцентная бактерия попадает в фотофор, она способна разрушать молекулу хитина в слизи, превращая ее в хитобиозу. Продукт расщепления хитина заманчив для вибрионов, которые его чувствуют и затем приближаются к нему [20].
Таким образом, получается привлекательный химический сигнал для других бактерий V. fischeri, который их заманивает к фотофору кальмара. Любопытно, что это всё происходит достаточно быстро — в течение нескольких часов после вылупления моллюска. Симбиотические отношения между вибрионами и моллюском поддерживаются на протяжении всей жизни [20].
Ученых всех времен интересовало взаимовыгодное сотрудничество между живыми существами. Ведь партнерство с различными микроорганизмами очень важно, поскольку они играют колоссальную роль в жизни и развитии множества организмов!
В симбиозе с бобтейл-кальмаром Euprymna scolopes, бактерии V. fischeri выступают в качестве «часовщиков», настраивая внутренние часы, а также формируют фотофор. Динофитовые водоросли Cladocopium goreaui могут спасти жизнь коралловых полипов, предотвращая их обесцвечивание. Даже в наших организмах находятся микропартнеры: микробиом кишечника человека участвует в стимуляции иммунной системы, защищая от патогенов.
А некоторые микроорганизмы способны не только поддерживать сотрудничество, но также испускать голубой свет за счет ряда физических и биохимических процессов. Все это доказывает, каким полезным, удивительным и необычайно красивым может быть микромир.
Литература
- Martha Valiadi, Debora Iglesias-Rodriguez. (2013). Understanding Bioluminescence in Dinoflagellates—How Far Have We Come?. Microorganisms. 1, 3-25;
- M. Fogel, J. W. Hastings. (1972). Bioluminescence: Mechanism and Mode of Control of Scintillon Activity. Proceedings of the National Academy of Sciences. 69, 690-693;
- Лозовая Е. (2004). Почему они светятся? «Наука и жизнь». 8;
- Биолюминесценция: возрождение;
- Микроскопическое свечение космического масштаба;
- Maziyar Jalaal, Nico Schramma, Antoine Dode, Hélène de Maleprade, Christophe Raufaste, Raymond E. Goldstein. (2020). Stress-Induced Dinoflagellate Bioluminescence at the Single Cell Level. Phys. Rev. Lett.. 125;
- Benoit Tesson, Michael I. Latz. (2015). Mechanosensitivity of a Rapid Bioluminescence Reporter System Assessed by Atomic Force Microscopy. Biophysical Journal. 108, 1341-1351;
- Madeleine J. H. van Oppen, James K. Oliver, Hollie M. Putnam, Ruth D. Gates. (2015). Building coral reef resilience through assisted evolution. Proc Natl Acad Sci USA. 112, 2307-2313;
- Ruth D. Gates, Tracy D. Ainsworth. (2011). The nature and taxonomic composition of coral symbiomes as drivers of performance limits in scleractinian corals. Journal of Experimental Marine Biology and Ecology. 408, 94-101;
- P. Buerger, C. Alvarez-Roa, C. W. Coppin, S. L. Pearce, L. J. Chakravarti, et. al.. (2020). Heat-evolved microalgal symbionts increase coral bleaching tolerance. Sci. Adv.. 6, eaba2498;
- Margaret McFall-Ngai. (2014). Divining the Essence of Symbiosis: Insights from the Squid-Vibrio Model. PLoS Biol. 12, e1001783;
- Elizabeth A. C. Heath-Heckman, Suzanne M. Peyer, Cheryl A. Whistler, Michael A. Apicella, William E. Goldman, Margaret J. McFall-Ngai. (2013). Bacterial Bioluminescence Regulates Expression of a Host Cryptochrome Gene in the Squid-Vibrio Symbiosis. mBio. 4;
- Karen L. Visick, Jamie Foster, Judith Doino, Margaret McFall-Ngai, Edward G. Ruby. (2000). Vibrio fischeri lux Genes Play an Important Role in Colonization and Development of the Host Light Organ. J. Bacteriol.. 182, 4578-4586;
- Silvia Moriano-Gutierrez, Eric J. Koch, Hailey Bussan, Kymberleigh Romano, Mahdi Belcaid, et. al.. (2019). Critical symbiont signals drive both local and systemic changes in diel and developmental host gene expression. Proc Natl Acad Sci USA. 116, 7990-7999;
- C. K. Chun, J. V. Troll, I. Koroleva, B. Brown, L. Manzella, et. al.. (2008). Effects of colonization, luminescence, and autoinducer on host transcription during development of the squid-vibrio association. Proceedings of the National Academy of Sciences. 105, 11323-11328;
- T. A. Koropatnick. (2004). Microbial Factor-Mediated Development in a Host-Bacterial Mutualism. Science. 306, 1186-1188;
- C. K. Chun, J. V. Troll, I. Koroleva, B. Brown, L. Manzella, et. al.. (2008). Effects of colonization, luminescence, and autoinducer on host transcription during development of the squid-vibrio association. Proceedings of the National Academy of Sciences. 105, 11323-11328;
- Margaret McFall-Ngai, Elizabeth A.C. Heath-Heckman, Amani A. Gillette, Suzanne M. Peyer, Elizabeth A. Harvie. (2012). The secret languages of coevolved symbioses: Insights from the Euprymna scolopes–Vibrio fischeri symbiosis. Seminars in Immunology. 24, 3-8;
- Белоконева О. (2011). Нобелевская премия по физиологии и медицине 2011 года. «Первая линия обороны». «Наука и жизнь». 11;
- Natacha Kremer, Eva E.R. Philipp, Marie-Christine Carpentier, Caitlin A. Brennan, Lars Kraemer, et. al.. (2013). Initial Symbiont Contact Orchestrates Host-Organ-wide Transcriptional Changes that Prime Tissue Colonization. Cell Host & Microbe. 14, 183-194;
- Margaret McFall-Ngai, Spencer V. Nyholm, Maria G. Castillo. (2010). The role of the immune system in the initiation and persistence of the Euprymna scolopes–Vibrio fischeri symbiosis. Seminars in Immunology. 22, 48-53;
- Margaret McFall-Ngai. (2014). Divining the Essence of Symbiosis: Insights from the Squid-Vibrio Model. PLoS Biol. 12, e1001783.







